Похожие презентации:
Водород. Водород в космосе
1. В день, когда его запасы иссякнут, жизнь во Вселенной прекратится. Погаснет Солнце, не станет воды … Вещество, без которого
жизньневозможна, «сидит» в самом
центре нашей планеты и вокруг
него, и оттуда «мигрирует» наружу.
Этот газ – начало всех начал.
2.
3.
4. Водород в космосе
5. Ближайшая к нам звезда Галактики, которую мы знаем под именем «Солнце», на 70 % своей массы состоит из водорода.
6. Водород на Земле
ВодаПриродный
газ
Нефть
7.
Кто не успел записать; ктополенился; кто не был на
уроке, у вас есть возможность
это исправить
8. 1. Положение в ПСХЭ
Водород, водород – элемент наоборот! Отщелочных металлов не отстал и к
галогенам не пристал!
9. Открытие водорода
Водород был открыт в первойполовине XVI века немецким
врачом и естествоиспытателем
Парацельсом
Первым ученым, описавшим свойства
этого газа, был английский ученый
Генри Кавендиш
10. В 1779 г. Антуан Лавуазье получил водород при разложении воды, пропуская ее пары через раскаленную докрасна железную трубку
В 1779 г. Антуан Лавуазье получил водород приразложении воды, пропуская ее пары через раскаленную
докрасна железную трубку
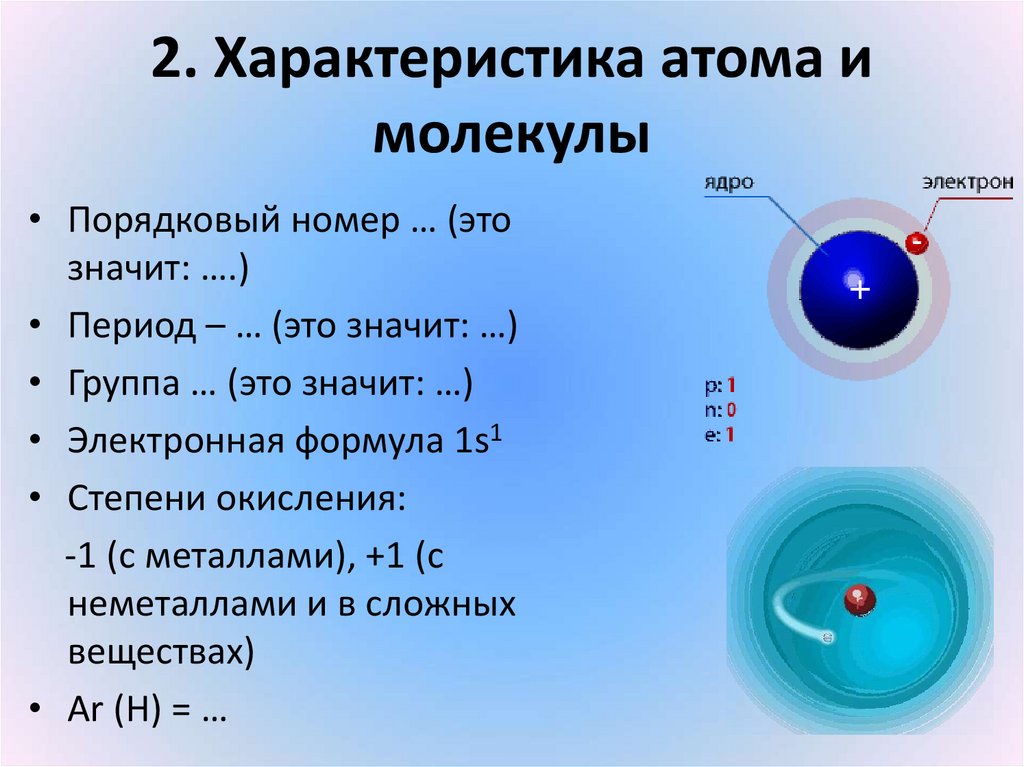
11. 2. Характеристика атома и молекулы
• Порядковый номер … (этозначит: ….)
• Период – … (это значит: …)
• Группа … (это значит: …)
• Электронная формула 1s1
• Степени окисления:
-1 (с металлами), +1 (с
неметаллами и в сложных
веществах)
• Аr (H) = …
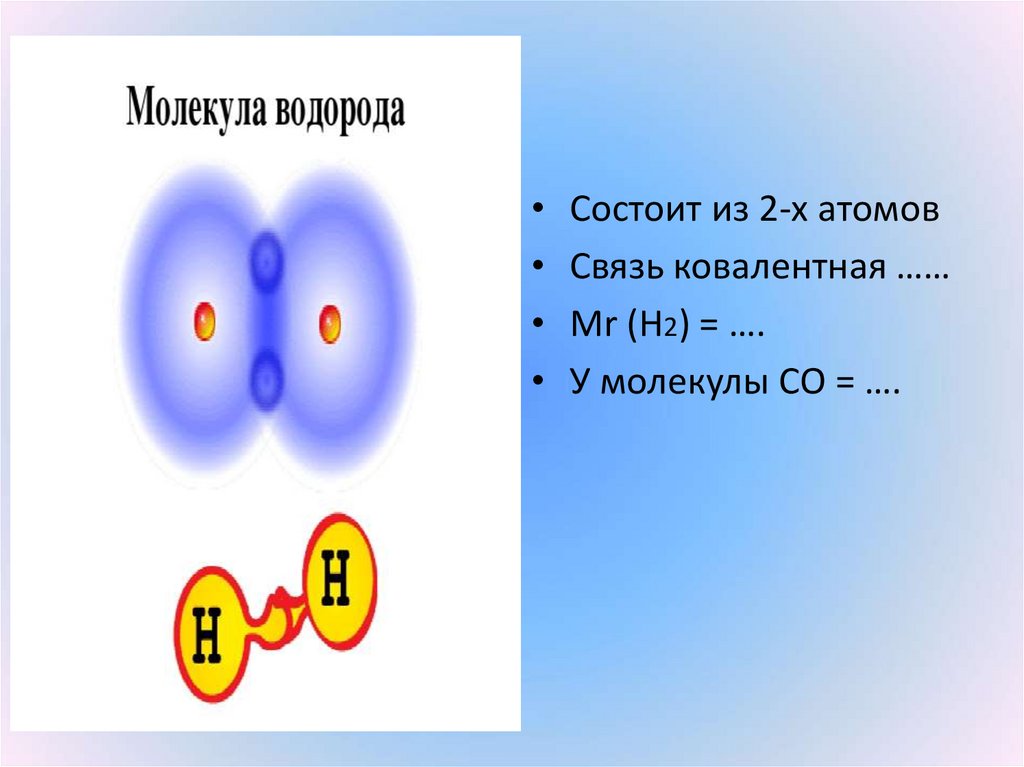
12.
• Состоит из 2-х атомов• Связь ковалентная ……
• Мr (Н2) = ….
• У молекулы СО = ….
13. 3. Физические свойства
Бесцветный газ.Без запаха и вкуса.
Малорастворим в воде.
Температура кипения
−252,76 °C.
В 14,5 раз легче воздуха.
14. Физические свойства
15. Летучий, но горючий…
Наработав в достаточном количествеэтот легкий газ, люди сначала
приспособили его для воздушных
полетов.
В этом качестве первый элемент
ПСХЭ Д.И. Менделеева применяли
вплоть до 1937 года, когда в воздухе
сгорел крупнейший в мире, размером
в два футбольных поля,
заполненный водородом немецкий
дирижабль «Гинденбург».
Катастрофа унесла жизни 36 человек.
С тех пор аэростаты заправляют
исключительно гелием. Гелий – газ
более плотный, но зато негорючий.
16. Водород – альтернативный источник энергии…
Ученые придумали, как использоватьводород в качестве горючего и при этом
не взорваться. В газ стали добавлять
специальные присадки-ингибиторы
(химические «тормоза»). Например,
пропилен. Всего 1% этого дешевого газа
— и водород из грозного оружия
превращается в безопасный газ.
В 1979 г. компания BMW выпустила
первый автомобиль, вполне успешно
ездивший на водороде, при этом не
взрывавшийся и выпускавший из
выхлопной трубы водяной пар.
17. Опыт Пилатра де Розьера
Как-то он решил проверить, что будет,если вдохнуть водород; до него никто
такого эксперимента не проводил.
Не заметив никакого эффекта,
ученый решил убедиться,
проник ли водород в легкие.
Он еще раз глубоко вдохнул
этот газ, а затем выдохнул его
на огонь свечи, ожидая увидеть
вспышку пламени. Однако водород
в легких экспериментатора
смешался с воздухом, и
произошел сильный взрыв.
18. Знаете ли вы, что…
19. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной
надписью "Водород".20. Использвание водорода в производстве
Температура водороднокислородного пламенидостигает 3000 °C. Если же
использовать специальные
горелки, то можно повысить
температуру пламени до 4000
°C. При такой температуре
проводят сварочные работы с
самыми тугоплавкими
материалами
21. Использвание водорода в производстве
Например, самаямощная ракета
«Энергия» использует
более 2000 тонн
топлива, большую
часть которого
составляют жидкий
водород и кислород.
22. Использвание водорода в производстве
Водород применяют идля получения металлов
из оксидов. Таким
способом получают
тугоплавкие металлы
молибден и вольфрам,
необходимые в
производстве нитей
накаливания
электролампочек.
23. Использвание водорода в производстве
В настоящее время в рядестран начаты исследования по
замене не возобновляемых
источников энергии (нефти,
газа, угля) на водород. При
сгорании водорода в кислороде
образуется экологически
чистый продукт – вода, а
углекислый газ, вызывающий
парниковый эффект, не
выделяется.
24. 4. Химические свойства
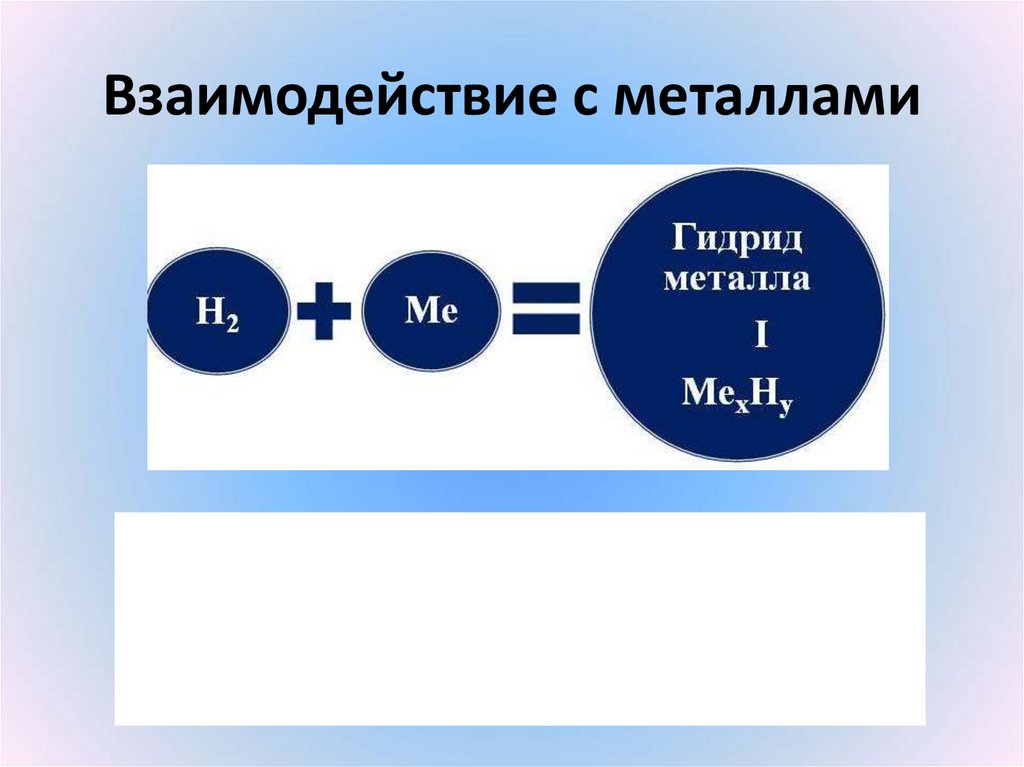
25. Взаимодействие с металлами
26. Составить уравнения водорода с
1) магнием;2) железом (III);
3) калием
(писать по схеме, которая на слайде выше)
Назвать продукты реакций
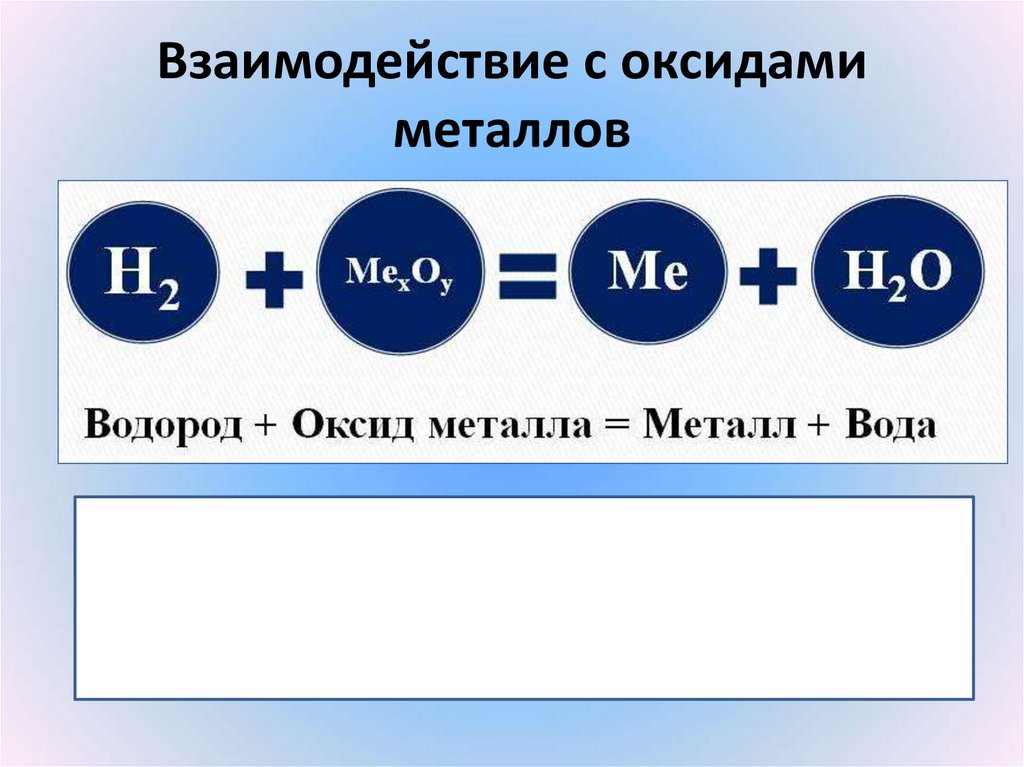
27. Взаимодействие с оксидами металлов
28. Составить уравнения реакций водорода с оксидами металлов:
1) оксидом алюминия2) оксидом ртути (II)
3) оксидом вольфрама (VI)
(писать по схеме, которая на слайде выше)
29. Взаимодействие с неметаллами
30. Написать уравнения реакций водорода с:
• 1) хлором• 2) серой
• 3) азотом
• 4) углеродом
(писать по схеме, которая на слайде выше
и все подсказки на этом слайде!)
Назвать продукты реакций



























 Химия
Химия








