Похожие презентации:
Кремний и его соединения
1.
2. Кремний Silicium
(лат.) – кремень(греч.) - утёс,
скала
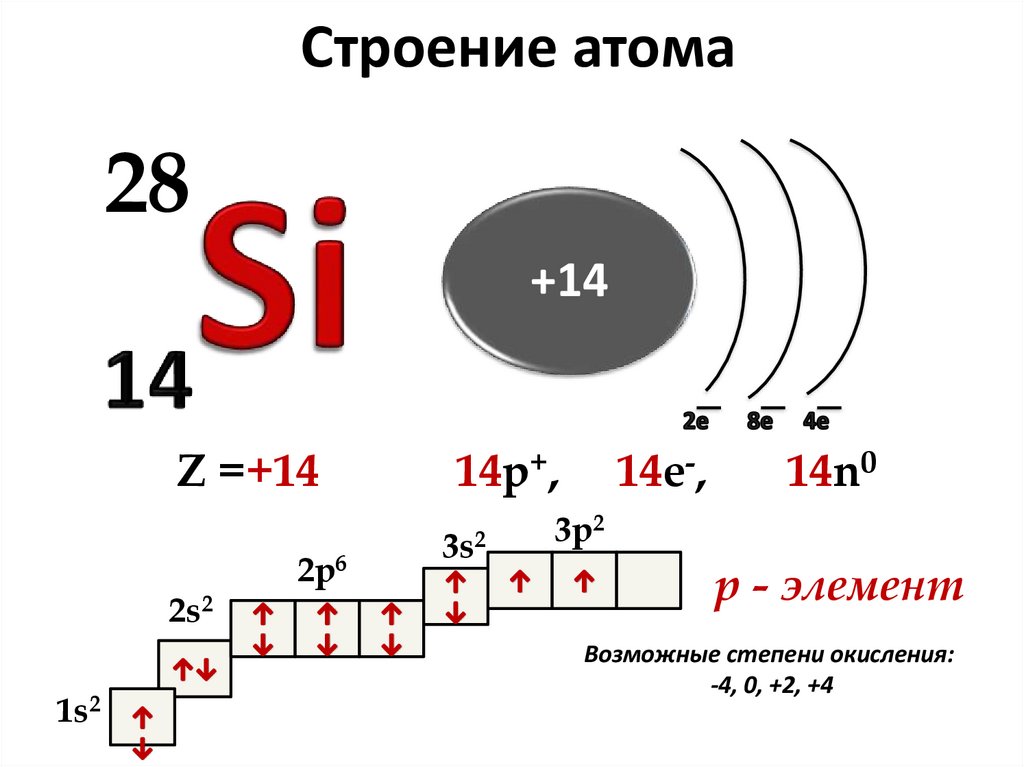
3. Строение атома
28+14
Z =+14
2s2
1s2
2p6
14p+,
3s2
14e-,
14n0
3p2
р - элемент
Возможные степени окисления:
-4, 0, +2, +4
4. Нахождение в природе
По распространенности занимает второе место после кислорода (26%)SiO2
SiO2 –горный
кремнезём (песок)
хрусталь
SiO2 –кварц
K2O ∙ Al2O3∙6SiO2
Полевой шпат
Al2O3∙ 2SiO2∙2H2O
каолинит (глина)
K2O ∙ Al2O3∙6SiO2 ∙ 2H2O
Слюда
5. Аллотропные модификации
Кристаллический кремнийАморфный кремний
Твердый, темно-серого цвета, обладающий
стальным блеском, твердый и хрупкий,
полупроводник. Обладает тепло- и
электропроводностью.
Структура подобна алмазу, но боле слабая
связь
Порошок бурого цвета, не имеет
определенной Tплав. На воздухе
покрыт прочной оксидной
пленкой, тугоплавок, слабо
проводит электрический ток. Не
реагирует с водой.
6. Получение кремния
1. В промышленности кремний получаютвосстановлением диоксида кремния коксом в
электрических печах:
SiO2+2C=Si+2CO
2. В лаборатории кремний получают прокаливанием с
магнием или алюминием белого песка:
SiO2 + 2Mg = 2MgO + Si
3SiO2 + 4Al = 2Al2О3 + 3Si
7. Химические свойства
Как восстановитель:1. С галогенами
Непосредственно взаимодействует только с фтором
Si + 2F2 = SiF4
Si + 2Cl2 = SiCl4 (Т до 400–600 °С)
2. С кислородом:
Si + O2 = SiO2
3. С другими неметаллами
При очень высокой Т (2000 °С) реагирует с углеродом, азотом
(при 1000 °С ):
Si + C = SiC
3Si + 2N2 = Si3N4
Si+ 2MgO = 2Mg+ SiO2 ( применяется в металлургии)
8.
Как окислитель:3
2
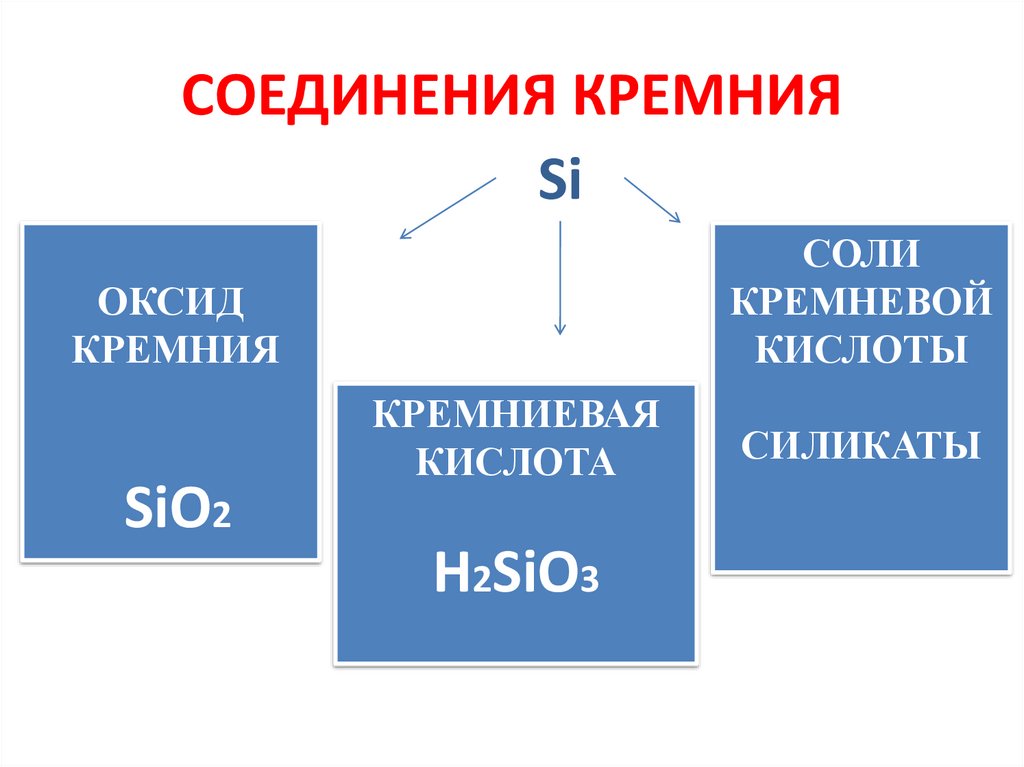
9. СОЕДИНЕНИЯ КРЕМНИЯ
SiСОЛИ
КРЕМНЕВОЙ
КИСЛОТЫ
ОКСИД
КРЕМНИЯ
SiO2
КРЕМНИЕВАЯ
КИСЛОТА
H2SiO3
СИЛИКАТЫ
10. Оксид кремния в природе
Горный хрустальХалцедон
Кварц
Агат
Песок, ракушки
Сердолик
Аметист
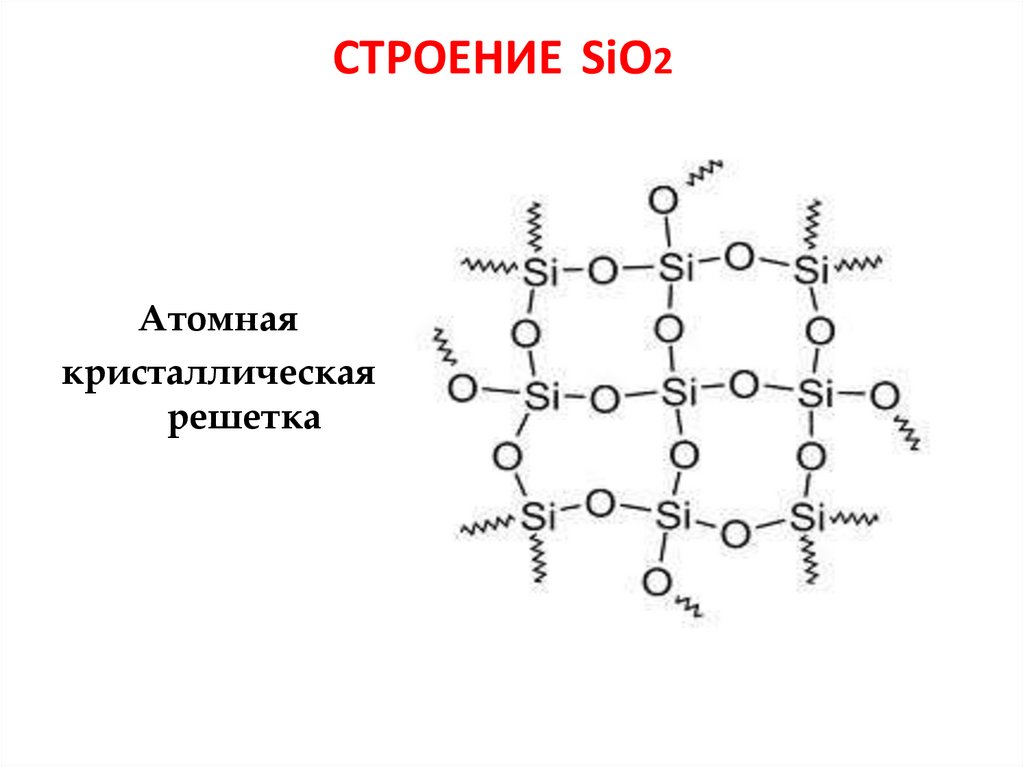
11. СТРОЕНИЕ SiO2
Атомнаякристаллическая
решетка
12. ОКСИД КРЕМНИЯ (IV) - SiO2
• Твердое кристаллическоевещество
• Атомная кристаллическая
решётка
• Очень твёрдый и
тугоплавкий
• Нерастворим в воде
• Инертный
13. ОКСИД КРЕМНИЯ (IV) - SiO2
• является кислотным оксидомНО!!!!!
• Не растворяется в кислотах (кроме HF)
плавиковая кислота
• Реагирует при высоких температурах со щелочами с
образованием силикатов:
При высоких температурах образует силикаты с оксидами
металлов и карбонатами:
14. КРЕМНиЕВАЯ КИСЛОТА H2SiO3
Получение:Na2SiO3 + 2HCl =2NaCl + H2SiO3 ↓
силикат натрия
кремниевая кислота
Кремниевая кислота нерастворима в воде
15. ПРИМЕНЕНИЕ КРЕМНИЯ
Кремнистые сталиФотоэлементы
Силиконовый каучук
Силиконовый герметик
16.
Силикон – это материал, который очень герметичный ивыдерживает при работе большой диапазон температур от 1200С до + 3000С.
Это жидкий материал, который
легко становится
твердым и его можно легко шлифовать, полировать,
вырезать и вообще обрабатывать как угодно.
Также силикон может быть резиноподобным – мягким и
эластичным, который можно с легкостью сжимать,
сгибать и растягивать.
17. Применение SiO2
при получении клеящихи вяжущих материалов
Силикатный кирпич
стекло
18. Каковы компоненты, используемые для изготовления обычного стекла?
кварцевый песок (SiO2)известняк (CaCO3)
cода (Na2CO3)
Они спекаются при высокой
температуре, и получается
однородная масса
19. СОЛИ КРЕМНИЕВОЙ КИСЛОТЫ
Растворимые силикаты натрия и калия называютжидким стеклом, который используют для
пропитки древесины, чтобы придать ей
огнеупорность.
Na2SiO3+ H2O+ CO2 →Na2CO3+ H2SiO3↓
Na2SiO3 + MgCl2 → MgSiO3 + 2NaCl
Na2SiO3 + H2O ↔ NaHSiO3 + NaOH
(гидролиз)
20. Силан- SiH4
Ядовитый газ с неприятным запахом плесени,легко воспламеняется на воздухе
21.
Это интересно!Аморфный кремний - это малая
энергетика.
• Солнечные батареи из аморфного
кремния не боятся ни снега, ни дождя,
ни пыли.
• Они подходят для того, чтобы в полевых
условиях обеспечить электроэнергией ту
электронику, которая необходима для
работы: спутниковую связь, компьютер,
беспилотную систему и пр.
• Системы с использованием аморфного
кремния способны обеспечить на
неосвоенных территориях
электроэнергией военных, МЧС,
спецслужбы и другие структуры.
22.
Это интересно!Кремниевые солнечные батареи
для освещения улиц и домов –
это наше настоящее и будущее.
Они эффективны и с высокой
мощностью. Они составляют почти
85% от выпуска всех подобных
батарей и панелей.
Если в пустыне Сахара разместить
солнечные батареи на 160 км. м, то
можно полностью отказаться от
всех видов получения энергии:
нефти, газа, урана, воды, ветра….
23.
Это интересно!• Кремний и его соединения необходимы для хорошего
состояния кожи, они придают ей эластичность и прочность.
• Кремний помогает процессу синтеза коллагена и эластина,
также он стимулирует рост волос и ногтей.
24. Домашнее задание
• П. 33 №7 + силикатная промышленность(стр. 180)






















 Химия
Химия








