Похожие презентации:
Азот и фосфор. Изотопы и аллотропные модификации
1. АЗОТ И ФОСФОР
2. 1. Положение в периодической системе
3.
В главной подгруппе (подгруппе азота) расположеныN, P, As, Sb, Bi.
Элементы имеют следующие электронные формулы:
1s22s22p3
7N
22s22p63s23p33d0
P
1s
15
1s22s22p63s23p63d104s24p34d0
33 As
1s22s22p63s23p63d104s24p64d105s25p35d0
51 Sb
145d106s26p36d0
Bi
…………4f
83
4. Типичные представители
N, P – типичные неметаллыAs, Sb – амфотерны
Bi – преобладают металлические свойства.
Восстановительные свойства нейтральных атомов
усиливаются от N к Bi, и в этой последовательности ослабевают
неметаллические свойства. У Sb – в равной степени выражены
металлические свойства и свойства неметаллов.
5. Водородные соединения
От N к Bi растет устойчивость соединений со с.о. = - 3. Сводородом элементы V группы образуют соединения типа
ЭН3:
NH3 – аммиак;
PH3 – фосфин;
AsH3 - арсин.
Водородные соединения проявляют восстановительные
свойства.
Наиболее сильный восстановитель – BiH3.
6. Кислоты
Способныобразовывать
кислородосодержащие
соединения, в которых имеют с.о. = +3 и +5.
HNO2
HNO3
H3PO3
H3PO4
Bi(OH)3
НBiO3
NaBiO3
Основные свойства молекул (т.е. свойства оснований)
увеличиваются по мере изменения электроотрицательности и
увеличения радиусов атомов. Все кислоты со с.о.=+5
являются сильными окислителями, кроме H3PO4
7.
Подгруппа азота(пниктогены) –
V группа, главная
подгруппа «А»
азот, фосфор, мышьяк,
сурьма, висмут.
Электронное
строение последнего
уровня: …ns2np3
Степени
окисления:
-3, 0, +1,+2,+3,+4,
+5
Первые представители подгруппы —
азот и фосфор — типичные
неметаллы, мышьяк и сурьма
проявляют металлические свойства,
висмут — типичный металл.
8.
• Атом азота содержит на внешнемэнергетическом уровне 3 неспаренных
электрона и одну неподеленную электронную
пару в основном энергетическом состоянии.
Следовательно, атом азота может образовать
3 связи по обменному механизму и 1 связь по
донорно-акцепторному механизму. Таким
образом, максимальная валентность азота в
соединениях равна IV. Также характерная
валентность азота в соединениях — III.
9. 2. Изотопы и аллотропные модификации
10. Азот: 17 изотопов, два стабильных изотопа 14N и 15N. Фосфор: 23 изотопа,среди них один стабильный 31P и только он встречается в
природе.АЗОТ:
В твердом состоянии
известны две
модификации азота: a
– кубическая и b –
гексагональная.
ФОСФОР: Известно 11 аллотропных модификаций
фосфора.
Традиционно различают четыре его модификации:
белый, красный, чёрный и металлический фосфор.
Также встречается «желтый фосфор» - неочищенный
белый.
11. 3. Нахождение в природе
12. Содержание в земной коре: азот - 0,01%, фосфор - 0,08%, мышьяк - 0,0006%, сурьма - 0,0004%, висмут - 0,00002%
АЗОТ - один из самых распространённых элементов на Земле, четвертыйв солнечной системе. Основной компонент воздуха (78,09 % объёма).
В живых организмах он входит в состав белков (16—18 % по массе),
аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла,
гемоглобина и др.
В составе живых клеток по массовой доле — около 2,5 % (четвёртое
место после водорода, углерода и кислорода).
В результате процессов гниения и разложения азотсодержащей
органики, при условии благоприятных факторов окружающей среды,
могут образоваться природные залежи полезных ископаемых,
содержащие азот, например, «чилийская селитра» (нитрат натрия с
примесями других соединений), норвежская, индийская селитры.
13. Содержание в земной коре: азот - 0,01%, фосфор - 0,08%, мышьяк - 0,0006%, сурьма - 0,0004%, висмут - 0,00002%
ФОСФОР: В свободном состоянии не встречается из-завысокой химической активности.
Образует около 190 минералов, важнейшими из
которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит
и другие.
Фосфор входит в состав важнейших биологических
соединений — фосфолипидов. Содержится в
животных тканях, входит в состав белков и других
важнейших органических соединений (АТФ, ДНК),
является элементом жизни.
14. ИСТОРИЯ ОТКРЫТИЯ
• 1772г. К.Шееле и Г.Кавендишполучили азот
• Д.Резерфорд описал получение
и свойства
• 1787г. Лавуазье предложил
название азот –
«безжизненный» (а – нет, зоэ –
жизнь)
© 11.12.2010
15. НАХОЖДЕНИЕ В ПРИРОДЕ: 1)в свободном состоянии в атмосфере (78%), 2)в связанном состоянии (смотри таблицу)
© 11.12.2010Природная форма
Соли аммония и азотной
кислоты
Азот
Оболочка
Земли
Литосфера,
гидросфера
Атмосфера
Азот и аммиак вулканов
Литосфера
Соединения в некоторых
видах топлива (нефть, уголь)
Литосфера
Нуклеиновые кислоты,
белковые вещества
Биосфера
16. 4. Физические свойства
17. АЗОТ
Газ без цвета, вкуса и запаха.Применяется как инертная среда
для множества технологических
процессов; жидкий азот —
хладагент.
В жидком состоянии (темп.
кипения −195,8 °C) — бесцветная,
подвижная, как вода, жидкость.
При повышенном давлении он
вызывает наркоз, опьянение или
удушье (при недостатке
кислорода); при быстром
снижении давления азот
вызывает кессонную болезнь.
18. Азот и его свойства Получение и физические свойства:
Азот - распространенный элемент: 4/5 атмосферноговоздуха состоит из азота, поэтому в промышленности его
получают фракционной перегонкой жидкого воздуха. В
лаборатории можно получить из солей при нагревании
NaNO2 NH 4Cl N 20 NaCl 2 H 2O
T0
или
NH 4 NO2 N 20 2 H 2O
T0
Tкип ( N 2 ) 196 0 C , Tпл ( N 2 ) 2100 C
В 1 л H2O растворяется 23 мл азота и 330 мл O2
19. АЗОТ
• В лаборатории1. Нагреваение смеси растворов нитрита натрия и хлорида аммония при
80 °С:
NaNO2 + NH4Cl = N2 + 2H2O + NaCl.
2. Разложение твердого нитрита аммония (со взрывом)
NH4NO2 = N2 + 2H2O.
3. Реакции окисления аммиака:
2NH3 + 3CuO = N2 + 3Cu + 3H2O;
4NH3 + 3O2 = 2N2 + 6H2O.
4. Реакции взаимодействия металлов с азотной кислотой:
12HNO3 (разб.) + 5Mg = N2 + 5Mg(NO3)2 + 6H2O.
5. Термическое разложение азида лития:
2LiN3 = 3N2 + 2Li.
20. АЗОТ
• В промышленностиЧистый азот в промышленности наряду с
кислородом и другими газами получают
фракционной перегонкой жидкого воздуха.
21. АЗОТ
Химически инертное (малоактивноевещество)
1. Взаимодействие с металлами
А) При обычных условиях молекулярный азот реагирует лишь с
некоторыми сильными восстановителями, например, литием:
6Li + N2 = 2Li3N.
Б) Для образования нитрида магния из простых веществ требуется
нагревание до 300 °С:
3Mg + N2 = Mg3N2.
Нитриды активных металлов представляют собой ионные соединения,
которые гидролизуются водой с образованием аммиака.
22. АЗОТ
2. Взаимодействие с кислородом Только под действиемэлектрического разряда азот реагирует с кислородом:
O2 + N2 = 2NO.
3. Взаимодействие с водородом Реакция с водородом
протекает при температуре порядка 400 °С и давлении
200 атм в присутствии катализатора – металлического
железа:
3H2 + N2 = 2NH3.
4. Взаимодействие с другими неметаллами При
высоких температурах реагирует с другими неметаллами,
например, с бором:
2B + N2 = 2BN.
23. Применение и получение:
Применение• Получение аммиака
• Создание инертной атмосферы
• Создание низких температур
• Насыщение поверхности стали
для повышения прочности
Получение
• В промышленности – из жидкого
воздуха
• В лаборатории – разложением
неустойчивых соединений азота
© 11.12.2010
24. Аммиак
В обычных условиях – бесцветный газ, с резким запахом(запах «нашатыря»); сжижается при -33,40С и затвердевает
при -77,70С.
Молекула аммиака имеет форму пирамиды, в жидком
аммиаке молекулы NH3 связаны водородными связями,
обусловливая тем самым аномально высокую температуру
кипения. Полярные молекулы NH3 очень хорошо растворимы
в воде (700 объемов NH3 в одном объеме H2O) – лучше, чем
любой другой газ.
25. Получение
Для получения аммиака в лабораторных условияхобычно нагревают смесь хлорида аммония и гидроксида
кальция:
2 NH 4Cl Ca(OH ) 2 CaCl2 2 H 2O 2 NH 3
Действие щелочей на соли аммония – качественная
реакция на обнаружение ионов аммония.
Продукты взаимодействия аммиака с кислотами
представляют собой соли аммония. Все аммонийные соли
растворимы в воде и при этом гидролизуются. Соли аммония
термически неустойчивы и при нагревании разлагаются.
26. Свойства
Азот в аммиаке имеет наименьшую степень окисления и поэтомупроявляет только восстановительные свойства. Так, например, при
горении аммиака образуются азот и вода:
4 NH 3 3O2 2 N 2 6 H 2O
В присутствии катализатора аммиак может окисляться и до оксида
азота NO:
4 NH 3 5O2 4 NO 6 H 2O
При нагревании аммиак с оксидами тяжелых металлов, галогенами,
пероксидом водорода образуется молекулярный азот:
3CuO 2 NH 3 3Cu N 2 3H 2O,
2 NH 3 3Br2 N 2 6 HBr ,
2 NH 3 H 2O2 N 2 6 H 2O
27. задача
• Определите объем азота, которыйобразуется при восстановлении 24 грамм
оксида меди 2
28. Соли аммония
При взаимодействии аммиака с кислотами образуются солиаммония, которые при нагревании разлагаются:
NH 4Cl NH 3 HCl ,
NH 4 HCO3 NH 3 H 2O CO2 ,
NH 4 NO3 N 2O 2 H 2O.
При действии щелочей на соли аммония выделяется аммиак,
например:
2 NH 4Cl Ca(OH ) 2 CaCl2 2 NH 4OH
t0
2 NH 3 2 H 2O
Эта реакция может служить лабораторным способом получения
аммиака, а также качественной реакцией на соли аммония.
29.
Азот способен проявлять несколько степеней окисления от -3 до +5.Известны несколько оксидов азота.
+1
+2
+3
+4
N2O
NO
N2O3
Солеобразующие: N2O3
+5
NO2
NO2
N2O4
N2O5
N2O5
димер
оксида азота(IV)
Несолеобразующие: N2O
NO
Все оксиды азота, кроме N2O, ядовитые вещества.
30.
N2O- оксид азота (I)II
IV
II
N=N=O Против всех правил
Степень окисления не всегда
совпадает с валентностью
+2 -2
N=N=O
степень окисления
распределяется на два атома азота и
равна для обоих +2, а для одного +1
Молекула линейна
Бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворим в
воде, но не взаимодействует с ней. В смеси с кислородом используется в
медицине для слабого наркоза. («веселящий» газ)
31.
Оксид азота(I) - N2O (“веселящий газ”)Физические свойства. Бесцветный газ с тошнотворным
cладковатым запахом, Бесцветный газ со слабым запахом и сладковатым вкусом,
хорошо растворим в воде, но не взаимодействует с ней. обладает
анестезирующим действием.
Растворим в воде. t0(плав) = -910С, t0(кип) = -88,60С.
Получение. Разложение нитрата аммония при нагревании:
NH4NO3 = N2O + 2H2O
Нагрев должен быть не более 2450С.
Химические свойства.
1. Разлагается при 7000С с образованием кислорода:
2N2O = 2N2 + O2
Поэтому поддерживает горение и является окислителем.
2. С водородом:
N2O + H2 = N2 + H2O
32.
NO-оксид азота (II)II
II
N=О молекула линейна, имеет неспаренный электрон, поэтому
является радикалом, используется как донор электронов.
Окислительно-восстановительная двойственность
Восстановитель:
Окислитель:
2NO + O2 = 2NO2 (легко!)
2NO + 2SO2 = 2SO3 + N2
так как радикал, очень легко
подвергается окислению
Нитрозный способ получения серной
кислоты
Бесцветный газ, не имеет запаха. В воде малорастворим. Образуется из
азота и кислорода при сильных электрических разрядах (например, во время
грозы в воздухе) или при высокой температуре:
N2 + O2 2NO
В лаборатории: 3 Сu +8 HNO3 = 3 Cu(NO3)2 +2NO + 4H2O
разб.
33.
Оксид азота(II) - NOФизические свойства. Бесцветный газ, при низких
температурах - голубая жидкость. В твердом состоянии димеризован (N2O2). Не растворим в воде.
t0(плав) = -1640С, t0(кип) = - 151,70С.
Получение. 1. При реакции неактивных металлов с
разбавленной азотной кислотой:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2. При каталитическом окислении аммиака:
4NH3 + 5O2 = 4NO + 6H2O
3. При взаимодействии с кислородом воздуха:
N2 + O2 = 2NO (t0 ≥ 20000C, кат. Pt/Rh)
4. При взаимодействии нитритов с серной кислотой:
2 NaNO2 + H2SO4 = Na2SO4 + NO + NO2 + H2O
34.
Химические свойства. Очень реакционноспособное вещество. Может проявлятьи окислительные и восстановительные свойства.
1. При обычной температуре окисляется кислородом
воздуха:
2NO + O2 = 2NO2
2. Восстановитель:
NO + NO2 = N2O3
2NO + Cl2 = 2NOCl (нитрозилхлорид)
3. Окислитель:
2NO + 2SO2 = 2SO3 + N2
2NO + 2Н2 = N2 + 2Н2О (2000С)
2NO + 2Cu = N2 + 2CuO (5000С)
2NO + 2H2S = N2 + 2S + 2Н2О (3000С)
4. Взаимодействует с органическими веществами. Примененяется. В
производстве азотной кислоты.
35.
N2O3-оксид азота (III)Кислотный оксид:
Приведите примеры
реакций, доказывающих
кислотные свойства
оксида азота(III)
N2O3 + H2O = 2HNO2
N2O3 + 2 KOH = 2 KNO2 + H2O
жидкость, темно – синего цвета, неустойчива при низких
температурах и разлагается: N2O3 = NO + NO2
36.
Оксид азота(III) - азотистый ангидридФизические свойства. Это синяя жидкость при обычных
условиях. В твердом состоянии - белое или голубоватое
вещество. t(плав) = -1020С.
Получить можно при сильном охлаждении эквимолярной
смеси NO и NO2:
NO + NO2 = N2O3
Химические свойства. N2O3 - кислотный оксид.
1. Взаимодействие со щелочами:
2NaOH + N2O3 = 2NaNO2 + H2O
2. Взаимодействие с водой:
N2O3 + H2O(хол) = 2HNO2
3N2O3 + H2O(гор) = 2HNO3 + 4NO
3. Окисляется кислородом воздуха при -100С:
2N2O3 + О2 = 4NO2
37.
Оксид азота (IV)Кислотный оксид:
II
III III
II
O=N-N=O
+3
+5
2NO2 + H2O = HNO2 + HNO3
Взаимодействие с водой происходит
таким образом, так как это
смешанный оксид, которому
соответствует две кислоты
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NO2 === N2O4
Ниже 22 С молекулы оксида азота(IV) легко
соединяются попарно и образуют бесцветную
жидкость состава N2O4 , которая при охлаждении до 10,2 С превращается в бесцветные кристаллы
«Лисий хвост» Ядовитый газ бурого цвета, имеет
характерный запах. Хорошо растворяется в воде.
38.
Оксид азота(IV) - NO2и его димер N2O4
Физические свойства. Это красно-бурый газ с резким запахом.
При низких температурах из-за наличия у атомов азота
неспаренных электронов димеризуется в N2O4. Димер в
жидком состоянии бесцветный, в твердом - белый. t(пл) = -11,20С.
Хорошо растворяется в холодной воде. Насыщенный раствор
имеет ярко-зеленый цвет.
Получение.
1. Термическим разложением нитратов металлов,
расположенных в ряду активности в интервале Al-Сu:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2. Взаимодействием меди с концентрированной азотной
кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
3. Окислением оксида азота(II):
2NO + O2 = 2NO2
39.
Химические свойства.1.
Взаимодействие с водой:
2NO2 + H2O(хол) = HNO3 + HNO2
3NO2 + H2O(гор) = 2HNO3 + NO
2.
Взаимодействие с растворами щелочей:
2NO2 + 2КОН = КNO3 + КNO2 + Н2О
3.
При растворении в воде в присутствии кислорода:
4NO2 + 2H2O + О2 = 4HNO3
Используется в промышленном способе получения
азотной кислоты.
3.
Хороший окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 4Cu = 4CuO + N2 (500-6000C)
40.
Оксид азота (V)Кислотный оксид:
N2O5 + H2O == 2HNO3
Легко разлагается (при нагревании – со
взрывом):
2N2O5 == 4NO2 + O2
Бесцветные прозрачные кристаллы, хорошо растворяющиеся в воде с
образованием азотной кислоты : N2O5 + H2O == 2HNO3
Нестойкие кристаллы: 2N2O5 ==4NO2 + O2
Как и оксид азота(III) практического значения не имеет
41.
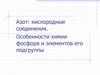
Оксид азота(V) - азотный ангидридN2O5
Строение.
O N O N
O
O
O
Физические свойства. Белое кристаллическое вещество, летучее, неустойчивое. При
нагревании возгоняется и
плавится. В воде легко растворяется.
Получение. Действие дегидратирующего агента Р4О10 на
азотную кислоту:
4HNO3 + P4O10 = 2N2O5 + 4HPO3
42.
Химические свойства. Оксид азота(V) - кислотный оксид.1. При растворении в воде образует азотную кислоту:
N2O5 + H2O = 2HNO3
2. Со щелочами образует нитраты:
N2O5 + 2NaOH = 2NaNO3 + H2O
3.
Малоустойчив и легко разлагается уже при
комнатной температуре:
2N2O5 = 4NO2 + O2
Прb нагревании разлагается со взрывом.
4.
Сильный окислитель:
N2O5 + 5Сu = 5CuO + N2 (5000C)
На практике реакции не проводятся ввиду его
труднодоступности и малой устойчивости
43.
Обобщающие задания.1.Имеются три закрытых цилиндра: с оксидом азота (IV), с азотом, с
аммиаком.
Как проще всего узнать, в каком цилиндре какой газ содержится?
В каких цилиндрах и как изменится окраска влажной фиолетовой
лакмусовой бумажки?
NH3
NO2
44.
• - Это вещество было описано арабским химиком в VIIIвеке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик
мудрости», а с ХV века это вещество добывалось для
производственных целей.
• - Благодаря этому веществу русский учёный В.Ф.
Петрушевский в 1866 году впервые получил динамит.
• - Это вещество – прародитель большинства взрывчатых
веществ (например, тротила, или тола).
• - Это вещество является компонентом ракетного топлива,
его использовали для двигателя первого в мире
советского реактивного самолёта БИ – 1.
• - Это вещество в смеси с соляной кислотой растворяет
платину и золото, признанное «царём» металлов. Сама
смесь, состоящая из 1-ого объёма этого вещества и 3-ёх
объёмов соляной кислоты, называется «царской водкой».
45. НЕМНОГО ИСТОРИИ
• Монах-алхимик Бонавентура в 1270 году впоисках универсального растворителя
«алкагеста» решил нагреть смесь железного
купороса с селитрой. Сосуд, в котором была
смесь, вскоре наполнился красно-бурым
«дымом». Монах в изумлении застыл, затем
убрал огонь и увидел, как в колбу-приемник стала
капать желтоватая жидкость. Она действовала на
все металлы, даже на серебро и ртуть. Алхимики
думали, что сидящий в жидкости рыжий дым
является демоном, управляющим одной из
стихий природы – водой. Поэтому желтоватую
жидкость называли «крепкой водой» или
«крепкой водкой». Это название сохранилось до
времен М. В. Ломоносова. Как сейчас называют
это вещество?
46.
• 2 FeSO4 · 7Н2О + 4 КNO3 = Fe2О3 +2 К2SO4 + 2НNO3 +13Н2О +2NO2
47.
48.
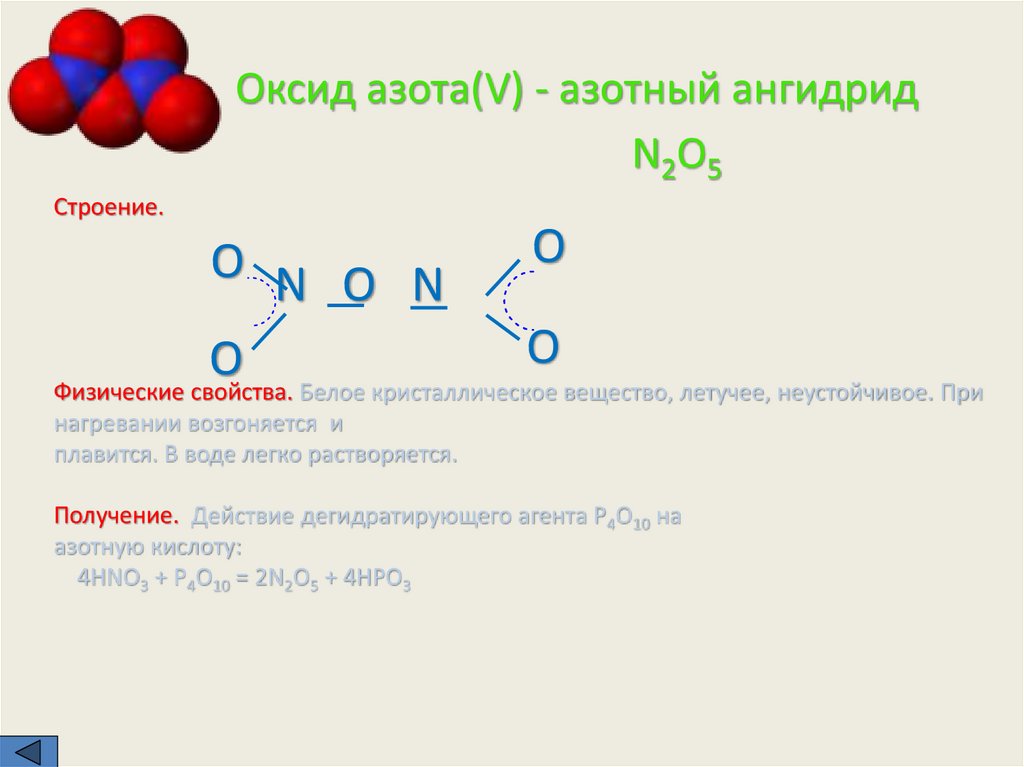
Опытным путем доказано, что двойная связьравномерно распределена между двумя атомами
кислорода. Степень окисления азота в азотной кислоте
равна +5, а валентность (обратите внимание) равна
четырем, ибо имеются только четыре общие
электронные пары. Связь – ковалентная полярная.
Кристаллическая решетка – молекулярная
49.
NaNO3+
H2SO4
t
NaHSO4
+
при этом получается дымящая азотная кислота
HNO3
50.
1. Окисления аммиaка в NO в присутствииплатино-родиевого катализатора:
4NH3 + 5O2 = 4NO + 6H2O
2. Окисления NO в NO2 на холоду под
давлением (10 ат):
2NO + O2 = 2NO2
3. Поглощения NO2 водой в присутствии
кислорода:
4NO2 + 2H2O + O2= 4HNO3
Массовая доля HNO3 составляет около
60%
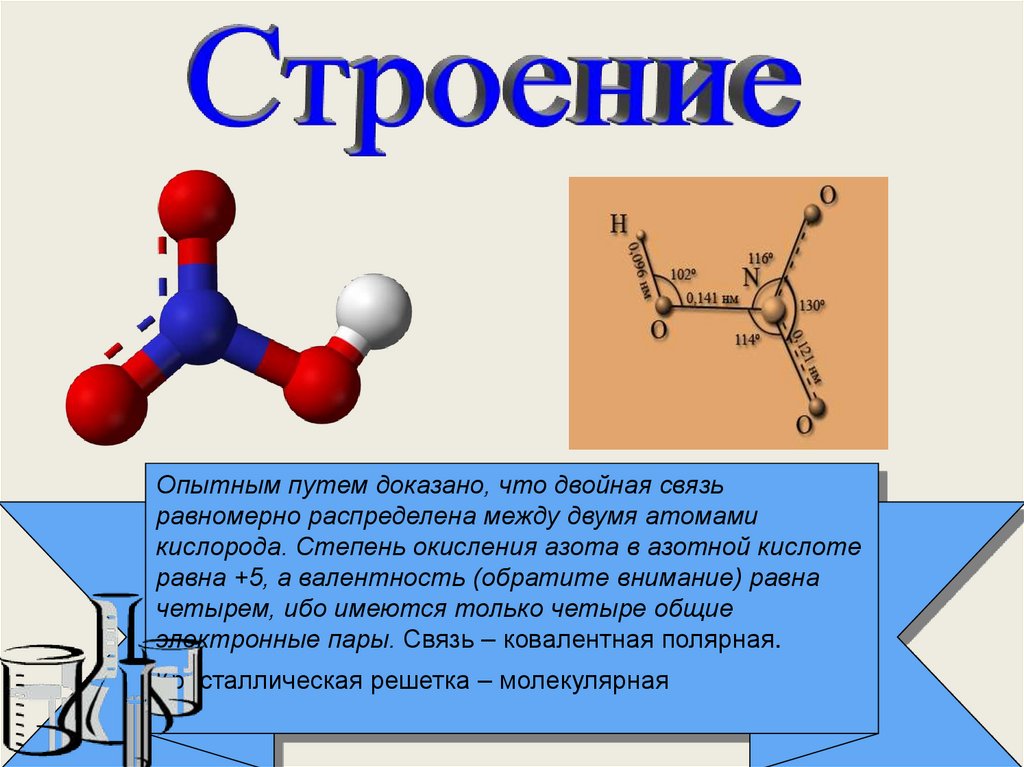
51. HNO3 – азотная кислота
Физические свойства1. Молярная масса 63,016 г/моль
2. Бесцветная жидкость с резким запахом,
«дымит» на воздухе, Т кип. = 86
3. Хорошо растворима в воде (сильная
одноосновная
кислота)
4. Молекула имеет
плоскую структуру
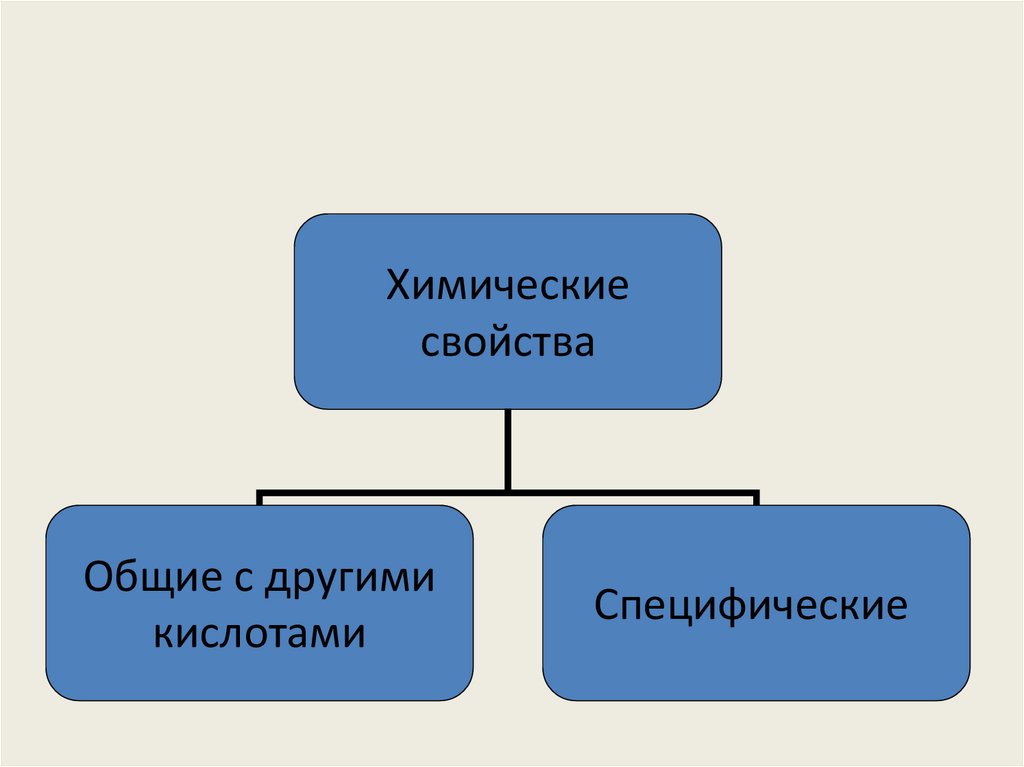
52.
Химическиесвойства
Общие с другими
кислотами
Специфические
53. Общие с другими кислотами
1) Изменяет цвет индикаторов (диссоциация)HNO3
2) Взаимодействие с основными и
амфотерными оксидами
CuO+2HNO3
3) Взаимодействие с основаниями и аммиаком
KOH+HNO3
NH3+HNO3
4) Взаимодействие с солями
Na2CO3+2HNO3
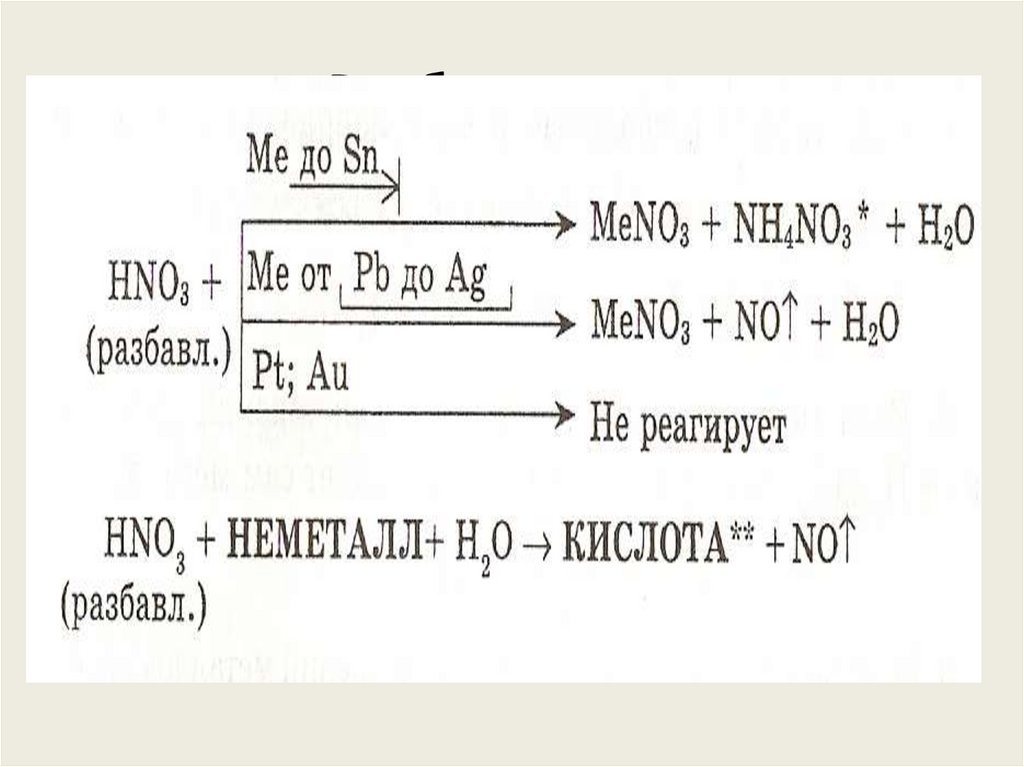
54. Специфические свойства – взаимодействие с металлами
ЗАПОМНИ!При взаимодействии азотной кислоты любой
концентрации с металлами водород никогда не
выделяется. Продукты зависят от металла и концентрации
кислоты.
55. Разбавленная
56. Концентрированная
57.
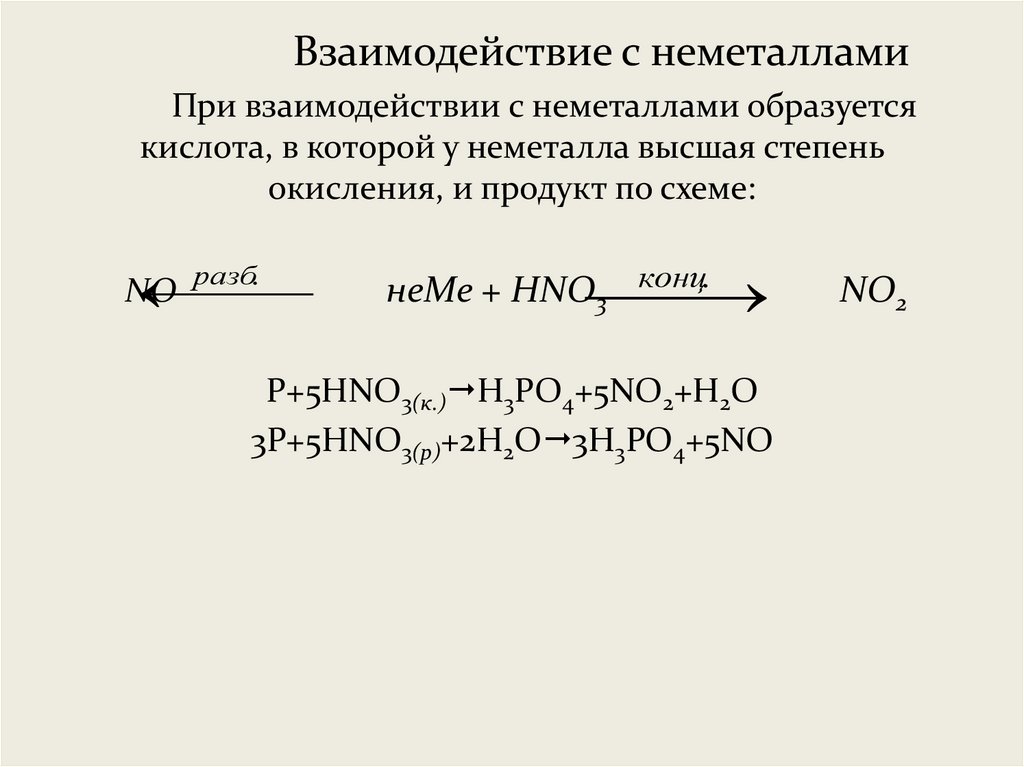
Взаимодействие с неметалламиПри взаимодействии с неметаллами образуется
кислота, в которой у неметалла высшая степень
окисления, и продукт по схеме:
разб.
NO
конц.
неMe + HNO
3
P+5HNO3(к.) H3PO4+5NO2+H2O
3P+5HNO3(р)+2H2O 3H3PO4+5NO
NO2
58. Действие на органические вещества
• Белки при взаимодействии с конц.азотнойкислотой разрушаются и приобретают
жёлтую окраску .
• Под действием азотной кислоты
воспламеняются бумага, масло, древесина,
уголь.
59. Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет даже
благородные металлы.Смесь HNO3 концентрации 100% и H2SO4
концентрации 96% при их соотношении по
объему 9:1 называют меланжем.
60. ФОСФОР
• В промышленностиФосфор получают восстановлением из
фосфата кальция, который входит в состав
апатита и фосфорита:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO.
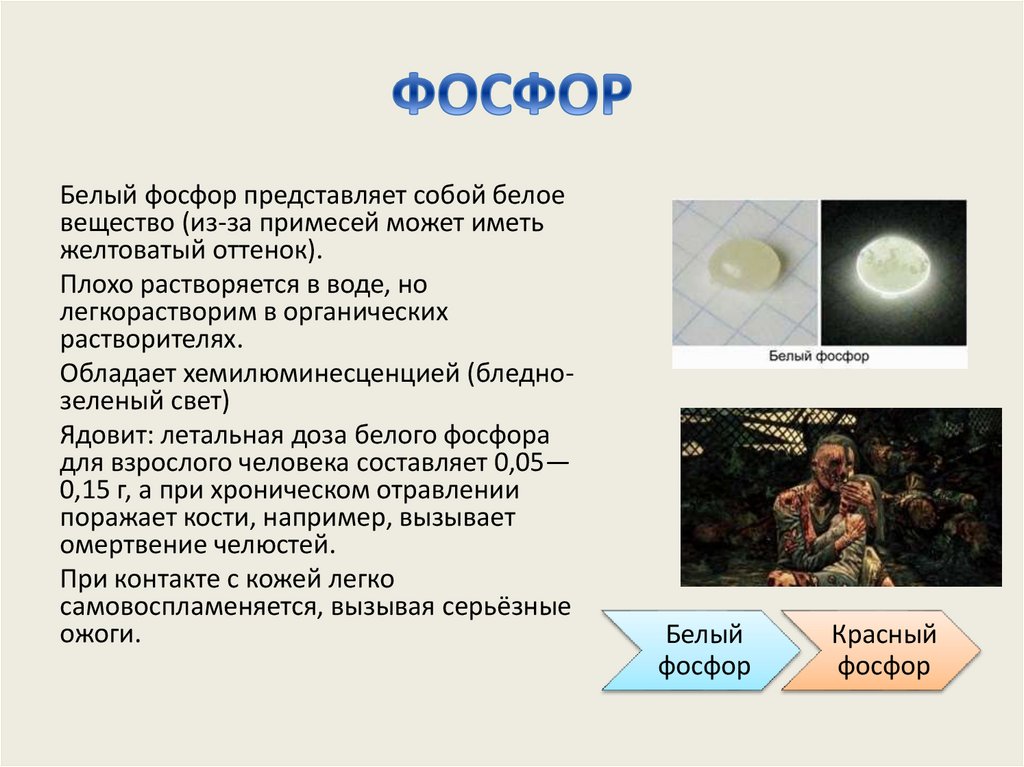
61. ФОСФОР
Белый фосфор представляет собой белоевещество (из-за примесей может иметь
желтоватый оттенок).
Плохо растворяется в воде, но
легкорастворим в органических
растворителях.
Обладает хемилюминесценцией (бледнозеленый свет)
Ядовит: летальная доза белого фосфора
для взрослого человека составляет 0,05—
0,15 г, а при хроническом отравлении
поражает кости, например, вызывает
омертвение челюстей.
При контакте с кожей легко
самовоспламеняется, вызывая серьёзные
ожоги.
Белый
фосфор
Красный
фосфор
62. ФОСФОР
Неочищенный белый фосфоробычно называют «жёлтый
фосфор». Сильно ядовитое,
огнеопасное кристаллическое
вещество от светло-жёлтого до
тёмно-бурого цвета.
В воде не растворяется, на
воздухе самовоспламеняется.
Горит ослепительным яркозеленым пламенем с
выделением густого белого
дыма
63. ФОСФОР
В зависимости от способаполучения и степени дробления,
красный фосфор имеет оттенки от
пурпурно-красного до фиолетового,
а в литом состоянии — тёмнофиолетовый с медным оттенком,
имеет металлический блеск.
Растворяется в свинце и висмуте.
На воздухе не воспламеняется, но
самовоспламеняется при ударе.
Менее ядовит.
Красный
фосфор
Пар
Белый
фосфор
64. ФОСФОР
Чёрный фосфор представляетсобой чёрное вещество с
металлическим блеском,
жирное на ощупь и весьма
похожее на графит, и с
полностью отсутствующей
растворимостью в воде или
органических растворителях.
Проводит электрический ток
и имеет свойства
полупроводника.
65. ФОСФОР
Металлическийфосфор – плотное
темно-серое вещество
с металлическим
блеском.
Металлический
фосфор очень хорошо
проводит
электрический ток.
Черный фосфор
Давление
Металлический
фосфор
66. 5. Химические свойства
67. ФОСФОР
Химическая активность фосфора значительно выше, чему азота. Химические свойства фосфора во многом
определяются его аллотропной модификацией. Белый
фосфор очень активен, в процессе перехода к красному и
черному фосфору химическая активность резко
снижается.
1. Взаимодействие с простыми веществами
А) Фосфор легко окисляется кислородом:
4P + 5O2 = 2P2O5,
4P + 3O2 = 2P2O3.
68. ФОСФОР
Б) Взаимодействует со многими простыми веществами –галогенами, серой, некоторыми металлами, проявляя
окислительные и восстановительные свойства:
- с металлами – окислитель, образует фосфиды:
2P + 3Ca = Ca3P2.
- с неметаллами – восстановитель :
2P + 3S = P2S3,
2P + 3Cl2 = 2PCl3.
Не взаимодействует с водородом.
69. ФОСФОР
2. Взаимодействие с водой4Р + 6Н2О = РН3 + 3Н3РО2
(фосфорноватистая кислота).
3. Взаимодействие со щелочами
4Р + 3KOH + 3Н2О = РН3 + 3KН2РО2 .
4. Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO;
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве
окислителя выступает бертолетова соль:
6P + 5KClO3 = 5KCl + 3P2O5.
70. фосфин
• Фосфин (фосфористый водород) при н.у.является ядовитым бесцветным газом,
имеющим запах чеснока.
• Фосфин хорошо растворяется в
органических растворителях, но
малорастворим в воде.
71. Химические свойства фосфина
• С сильными кислотами фосфин образует соли(содержат ион PH4+) - крайне неустойчивые, легко
гидролизующиеся, бесцветные кристаллы,
которые, как и сам фосфин, являются сильными
восстановителями:
PH3+HCl = PH4Cl (хлорид фосфония)
PH3+HClO4 = PH4ClO4 (перхлорат
фосфония)
72.
• В окислительно-восстановительных реакцияхфосфин является более сильным
восстановителем, чем аммиак
• При температуре порядка 150°C фосфин
самовоспламеняется на воздухе:
2P-3H3+4O2 = P2+5O5+3H2O
• Соли малоактивных металлов фосфин
восстанавливает до свободного металла:
P-3H+8Ag+1NO3+4H2O
+5
0
=H3P O4+8Ag +8HNO3
73. Получение фосфина:
• взаимодействием фосфора с воднымирастворами щелочей в реакциях
диспропорционирования:
4P0+3KOH+3H2O = P-3H3↑+3KH2P+1O2
• действием соляной кислоты на
фосфиды металлов:
Zn3P2+6HCl = 2PH3↑+3ZnCl2
74. Оксиды фосфора
• Фосфор является очень "плодовитым"элементом, образуя много разнообразных
оксидов и кислот.
• Самым устойчивым является оксид
фосфора P2O5(V), который
называется фосфорным ангидридом.
• Физические свойства фосфорного
ангидрида:
• Белый порошок, не имеющий запаха;
75. Химические свойства P2O5(V)
ХИМИЧЕСКИЕ СВОЙСТВА P2O5(V)• Фосфорный ангидрид является типичным
кислотным оксидом, активно
взаимодействует с водой, с
образованием фосфорных кислот:
P2O5+H2O = 2HPO3 (метафосфорная к-та)
P2O5+2H2O = H4P2O7 (пирофосфорная к-та)
P2O5+3H2O = 2H3PO4 (ортофосфорная к-та)
76. Взаимодействие фосфорного ангидрида с основаниями и основными оксидами:
• P2O5+3CaO = Ca3(PO4)2P2O5+6NaOH = 2Na3PO4+3H2O
• В реакциях со щелочами кислотный оксид
P2O5(V) образует, как средние, так и кислые
соли, в зависимости от соотношения
реагентов:
P2O5+4NaOH = 2Na2HPO4+H2O
P2O5+2NaOH+H2O = 2NaH2PO4
77. Получают P2O5(V) при горении фосфора в избытке кислорода: 4P+5O2 = 2P2O5
Получают P2O5(V) при горении фосфора визбытке кислорода:
4P+5O2 = 2P2O5
• Эффективное водоотнимающее средство,
способен превращать азотную и серную
кислоты в оксиды:
• 2HNO3 + P2O5 = 2HPO3 + N2O5;
• H2SO4 + P2O5 = 2HPO3 + SO3.
78. Оксид фосфора P2O3(III)
ОКСИД ФОСФОРА P2O3(III)• оксид фосфора P2O3(III) имеет несколько
модификаций, это ядовитое вещество белого
цвета, похожее на воск.
• Свойства оксида P2O3(III) кислотный оксид,
образующий фосфористую кислоту (является
сильным восстановителем, как и ее соли) при
его растворении в воде:
P2O3+3H2O = 2H3PO3
79.
• P2O3(III) реагирует с основаниями иосновными оксидами с образованием
фосфитов (солей фосфористой кислоты):
P2O3+4NaOH = 2Na2HPO3+H2O
• Получают оксид фосфора P2O3(III)
окислением фосфора при недостатке
кислорода:
4P+3O2 = 2P2O3
80. Кислоты фосфора
• Дифосфорная кислота (H4P2O7)• Метафосфорная кислота (HPO3)
• Ортофосфорная кислота (H3PO4)
• Фосфористая кислота (H2(PHO3))
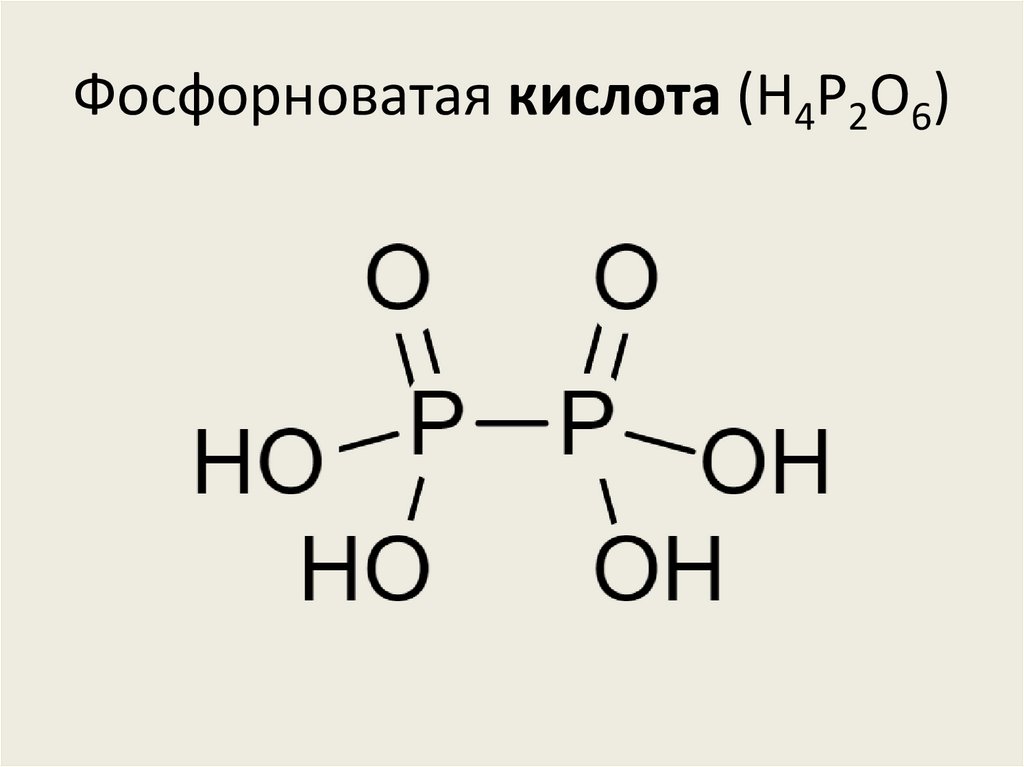
• Фосфорноватая кислота (H4P2O6)
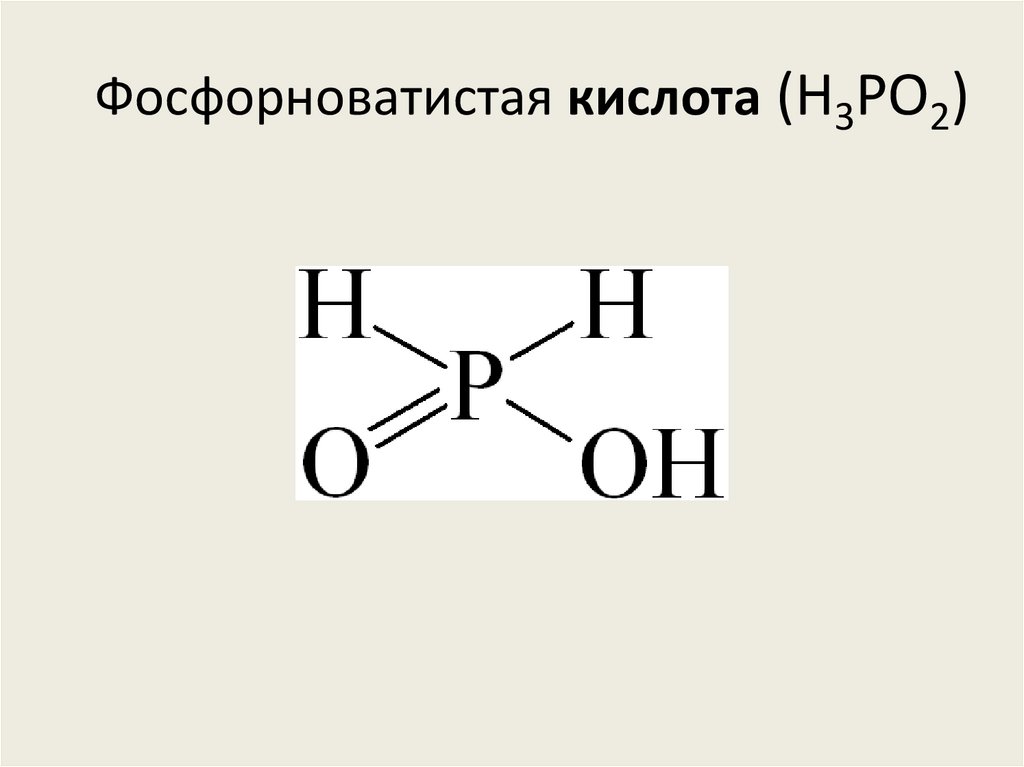
• Фосфорноватистая кислота (H3PO2)
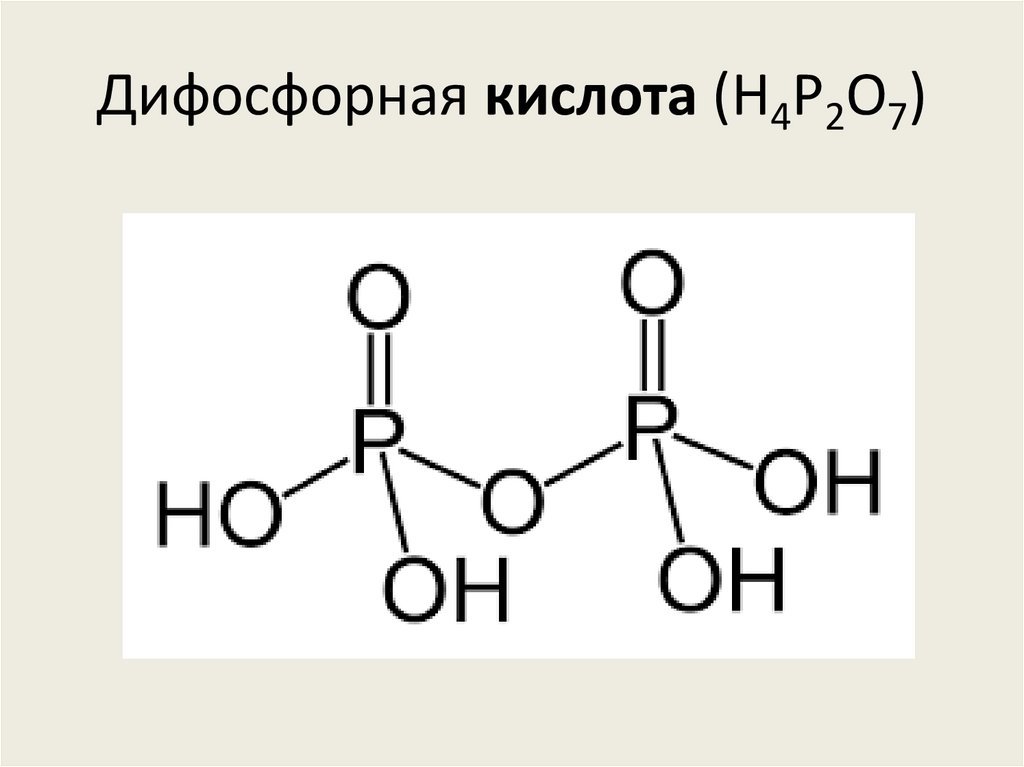
81. Дифосфорная кислота (H4P2O7)
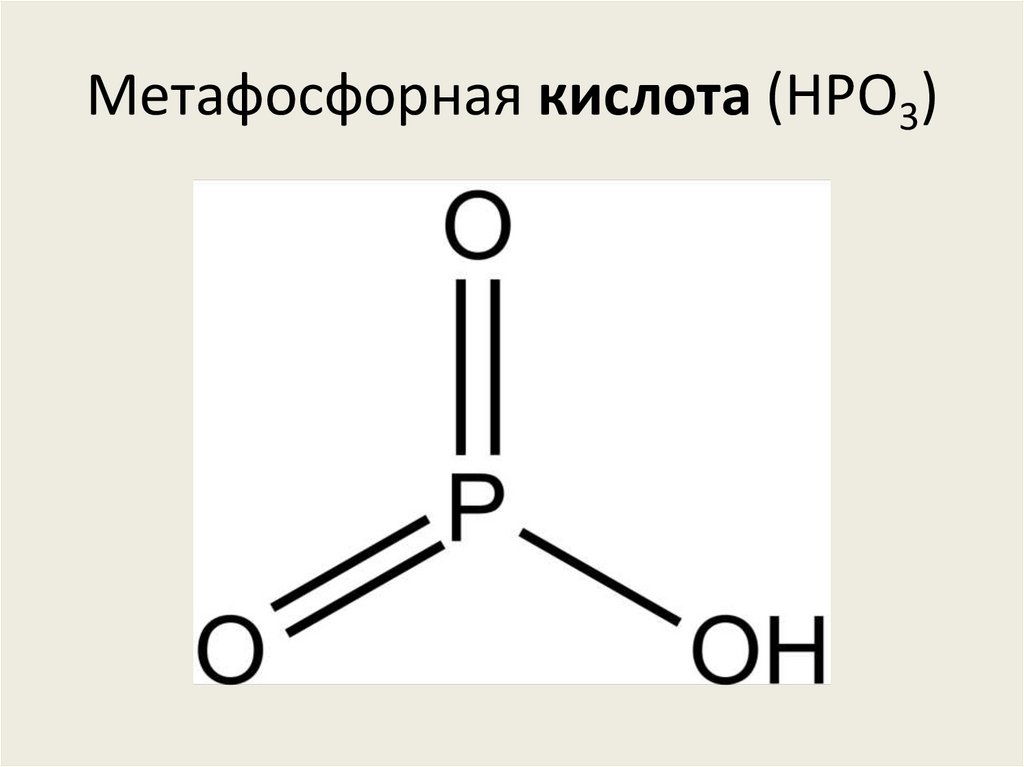
Дифосфорная кислота (H4P2O7)82. Метафосфорная кислота (HPO3)
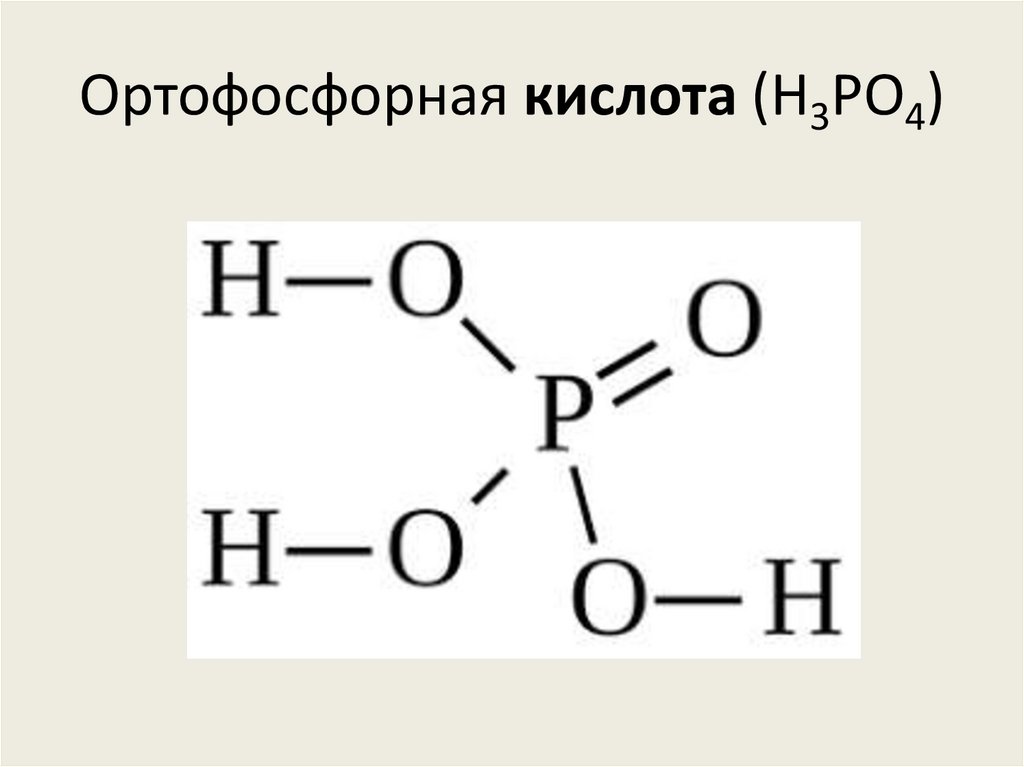
Метафосфорная кислота (HPO3)83. Ортофосфорная кислота (H3PO4)
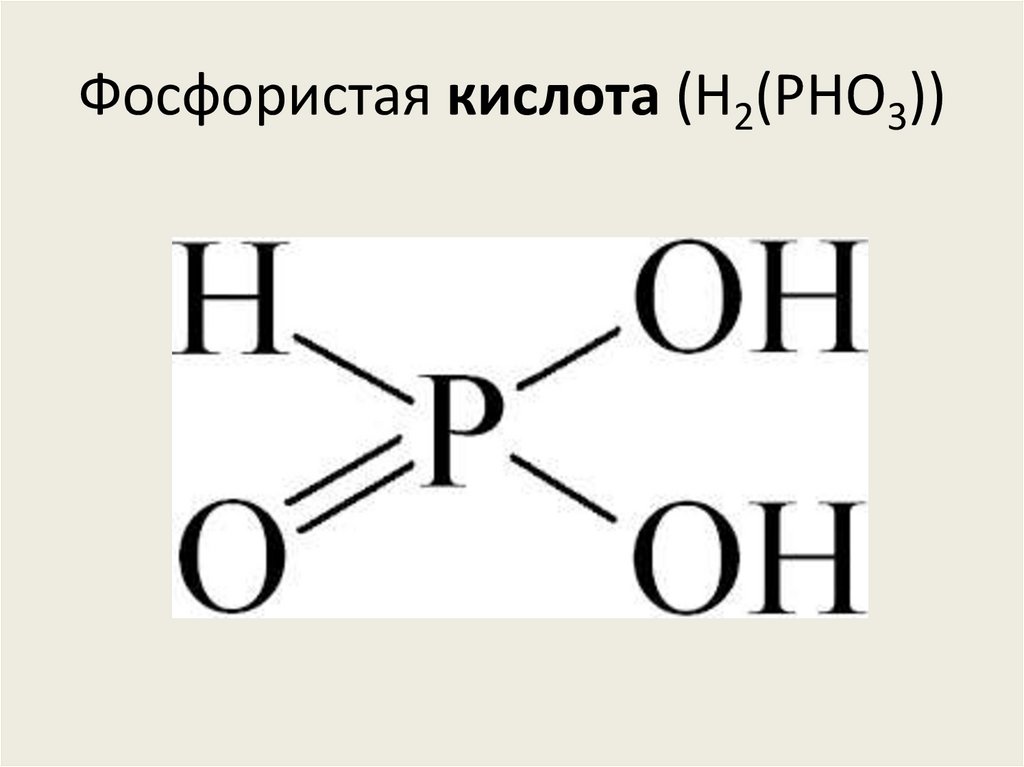
Ортофосфорная кислота (H3PO4)84. Фосфористая кислота (H2(PHO3))
Фосфористая кислота (H2(PHO3))85. Фосфорноватая кислота (H4P2O6)
Фосфорноватая кислота (H4P2O6)86. Фосфорноватистая кислота (H3PO2)
Фосфорноватистая кислота (H3PO2)87. 6. Получение
88. ЗАДАНИЕ
№1. Осуществите превращения по схеме:N2→Li3N→NH3
№2. Составьте уравнения реакции
взаимодействия азота с кислородом, магнием и
водородом. Для каждой реакции составьте
электронный баланс, укажите окислитель и
восстановитель.
№3. В одном цилиндре находится газ азот, в
другом - кислород, а в третьем - углекислый газ.
Как различить эти газы?











































































 Химия
Химия