Похожие презентации:
Кинетика химических реакций
1. Кинетика химических реакций
Химическая кинетика – это учение о химическом процессе, его механизме изакономерностях протекания во времени.
Химическая кинетика устанавливает:
временные закономерности протекания химических реакций;
связь между скоростью реакции и условиями ее проведения;
выявляет факторы, влияющие на скорость и направление химических
реакций.
Важнейшая задача химической кинетики: выяснение механизма химических
превращений, взаимосвязи между скоростью химической реакции и
строением молекул реагирующих веществ; изучение элементарных
реакций с участием активных частиц: свободных атомов и радикалов,
ионов и ион – радикалов, возбужденных молекул и др.
2. Основоположники химической кинетики
Якоб Хендрик Вант-Гофф (нидерл.Jacobus Henricus (Henry) van 't
Hoff; 1852, — 1911, Роттердам) —
голландский химик, первый
лауреат Нобелевской премии по
химии (1901 год)
Сва́нте А́вгуст Арре́ниус (1859—
1927, имение Вейк) —
выдающийся шведский физикохимик и астрофизик, лауреат
Нобелевской премии по химии
(1903).
3.
Э́ЙРИНГ (Eyring) Генри (1901-1981),американский физикохимик.
Область изучения - квантовая
химиия и химическая кинетика.
Один из создателей теории
абсолютных скоростей реакций.
Ввел в химию термин
«активированный комплекс».
ПОЛЯНИ (Polanyi) Майкл
(1891 - 1976 ). Основные работы
посвящены физической химии,
прежде всего химической кинетике
и изучению кристаллических
структур.
4. Введение в кинетику
Стехиометрия.Химическую
реакцию
принято
записывать
в
форме
стехиометрического уравнения. Последнее представляет собой
простейшее отношение числа молекул реагентов и продуктов и
является количественным соотношением
между исходными
реагентами и продуктами.
Нельзя считать, что стехиометрическое уравнение обязательно
отражает механизм молекулярного процесса между реагентами.
Стехиометрическое уравнение для производства аммиака по Габеру
имеет вид:
N2 + 3H2 =2NH3 ,
но это вовсе не означает, что три молекулы водорода и одна азота,
одновременно сталкиваясь, дают две молекулы аммиака.
5.
Молекулярность - число молекул реагентов, участвующих в простойреакции, состоящей из одного элементарного акта. Большинство
элементарных реакций имеет молекулярность один или два, хотя
некоторые реакции происходят путем одновременного столкновения трех
молекул и, в очень редких случаях, в растворах, молекулярность равна
четырем.
В зависимости от числа исходных частиц, участвующих в элементарном
акте, говорят о разной молекулярности реакции.
В
мономолекулярной
реакции
участвует
одна
частица
и
молекулярность
равна единице. Например, реакция изомеризации:
СН2
СН2
СН2=СН-СН3
СН2
6.
В бимолекулярной реакции взаимодействуют две одинаковыеили неодинаковые молекулы реагентов с образованием одной или
нескольких молекул продукта. Молекулярность равна двум.
Например, реакция присоединения:
СН2=СН2+HI →CH3-CH2-I
В
тримолекулрной
реакции
одновременно
происходит
столкновение трех молекул с образованием продукта. Такие реакции
встречаются крайне редко. Молекулярность равна трем.
H·+ H·+ Ar
,
H2+Ar
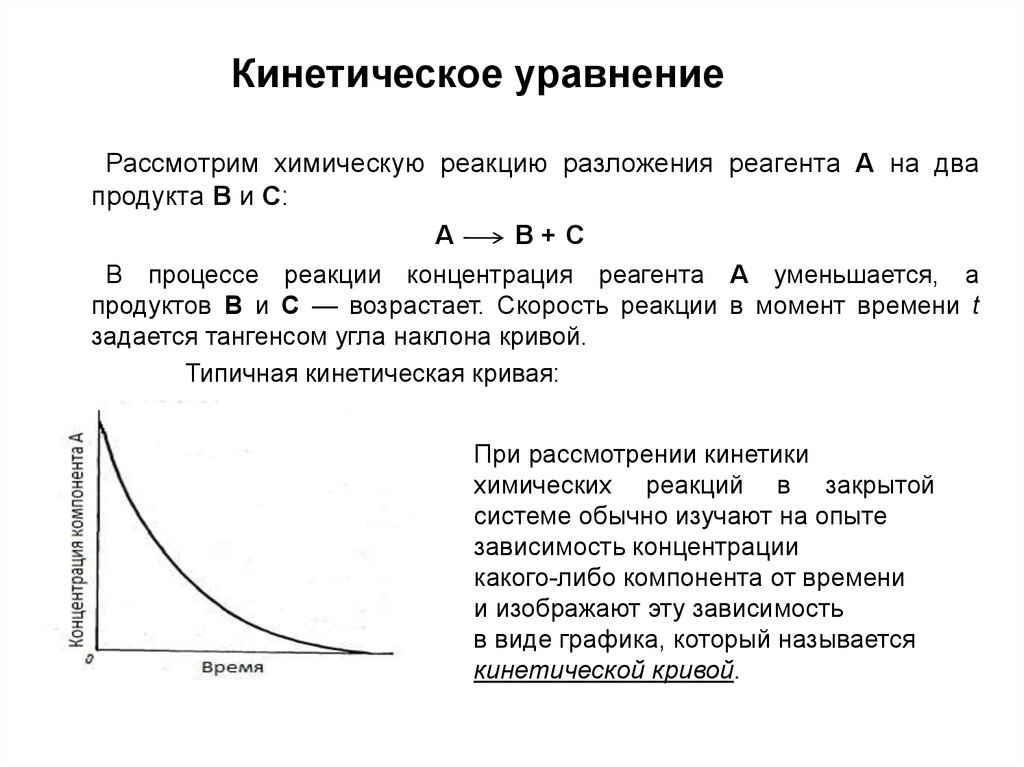
7. Кинетическое уравнение
Рассмотрим химическую реакцию разложения реагента A на двапродукта В и С:
А
В+С
В процессе реакции концентрация реагента А уменьшается, а
продуктов В и С — возрастает. Скорость реакции в момент времени t
задается тангенсом угла наклона кривой.
Типичная кинетическая кривая:
При рассмотрении кинетики
химических реакций в закрытой
системе обычно изучают на опыте
зависимость концентрации
какого-либо компонента от времени
и изображают эту зависимость
в виде графика, который называется
кинетической кривой.
8.
d[A]υ
dt
;
d[B] d[C]
υ
dt
dt
-скорость реакции, кмоль/ м3, моль/л.
Скорость реакции равна скорости уменьшения концентрации реагента А во
времени. Кроме того, скорость реакции определяется так же, как скорость
увеличения концентрации продуктов В или С во времени. Скорость реакции
зависит от концентраций реагентов, поэтому одновременно с уменьшением
концентрации А снижается и скорость реакции.
Соотношение между скоростью и концентрацией называют кинетическим
уравнением:
d[A]
n
k[A]
dt
,
где k – константа скорости; n – порядок реакции.
Константа и скорость реакции не зависят от концентрации продуктов.
9.
Порядок реакцииЕсли зависимость скорости скорости реакции от концентрации
реагирующих веществ записывается в виде:
n1
n2
nl
1
2
l
,
то величины ni
(i=1, 2, …) принято называть порядком реакции
относительно вещества Ai
υ k[A ] [A ] ...[A ]
Порядок реакции есть сумма показателей степени n1 + n2 + n3 + …, где
порядок
относительно
реагента
A1—n1,относительно
A2—n2,
относительно A3— n3 и т. д.
А
В+С
Если для приведенной выше реакции экспериментально найдено, что
скорость пропорциональна концентрации реагента А, реакция
называется реакцией первого порядка, так как
d[A]
k[A]
dt
Если скорость пропорциональна квадрату концентрации реагента А,
реакция называется реакцией второго порядка, так как
d[A]
2
k[A]
dt
10.
Константа скоростиКонстанта скорости химического процесса – это множитель в кинетическом
уравнении, показывающий, с какой скоростью идет химический процесс при
концентрациях реагирующих веществ, равных единице.
Единицы измерения константы скорости зависят от порядка реакции. Так
для реакций константа скорости измеряется в единицах :
первого порядка второго порядка нулевого порядка третьего порядка —
[время]-1;
[концентрация]-1·[время]-1, например, дм3•моль-1•с-1.
моль•дм-3•с-1
дм6•моль-2•с-1
В общем случае константа скорости реакции n-го порядка измеряется в
единицах [концентрация]1-n·[время]-1..
Константы скорости реакций разных порядков являются разными
физическими величинами и сопоставление их абсолютных значений не
имеет смысла.
11.
Кинетические уравнения первого порядкаРассмотрим реакцию:
А
Продукты.
Пусть а — начальная концентрация реагента А; x —уменьшение ее за время
t. Тогда концентрация А в момент t равна а —х. Выражение для скорости
реакции примет вид
и кинетическое уравнение
можно записать как
d[A]
k[A]
dt
- дифференциальное
кинетическое уравнение
первого порядка
Интегрированием последнего уравнения получаем:
a - интегральное кинетическое
kt ln(
) уравнение первого порядка
a x
2
1
12.
Определение константы скорости реакции первого порядкаВыразим константу скорости реакции из уравнения(2):
1
a
k ln(
)
t
a x
3
Или используя десятичный логарифм:
2,303
a
k
lg(
)
t
a x
4
13.
Метод подстановкиЗная значения а – х, то есть текущие концентрации реагента А в разные
моменты времени t, полученные величины подставляют в уравнение (3) или
(4) и определяют среднее значение константы скорости.
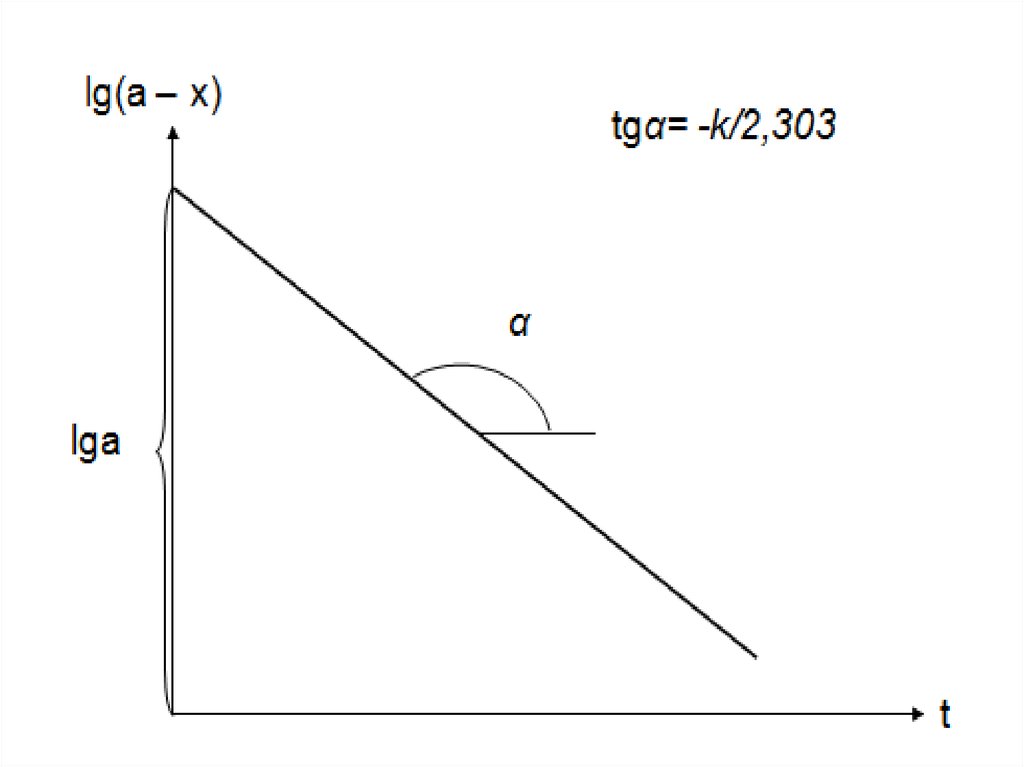
Графический метод
Из уравнения (4) видно, что для реакции первого порядка зависимость
a
lg(
) от t должна представлять собой прямую с тангенсом угла наклона,
a x
равным k/2,303. Уравнение (4) можно также преобразовать к виду
kt
lg(a x) lga
2,303
Зависимость lg(a – x) от t будет линейной с тангенсом угла наклона,
равным -k/2,303.
Строится график в координатах [ lg(a – x), t ]. Константа скорости
определяется из угла наклона полученной прямой. Графическое
определение k дает лучшие результаты, чем метод подстановки.
14.
15.
Кинетические уравнения второго порядкаРассмотрим реакцию:
А+В
Продукты.
Пусть начальные концентрации реагентов А и В равны cоответственно а и b,
и х — уменьшение концентраций реагентов А и В за время t. Тогда в
момент t концентрации A и В равны а —х и b —х. Кинетическое
уравнение:
d[A]
d[B]
k[A][B]
dt
dt
принимает вид
dx
k(a x) b - x
dt
- дифференциальное
кинетическое уравнение
второго порядка
Интегрированием последнего уравнения получаем:
ln(a x) ln(b x)
kt
const
a b
5
16.
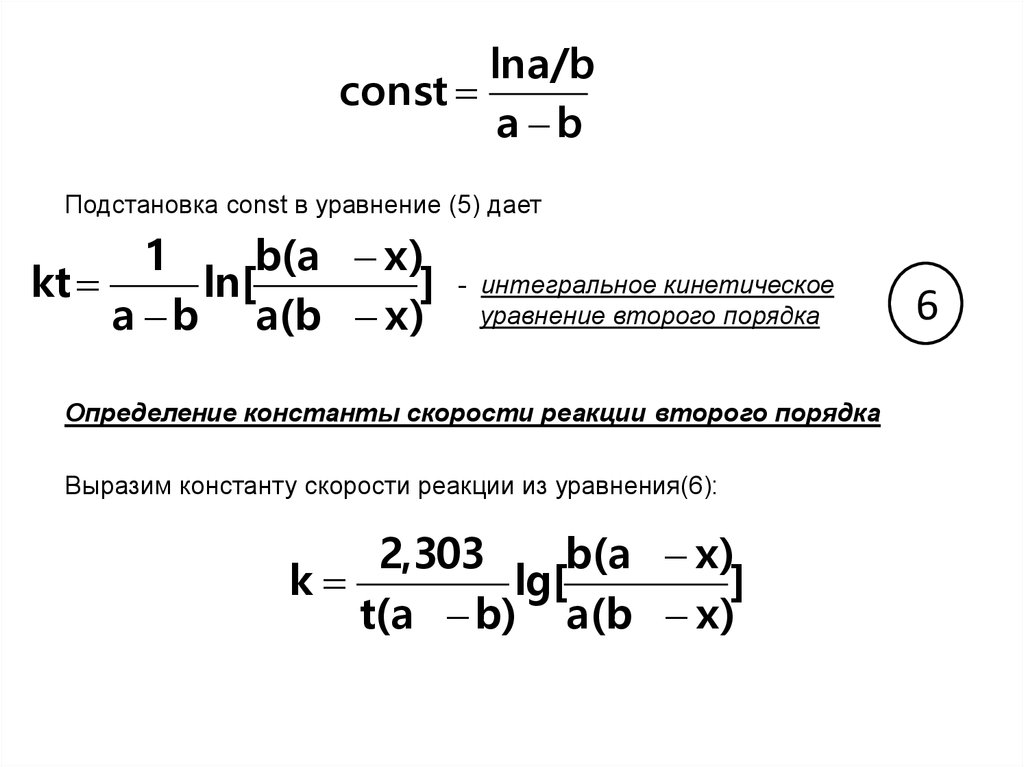
lna/bconst
a b
Подстановка const в уравнение (5) дает
1
b(a x)
kt
ln[
]
a b a(b x)
- интегральное кинетическое
уравнение второго порядка
Определение константы скорости реакции второго порядка
Выразим константу скорости реакции из уравнения(6):
2,303
b(a x)
k
lg[
]
t(a b) a(b x)
6
17.
Метод подстановкиКонстанту скорости рассчитывают путем подстановки экспериментальных
значений а - х и b - х, установленных в разные моменты t, в уравнение (6).
Если получаемые при этом значения k постоянны в пределах ошибки
эксперимента, то принимают, что реакция подчиняется кинетическому
уравнению второго порядка.
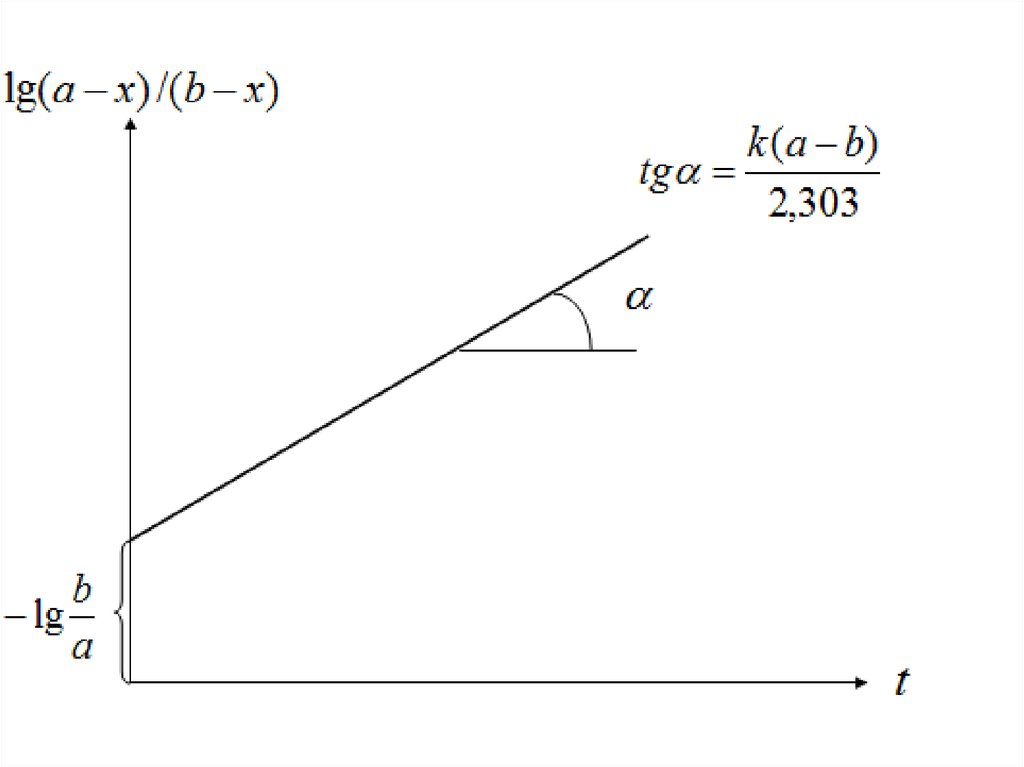
Графический метод
Для реакции второго порядка уравнение (6) можно преобразовать к виду
b k(a b)
a x
lg
t
lg
a
2,303
b x
Зависимость \g(a — x)/(b — х) от t должна быть линейной с тангенсом
угла наклона, равным k(a—b)/2,303, из которого можно найти k.
18.
19.
Кинетические уравнения третьего порядкаРассмотрим в общем виде реакцию третьего порядка
А+В+С
Продукты.
Если a, b и с — начальные концентрации реагентов А, В и С
соответственно их — уменьшение этих концентраций за время t, то
дифференциальное кинетическое уравнение третьего порядка имеет
вид
dx
k a - x b x c x
dt
В простейшем случае, когда все начальные концентрации одинаковы и
равны а, предыдущее уравнение может иметь вид
dx
3
k(a x)
dt
7
После интегрирования уравнения (7) получим
1
kt const
2
2(a x)
8
20.
1const
2
2a
Подстановка const в уравнение (8) дает
1
1
kt
2
2
2(a x) 2a
Константу скорости можно
экспериментальных данных
зависимости 1/(а—х)2 от t .
- интегральное кинетическое
уравнение третьего порядка
9
определить подстановкой соответствующих
в уравнение (9), или из графической
21.
Кинетика сложных реакцийБольшинство реакций являются сложными и состоят из нескольких
элементарных стадий при этом все многообразие сложных реакций можно
свести к комбинации нескольких типов простейших сложных реакций, а
именно двусторонних (обратимых), параллельных и последовательных
реакций.
Для описания кинетики сложных реакций используют принцип
независимости, согласно которому при протекании в системе нескольких
реакций каждая из них протекает независимо от других и подчиняется
основному закону кинетики. Следует заметить, что этот принцип не является
абсолютно строгим и не выполняется, например, для сопряженных реакций.
Двусторонние (обратимые) реакции
Рассмотрим обратимую реакцию первого порядка
k1
А
к-1
В
где k1 и k -1 — константы скорости соответственно прямой и обратной
реакций.
22.
Пусть а — начальная концентрация реагента А, х — уменьшениеконцентрации А за время t и хе—уменьшение концентрации А при
достижении равновесия. Тогда концентрации реагентов А и В составляют:
Концентрации
Реагент
Начальные
В момент t
Равновесные
А
а
а-х
а-хе
В
0
х
хе
Скорость реакции определяется уравнением
dС А
(k1 k 1 )(С А С А )
dt
Где
СА
- равновесная концентрация вещества А.
,
10
23.
Интегрирование кинетического уравнения (10) при начальных условияхСА=СА,0 и t=0 приводит к следующему выражению
ln
С А0 C A
CA CA
(k
1
k 1 )t
Полученное соотношение можно записать в виде:
ln(C
A
C A ) ln(C
A0
C A ) (k
1
k 1 )t
Таким образом, при обратимой реакции должна соблюдаться линейная
зависимость
.
ln(C
A
CA )
Определив из экспериментальных данных равновесные значения C и
A
можно вычислить константу равновесия
СВ
C A0 C B 0 C A
CB
Kc
C A0 C B 0 C B
CA
По значениям величины(k
и K можно вычислить k и k :
k
)
1
1
1
1
Kc
k1
(k
1 K c
1
k 1 )
c
k 1
k1 k 1
1 K c
24.
Последовательные реакцииРассмотрим две последовательные реакции первого порядка:
k1
Р
A
k2
Р
В
Кинетика процесса описывается системой двух дифференциальных
уравнений и одного уравнения материального баланса:
dС А
k1С А
dt
dС Р
k1С А k 2C P
dt
С А C P C B C A0
11
12
25.
Интегрированием уравнения (11) при начальных условиях СА=СА,0 и t=0получают зависимость изменения концентрации исходного реагента А во
времени
С А С А0 е
k1t
или
ln
C A0
CA
k1t
13
Таким образом, в координатах ln(СА,0/CA) – t определяют значение
константы скорости k1 как тангенс угла наклона.
Подстановка выражения (13) в дифференциальное уравнение (12)
приводит к уравнению :
dС Р
k1С А 0 е k1t k 2C P
dt
26.
При интегрировании полученного дифференциального уравнения приначальных условиях: СР=0, СА=СА,0 и t=0, получают зависимость
накопления промежуточного продукта Р во времени:
СР
k1C A 0
(e
k 2 k1
k1t
e k 2 t )
С помощью уравнения материального баланса и кинетических уравнений
для А и Р (11 и 12) находят выражение для конечного продукта В:
С B C A0
k 2C A 0
k 2 k1
e
k1t
k1C A 0
k 2 k1
e k 2 t
27.
Параллельные реакцииРассмотрим две параллельные реакции первого порядка, в которых
вещество А одновременно превращается по двум направлениям:
k1
В1
A
k2
A
В2
Дифференциальное уравнение для вещества А имеет вид:
dC A
k1C A k 2C A (k
dt
1
k 2 )C
A
Интегрирование этого уравнения СА=СА,0 и t=0 приводит к выражению:
С A C A0 e
(k
1 k 2
)t
28.
Дифференциальные уравнения для продуктов В1 и В2 имеют следующий вид:dC B1
dt
dC B 2
dt
k1С A k1C A0 e
(k
1 k 2
)t
k 2С A k 2C A 0 e
(k
1 k 2
)t
Интегрирование этих уравнений соответственно при начальных условиях
СВ1=0, СВ2=0 и t=0 приводит к выражениям:
C B1
C B2
k1C A0
(1 e
(k
1 k 2
)t
)
(k
1 k 2
)t
)
k1 k 2
k 2C A 0
(1 e
k1 k 2
29.
Таким образом, для химического процесса, протекающего по схемепараллельных реакций, соотношения концентраций продуктов реакции СВ1
и СВ2 в любой момент времени постоянно и равно k1/k2. Доля продукта В1 в
продуктах реакции определяется величиной k1/(k1+k2).
Сопряженные реакции
Реакции вида: А + В→ М (1)
и А + D→ N (2)
Из которых одна реакция (2) протекает лишь совместно с другой, то есть
индуцируется (1) реакцией. При этом вещество В называется индуктором,
вещество А (участвующее в обеих реакциях) называется актором.
Вещество D – акцептор. Связующим звеном в таких реакциях является
промежуточный продукт, образованный в результате 1-ой реакции.
Шилов классифицировал реакции на 3 группы. В основе классификации он
положил зависимость концентрации индукторов от времени.
1) реакции, когда концентрация индукторов во времени убывает. Это
обычные сопряженные реакции.
2) реакции, когда концентрация индукторов во времени не меняется. Это
каталитические реакции.
3) реакции, когда концентрация индукторов во времени возрастает. Это
самоускоряющиеся автокаталитические реакции.
30. Цепные реакции многие гомогенные реакции имеют особенности: 1) реакции не подчиняются уравнению первого, второго и высших порядков. 2) скоро
Цепные реакциимногие гомогенные реакции имеют особенности:
1) реакции не подчиняются уравнению первого, второго и высших
порядков.
2) скорость реакции очень велика.
3) необычайная чувствительность к следам примесей.
4) зависимость скорости реакции от формы и размеров
реакционного сосуда, а так же от материала стенок из которого
изготовлен реакционный сосуд.
5) наличие индукционного периода, когда реакция начинается не
сразу, а спустя некоторое время.
6) возможность протекания реакции в определенном интервале
давления.
Все эти положения легко объясняются цепным механизмом реакции.
Сущность заключается в том, что вначале в системе образуются
активные частицы чаще всего это свободные радикалы. Эти частицы
вступают в реакцию, но при этом вновь возникает валентно
насыщенный радикал. Процесс исчезновения и появления каждой
активной частицы и создает цепь превращений.
31.
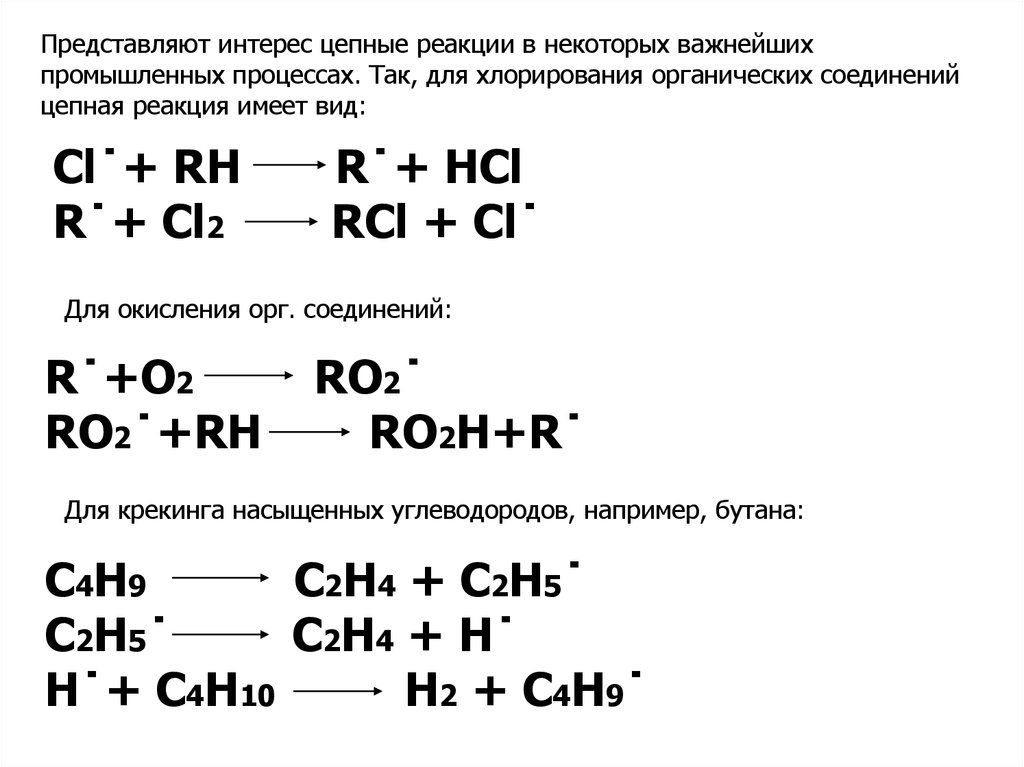
Представляют интерес цепные реакции в некоторых важнейшихпромышленных процессах. Так, для хлорирования органических соединений
цепная реакция имеет вид:
Cl˙+ RH
R˙+ Cl2
R˙+ HCl
RCl + Cl˙
Для окисления орг. соединений:
R˙+O2
RO2˙+RH
RO2˙
RO2H+R˙
Для крекинга насыщенных углеводородов, например, бутана:
C4H9
C2H4 + C2H5˙
C2H5˙
C2H4 + H˙
H˙+ C4H10
H2 + C4H9˙
32. Метод стационарных концентраций
Для описания кинетики многостадийных реакций можно использоватьприближенный метод стационарных концентраций Боденштейна. В
его основе лежит положение о том, что через некоторое небольшое
время после начала реакции скорость образования промежуточного
продукта становится примерно равной скорости его распада и
суммарную скорость изменения концентрации неустойчивого
промежуточного продукта можно считать приблизительно равной нулю
в течение достаточно длительного времени, то есть в течение этого
времени устанавливается стационарная концентрация неустойчивого
продукта.
Рассмотрим реакцию, которая протекает по схеме:
2О3 3О 2
k1
О3 О2 О
k2
k3
О О3 2О2
О
– интермедиат
33.
Запишем дифференциальное кинетическое уравнение по интермедиату:dC 0
k1С 03 k 2C 02 C 0 k 3C 0C 03 0
dt
k1C 03
C0
k 2C 02 k 3C 03
Запишем дифференциальное уравнение по озону:
dC 03
k1С 03 k 2C 02 C 0 k 3C 0C 03 0
dt
Подставляем выражение для
C 0:
dC 03
k1C 03
k1C 03
k1С 03 k 2C 02
k 3C 03
dt
k 2C 02 k 3C 03
k 2C 02 k 3C 03
2
dC 03
2k1k 3C 03
dt
k 2C 02 k 3C 03




























 Физика
Физика Химия
Химия








