Похожие презентации:
Основы термодинамики. Урок физики в 10 классе
1. Основы т ермодинамики
Основытермодинамики
Урок физики в 10 классе
2. Основы термодинамики
_________Термодинамика – теория тепловых
процессов, в которой не учитывается
молекулярное строение тел.
3.
Внутренняя энергия• Определение:
Внутренняя энергия тела – это сумма
кинетической энергии хаотического
теплового движения частиц (атомов и молекул) тела и потенциальной энергии их
взаимодействия
• Обозначение:
• Единицы измерения:
U
[Дж]
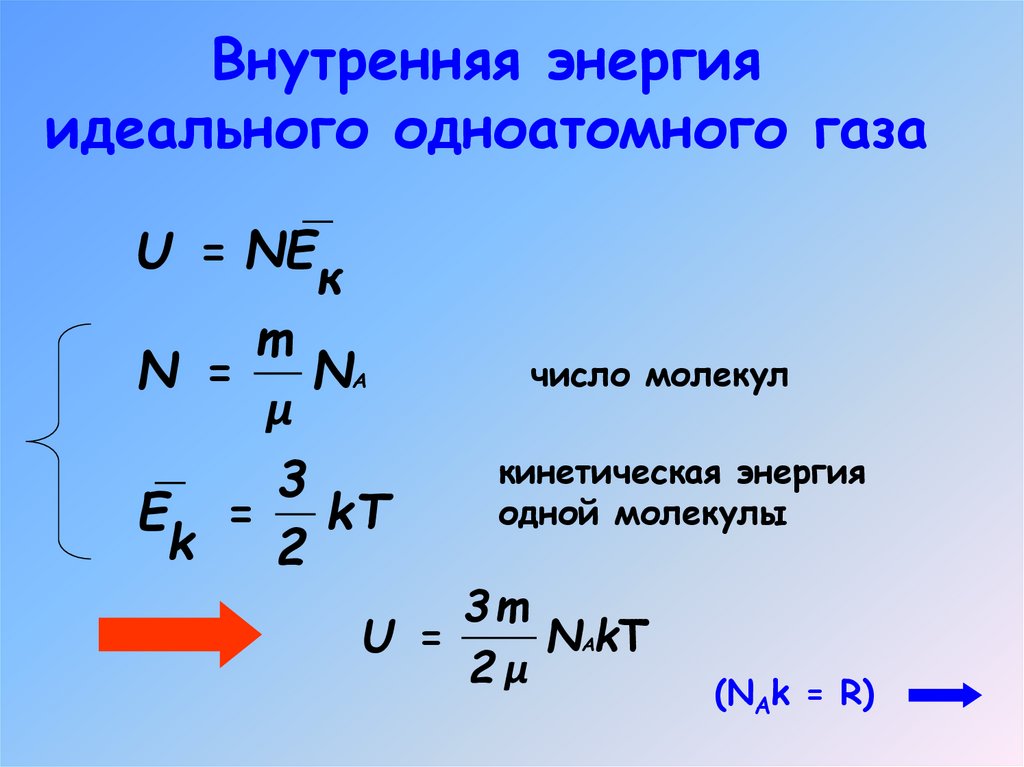
4. Внутренняя энергия
идеального одноатомного газаU = NE
к
m
N =
NА
μ
3
E = kT
k
2
число молекул
кинетическая энергия
одной молекулы
3m
U =
NАkT
2μ
(NAk = R)
5. Внутренняя энергия идеального одноатомного газа
3 mU =
RT
2 μ
Внутренняя энергия идеального одноатомного газа зависит лишь
от одного термодинамического параметра - температуры
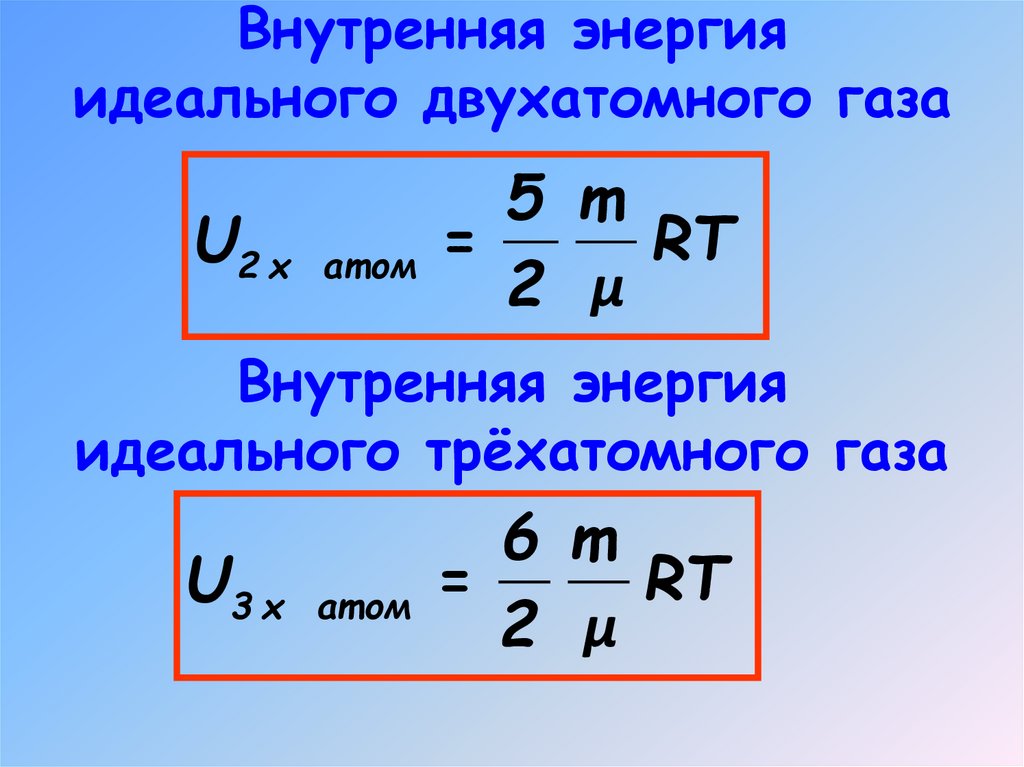
6. Внутренняя энергия идеального одноатомного газа
Внутренняя энергияидеального двухатомного газа
5 m
U2 х ат ом =
RT
2 μ
Внутренняя энергия
идеального трёхатомного газа
6 m
U3 х ат ом =
RT
2 μ
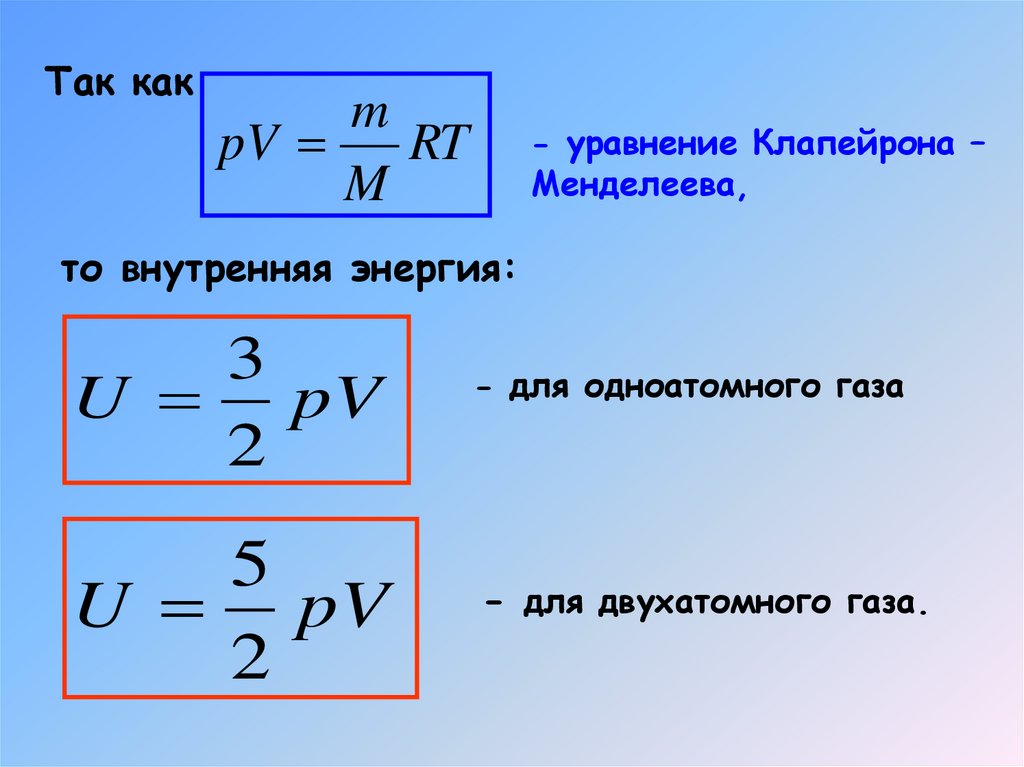
7. Внутренняя энергия идеального двухатомного газа
Так какm
pV
RT
M
- уравнение Клапейрона –
Менделеева,
то внутренняя энергия:
3
U pV
2
5
U pV
2
- для одноатомного газа
- для двухатомного газа.
8.
В общем виде:i m
i
U
RT pV
2M
2
где i – число степеней свободы молекул
газа (i = 3 для одноатомного газа и i = 5
для двухатомного газа), i = 6 для
трёхатомного газа),
9. В общем виде:
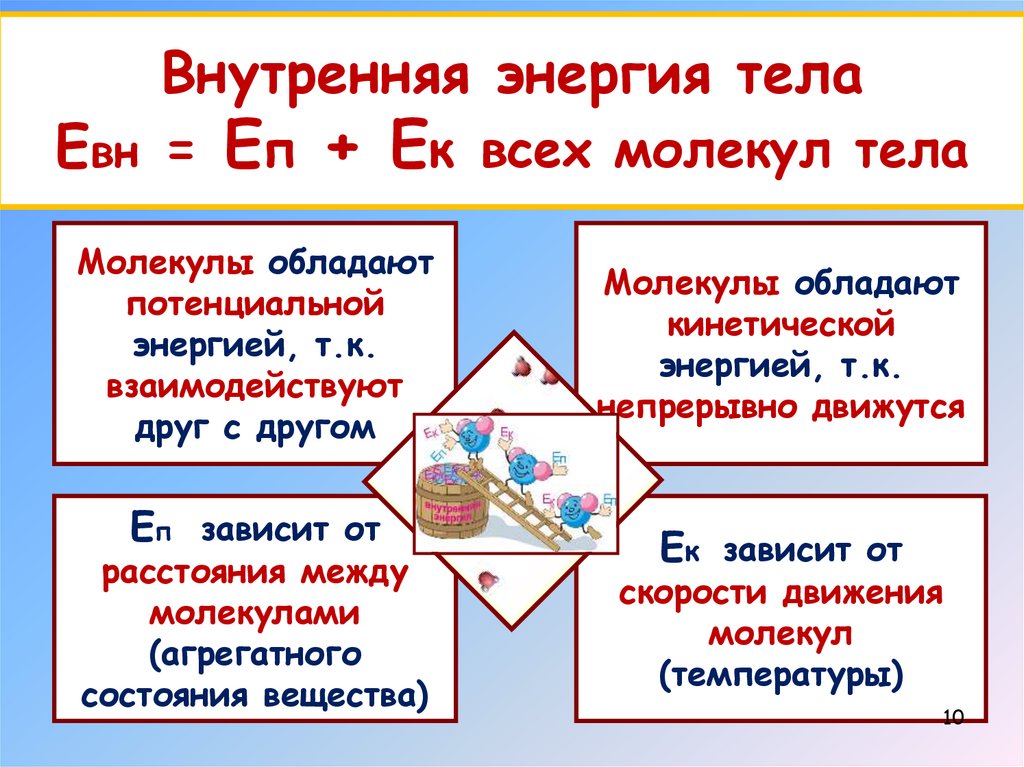
Внутренняя энергия телаЕвн = Еп + Ек всех молекул тела
Молекулы обладают
потенциальной
энергией, т.к.
взаимодействуют
друг с другом
Еп зависит от
расстояния между
молекулами
(агрегатного
состояния вещества)
Молекулы обладают
кинетической
энергией, т.к.
непрерывно движутся
Ек зависит от
скорости движения
молекул
(температуры)
10
10.
Процесс изменения внутренней энергии без совершенияработы над телом или самим
телом называется теплопередачей
11
11.
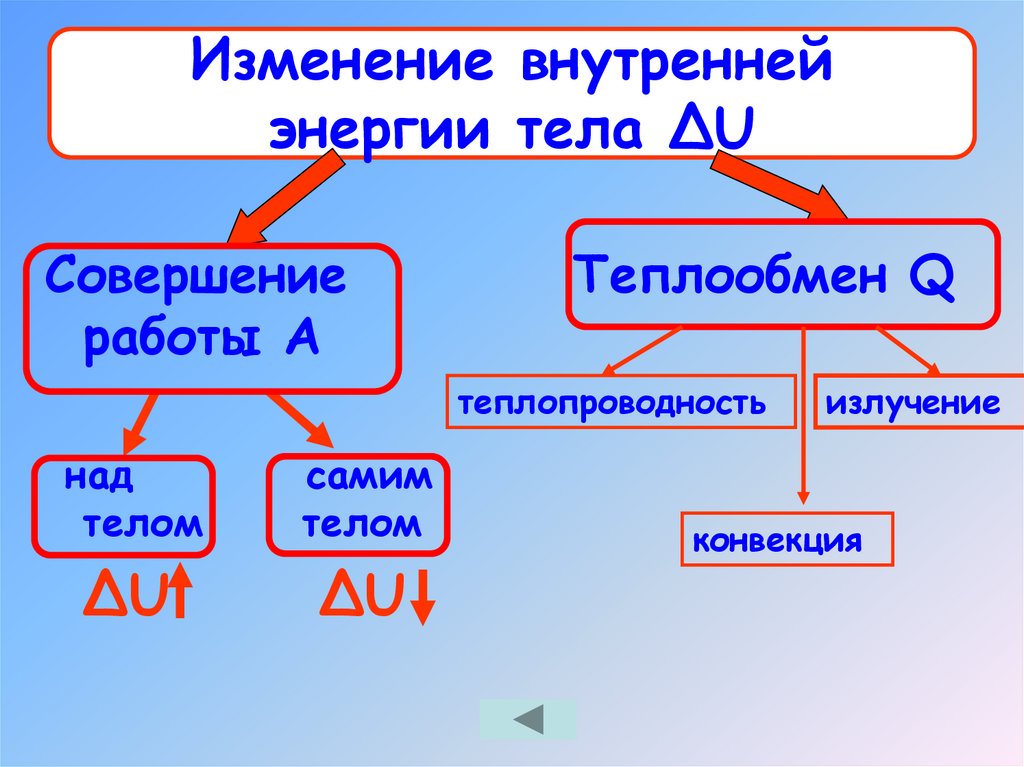
Изменение внутреннейэнергии тела ΔU
Совершение
работы А
Теплообмен Q
теплопроводность
над
телом
самим
телом
ΔU
ΔU
излучение
конвекция
12. Изменение внутренней энергии тела ΔU
Работа газа при изобарном процессеГаз до расширения и после
Работа газа при
изобарном процессе
Это работа, которую выполняла сила,
с которой газ действовал на поршень
По третьему закону Ньютона, эта сила
по модулю равна силе, с которой
поршень действовал на газ, и
противоположна ей по направлению.
Обозначим силу, действовавшую на
газ:
13.
Работа в термодинамике• Работа газа:
A p(V2 V1 ) p V
• Работа внешних сил:
A A
14. Работа в термодинамике
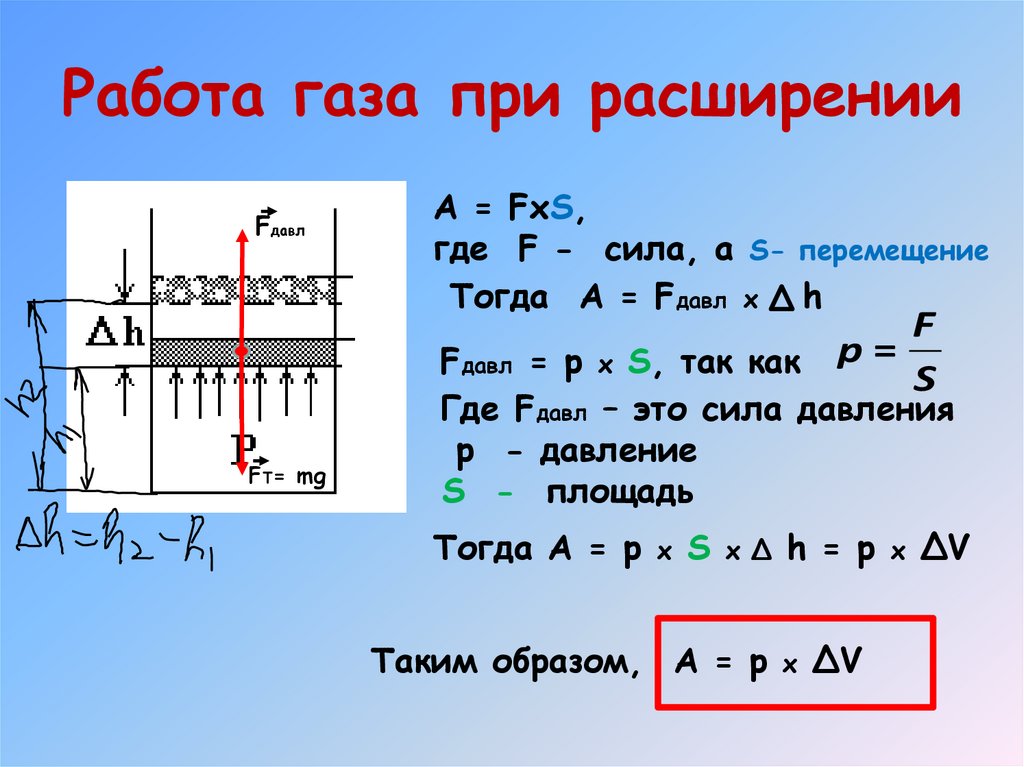
Работа газа при расширенииFдавл
A = FxS,
где F - сила, а S- перемещение
Тогда A = Fдавл x h
F
Fдавл = p x S, так как p =
S
FT= mg
Где Fдавл – это сила давления
p - давление
S - площадь
Тогда A = p x S x Δ h = p x ΔV
Таким образом, A = p x ΔV
15. Работа газа при расширении
Работа газа при изопроцессах• При изохорном процессе (V=const):
ΔV = 0 работа газом не
совершается:
P
A = p x ΔV , ΔV = 0
A 0
V
Изохорное нагревание
16. Работа газа при изопроцессах
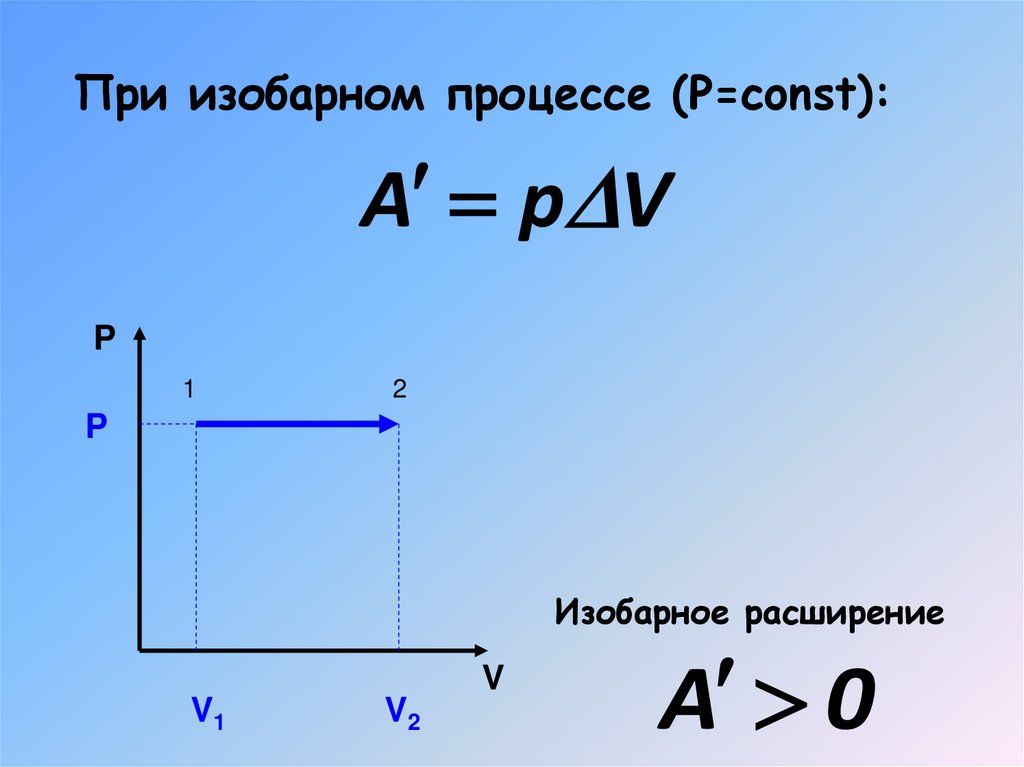
При изобарном процессе (Р=const):A p V
P
1
2
P
Изобарное расширение
V
V1
V2
A 0
17. При изобарном процессе (Р=const):
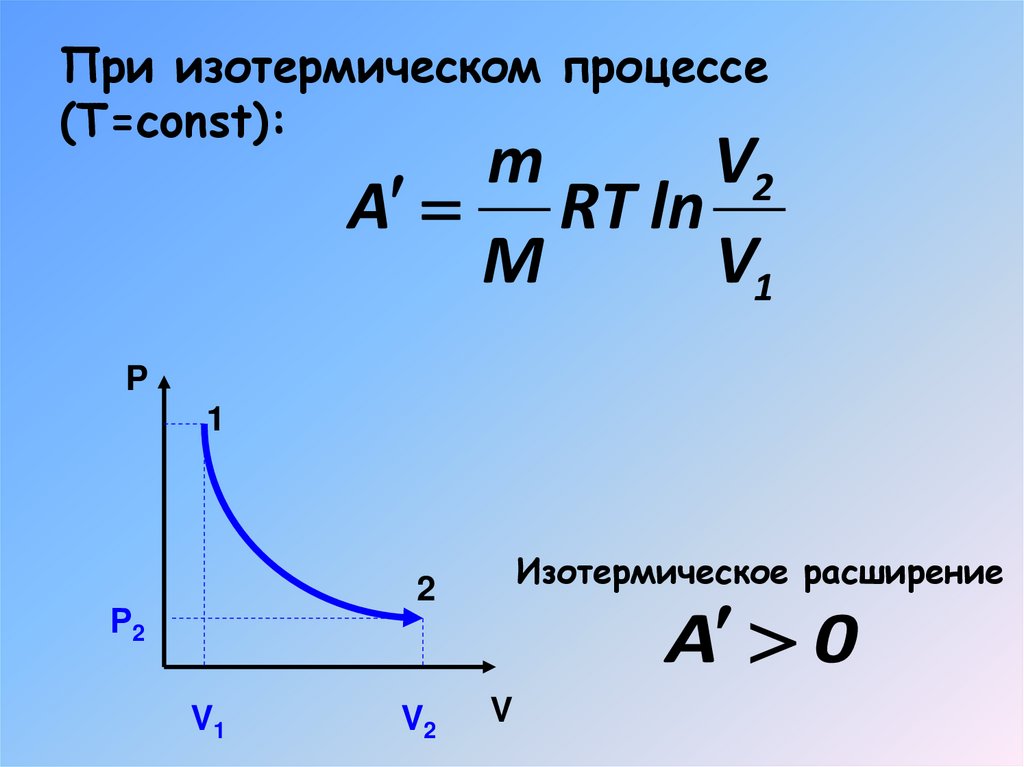
При изотермическом процессе(Т=const):
m
V2
A RT ln
M
V1
P
1
Изотермическое расширение
2
Р2
V1
V2
A 0
V
18. При изотермическом процессе (Т=const):
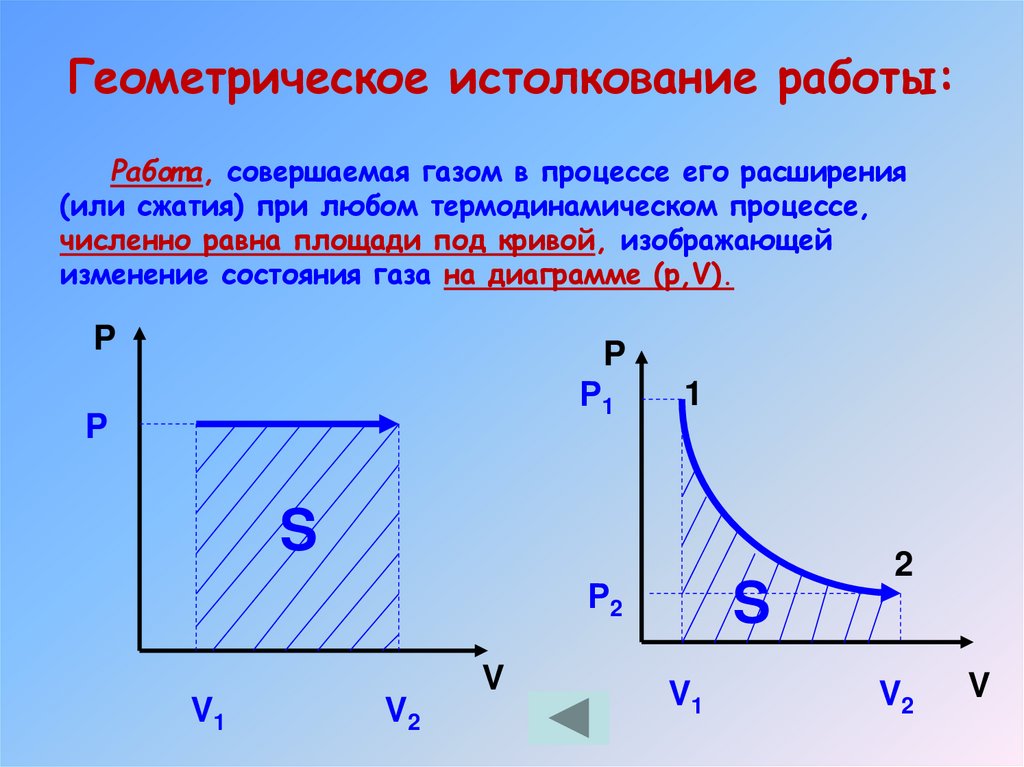
Геометрическое истолкование работы:Работ а, совершаемая газом в процессе его расширения
(или сжатия) при любом термодинамическом процессе,
численно равна площади под кривой, изображающей
изменение состояния газа на диаграмме (р,V).
P
P
Р1
P
1
S
Р2
V
V1
V2
S
V1
2
V2
V
19. Геометрическое истолкование работы:
Количество теплоты – часть внутреннейэнергии, которую тело получает или теряет при
теплопередаче
формула
Процесс
Нагревание или
охлаждение
Кипение или
конденсация
Плавление или
кристаллизация
Сгорание
топлива
Q cm T
Q rm
С – удельная теплоёмкость
вещества [ Дж/кг 0К], m –
масса [кг], ΔT – изменение
температуры [ 0K].
r – удельная теплота
парообразования [ Дж/кг ]
Q m λ- удельная теплота
плавления вещества [ Дж/кг ]
– удельная теплота сгорания
Q qm qтоплива
[ Дж/кг ]
20. Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче
Анализ результатов опытов и наблюдений природныхявлений, выполненных к середине XIX века, привел
немецкого ученого Р. Майера, английского ученого
Д-Джоуля и немецкого ученого Г. Гельмгольца
к выводу о существовании закона сохранения энергии:
21.
Закон сохранения энергии: При любых взаимодействиях тел энергия не исчезает бесследно и не возникаетиз ничего. Энергия только передается от одного тела к
другому или превращается из одной формы в другую.
22.
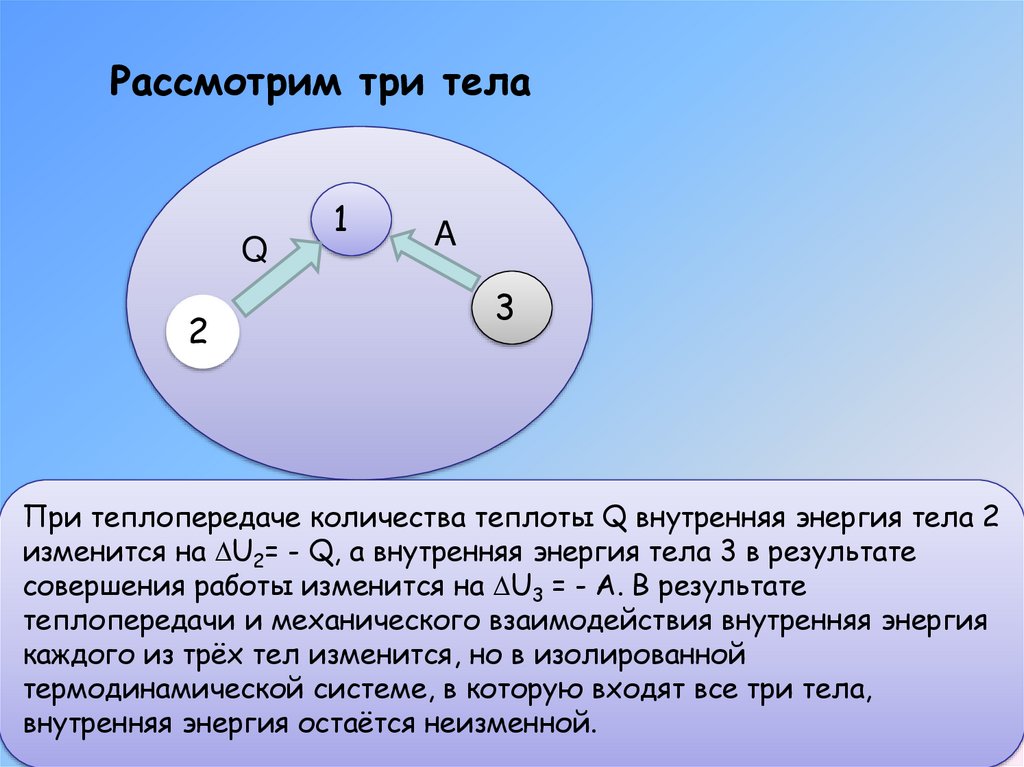
Рассмотрим три телаQ
2
1
A
3
При теплопередаче количества теплоты Q внутренняя энергия тела 2
изменится на U2= - Q, а внутренняя энергия тела 3 в результате
совершения работы изменится на U3 = - A. В результате
теплопередачи и механического взаимодействия внутренняя энергия
каждого из трёх тел изменится, но в изолированной
термодинамической системе, в которую входят все три тела,
внутренняя энергия остаётся неизменной.
23.
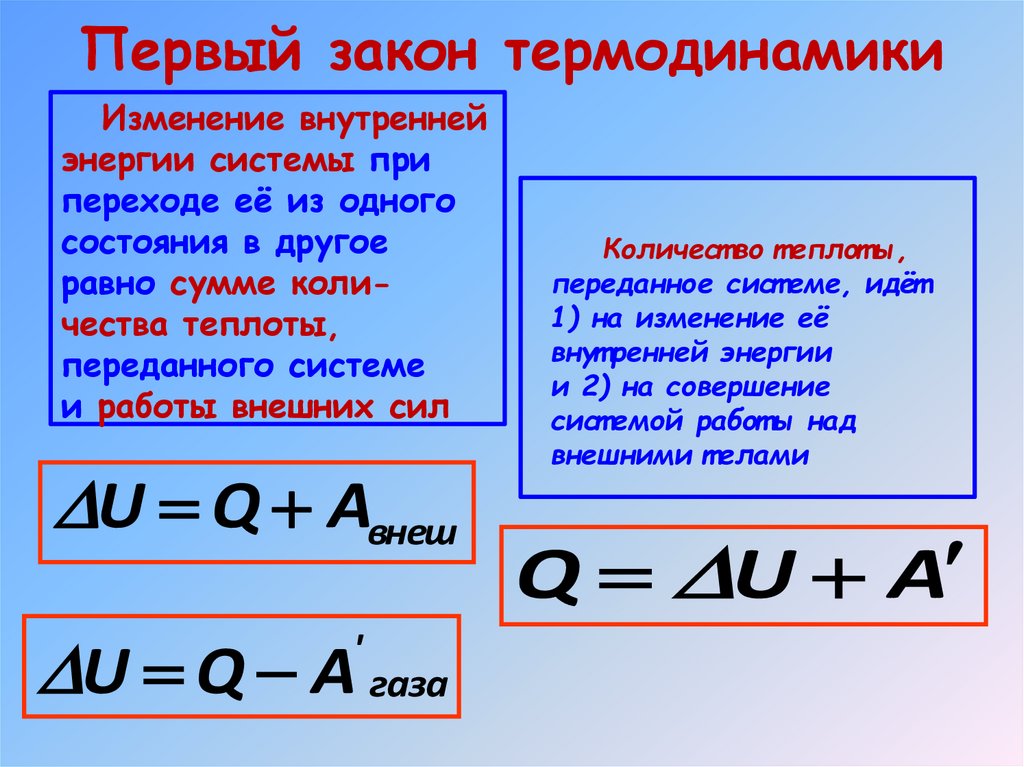
Первый закон термодинамикиИзменение внутренней
энергии системы при
переходе её из одного
состояния в другое
равно сумме количества теплоты,
переданного системе
и работы внешних сил
U Q Aвнеш
U Q A газа
'
Количест во т еплот ы,
переданное сист еме, идёт
1) на изменение её
внут ренней энергии
и 2) на совершение
сист емой работ ы над
внешними т елами
Q U A
24. Первый закон термодинамики
Применение первого законатермодинамики к различным
процессам
Процесс
Изохорный
Постоянный Первый закон
параметр
термодинамики
V = const
ΔU=Q; А=0
Изотермический Т = const
Q=A‘; ΔU=0
Изобарный
Р = const
Q=ΔU+A'
Адиабатный
Q = const
ΔU=-A'
25. Применение первого закона термодинамики к различным процессам
26.
27.
28.
29.
30.
31.
32.
Одним из главных следствийпервого закона
термодинамики является
невозможность построения
вечного двигателя.
33.
Домашнее заданиеВыучить лекцию.






















 Физика
Физика








