Похожие презентации:
Алюминий и его свойства
1. Презентация по теме «Алюминий и его свойства»
2. Открытие алюминия
Впервые был получен датским физикомЭрстедем в 1925 году.
Название было дано от латинского «alume»,так
в древности назывались квасцы для крашения
тканей.
3. Применение
Применяется в одной из отраслейметаллургии – алюмотермии
Алюминаты используются во многих
отраслях промышленности
В авиапромышленности
В фармацевтики
Для дубления кож
Для крашения тканей
4. Электронное строение
Алюминий, как и все элементы, находящиесяв III группе, главной подгруппе, имеет на
последнем энергетическом уровне 3
электрона, что объясняет его амфотерные
свойства.
Алюминий имеет радиус атома равный 0,125
нм.
Его восстановительные свойства хотя и
велики, но значительно меньше, чем у
элементов, стоящих в первой и второй
группах, из-за уменьшения радиуса атома.
5. Физические свойства
Самый распространенный металл в природе.Легкий
Серебристо-белый
Пластичный
Не имеет характерного металлического блеска
(покрыт тонкой белой пленкой из оксида
алюминия)
По электропроводности превосходит другие
металлы, кроме серебра и меди
Температура плавления – 6600С
Образует с другими металлами легкие, но
прочные сплавы
6. Химические свойства
Алюминий активен, но принормальных условиях активность
снижена наличием прочной оксидной
пленки, которая защищает металл от
атмосферных воздействий.
Обладает амфотерными свойствами
7. Взаимодействует с…
НеметалламиКислородом
Щелочами
Водой
Кислотами
Оксидами металлов
8. Соли алюминия (алюминаты)
Алюминат натрия используют дляполучения оксида алюминия в текстильной
промышленности, как протраву для тканей,
в бумажной промышленности, для ионнообменной очистки воды
Алюминат кальция – для приготовления
быстротвердеющего цемента.
Алюминат бария – для очистки воды от
сульфат-, карбонатионов и ионов кальция
9. Взаимодействие с неметаллами
Способен к взаимодействию поддействием температуры с серой,
азотом и углеродом.
С галогенами реагирует при
нормальных условиях.
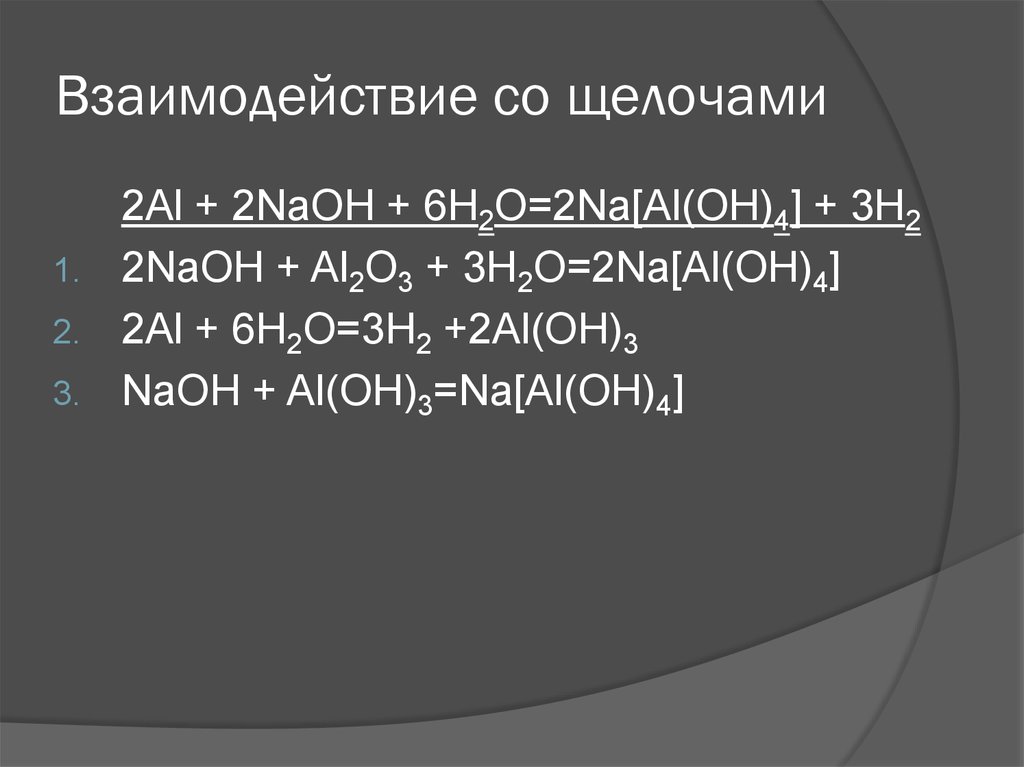
10. Взаимодействие со щелочами
1.2.
3.
2Al + 2NaOH + 6H2O=2Na[Al(OH)4] + 3H2
2NaOH + Al2O3 + 3H2O=2Na[Al(OH)4]
2Al + 6H2O=3H2 +2Al(OH)3
NaOH + Al(OH)3=Na[Al(OH)4]
11. Взаимодействие с водой
Если в отсутствии воздуха удалить споверхности алюминия оксидную
пленку, то он активно реагирует с
водой.
2Al + 6H2O=2H2 + 2Al(OH)3
12. Взаимодействие с кислотами
Концентрированные серная и азотнаякислоты пассивируют алюминий
(образуется плотная оксидная
пленка).
При взаимодействии с
разбавленными кислотами алюминий
образует соли.
13. Взаимодействие с кислородом
Алюминий взаимодействует скислородом воздуха, образуя при
этом оксид алюминия, покрывающий
металл тонкой плотной белой
пленкой.
При сильном нагревании порошок
алюминия воспламеняется и сгорает
ослепительным белым пламенем.
14. Взаимодействие с оксидами металлов
При высоких температурах алюминийспособен восстанавливать многие
металлы из их оксидов.













 Химия
Химия