Похожие презентации:
Аналитическая химия как наука. Лекция №1
1. Аналитическая химия как наука
Лекция №12. Литература
1.2.
3.
4.
5.
Саенко О.Е. Аналитическая химия. учебник для средних
специальных учебных заведений. Издательство Феникс, 2012.
Никитина, Н. Г. Аналитическая химия : учебник и практикум
для среднего профессионального образования / Н. Г. Никитина,
А. Г. Борисов, Т. И. Хаханина ; под редакцией Н. Г. Никитиной.
— 4-е изд., перераб. и доп. — Москва : Издательство Юрайт,
2018. — 394 с.
Александрова Э., Гайдукова Н. Аналитическая химия. Книга 1.
Химические методы анализа. Учебник и практикум для СПО
Издательство Юрайт, 2019.
Харитонов Ю.Я. Аналитическая химия. учебник для средних
специальных учебных заведений. Издательская группа
ГЭОТАР-Медиа 2018
Ищенко А.А. Аналитическая химия. учебник для средних
специальных учебных заведений. — Москва. Издательство:
Академия, 2007.- 320
3. Аналитическая химия как наука
Аналитическая химия — наука о методах и средствахопределения химического состава веществ и их смесей
Задачей аналитической химии является
• создание и совершенствование её методов,
• определение границ их применимости,
• оценка метрологических и других характеристик,
• разработка методик анализа конкретных объектов.
Цель изучения аналитической химии – освоение современных
методов анализа веществ и их применение для решения народнохозяйственных задач. Тщательный и постоянный контроль
производства и объектов окружающей среды основан на
достижениях аналитической химии.
4. Аналитическая химия как наука
• Система,которая
обеспечивает
конкретный
анализ
определённых
объектов
с
использованием
методов,
рекомендуемых
аналитической
химией,
называется
аналитической службой.
• Аналитическая служба представляет собой совокупность
аналитических служб отдельных ведомств, предприятий
например в области промышленности, геологии, сельского
хозяйства, ведомств охраны природы, здравоохранения и др.
• Про аналитическую химию говорят, что это наука о методах и
средствах химического анализа и в известной мере установления
химического строения. Под химическим анализом мы понимаем
совокупность действий, которые имеют своей целью получение
информации о химическом составе объекта.
5. Основные этапы анализа
1. Общая постановка задачи.2. Постановка конкретной аналитической задачи.
3. Выбор метода и методики анализа.
4. Пробоотбор.
5. Пробоподготовка.
6. Проведение анализа.
7. Расчеты.
8. Обработка результатов.
6. Метод и методика
Метод анализа - это сумма правили приёмов выполнения
анализа, позволяющих определить химический состав и структуру
веществ.
В
фиксируемым
основе
анализа
аналитическим
лежит
сигналом
зависимость
от
между
наличия
или
концентрации определяемого вещества.
Методика анализа - подробное описание выполнения анализа
данного объекта с использованием выбранного метода, которое
обеспечивает
регламентированные
правильности и воспроизводимости.
характеристики
7.
1. Классификация методов анализа по объектам определения• Изотопный – применяется в атомной энергетике, экологии,
медицине, археологии.
• Молекулярный
–
применяется
в
химической
технологии,
экологии, геологии, металлургии.
Элементный – применяется
повсеместно в технологии,
пищевой промышленности, медицине, криминалистике.
• Фазовый
–
применяется
в
металлургии,
стройматериалах.
2. Классификация по природе исследуемого объекта
• анализ неорганических веществ;
анализ органических веществ;
геологии,
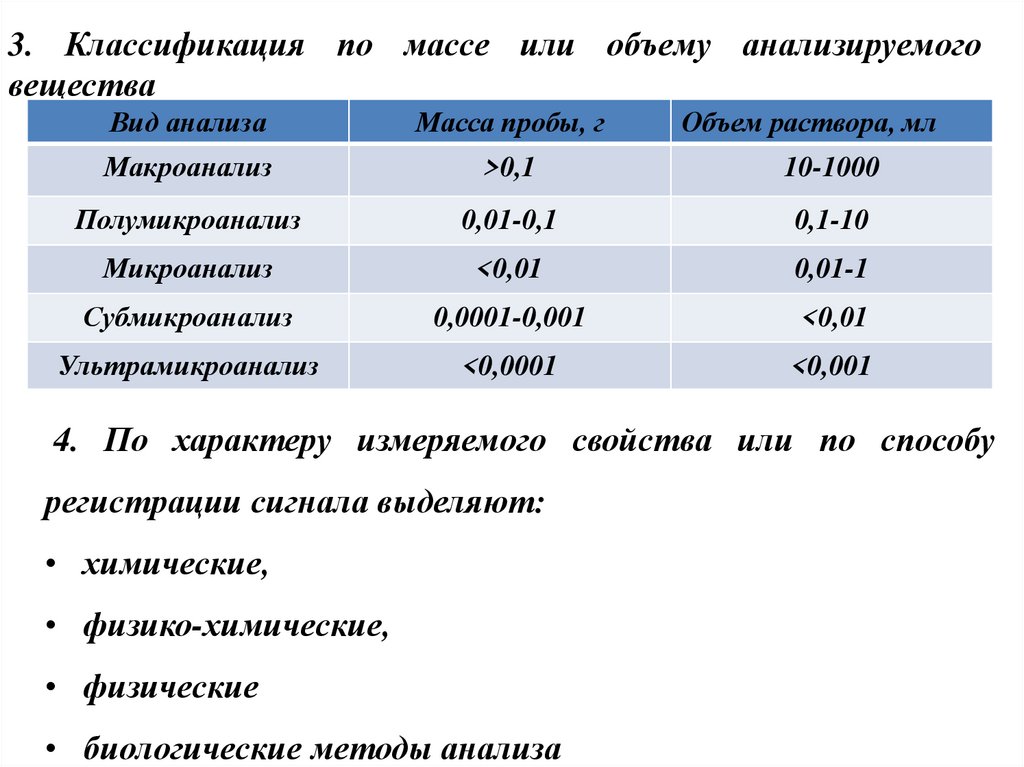
8. 3. Классификация по массе или объему анализируемого вещества
Вид анализаМасса пробы, г
Объем раствора, мл
Макроанализ
>0,1
10-1000
Полумикроанализ
0,01-0,1
0,1-10
Микроанализ
<0,01
0,01-1
Субмикроанализ
0,0001-0,001
<0,01
Ультрамикроанализ
<0,0001
<0,001
4. По характеру измеряемого свойства или по способу
регистрации сигнала выделяют:
• химические,
• физико-химические,
• физические
• биологические методы анализа
9. Химические методы анализа
Химические методы анализа основаны на химических реакциях,сопровождающихся наглядным внешним эффектом – образования
окрашенных соединений, выделение или растворение осадков,
выделение газов, образование кристаллов характерной формы,
окрашивание пламени газовой горелки, образование соединений,
люминесцирующих в растворах, то есть появлением внешнего эффекта,
по
которому
можно
судить
о
протекании
той
или иной реакции.
Внешние эффекты, по которым можно судить о протекании той или
иной реакции, называются аналитическим сигналом. Происходящие
изменения называются аналитической реакцией, а вещества, вызвавшие
эти изменения, – химическими реагентами.
Аналитический сигнал – это фиксируемое и измеряемое свойство
объекта
10. Химические методы анализа
Катион аммония неустойчив в щелочной среде:+
NH4 + OH ↔ NH3↑ + H2O
Соли аммония термически нестойки: при прокаливании они
разлагаются с образованием газообразных азотсодержащих продуктов
NH4Cl ↔ NH3↑ + HCl↑
AgNO3 + HCl → AgСl↓ + HNO3
Ag + + Cl - → AgCl↓ белый
Роданид калия KSCN образует с раствором соли железа (III) в слабокислой
среде ряд комплексных ионов кроваво-красного цвета
FeCl3 + 3KSCN → Fe(SCN)3 + 3KCl
Fe 3+ + 3SCN - → Fe(SCN)3
Раствор кроваво-красного цвета
Химические методы можно применять в растворах («мокрый путь» анализа),
или с твердыми веществами без использования растворителя («сухой путь»
анализа). «Сухим путем» осуществляют пирохимический анализ: твердое
вещество нагревают, летучие соли окрашивают пламя в соответствующий
цвет или сплавляют твердые вещества и получают «перлы» разной окраски.
11.
12. Физические и физико-химические методы
Физические методы основаны на физических явлениях и процессах. Физическиеметоды анализа это методы, которые позволяют определить состав вещества,
не прибегая к использованию химических реакций. Физические методы основаны
на измерении каких
либо параметров системы (оптических, электрических,
магнитных, тепловых), которые являются функцией состава. К физическим
методам
анализа
относятся:
спектральный,
люминесцентный,
рентгеноструктурный, масс-спектрометрический методы анализа
Физико-химические методы анализа основаны на изучении физических явлений,
которые происходят при химических реакциях. Для этой цеди, обычно,
применяют приборы со сложными оптическими и электрическими схемами,
позволяющие
с
большой
точностью
измерять
значения
определенных
параметров, характеризующих те или иные свойства вещества. эти методы
получили название методов инструментального анализа.
13.
Инструментальные методы анализа1. Оптический метод
спектральный (о присутствии того или иного элемента судят по наличию в
спектре линий, характерных для этого элемента);
люминесцентный(флуоресцентный) –используют свечение исследуемого
объекта, возникающее под действием ультрафиолетовых лучей;
рефрактометрический анализ основан на зависимости между показателем
преломления, концентрацией растворенного вещества и его молекулярным
строением
2. Радиометрический анализ основан на измерении радиоактивного излучения
того или иного элемента.
3. Рентгеноструктурный анализ использует рентгеновские лучи для изучения
строения веществ
14.
4. Масс-спектрометрический анализ позволяет определять массу отдельныхионизированных атомов, молекул и радикалов с помощью специальных приборов
–масс-спектрометров
5. Колориметрический метод основан на сравнении интенсивности окраски
исследуемого и стандартного растворов;
6. Кондуктометрический – измеряют электропроводность раствора, в
котором протекает реакция;
7.Потенциометрический – потенциал электрода, находящегося в исследуемом
растворе;
8.Полярографический метод учитывает изменение силы тока с ростом
напряжения при электролизе анализируемого раствора в специальном приборе
полярографе;
9.Хроматографические методы - основаны на разделении компонентов между
двумя фазами – подвижной и неподвижной
15.
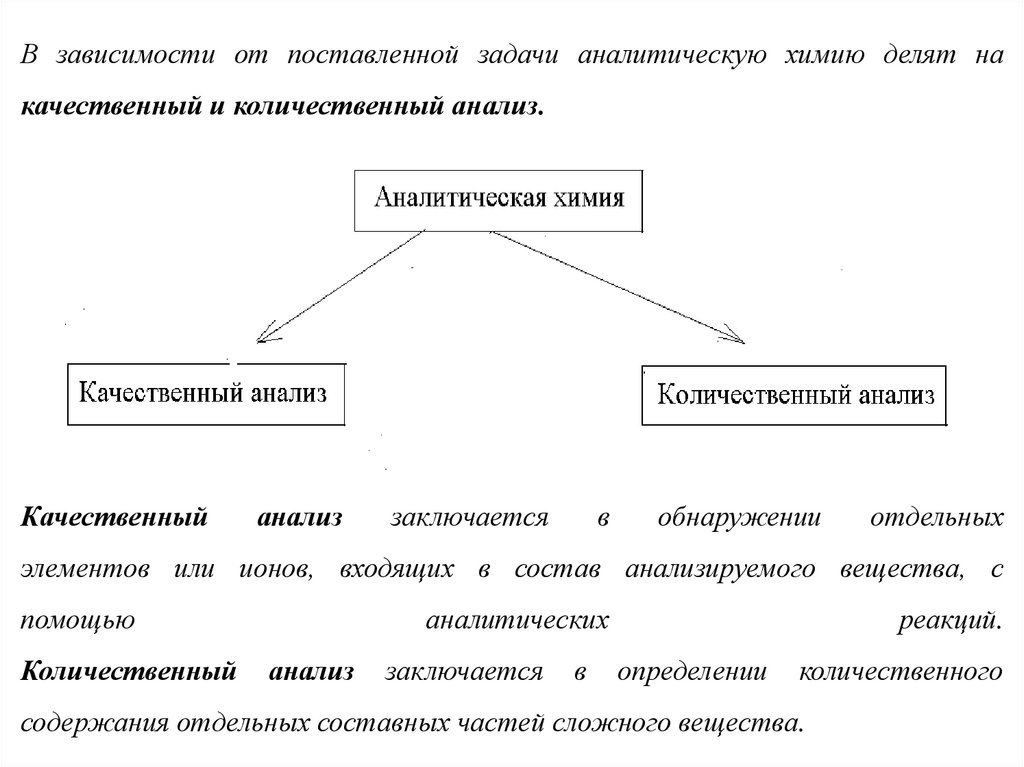
В зависимости от поставленной задачи аналитическую химию делят накачественный и количественный анализ.
Качественный
анализ
заключается
в
обнаружении
отдельных
элементов или ионов, входящих в состав анализируемого вещества, с
помощью
Количественный
аналитических
анализ
заключается
в
реакций.
определении
количественного
содержания отдельных составных частей сложного вещества.
16. Дробный анализ.
Есть два вида качественного анализа:1. Дробный анализ. Не предполагает предварительного разделения
компонентов пробы. В дробном методе используют специфические реагенты,
которые позволяют обнаружить любой ион в присутствии других ионов. Ионы
обнаруживают в отдельных порциях исследуемого раствора, добавляя
соответствующие реагенты. Для дробного метода характерны следующие
особенности:
1. Определяемый ион обнаруживают в любой последовательности в отдельных
пробах;
2. Исключаются процессы выпаривания и прокаливания и промывание осадка,
так как обычно анализируют фильтрат.
Недостатки: 1. Мало специфических реагентов; 2. Чем меньше селективность
реакций, тем больше ошибка.
17. Систематический анализ
2. Систематический анализ. При систематическом анализе используютгрупповые реагенты. Из пробы сложного состава последовательно выделяют
более простые по составу группы – фракции. В зависимости от состава
смеси применяют разные методы фракционирования – осаждение,
экстракцию, сорбцию, возгонку, хроматографическое разделение. Каждый
ион обнаруживают после того, как удалены другие ионы, мешающие своим
присутствием.
Недостатки:
1. громоздкость и длительность выполнения анализа;
2. потери обнаруживаемых ионов, если они находятся в малых
количествах. Реакции обнаружения отдельных ионов чередуются с реакциями
отделения их друг от друга. Для разделения пользуются различиями в
растворимости аналогичных соединений разделяемых ионов или различиями в
летучести соответствующих соединений.
18. Требования к аналитическим реакциям
Аналитические реакции должны:1. Протекать с большой скоростью.
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2. Равновесие должно устанавливаться за несколько секунд, или, в крайнем
случае, за несколько минут.
CuCl2 + 4NH3 ↔ [Cu(NH3)4]Cl2
3. При установившемся равновесии степень превращения реагирующих
веществ должна быть высокой, желательно 100 %.
4. Реакция должна соответствовать определенному стехиометрическому
коэффициенту.
19. Свойства аналитических реакций - селективность , специфичность, и чувствительность.
Аналитические реакции бывают:1. Селективные (избирательные) – реакции, которые дают сходные эффекты
лишь с ограниченным числом ионов. Например Cu2+, Hg2+ ,Pb2+ и другие
образуют с I – осадки. Чем меньше таких ионов, тем выше избирательность.
2. Специфические – реакции, которые позволяют обнаружить ион в
присутствии других ионов. Примером реакции с участием специфического
реагента является выделение газообразного NH3 при действии сильных
+
оснований (KOH или NaOH) на вещество, содержащее ион NH4 Ни один
+
катион не помешает обнаружению иона NH4 , потому что только он
реагирует со щелочами с выделением NH3 . Реакции в растворах бывают
между ионами, поэтому аналитические реакции позволяют обнаружить не
вещество, а ионы.
20. Свойства аналитических реакций - селективность , специфичность, и чувствительность.
Чувствительность реакции характеризуется пределом обнаружения илипределом разбавления. (Например, предел обнаружения в
микрокристаллоскопической реакции на ион Ca2+ действием серной кислоты
равен 0,04 мкг Ca2+ в капле раствора.)
21. Марки аналитических реагентов
К реактивам (R) предъявляют специальные требования:1. Они должны обладать высокой степенью чистоты (содержать минимальное
количество примесей). В анализе в основном используют R:
Химически чистый – «х.ч.». Содержание основного компонента более 99 %.
Чистый для анализа – «ч.д.а.».Содержание основного компонента до 99,9 %.
Особо чистый – «о.с.ч.». Такая квалификация установлена для веществ высокой
чистоты. «О.с.ч.» содержат примеси в таком незначительном количестве
(менее 0,1 %), что они не влияют на основные специфические свойства веществ.
Чистый – «ч.».Содержание основного компонента не ниже 98,0 %.
В практике химического анализа используют обычно реактивы с маркировкой
"х.ч." и "ч.д.а.".
2. Реактивы должны быть максимально доступны, недороги, нелетучи,
безопасны.
3. Должны обладать необходимой реакционной способностью.
22. Реактивы
Реактивы бывают:1.
Общими. К общим реактивам относят те, которые взаимодействуют со
многими ионами. Например, реакции взаимодействия со щелочами, растворами
аммиака, кислотами, растворимыми фосфатами.
2.
Групповыми. Групповые реактивы служат для отделения одной группы ионов
от другой. Групповой реактив должен удовлетворять следующим требованиям:
• Все ионы, входящие в состав данной группы, под действием группового
реактива должны полностью переходить в осадок;
• Осадок ионов одной группы не должен даже частично захватывать ионы других
групп;
• В составе группового реактива не должно быть ионов, присутствие которых
собираются проверять в ходе дальнейшего анализа;
23.
• Полученный осадок должен легко растворяться при изменении рН;• Избыток добавленного реагента не должен мешать дальнейшему анализу,
или должен легко удаляться из раствора.
Групповыми реактивами являются (NH4 )2 CO3, (NH4 )2 S, H2 S и другие.
3. Селективными. Селективными реактивами являются такие реактивы,
которые взаимодействуют с небольшим числом ионов.
Селективность реагента можно повысить одним из приемов:
а).Выбрав оптимальное значение рН;
в). Переведя продукт реакции в другую фазу;
с). Маскируя мешающий компонент, переведя его в форму, не мешающую
основной аналитической реакции.
24.
4. Специфическими.Специфическими реактивами являются такие реактивы, которые
взаимодействуют с одним ионом. Специфических реактивов очень немного.
Примером может служить щелочь, применяемая для обнаружения ионов
аммония, а также крахмал, позволяющий открывать иод.
25. Количественный анализ – заключается в определении количественного содержания отдельных составных частей сложного вещества.
Количественные химические методы классифицируют:Гравиметрический (весовой) метод анализа основан на выделении
определяемого вещества в чистом виде и его взвешивании.
Гравиметрические методы по способу получения продукта реакции
делят:
а). Химиогравиметрические методы основаны на измерении массы
продукта химической реакции;
б). Электрогравиметрические методы основаны на измерении массы
продукта электрохимической реакции;
в). Термогравиметрические методы основаны на измерении массы
вещества, образующегося при термическом воздействии.























 Химия
Химия








