Похожие презентации:
Основные классы неорганических веществ
1. Химия
ЛекцияОсновные классы неорганических
веществ
2. План
• 1. Оксиды.• 2. Кислоты.
• 3. Основания.
• 4. Соли.
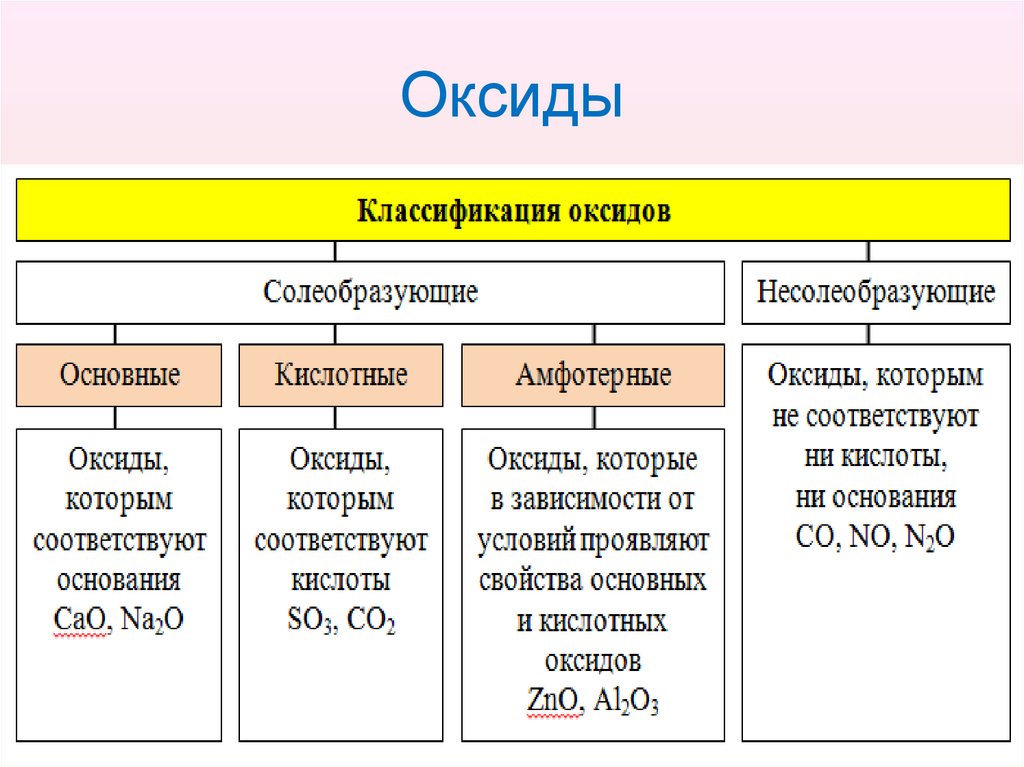
3. Оксиды
• Оксиды – это сложные вещества,состоящие из атомов двух химических
элементов, один из которых Оксиген.
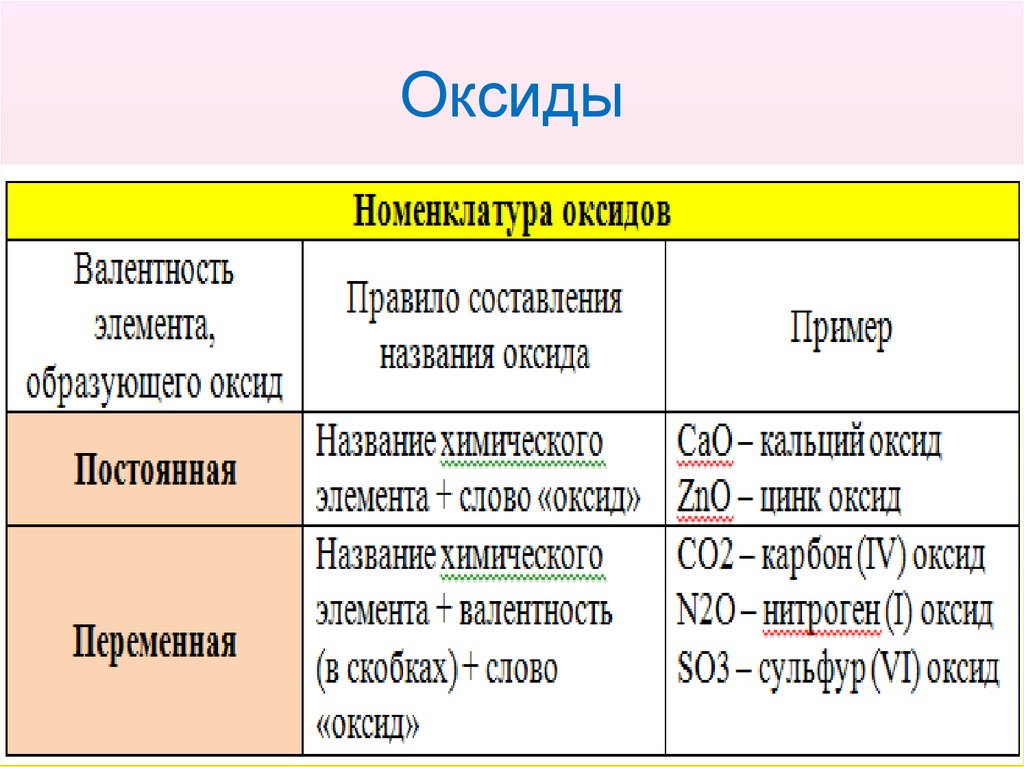
4. Оксиды
5. Оксиды
6. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
• Химические свойства основных оксидовВзаимодействуют с водой, если в результате реакции
образуются щелочи.
• CaO + H2O = Ca(OH)2
Взаимодействуют с кислотами с образованием соли и
воды.
• CaO + H2SO4 = CaSO4 + H2O
Взаимодействуют с кислотными оксидами с образованием
соли.
• CaO + CO2 = CaCO3
Не взаимодействуют с основными оксидами и щелочами.
7. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
• Химические свойства амфотерных оксидовВзаимодействуют с кислотами с образованием соли и воды.
ZnO + 2HCl = ZnCl2 + H2O
Взаимодействуют со щелочами с образованием соли и воды.
ZnO + 2NaOH = Na2ZnO2 + H2O
Взаимодействуют с кислотными оксидами с образованием соли.
ZnO + СO2 = ZnСO3
Взаимодействуют с основными оксидами с образованием соли.
ZnO + СaO = CaZnO2
Не взаимодействуют с водой.
8. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
• Химические свойства кислотных оксидовВзаимодействуют с водой с образованием кислот.
• SO2 + H2O = H2SO3 (исключение: SiO2 + H2O ≠)
Взаимодействуют со щелочами с образованием соли и
воды.
• SO2 + Ca(OH)2 = CaSO3 + H2O
Взаимодействуют с основными оксидами с
образованием соли.
• СaO + SO3 = CaSO4
Не взаимодействуют с кислотами и кислотными
оксидами.
9. ПОЛУЧЕНИЕ ОКСИДОВ
Взаимодействие простых и сложных веществ скислородом
• 2Mg + O2 = 2MgO
• CH4 + 2O2 = CO2↑ + 2H2O
Разложение оснований при нагревании
• Fe(OH)2 = FeO + H2O
Разложение кислот при нагревании
• 4HNO3 = 4NO2↑ + 2H2O + O2↑
10. ПОЛУЧЕНИЕ ОКСИДОВ
Разложение солей при нагревании
CaCO3 = CaO + CO2↑
2Pb(NO3)2 = 2PbO + 4NO2 + O2↑
Разложение высших оксидов с образованием низших оксидов
4CrO3 = 2Cr2O3 + 3O2↑
Окисление низших оксидов с образованием высших оксидов
2CO + O2 = 2CO2↑
Вытеснение одних оксидов другими
Na2CO3 + SiO2 = Na2SiO3 + CO2↑
Окислительно-восстановительные реакции
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
S + H2SO4 (конц.) = 3SO2↑ + 2H2O
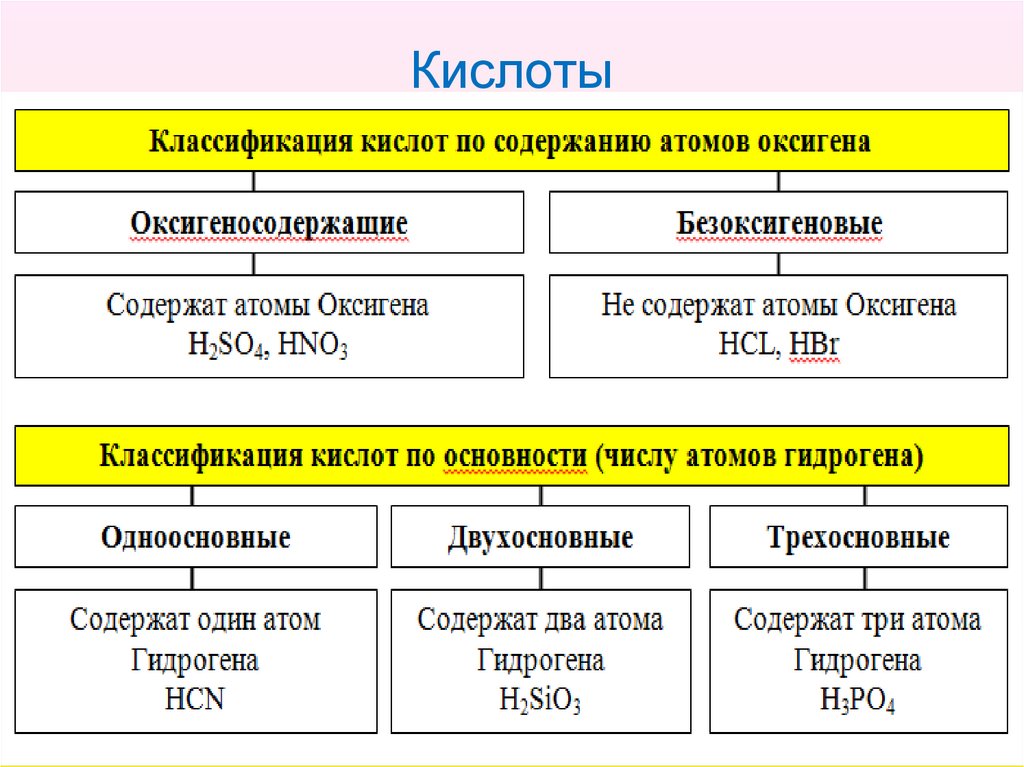
11. Кислоты
Кислоты – это сложные вещества, содержащие атомыГидрогена, которые могут замещаться атомами
металлических элементов, и кислотные остатки
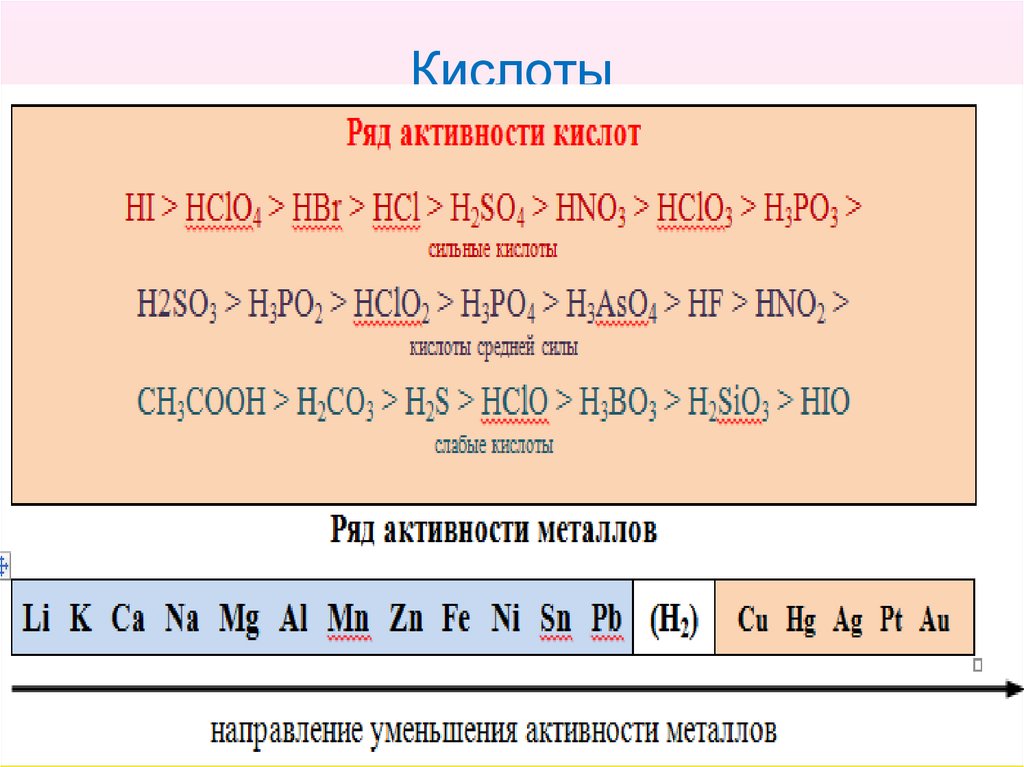
12. Кислоты
13. Кислоты
14. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Изменяют цвет индикаторов• Кислота + лакмус (фиолетовый) → красный
• Кислота + метиловый оранжевый → розовый
Взаимодействуют с основаниями (реакция
нейтрализации) с образованием соли и воды
• NaOH + HCl = NaCl + H2O
Взаимодействуют с основными оксидами с
образованием соли и воды
• CuO + 2HCl = CuCl2 + H2O
15. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Взаимодействуют с металлами (если металлыстоят в ряду активности до Н2) с образование
соли и водорода
• 2HCl + Zn = ZnCl2 + H2↑
исключения:
HNO3, H2SO4 (конц.)
Взаимодействуют с солями (если образуется
осадок ↓ или газ ↑, соль более слабой или
летучей кислоты) с образованием новой соли и
новой кислоты
• 2HCl + K2CO3 = 2KCl + H2CO3
16. ПОЛУЧЕНИЕ КИСЛОТ
Взаимодействие кислотных оксидов с водой• SO3 + H2O = H2SO4
Взаимодействие солей с кислотами (кислота,
вступающая в реакцию, должна быть более
сильной, чем та, которая образуется)
• Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
Окисление некоторых простых веществ
• 5HNO3 (разб.) + 3P + 2H2O = 5NO↑ + 3H3PO4
Взаимодействие неметаллов с водородом
• H2 + Cl2 = 2HCl
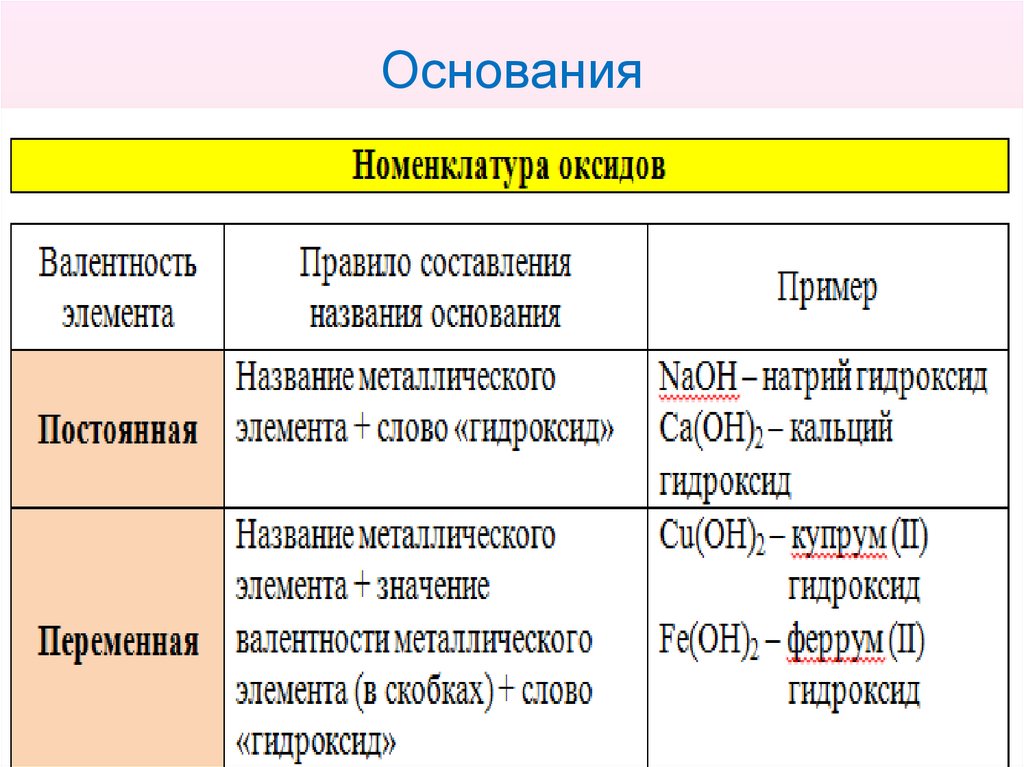
17. Основания
• Основания – это сложные вещества,содержащие атомы металлического элемента
(Ме) и одну или несколько гидроксогрупп (ОН).
• Общая формула оснований:
• где n – валентность металлического элемента.
18. Основания
19. Основания
20. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
• Растворимые основания (щелочи)Изменяют цвет индикаторов
• NaOH + лакмус (фиолетовый) → синий
• NaOH + метиловый оранжевый → желтый
• NaOH + фенолфталеин (бесцветный) →
малиновый
Взаимодействуют с кислотами (реакция
нейтрализации) с образованием соли и воды
• 2NaOH + H2SO4 = Na2SO4 + 2Н2O
21. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
Взаимодействуют с кислотными оксидами с образованием соли
и воды
2NaOH + SO3 = Na2SO4 + Н2O
Взаимодействуют с амфотерными оксидами с образованием
соли и воды
2NaOH + ZnO Na2ZnO2 + Н2O
Взаимодействуют с амфотерными гидроксидами:
а) с образованием соли: Zn(OH)2 + 2NaOH Na2[Zn(OH)4]
б) с образованием соли и воды: Zn(OH)2 + 2NaOH
Na2ZnO2+2H2O
Взаимодействуют с растворами солей (если образуется осадок
↓, или газ ↑) с образованием соли и воды
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
Не разлагаются при нагревании
22. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
• Нерастворимые в водеНе изменяют цвет индикаторов
Взаимодействуют с кислотами (реакция нейтрализации) с
образованием соли и воды
• Cu(OH)2 + H2SO4 = CuSO4 + 2Н2O
Взаимодействуют с некоторыми кислотными оксидами
при нагревании с образованием соли и воды
• Mg (ОН)2 + SiO2 MgSiO3 + Н2O
Не взаимодействуют с амфотерными оксидами,
амфотерными гидроксидами и растворами солей
Разлагаются при нагревании с образованием оксида и воды
• Cu(OH)2 СuО + Н2O
23. ПОЛУЧЕНИЕ РАСТВОРИМЫХ ОСНОВАНИЙ (ЩЕЛОЧЕЙ)
Взаимодействие активных металлов с водой (щелочных ищелочноземельных)
• 2Na + 2Н2O = 2NaOH + Н2↑
Взаимодействие основных оксидов с водой (только оксиды
щелочноземельных и щелочных металлических элементов)
• ВаО + Н2O = Ва(ОН)2
Взаимодействие соли со щелочью (если образуется
нерастворимая соль)
• Na2SO4 + Ва (ОН)2 = BaSO4↓+2NaOH
Электролиз водных растворов солей Калия или Натрия
• 2NaCl + 2Н2O =Н2↑ + Cl2↑ + 2NaOH
24. ПОЛУЧЕНИЕ НЕРАСТВОРИМЫХ ОСНОВАНИЙ
Взаимодействие солей со щелочами• CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
• MgCl2 + 2KOH = Mg(OH)2↓ + 2KC1
• Pb(NO3)2 + 2NaOH = Pb(OH)2↓ +2NaNO3
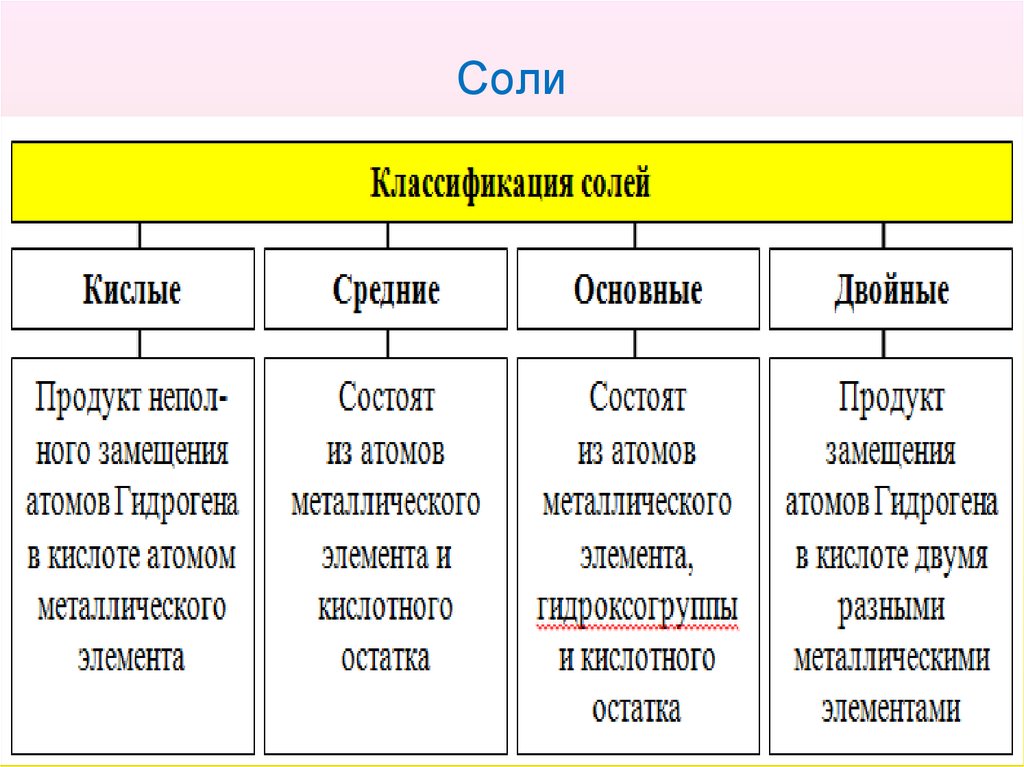
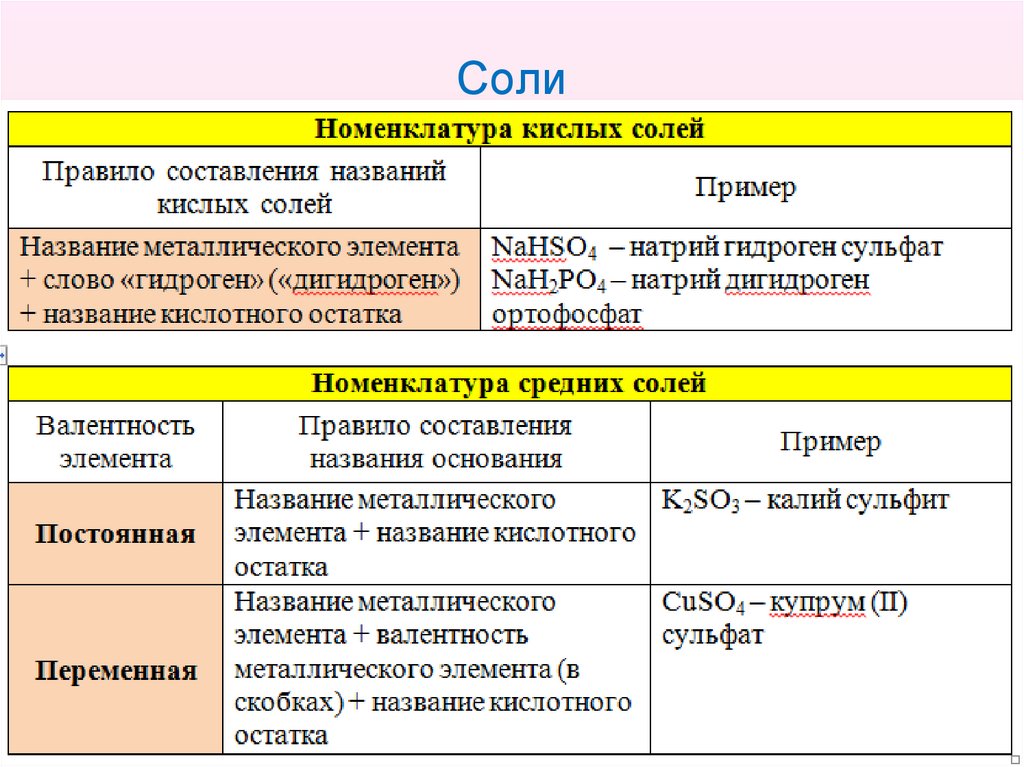
25. Соли
• Соли – это сложные вещества, содержащие ионыметаллических элементов и кислотные остатки.
26. Соли
27. Соли
28. Соли
29. ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Взаимодействуют с металлами (реакция замещения) при условиях:реагирующий металл активнее металла, который образовал
соль;
соль растворима в воде
• CuSO4 + Fe = FeSO4 + Сu,
FeSO4 + Сu ≠
Взаимодействуют со щелочами (реакция обмена)
• CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Взаимодействуют с солями (реакция обмена) при условиях:
реагирующие соли растворимы;
одна из образовавшихся солей нерастворима
• Na2SO4 + ВаСl2 = BaSO4↓ + 2NaCl
30. ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Взаимодействуют с кислотами при условиях:реагирующая кислота сильнее, чем та, которая образовала
соль;
образуется газ ↑ или осадок ↓
• Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
• CaCO3 + 2НСl = СаСl2 + H2CO3
.
Термическое разложение солей с образованием веществ
более простого состава
• СаСO3 = СаО + СO2↑
• Са(НСO3)2 = CaCO3 +CO2↑+H2O
• NH4NO2 = N2 + 2H2O
• 2KClO3 = 2KCl + 3O2↑
31. ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
Взаимодействие металлов с кислотами• Mg + 2НС1 = MgCl2 + Н2↑
Взаимодействие основных оксидов с кислотами
• CuO + H2SO4 = CuSO4 + Н2O
Взаимодействие оснований с кислотами
• NaOH + НС1 = NaCl + Н2O
Взаимодействие солей, с кислотами
• СаСO3 + 2HNO3 = Ca(NO3)2 + Н2O + СO2↑
Взаимодействие основных оксидов с кислотными
• СаО + СO2 = СаСО3
Взаимодействие щелочей с кислотными оксидами
• 2NaOH + СO2 = Na2CO3 + Н2O
32. ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
Взаимодействие солей с кислотными оксидами
СаСO3 + SiO2 = CaSiO3 + СO2↑
Взаимодействие щелочей с солями
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Взаимодействие двух солей
ВаСl2 + Na2SO4 = BaSO4↓+2NaCl
Взаимодействие металлов с солями
Рb + Hg(NO3)2 = Hg + Pb(NO3)2
Взаимодействие металлов с неметаллами
2Fe + ЗСl2 = 2FeCl3
Взаимодействие неметаллов с солями
Сl2 + 2KI = 2КСl +I2
Термическое разложение солей
2KNO = 2KNO + O ↑
33. ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
Взаимодействие излишка кислоты со щелочами• NaOH + H2SO4 = NaHSO4 + Н2O
Взаимодействие излишка кислоты с основными
оксидами
• СаО + 2H2SO4 Са (HSO4)2 + Н2O
Взаимодействие кислот и их средних солей
• СаСO3 + Н2O + СO2 = Са(НСO3)2
Взаимодействие щелочей с излишком кислотного
оксида
• Ва(ОН)2 +2СO2 = Ва(НСO3)2
34. Задания для закрепления
1. Укажите кислоту, которая может образовывать кислыесоли:
• А) карбонатная кислота
• Б) азотная кислота
• В)уксусная кислота
• Г)хлоридная кислота
• 2. Укажите ряд кислот, в которых приведены только
оксигенсодержащие кислоты:
• А) сульфатная, азотная, хлоридная
• Б) флуоридная, сульфидная, бромидная
• В)сульфитная, ортофосфатная, силикатная
• Г)нитратная, сульфидная, фосфитная
35. Задания для закрепления
3.Обозначьте классы веществ с которыми взаимодействуюткислоты:
•А) кислотные оксиды
•Б) основные оксиды
•В)неметаллы
•Г)металлы
•Д) основания
•Е) соли
•4.Вычислите и обозначьте степень окисления Серы в
алюминий сульфате Al2(SO4)3:
•А) -2
•Б) +6
•В)+4 Г)+3
36. Задания для закрепления
5.Укажите продукты реакции взаимодействия азотной кислотыс кальций карбонатом:
•А) кальций гидроген карбонат
•Б) кальций нитрат, карбон(4) оксид и вода
•В)карбоновая кислота и кальций гидрогенкарбонат
•Г)кальций нитрат и натрий нитрат
37. Задания для закрепления
6.Укажите вещества при взаимодействии которых образуетсяжелтый осадок:
•А) нитроген (2) оксид и кислород
•Б) натрий йодид и аргентум нитрат
•В)кальций силикат и нитратная кислота
•Г)натрий сульфат и калий нитрат
7.Обозначьте ионы, которые обуславливают превращение
окраски фенолфталеина в розовую:
•А) гидроксид -ионы
•Б) сульфат ионы
•В) ионы гидрогена
•Г) ионы кальция
38. Задания для закрепления
8.Обозначьте вещество с которым реагирует натрий гидроксид:•А) кальций оксид
•Б) калий сульфат
•В)этанол
•Г)кальций гидроксид
9.Укажите название элемента, образующего кислотные оксиды:
•А) калий
•Б) алюминий
•В)сера
•Г)магний
39. Задания для закрепления
10.Обозначьте вещества, взаимодействующие с карбон(4)оксидом:
•А) калий оксид
•Б) калий нитрат
•В)кальций нитрат
•Г)кальций хлорид
•Д) кислород
•Е) калий хлорид
•Ж) вода
































 Химия
Химия








