Похожие презентации:
Thème 2 Liaisons chimiques
1.
Thème 2Liaisons chimiques
Cours: 1441.1 Chimie
Support de cours de Pr. Oksana Banakh
2.
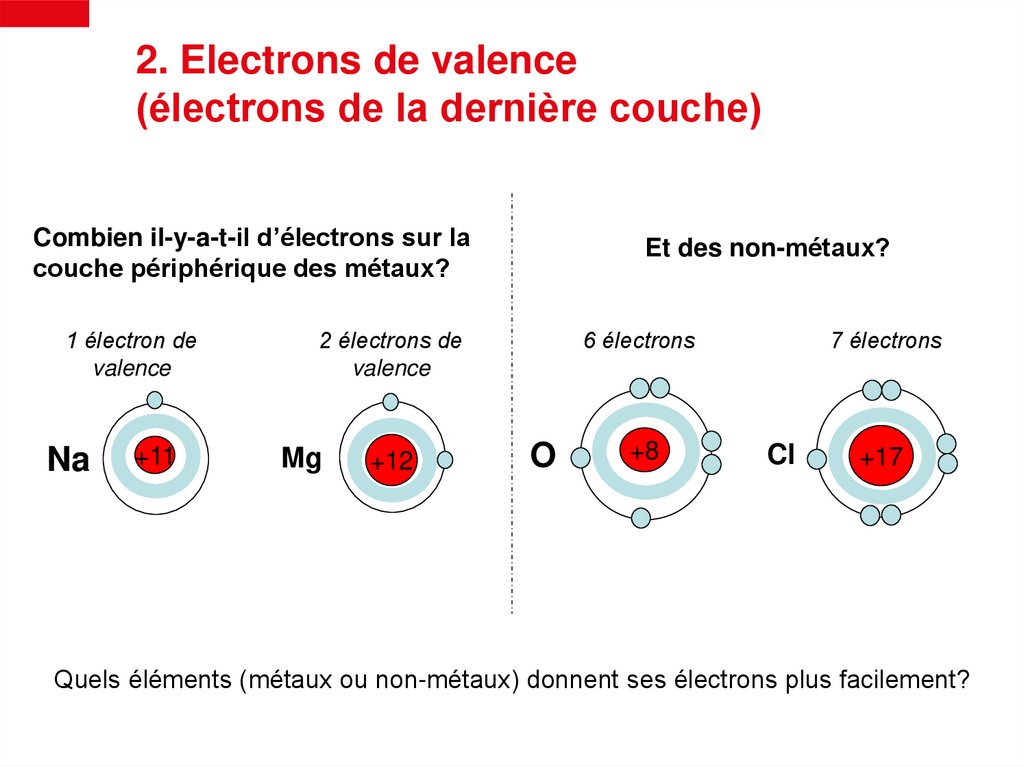
2. Electrons de valence(électrons de la dernière couche)
Combien il-y-a-t-il d’électrons sur la
couche périphérique des métaux?
1 électron de
valence
Na
+11
Et des non-métaux?
2 électrons de
valence
Mg
+12
6 électrons
O
+8
7 électrons
Cl
+17
Quels éléments (métaux ou non-métaux) donnent ses électrons plus facilement?
3.
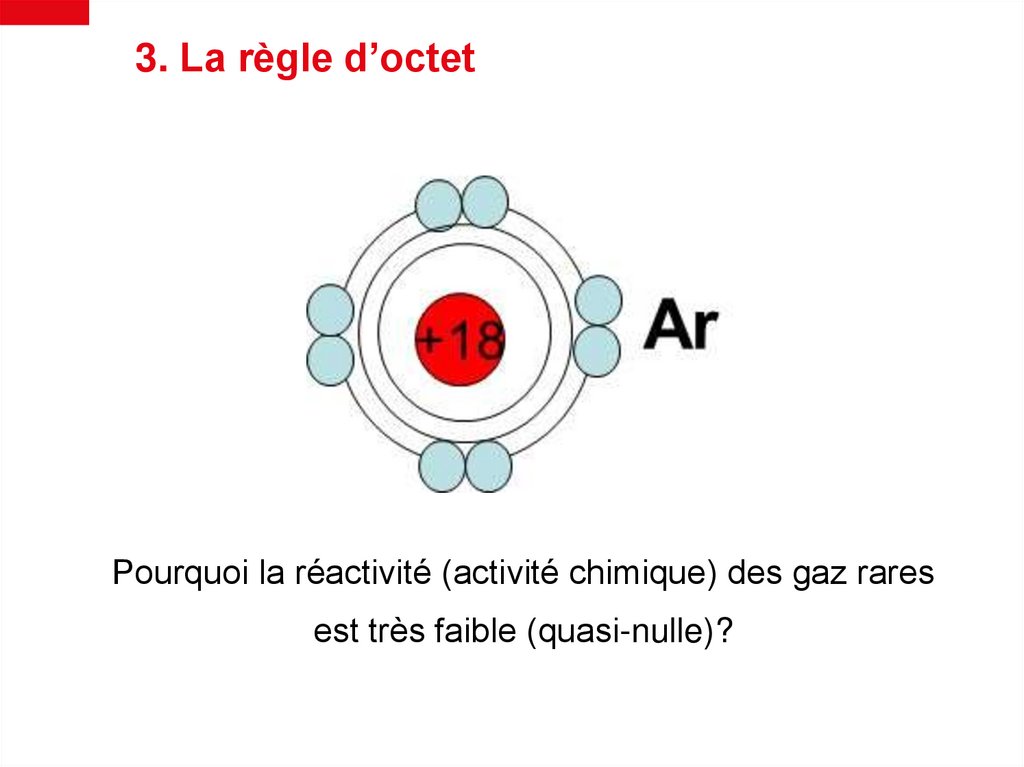
3. La règle d’octetPourquoi la réactivité (activité chimique) des gaz rares
est très faible (quasi-nulle)?
4.
4. Symboles de Lewis (schéma)• Les électrons célibataires sont représentés par un point «·»
• Une paire d’électrons (un doublet) par des doubles points «:» ou par
un trait «-»
•Les électrons se répartissent sur 4 cases disponibles.
D’abord un électron par case, puis, à partir du 5ème, ils se mettent par 2
(maximum 4 cases, maximum 8 électrons)
5.
4. Symboles de LewisPour les premiers 18 éléments, dessinez les symboles de Lewis
Groupe/
Période
1A
2A
3A
4A
5A
6A
1
2
3
Quelle conclusion peut-on tirer?
7A
8A
6.
1. Exercice : Symboles de LewisReprésentez le symbole de Lewis des particules suivantes :
Rb, Sr, Ge, Li+, Cl-, S2-, Mg2+, N3-
7.
5. Liaison ioniqueExemple 1:
Dessinez le schéma de création des liaisons dans le cristal de sel de cuisine (entre
un atome métallique (Na) et un atome du non-métal (Cl).
• Que deviennent des atomes Na et Cl après la réaction chimique?
• Quel composé (formule) se forme?
• Quelle est la force qui retient les ions Na+ et Cl- ensemble dans un cristal?
Na+
Cl -
8.
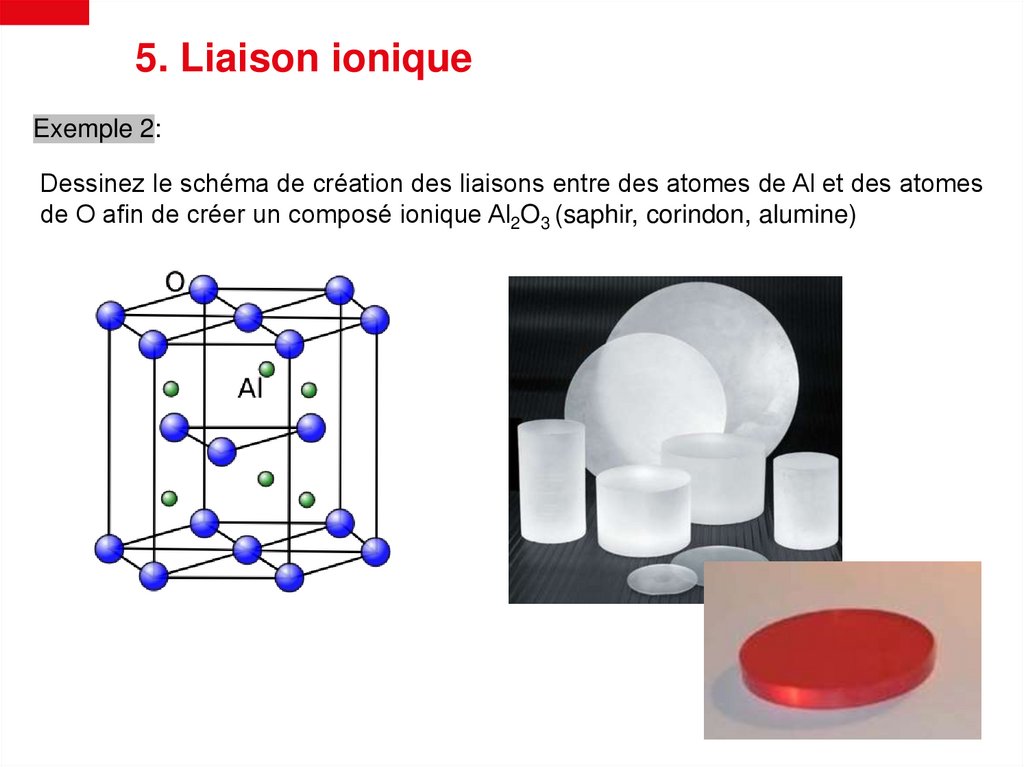
5. Liaison ioniqueExemple 2:
Dessinez le schéma de création des liaisons entre des atomes de Al et des atomes
de O afin de créer un composé ionique Al2O3 (saphir, corindon, alumine)
9.
6. Charges de cations/anionsLes métaux ont tendance de perdre un ou plusieurs électrons (pour satisfaire la
règle de l’octet), ils deviennent les cations positifs:
Groupe IA: Li+, Na+, K+, Rb+, Cs+
Groupe IIA: Be2+, Mg2+, Ca2+, Sr2+, Ba2+
Groupe IIIA: Al3+
Quel est le rapport entre la charge d’un
cation et sa position dans le TPE?
Les non-métaux acceptent un ou plusieurs électrons et deviennent les anions
négatifs.
Groupe VA: N3-, P3Groupe VIA: O2-, S2Groupe VII A: F-, Cl-, Br-, I-
Quel est le rapport entre la charge d’un
anion et sa position dans le TPE?
La liaison ionique se forme entre un cation métallique et un anion formé par un
non-métal (ou plusieurs non-métaux, p.ex. NO3-, CO32-)
10.
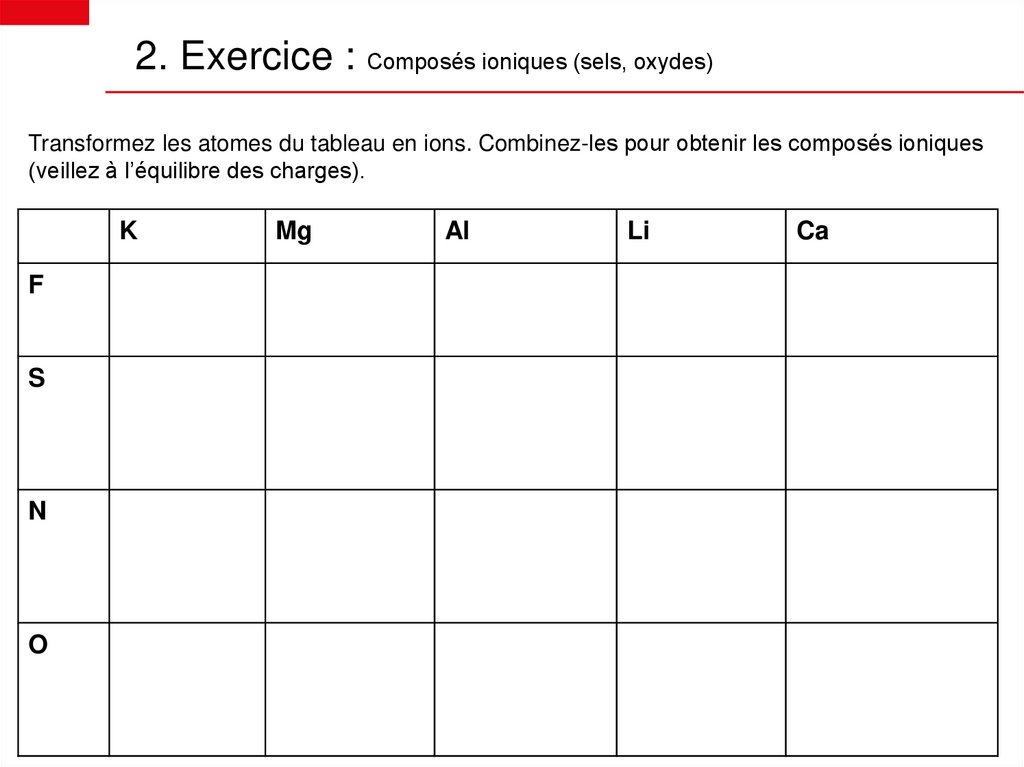
2. Exercice : Composés ioniques (sels, oxydes)Transformez les atomes du tableau en ions. Combinez-les pour obtenir les composés ioniques
(veillez à l’équilibre des charges).
K
F
S
N
O
Mg
Al
Li
Ca
11.
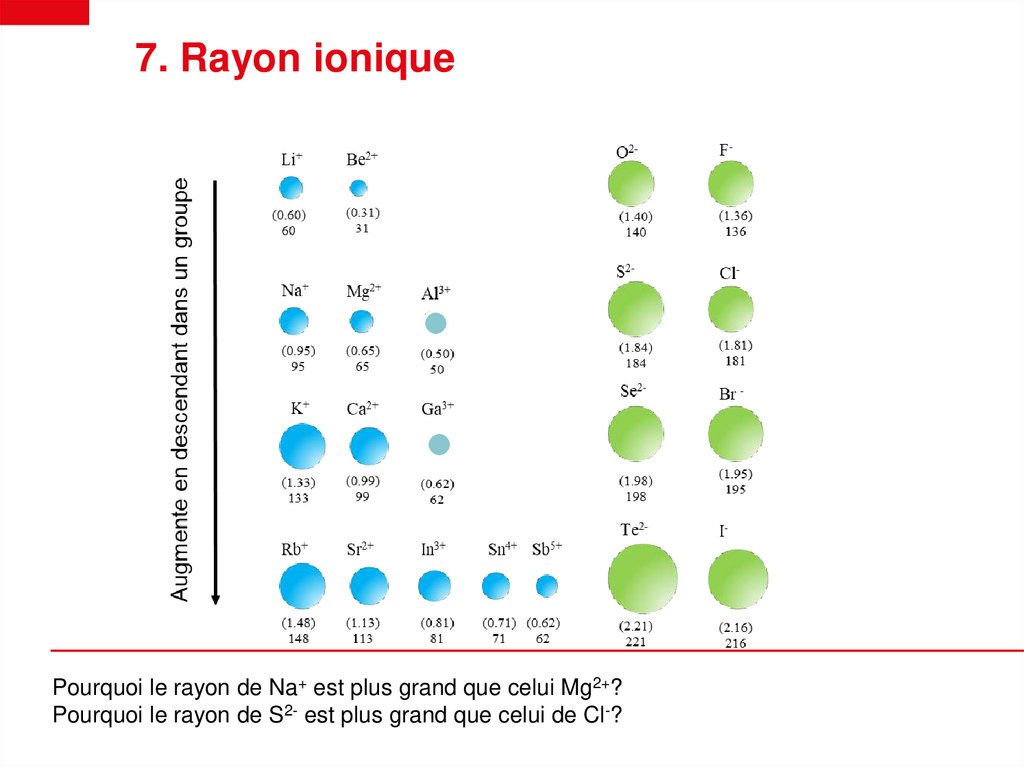
7. Rayon ioniquePourquoi le rayon de Na+ est plus grand que celui Mg2+?
Pourquoi le rayon de S2- est plus grand que celui de Cl-?
12.
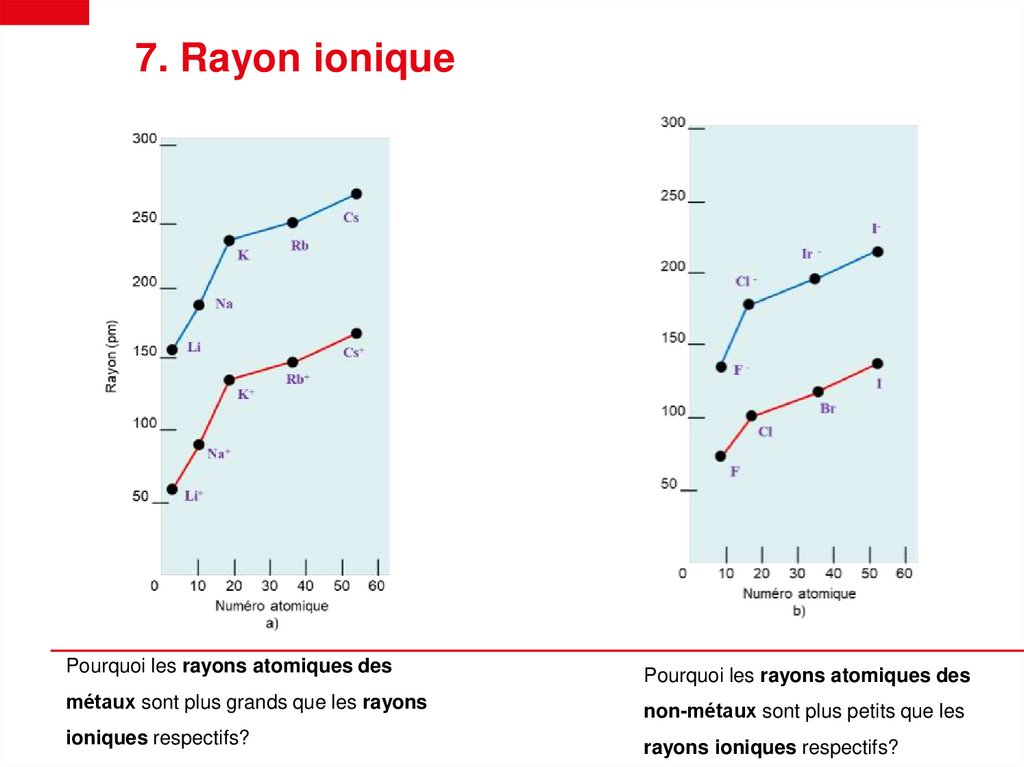
7. Rayon ioniquePourquoi les rayons atomiques des
Pourquoi les rayons atomiques des
métaux sont plus grands que les rayons
non-métaux sont plus petits que les
ioniques respectifs?
rayons ioniques respectifs?
13.
3. Exercice : Rayon ionique vs. rayon atomiqueComparez les rayons des ions et d’atomes dans des paires suivantes :
Na+
Mg2+
Na+
K+
Mg
Mg2+
S2-
Cl-
S2-
S
O2-
S2-
14.
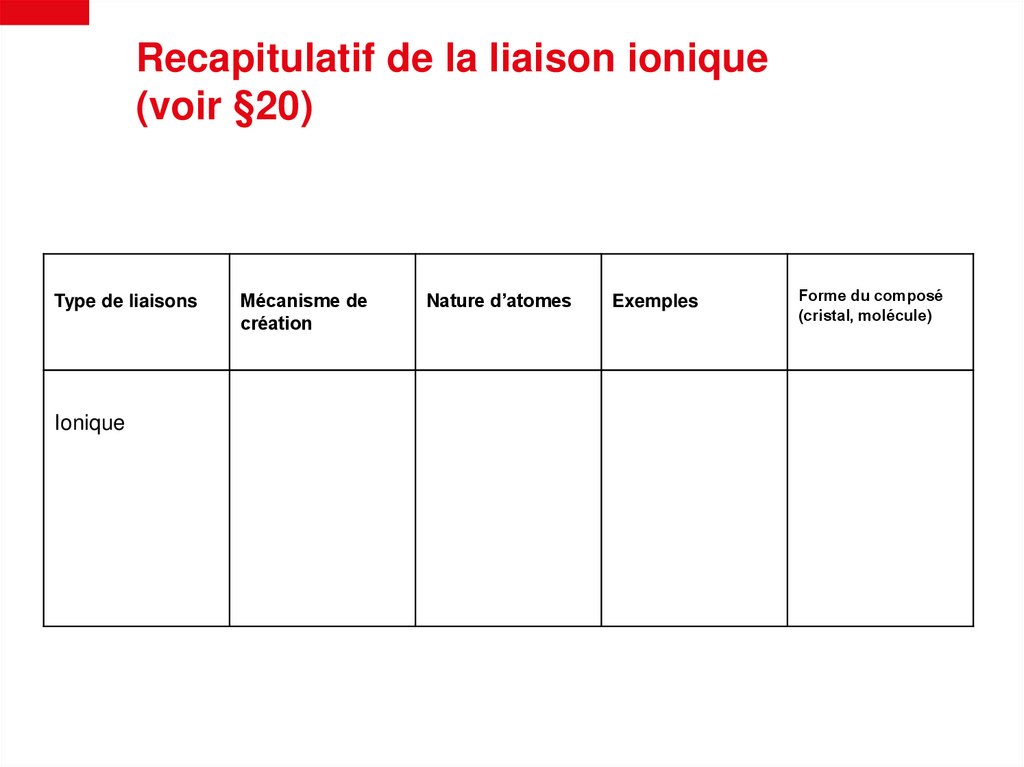
Recapitulatif de la liaison ionique(voir §20)
Type de liaisons
Ionique
Mécanisme de
création
Nature d’atomes
Exemples
Forme du composé
(cristal, molécule)
15.
8. Liaison covalenteDessinez le schéma de création des liaisons entre deux atomes F dans une molécule F2.
Comment la règle d’octet peut être respectée pour les deux atomes de F?
F
+
F
Symbole de Lewis
(pour un élément)
F2
Structure de Lewis
(pour une molécule covelante)
La structure de Lewis décrit schématiquement les liaisons dans les molécules covalentes
16.
4. Exercice : La liaison covalente simple (structures de Lewis)Dessinez le schéma de création des liaisons dans les molécules suivantes.
Veillez au respect de la règle d’octet.
PCl3
HCl
H2O
NH3
Hydrogène fait l’exception de la règle d’octet! (max. 2 électrons sur sa dernière couche)
17.
9. Liaisons simples et multiples5. Exercice : Liaisons covalentes multiples
Dessinez le schéma de création des liaisons covalentes dans les molécules suivantes.
Veillez au respect de la règle d’octet.
O2
N2
C2H4
C2H2
C6H6
18.
6. Exercice : Structures de Lewis des composés covalentsDessinez la structure de Lewis des molécules et des ions suivants
CO2
CO
OH- (ion d’hydroxyde)
NH4+ (ion d’ammonium)
H2CO3
PCl5
SO2
CH3CH2Br; PH3 ; P4 ; H2S ; N2H4 ; H3PO4 ; H2SO4 ; CH3CH2OH ; CH3CH2COOH ;
C6H6 ; CH3-CO-CH3.
19.
10. ElectronégativitéL’électronégativité ( ) est la capacité d’un atome d’attirer le nuage
électronique vers lui dans une liaison.
est un nombre indicatif (0.7 – 4.0) sans unités
20.
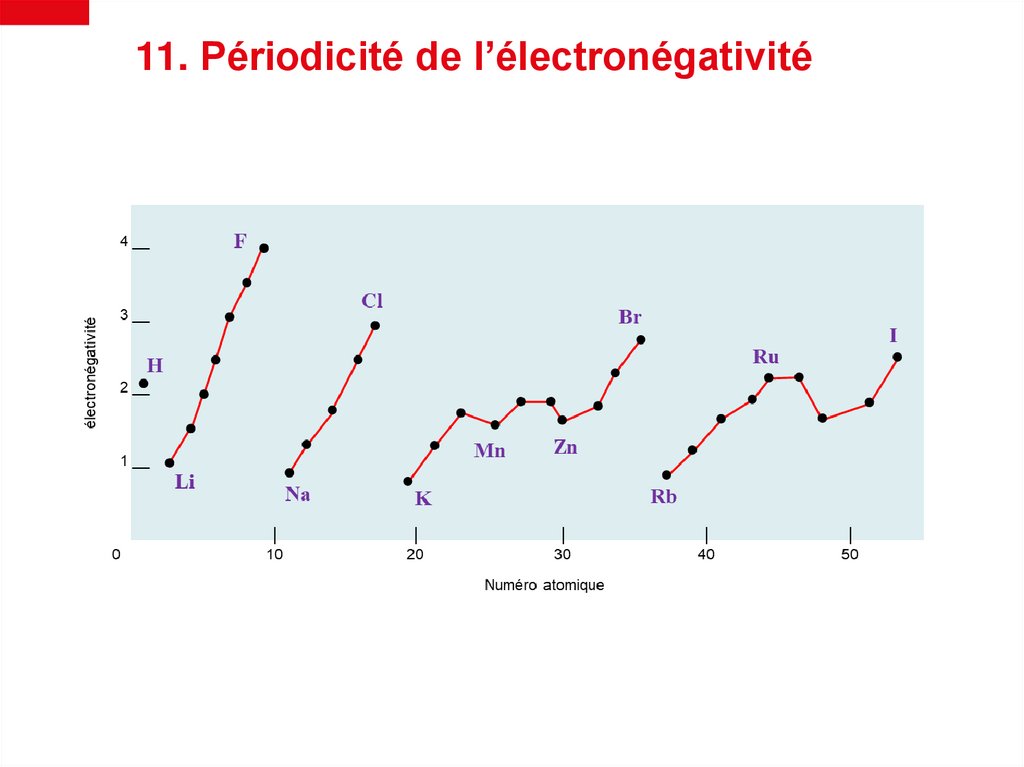
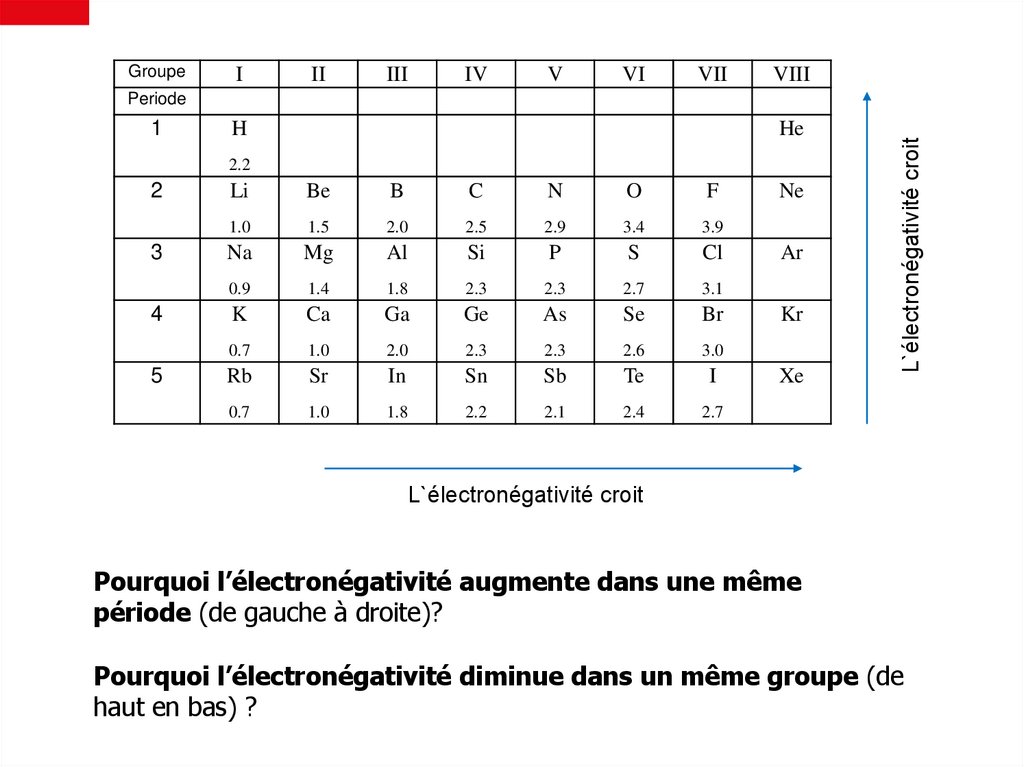
11. Périodicité de l’électronégativité21.
GroupeI
II
III
IV
V
VI
VII
VIII
1
H
He
2.2
2
3
4
5
Li
Be
B
C
N
O
F
1.0
1.5
2.0
2.5
2.9
3.4
3.9
Na
Mg
Al
Si
P
S
Cl
0.9
1.4
1.8
2.3
2.3
2.7
3.1
K
Ca
Ga
Ge
As
Se
Br
0.7
1.0
2.0
2.3
2.3
2.6
3.0
Rb
Sr
In
Sn
Sb
Te
I
0.7
1.0
1.8
2.2
2.1
2.4
2.7
Ne
Ar
Kr
Xe
L`électronégativité croit
Periode
L`électronégativité croit
Pourquoi l’électronégativité augmente dans une même
période (de gauche à droite)?
Pourquoi l’électronégativité diminue dans un même groupe (de
haut en bas) ?
22.
12. Polarité des liaisons chimiquesDans les molécules covalentes, le partage des électrons entre deux atomes peut être
1) Symétrique 50%-50% (liaison covalente non polaire ou apolaire): O2, H2
o o
2) Asymétrique (liaison covalente polaire): HCl, HF, H2O
La polarité d’une liaison est la différence de l’électronégativité de deux atomes liés,
= | A- B |.
Plus cette différence est grande, plus la liaison est polaire (voire, ionique)
Règle empirique (approximative):
A- B < 0.5
liaison covalente non-polaire (apolaire)
0.5 ≤ A- B ≤ 1.6
liaison covalente polaire
1.6 < A- B < 2.0
liaison covalente polaire ou ionique, si (métal + non-métal)
A- B > 2.0
liaison ionique (métal + non-métal)
23.
7. Exercice : Polarité des liaisonsClassez les liaisons suivantes par ordre croissant de leur polarité (ionicité):
- la liaison entre Li et F dans LiF ;
- la liaison entre K et O dans K2O ;
- la liaison entre les atomes N dans N2 ;
- la liaison entre S et O dans SO2 ;
- la liaison entre C et H dans CH4
- la liaison entre Si et O dans SiO2
0
covalente
apolaire
0.5
1
1.5
covalente polaire
2
2.5
ionique
3.0
24.
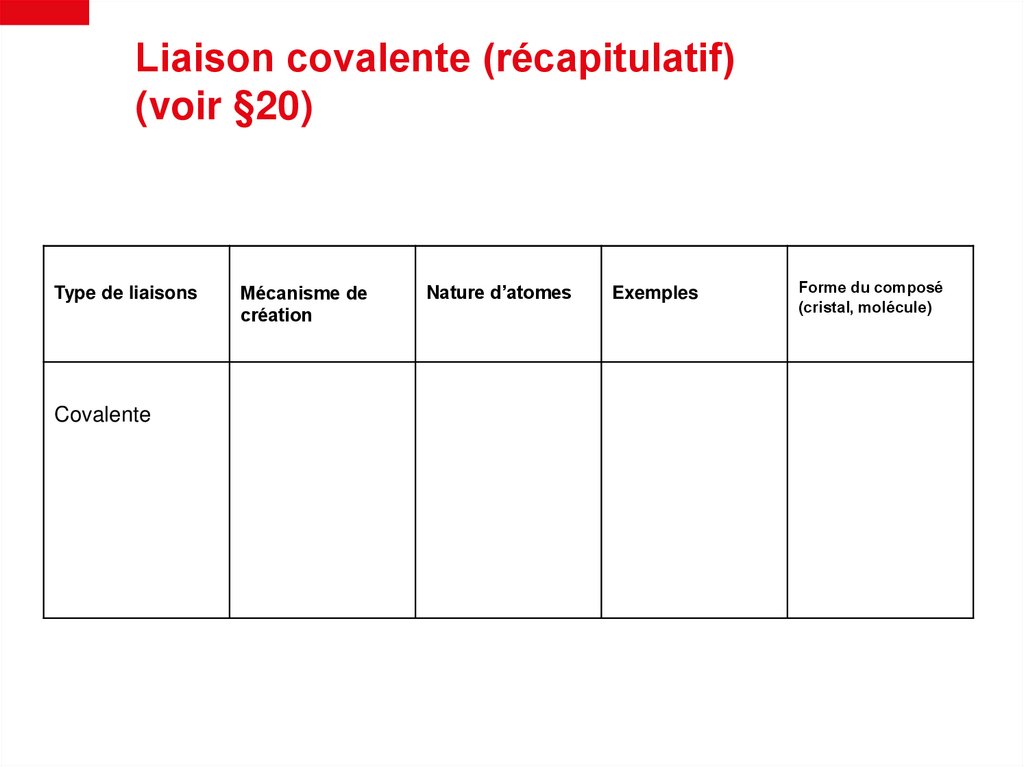
Liaison covalente (récapitulatif)(voir §20)
Type de liaisons
Covalente
Mécanisme de
création
Nature d’atomes
Exemples
Forme du composé
(cristal, molécule)
25.
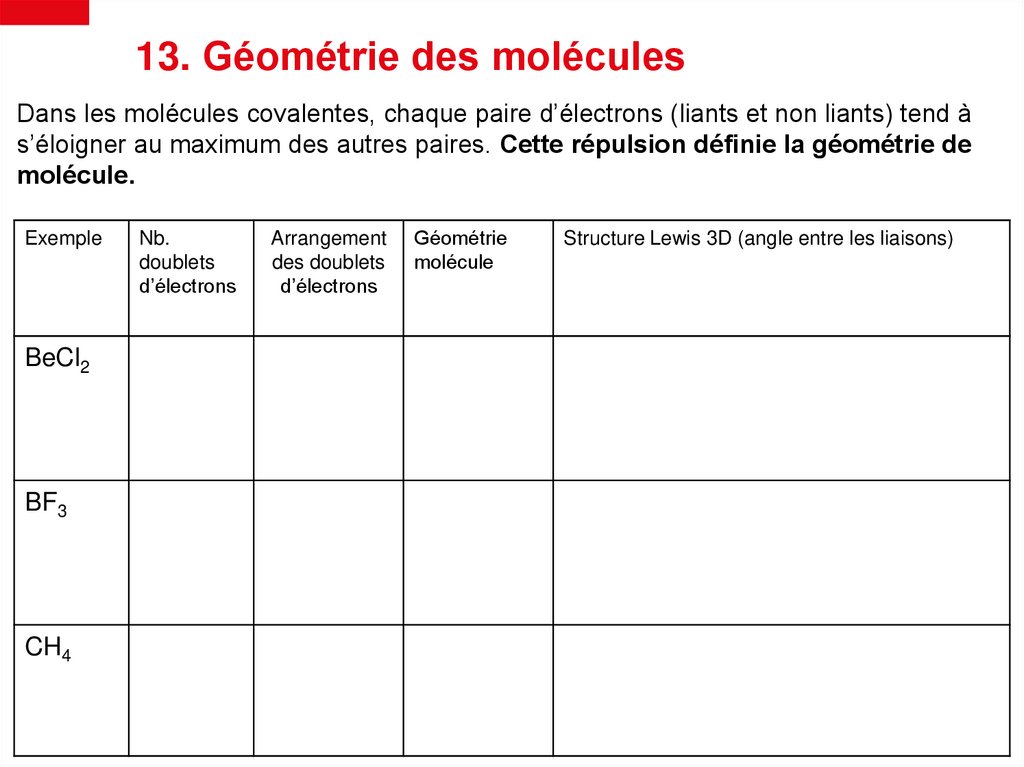
13. Géométrie des moléculesDans les molécules covalentes, chaque paire d’électrons (liants et non liants) tend à
s’éloigner au maximum des autres paires. Cette répulsion définie la géométrie de
molécule.
Exemple
BeCl2
BF3
CH4
Nb.
doublets
d’électrons
Arrangement
des doublets
d’électrons
Géométrie
molécule
Structure Lewis 3D (angle entre les liaisons)
26.
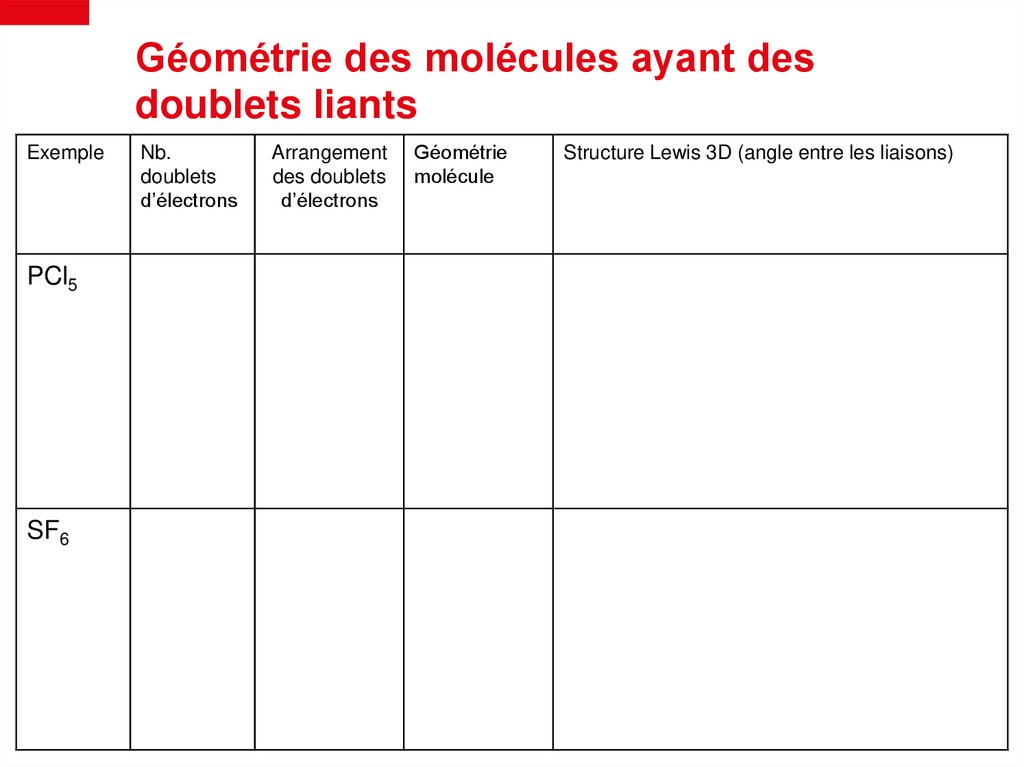
Géométrie des molécules ayant desdoublets liants
Exemple
PCl5
SF6
Nb.
doublets
d’électrons
Arrangement
des doublets
d’électrons
Géométrie
molécule
Structure Lewis 3D (angle entre les liaisons)
27.
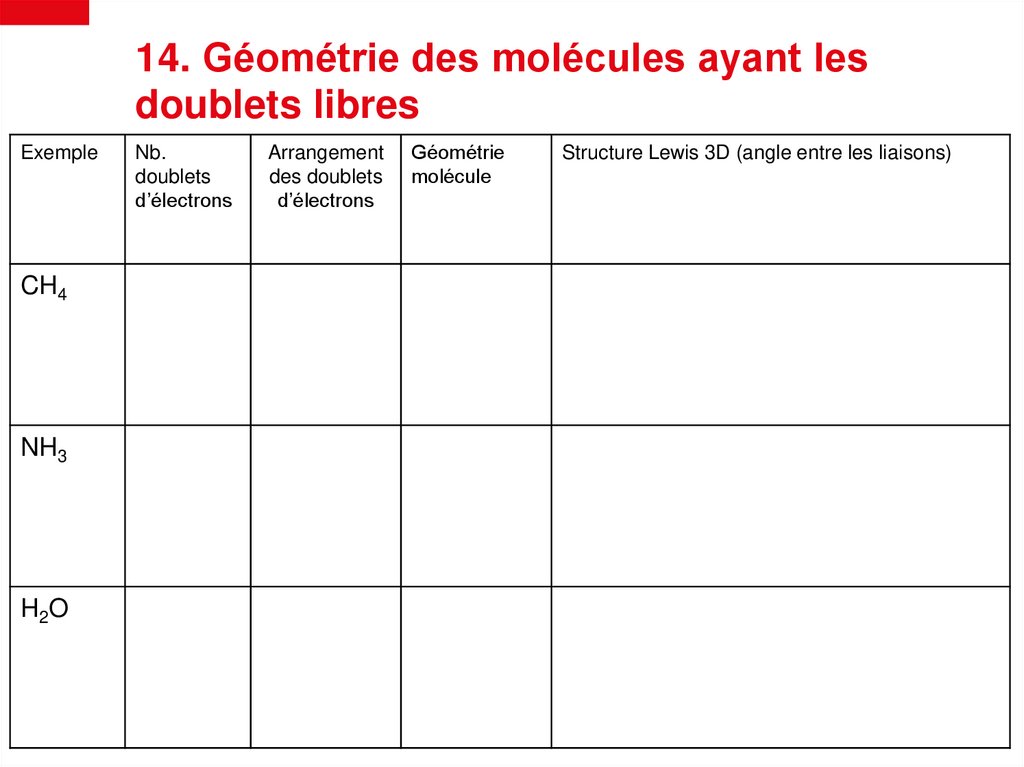
14. Géométrie des molécules ayant lesdoublets libres
Exemple
CH4
NH3
H2O
Nb.
doublets
d’électrons
Arrangement
des doublets
d’électrons
Géométrie
molécule
Structure Lewis 3D (angle entre les liaisons)
28.
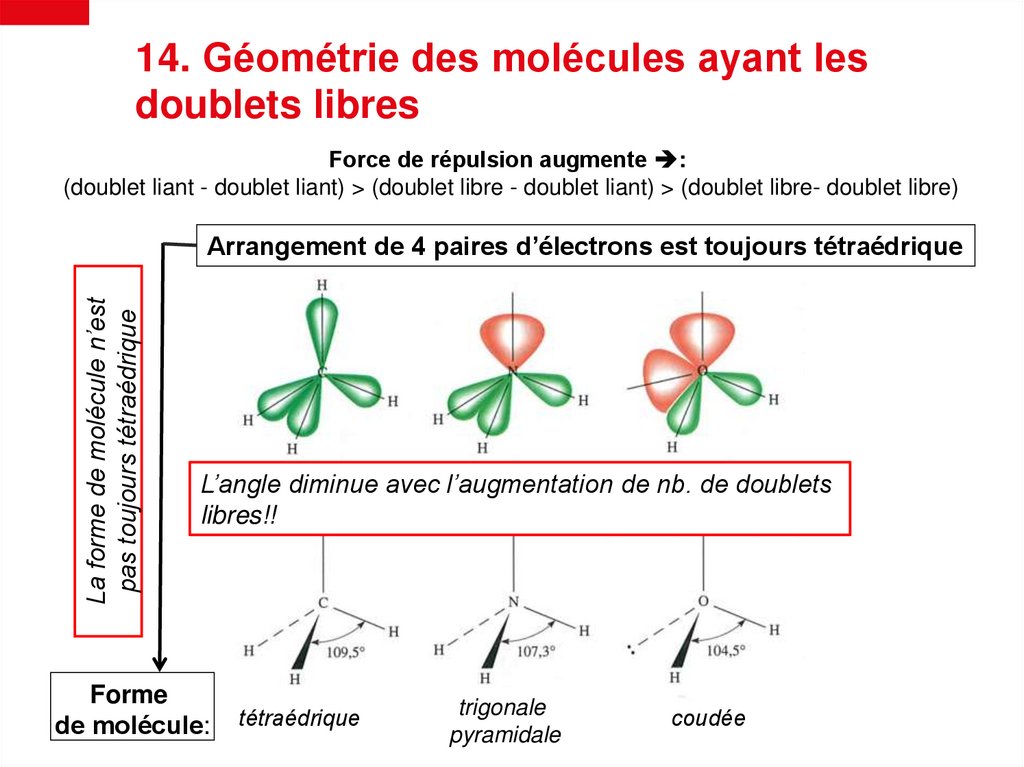
14. Géométrie des molécules ayant lesdoublets libres
Force de répulsion augmente :
(doublet liant - doublet liant) > (doublet libre - doublet liant) > (doublet libre- doublet libre)
La forme de molécule n’est
pas toujours tétraédrique
Arrangement de 4 paires d’électrons est toujours tétraédrique
L’angle diminue avec l’augmentation de nb. de doublets
libres!!
Forme
de molécule:
tétraédrique
trigonale
pyramidale
coudée
29.
15. Forme des molécules contenant lesliaisons multiples (doubles, triples)
Exemple
Nb.
doublets
d’électrons
autour du
carbone
Nb. doublets
considérés
pour la
géométrie
Géométrie
molécule
Structure Lewis 3D (angle entre les liaisons)
C2H6
C2H4
C2H2
Pour la géométrie (angle), les liaisons doubles et triples comptent comme des simples
30.
16. Géométrie et le moment dipolaire(polarité) des molécules
Les molécules composées de liaisons covalentes peuvent être polaires ou
apolaires.
La polarité d’une molécule covalente est déterminée par son moment dipolaire, µ.
Le moment dipolaire est une grandeur vectorielle.
Le moment dipolaire dépend des charges partielles (+q, -q) et de la distance entre
ces charges.
Direction : celle de la liaison
Sens : En chimie, du pôle + vers le pôle -
Molécule apolaire AB ayant une liaison
Molécule polaire AB ayant une liaison
covalente apolaire (µ=0)
covalente polaire (µ ≠ 0)
31.
16. Géométrie et le moment dipolaire(polarité) des molécules
Les moments dipolaires de chaque liaison s ’ajoutent vectoriellement. Leur
résultante est le moment dipolaire global de la molécule.
Pour déterminer la polarité d’une molécule (le moment dipolaire, µ), il faut:
• dessiner la structure de Lewis d’une molécule dans l’espace (3D)
• analyser la polarité de chaque liaison (en faisant le calcul de ) et dessiner
les vecteurs du champ électrique pour chaque liaison
• faire la somme géométrique de tous les vecteurs du champ électrique
• si le vecteur résultant est zéro, la molécule est apolaire ( µ = 0);
• si le vecteur résultant est différent de zéro, la molécule est polaire ( µ ≠ 0)
32.
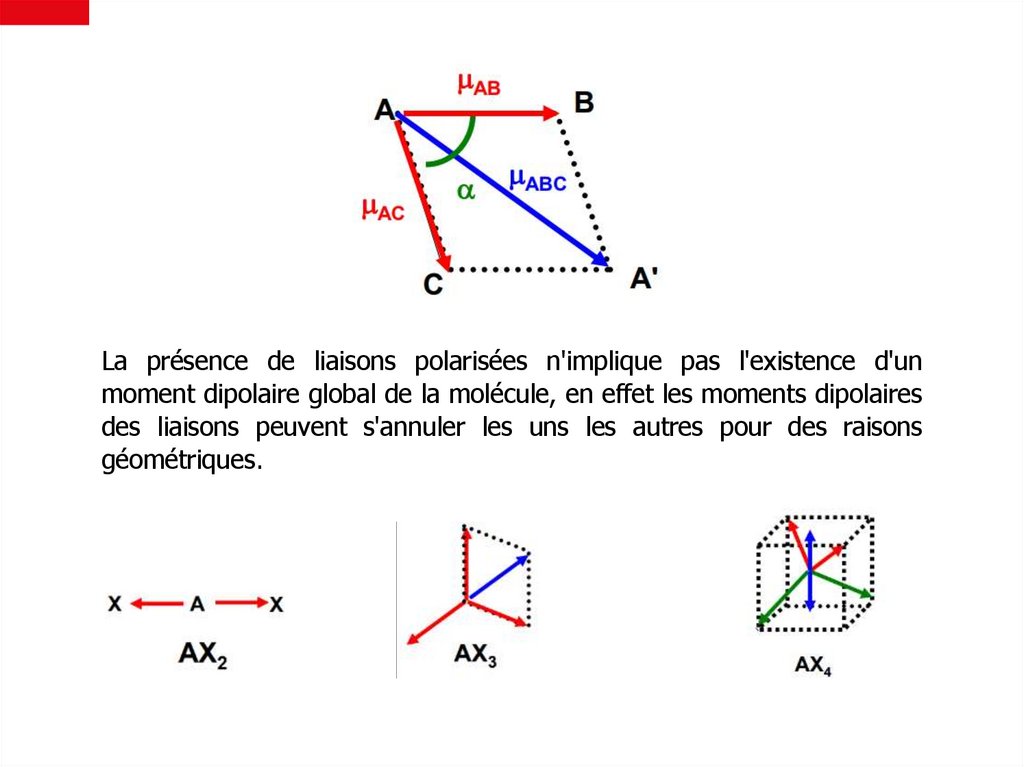
La présence de liaisons polarisées n'implique pas l'existence d'unmoment dipolaire global de la molécule, en effet les moments dipolaires
des liaisons peuvent s'annuler les uns les autres pour des raisons
géométriques.
33.
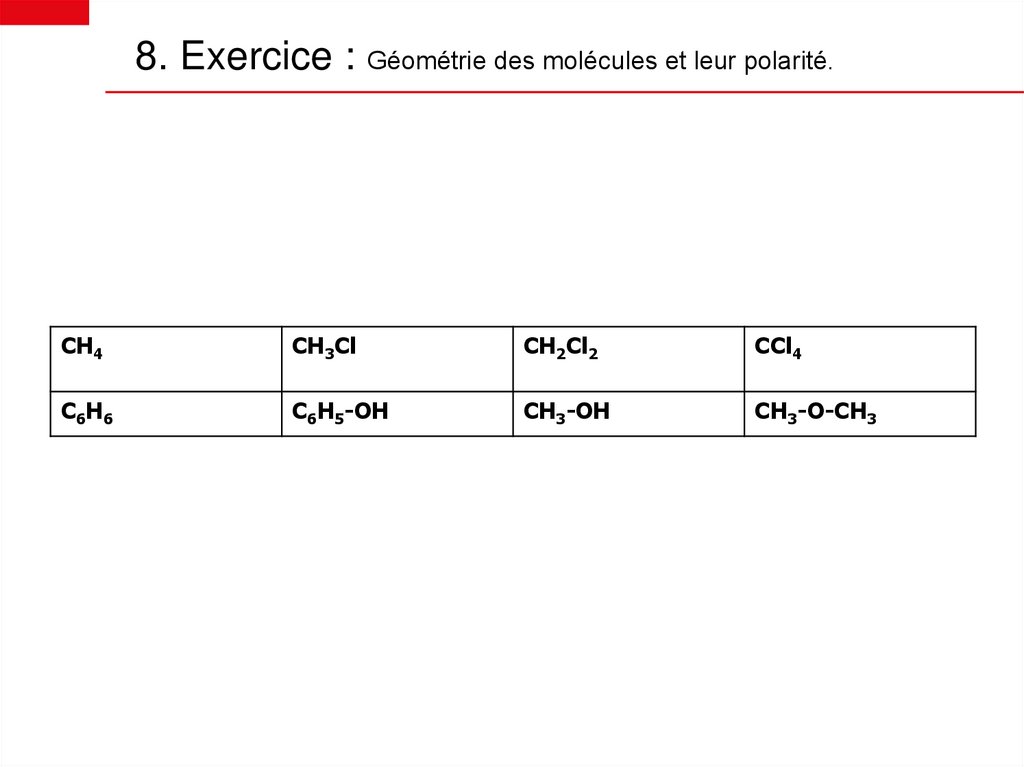
8. Exercice : Géométrie des molécules et leur polarité.CH4
CH3Cl
CH2Cl2
CCl4
C6 H 6
C6H5-OH
CH3-OH
CH3-O-CH3
34.
9. Exercice : Géométrie des molécules et leur polaritéPrécisez le type de liaisons (covalente non-polaire, covalente polaire ou ionique)
dans les substances (ions) suivantes. Justifiez votre réponse par le calcul. Dessinez la
structure de Lewis en 3D pour les molécules covalentes et déterminez si elles sont
polaires ou apolaires. Soulignez les substances qui n’obéissent pas à la règle d’octet
H2S
NH4+
CaF2
BF3
H2CO3 SCl6
CH3-OH
35.
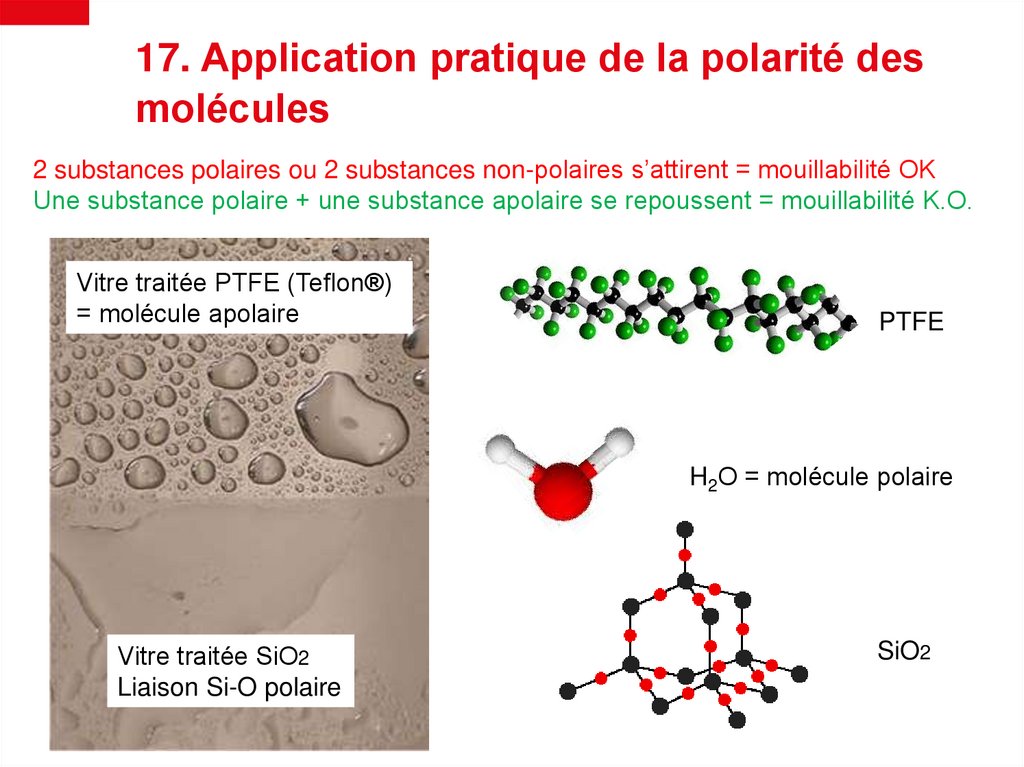
17. Application pratique de la polarité desmolécules
2 substances polaires ou 2 substances non-polaires s’attirent = mouillabilité OK
Une substance polaire + une substance apolaire se repoussent = mouillabilité K.O.
Vitre traitée PTFE (Teflon®)
= molécule apolaire
PTFE
H2O = molécule polaire
Vitre traitée SiO2
Liaison Si-O polaire
SiO2
36.
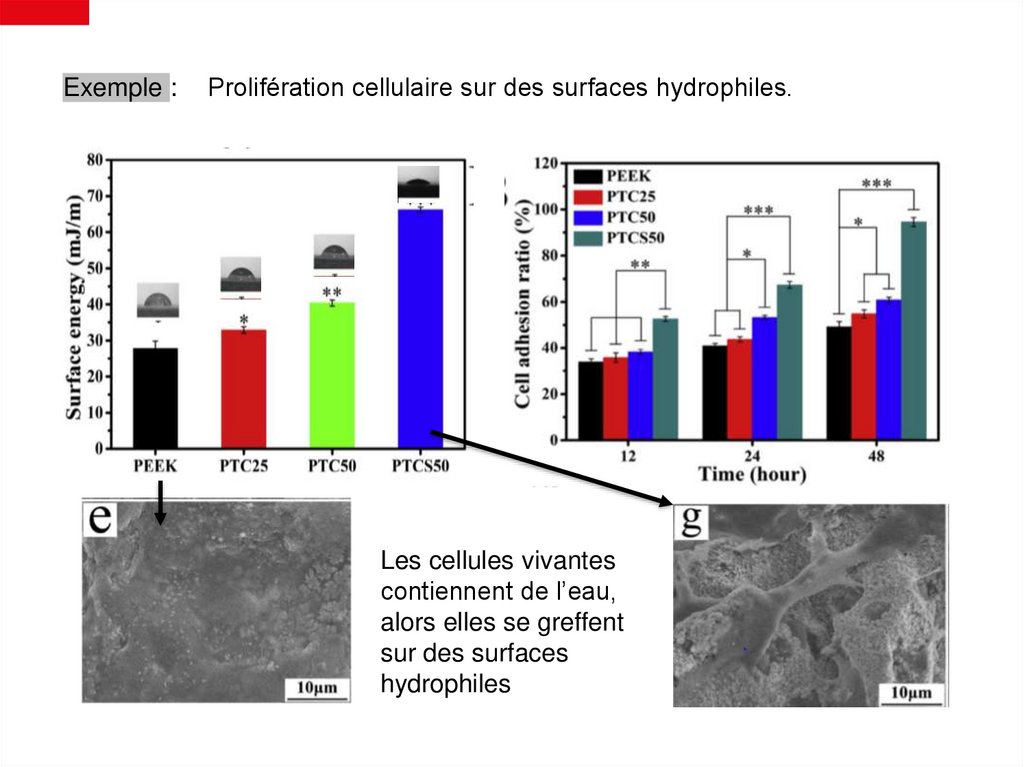
Exemple :Prolifération cellulaire sur des surfaces hydrophiles.
Les cellules vivantes
contiennent de l’eau,
alors elles se greffent
sur des surfaces
hydrophiles
37.
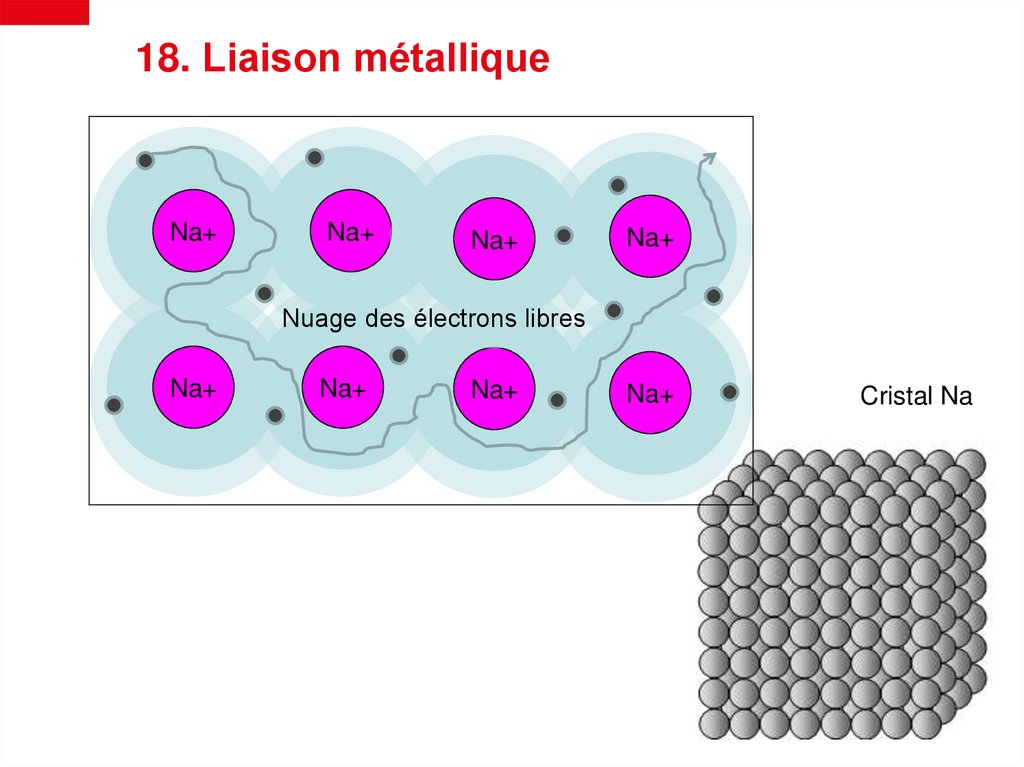
18. Liaison métalliqueNa+
Na+
Na+
Na+
Nuage des électrons libres
Na+
Na+des électrons
Na+ libres
Nuage
Na+
Cristal Na
38.
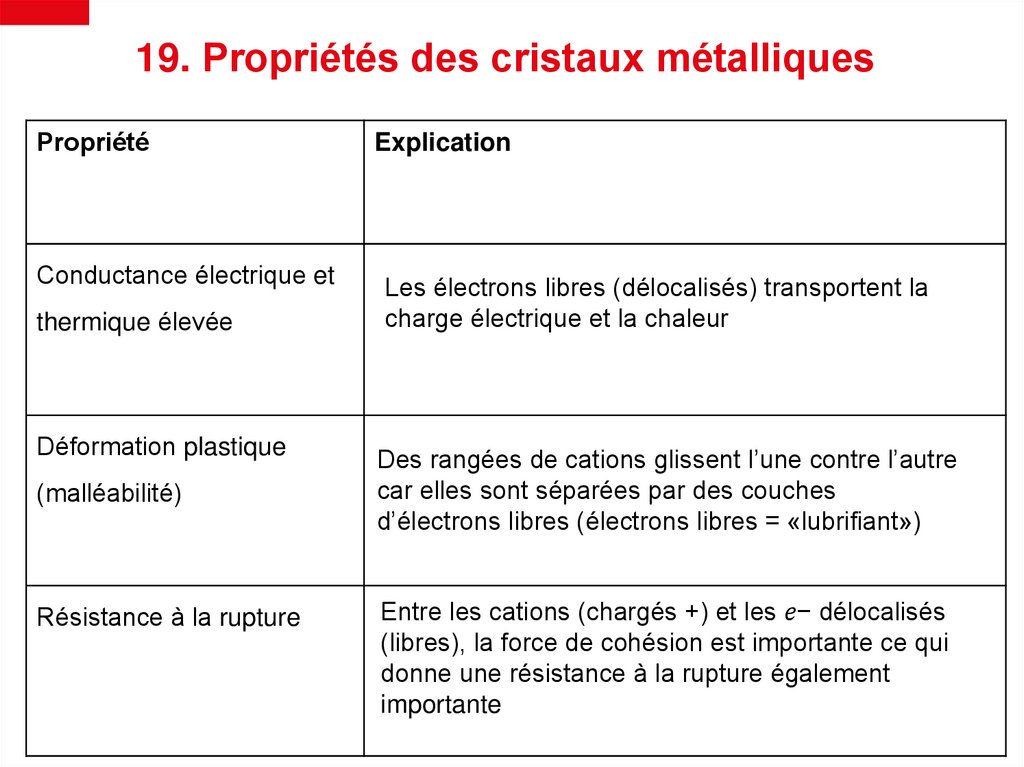
19. Propriétés des cristaux métalliquesPropriété
Explication
Conductance électrique et
Les électrons libres (délocalisés) transportent la
charge électrique et la chaleur
thermique élevée
Déformation plastique
(malléabilité)
Résistance à la rupture
Des rangées de cations glissent l’une contre l’autre
car elles sont séparées par des couches
d’électrons libres (électrons libres = «lubrifiant»)
Entre les cations (chargés +) et les


















 Химия
Химия
