Похожие презентации:
Классы неорганических веществ
1.
31.01.19.09.2025г
2013год
2.
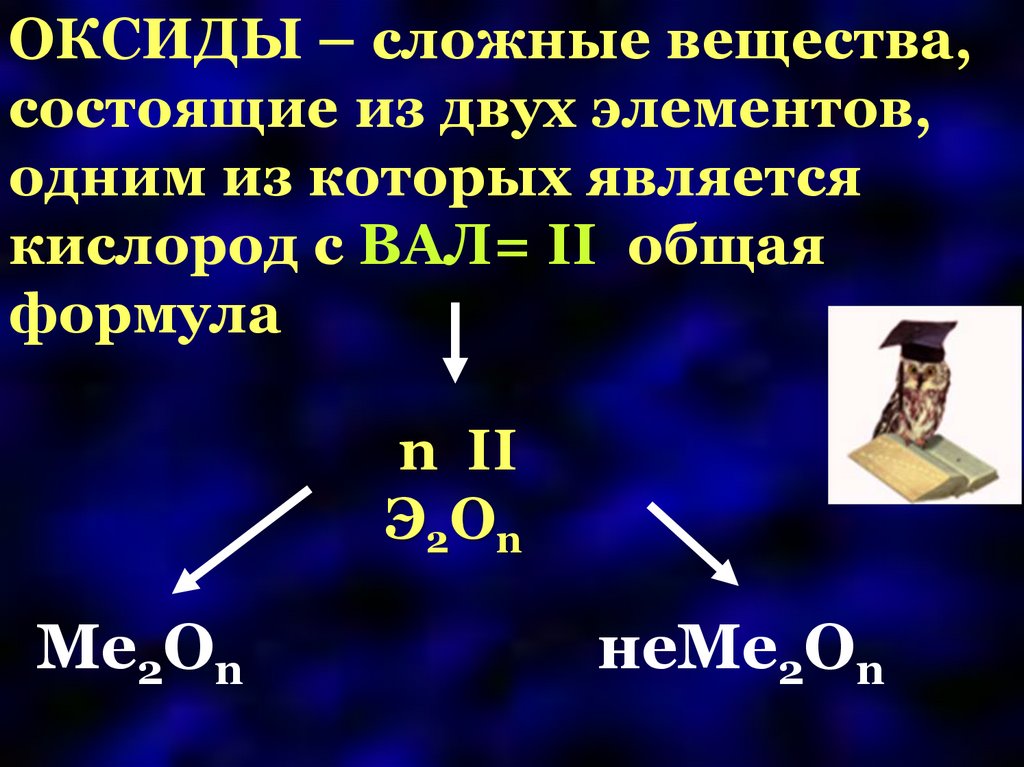
ОКСИДЫ – сложные вещества,состоящие из двух элементов,
одним из которых является
кислород с ВАЛ= II общая
формула
n II
Э2Оn
Ме2Оn
неМе2Оn
3.
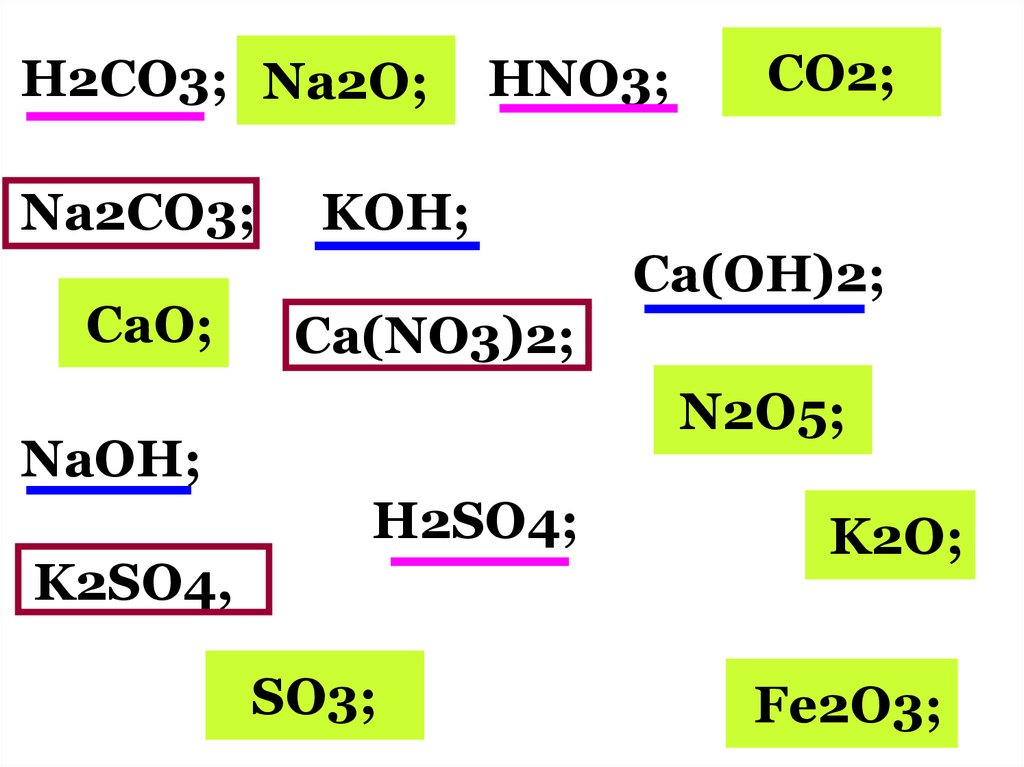
H2CO3; Na2O;Na2CO3;
CaO;
HNO3;
СO2;
KOH;
Сa(OH)2;
Ca(NO3)2;
N2O5;
NaOH;
H2SO4;
K2SO4,
SO3;
K2O;
Fe2O3;
4.
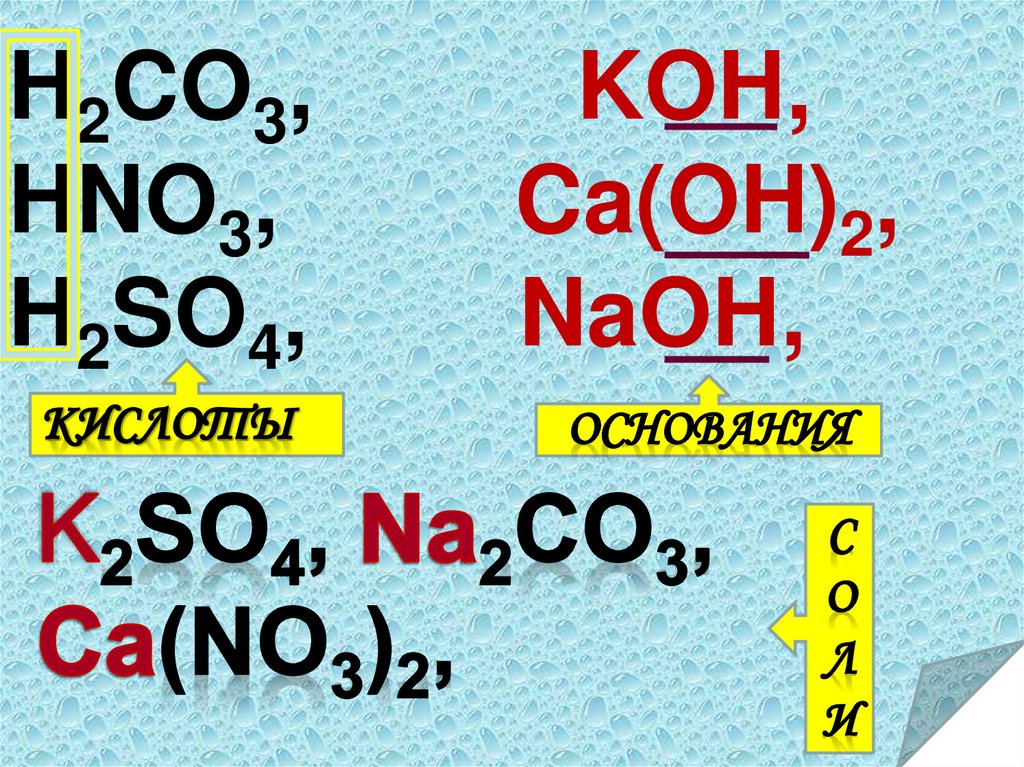
HCO
,
KOH,
Na
CO
,
2
3
H22CO33,
KOH,
HNO
,
Ca(OH)
,
2
HNO33,
Ca(OH)
,
2
Ca(NO
)
,
NaOH,
H2SO4,3 2 NaOH,
H2SO4, K2SO4,
5.
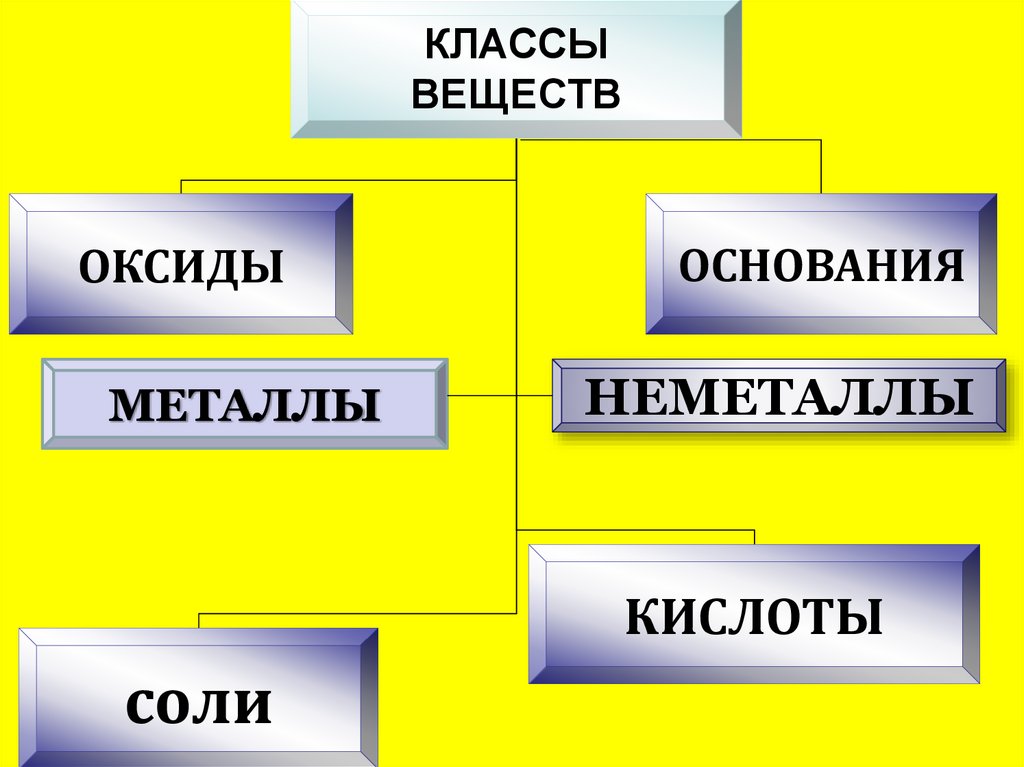
КЛАССЫВЕЩЕСТВ
ОКСИДЫ
МЕТАЛЛЫ
ОСНОВАНИЯ
НЕМЕТАЛЛЫ
КИСЛОТЫ
соли
6.
Несолеобразующиеобразованы
неМе с
ВАЛ=I,II
N2O,NO,CO
Кислотные-образованы
все неМе и Ме с
ВАЛ=V,VI,VII
Амфотерныеобразованы
Ме с ВАЛ=III, IV,
а также (ZnO,BeO,
SnO,PbO)
ОснОвныеобразованы
Ме с ВАЛ=I,II
(кроме-ZnO,BeO)
7.
Вывод: характер свойств оксидовв первую очередь зависит от
валентности элемента.
Например, CrO (II - основный);
Cr2O3 (III - амфотерный);
CrO3 (VI - кислотный)
8.
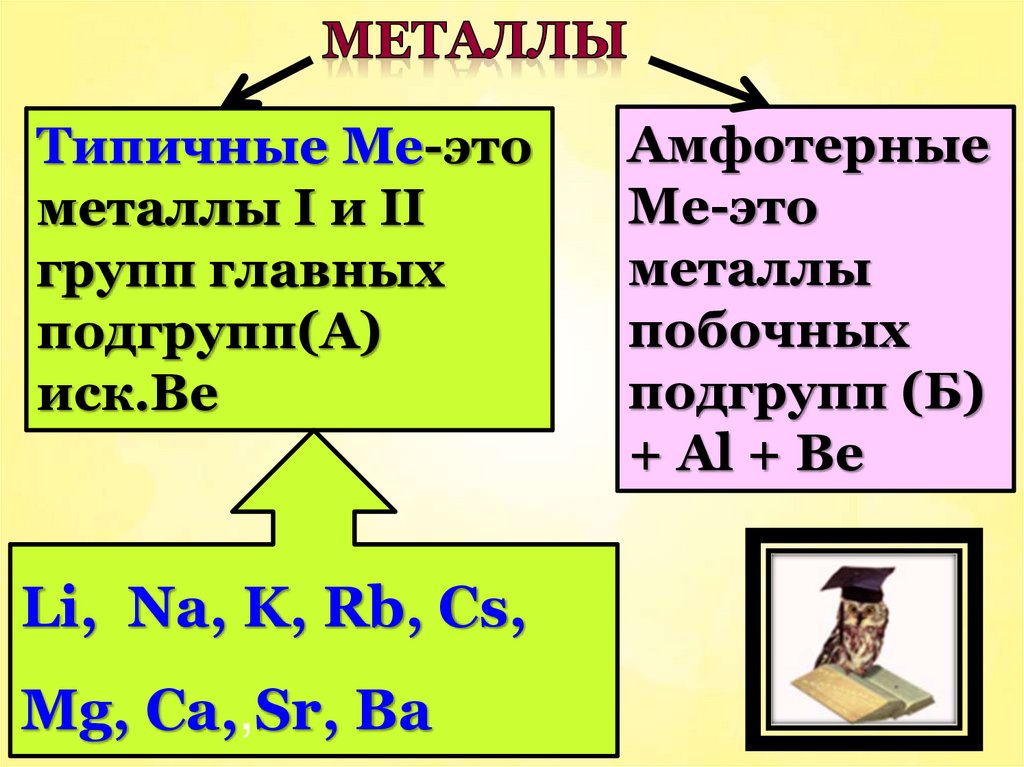
Типичные Ме-этометаллы I и II
групп главных
подгрупп(А)
иск.Ве
Li, Na, K, Rb, Cs,
Mg, Ca,,Sr, Ba
Амфотерные
Ме-это
металлы
побочных
подгрупп (Б)
+ Al + Ве
9.
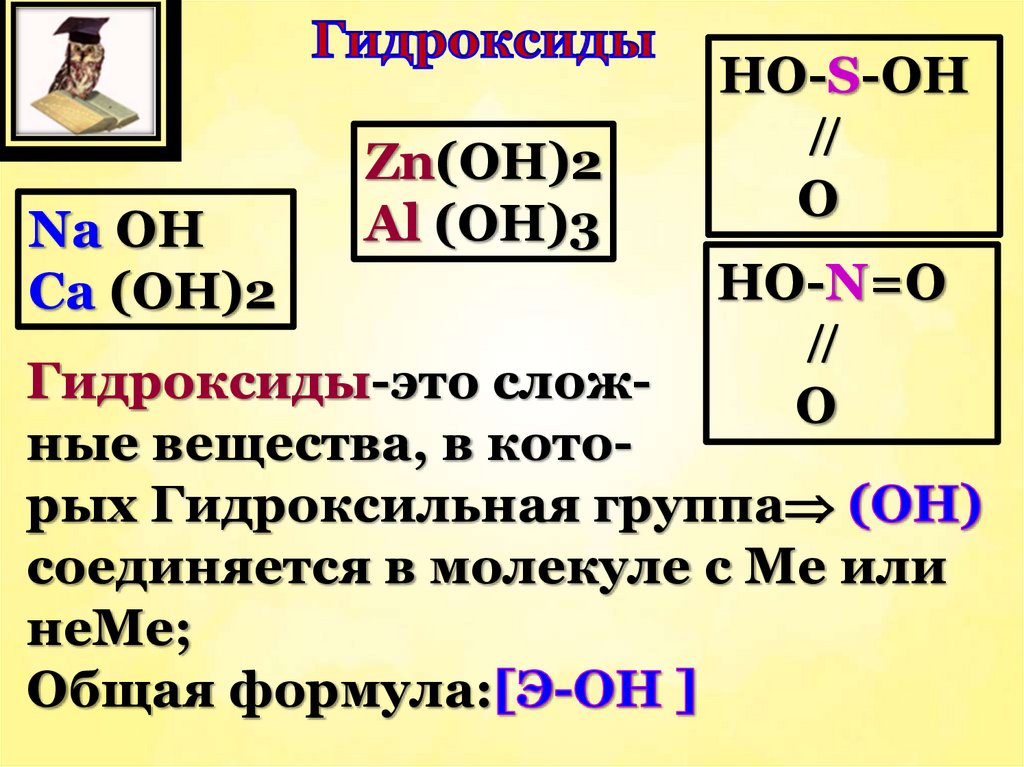
Na OHCa (OH)2
Zn(OH)2
Al (OH)3
HO-S-OH
O
HO-N=O
O
Гидроксиды-это сложные вещества, в которых Гидроксильная группа
соединяется в молекуле с Ме или
неМе;
Общая формула:
10.
Амфотерныегидроксиды
11.
12.
Основания-это сложные вещества,состоящие из атома металла (Ме) и
связанных с ним гидроксильных
групп→(ОН) с ВАЛ=I;
общая формула оснований:
n I
Ме(ОН)n
где n-валентность Ме
равная I или II
Например
13.
II
II I
II I
Na OH; Ca(OH)2; Sr(OH)2;
Число гидроксогрупп, определяется индексом численно
равным валентности Ме
Названия оснований
KOH
Ca(OH)2
NaOH
гидроксид гидроксид
калия
кальция
гидроксид
натрия
14.
15.
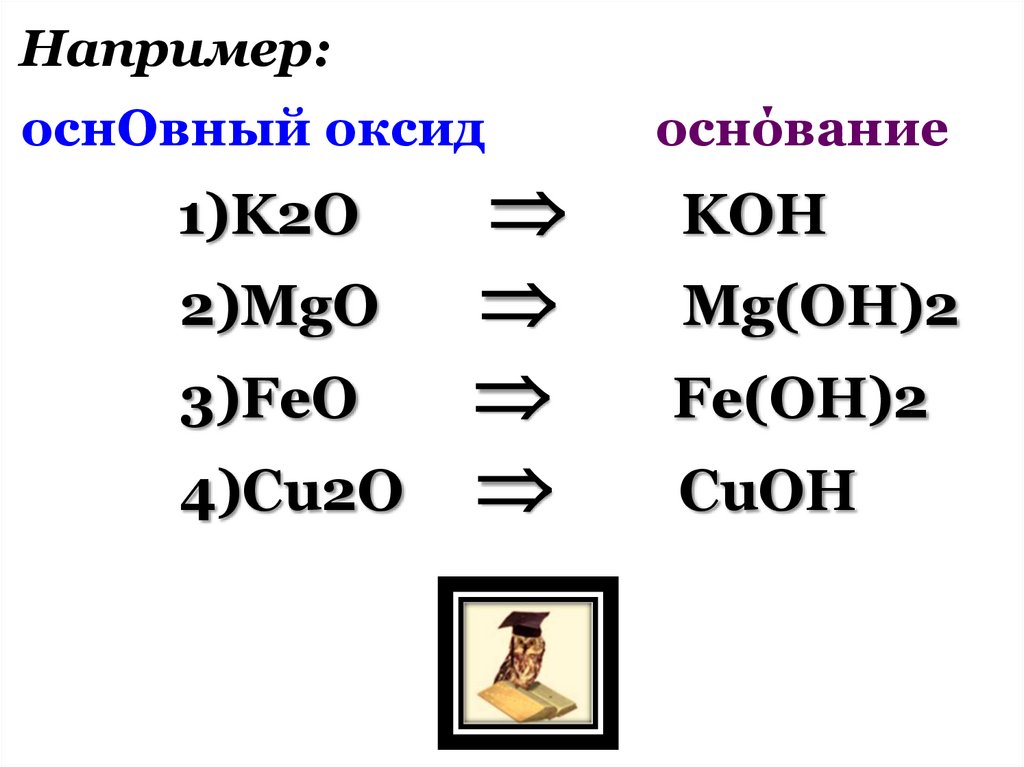
Например:оснОвный оксид
1)K2O
2)MgO
3)FeO
4)Cu2O
оснόвание
KOН
Mg(OН)2
Fe(OН)2
CuOН
16.
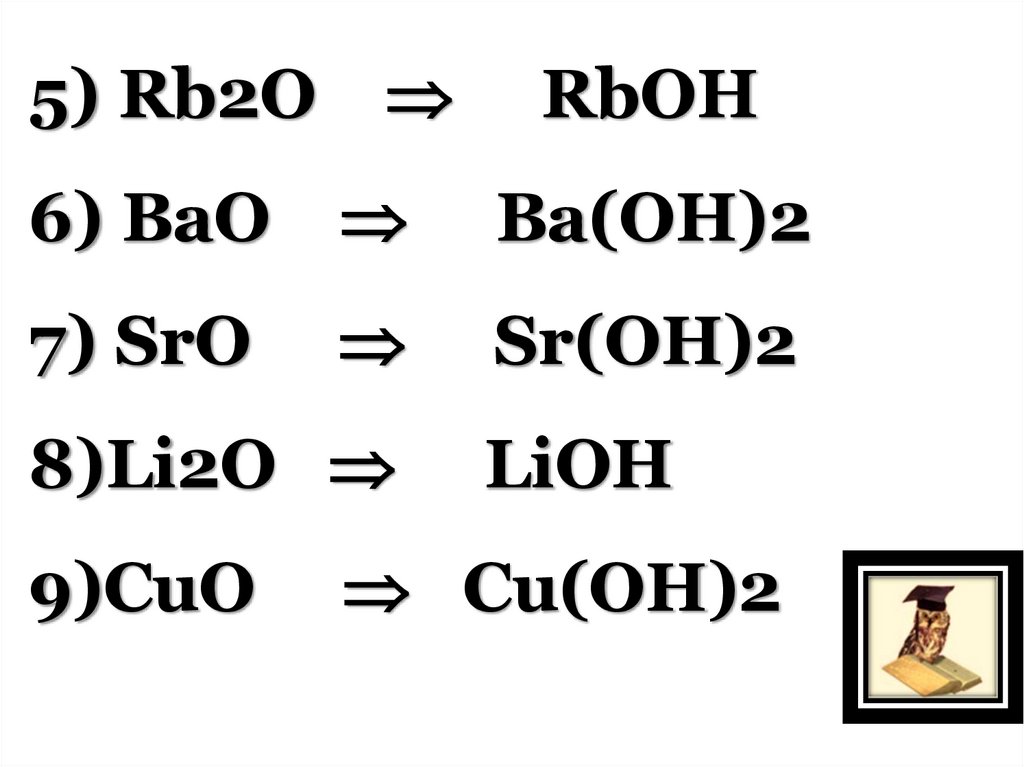
5) Rb2ORbOН
6) BaO
Ba(OН)2
7) SrO
Sr(OН)2
8)Li2O
9)CuO
LiOН
Cu(OН)2
17.
18.
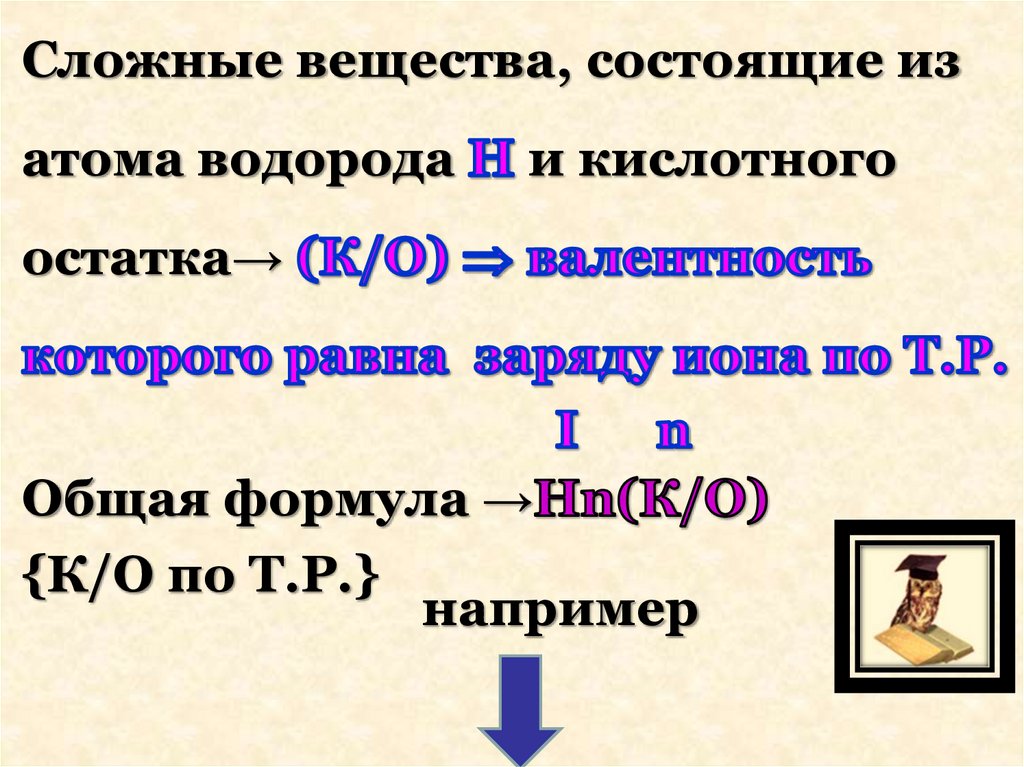
Сложные вещества, состоящие изатома водорода
и кислотного
остатка→
Общая формула →
{К/О по Т.Р.}
например
19.
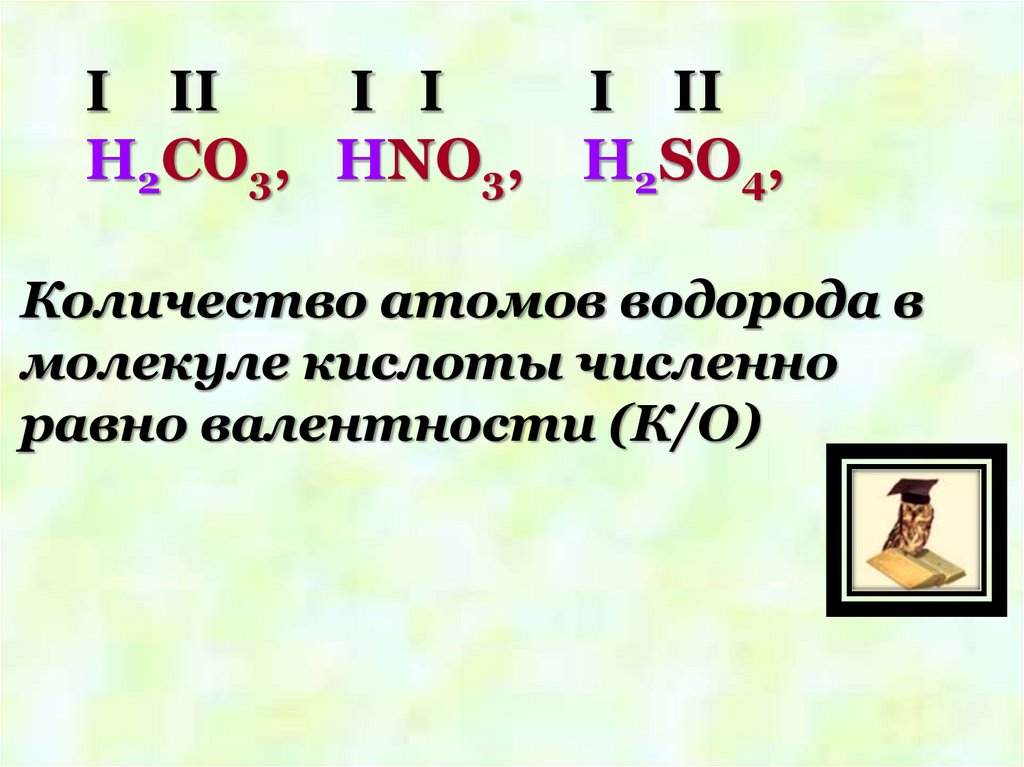
I III I
H2CO3, HNO3,
I II
H2SO4,
Количество атомов водорода в
молекуле кислоты численно
равно валентности (К/О)
20.
ФОРМУЛЫИ
НАЗВАНИЯ
КИСЛОТ
21.
IIHF
I I
HCl
I I
HBr
II
HI
I II
H2S
-ФТОРОВОДОРОДНАЯ КИСЛОТА
(ПЛАВИКОВАЯ)
-ХЛОРОВОДОРОДНАЯ КИСЛОТА
(СОЛЯНАЯ)
-БРОМОВОДОРОДНАЯ КИСЛОТА
-ЙОДОВОДОРОДНАЯ КИСЛОТА
-СЕРОВОДОРОДНАЯ КИСЛОТА
22.
I IHNO3 -АЗОТНАЯ КИСЛОТА
I I
HNO2 -АЗОТИСТАЯ КИСЛОТА
II II
- СЕРНИСТАЯ КИСЛОТА
H2SO3
II II
-СЕРНАЯ КИСЛОТА
H2SO4
(ОРТО)ФОСФОРНАЯ
I II
КИСЛОТА
H3PO4
23.
III
H2CO3 -УГОЛЬНАЯ КИСЛОТА
I II
-КРЕМНИЕВАЯ
Н2SiO3
КИСЛОТА
24.
Каждому кислотному оксидусоответствует кислота:
кислотный кислота
оксид N2O5 HNO3
N2O3 HNO2
SO2 H2SO3
SO3 H2SO4
P2O5 H3PO4
CO2 H2CO3
SiO2 H2SiO3
25.
26.
Амфотерные гидроксиды-этосложные вещества, состоящие из
атома металла (Ме) с валентностью
III и IV связанных с ним
гидроксильных групп→(ОН) с ВАЛ=I;
а также Zn,Be,Al;
общая формула оснований:
n I
Ме(ОН)n
27.
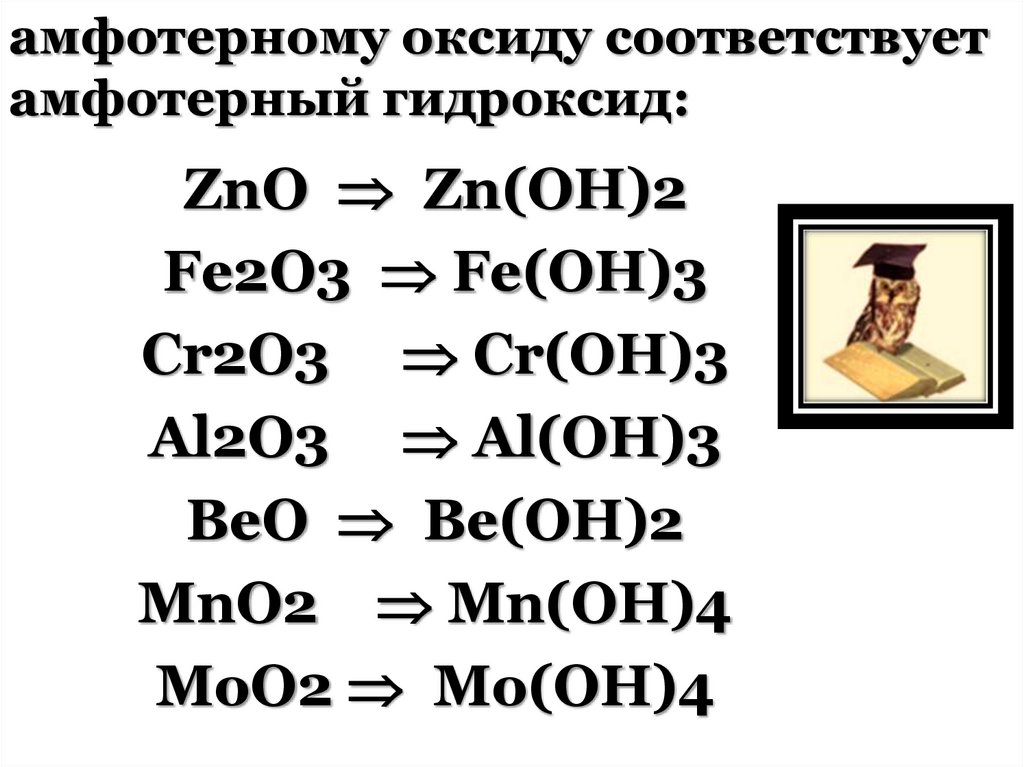
амфотерному оксиду соответствуетамфотерный гидроксид:
ZnO Zn(OH)2
Fe2O3 Fe(OH)3
Cr2O3 Cr(OH)3
Al2O3 Al(OH)3
BeO Be(OH)2
MnO2 Mn(OH)4
MoO2 Mo(OH)4
28.
29.
СОЛИ- это сложныевещества, состоящие из
n+
mионов Ме и (К/О)
Общая формула:
n+
mМе m (К/О) n
30.
ПРАВИЛА НАЗВАНИЯСОЛЕЙ
1-МЕСТО-НАЗВАНИЕ (К/О)
2-МЕСТО НАЗВАНИЕ Ме в
Р.п.
31.
например:АЛГОРИТМ НАЗВАНИЯ СОЛЕЙ
Fe2(SO4)3 –CУЛЬФАТ ЖЕЛЕЗА(III)
CuCl2 – ХЛОРИД МЕДИ (II)
Al2(CO3)3 – КАРБОНАТ
АЛЮМИНИЯ
MgBr2 – БРОМИД МАГНИЯ
K2SiO3 – СИЛИКАТ КАЛИЯ
32.
НАЗВАНИЯ К/О солейF-
-ФТОРИД
Cl-
-ХЛОРИД
Br-
-БРОМИД
I-
-ЙОДИД
S2-
-СУЛЬФИД
SO32-
-СУЛЬФИТ
33.
SO4 2- -СУЛЬФАТNO3-
-НИТРАТ
NO23PO4
-НИТРИТ
-(ОРТО)ФОСФАТ
CO32-
-КАРБОНАТ
SiO32- -СИЛИКАТ





















 Химия
Химия








