Похожие презентации:
Proprietăţile fizico-chimice ale proteinelor
1. PROPRIETĂŢILE FIZICO-CHIMICE ALE PROTEINELOR
Silvia StratulatConferențiar universitar
2. OBIECTIVELE:
1. Masa moleculară a proteinelor. Principiile de bază utilizate pentru determinarea masei moleculare(ultracentrifugarea, cromatografia, spectrometria de masă).
2. Proprietăţile amfotere ale proteinelor. Sarcina electrică a proteinelor. Factorii ce determină sarcina proteinei.
Punctul şi starea izoelectrică.
3. Solubilitatea proteinelor. Proprietăţile hidrofile ale proteinelor în funcție de componența aminoacizilor,
particularităţile structurale, pH-ul și temperatura solventului. Proprietățile soluțiilor proteice ca soluții
coloidale. Stările de agregare ale soluțiilor proteice (sol, gel, xerogel). Utilizarea biomedicală a xerogelurilor.
4. Denaturarea proteinelor, agenţii ce provoacă denaturarea. Modificările structurale ale proteinei la
denaturare. Importanța biomedicală a denaturării.
5. Metodele de separare, purificare și analiză ale proteinelor (principiul metodelor, importanța biomedicală): a)
salifierea; b) dializa; c) electroforeza; d) cromatografia; e) spectrofotometria; f) ELISA – analiza
imunoenzimatică.
3. PROPRIETĂŢI FIZICO-CHIMICE
• Masa moleculară• Solubilitatea proteinelor
• Proprietăţile amfotere și sarcina electrică a proteinei
• Denaturarea
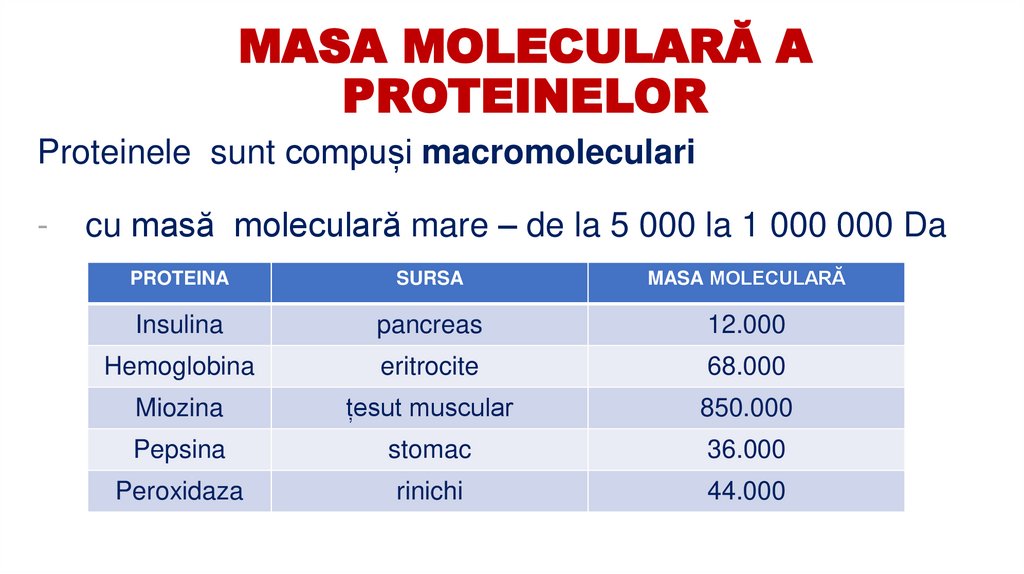
4. MASA MOLECULARĂ A PROTEINELOR
Proteinele sunt compuși macromoleculari-
cu masă moleculară mare – de la 5 000 la 1 000 000 Da
PROTEINA
SURSA
MASA MOLECULARĂ
Insulina
pancreas
12.000
Hemoglobina
eritrocite
68.000
Miozina
țesut muscular
850.000
Pepsina
stomac
36.000
Peroxidaza
rinichi
44.000
5. METODELE DE DETERMINARE A MASEI MOLECULARE A PR
se determină prin următoarele metode:
1. Ultracentrifugarea (pr. sedimentează în raport cu masa şi
mărimea lor)
2. Cromotografiă
3. Spectrometria de masă
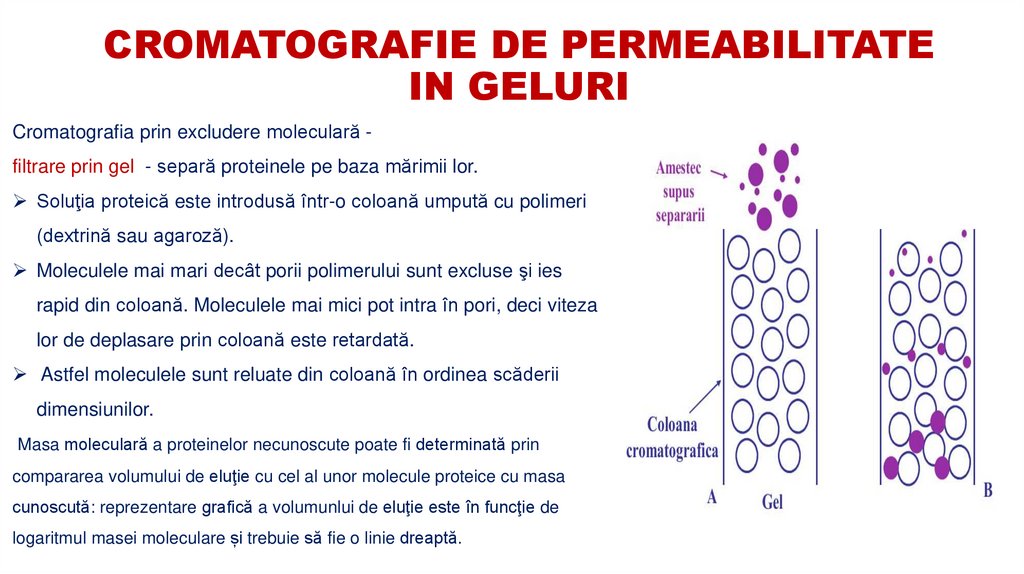
6. CROMATOGRAFIE DE PERMEABILITATE IN GELURI
Cromatografia prin excludere moleculară filtrare prin gel - separă proteinele pe baza mărimii lor.Soluţia proteică este introdusă într-o coloană umpută cu polimeri
(dextrină sau agaroză).
Moleculele mai mari decât porii polimerului sunt excluse şi ies
rapid din coloană. Moleculele mai mici pot intra în pori, deci viteza
lor de deplasare prin coloană este retardată.
Astfel moleculele sunt reluate din coloană în ordinea scăderii
dimensiunilor.
Masa moleculară a proteinelor necunoscute poate fi determinată prin
compararea volumului de eluţie cu cel al unor molecule proteice cu masa
cunoscută: reprezentare grafică a volumunlui de eluţie este în funcţie de
logaritmul masei moleculare și trebuie să fie o linie dreaptă.
7. SPECTROMETRIA DE MASĂ
o metodă fizică ce constă în ionizarea substanţei
investigate, urmată de separarea ionilor obţinuţi în
funcţie de raportul dintre masă şi sarcină.
• spectrul de masă reprezintă înregistrarea maselor şi a
abundenţelor relative ale ionilor obţinuţi.
• reamintim ca nu se masoara direct masa
moleculei ci mai exact raportul masa/ sarcină
pentru un ion.
8.
• PROPRIETĂŢILE AMFOTERE ALEPROTEINELOR.
• SARCINA ELECTRICĂ A PROTEINELOR.
• PUNCTUL ŞI STAREA IZOELECTRICĂ
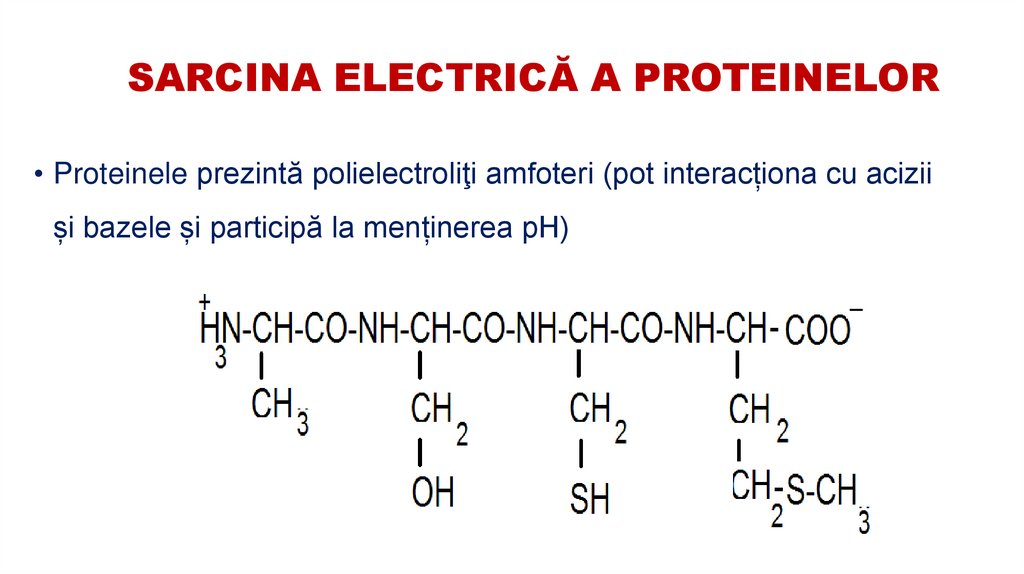
9. SARCINA ELECTRICĂ A PROTEINELOR
• Proteinele prezintă polielectroliţi amfoteri (pot interacționa cu aciziiși bazele și participă la menținerea pH)
10. SARCINA ELECTRICĂ A PROTEINELOR
Depinde de:Componența aminoacidică a proteinei;
pH-ul soluției în care este dizolvată proteina
11.
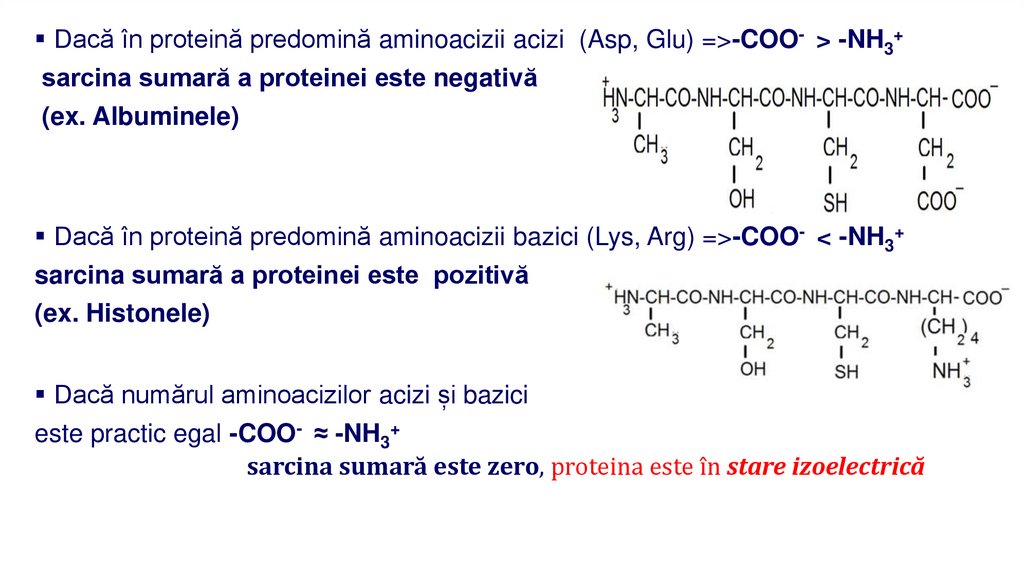
Dacă în proteină predomină aminoacizii acizi (Asp, Glu) =>-COO- > -NH3+sarcina sumară a proteinei este negativă
(ex. Albuminele)
Dacă în proteină predomină aminoacizii bazici (Lys, Arg) =>-COO- < -NH3+
sarcina sumară a proteinei este pozitivă
(ex. Histonele)
Dacă numărul aminoacizilor acizi și bazici
este practic egal -COO- ≈ -NH3+
sarcina sumară este zero, proteina este în stare izoelectrică
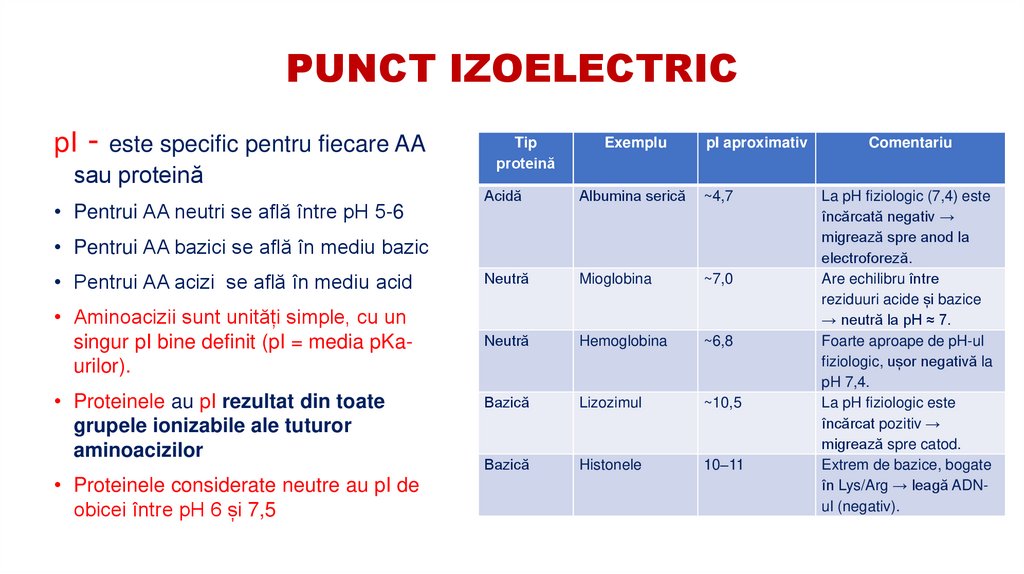
12. PUNCT IZOELECTRIC
Punctul izoelectric (pI) este pH-ul la care o moleculă proteică aresarcina electrică netă egală cu zero ( suma sarcinilor pozitive este
egală cu suma sarcinilor negative)
• La pH = pI, proteinele au sarcina netă zero și nu migrează într-un
câmp electric. Interacțiunile electrostatice dintre grupările –COO⁻ și –
NH₃⁺ favorizează aglomerarea moleculelor, ceea ce determină
scăderea solubilității până la un minim
13. PUNCT IZOELECTRIC
pI - este specific pentru fiecare AAsau proteină
Tip
proteină
Exemplu
pI aproximativ
Acidă
Albumina serică
~4,7
• Pentrui AA acizi se află în mediu acid
Neutră
Mioglobina
~7,0
• Aminoacizii sunt unități simple, cu un
singur pI bine definit (pI = media pKaurilor).
Neutră
Hemoglobina
~6,8
Bazică
Lizozimul
~10,5
Bazică
Histonele
10–11
• Pentrui AA neutri se află între pH 5-6
• Pentrui AA bazici se află în mediu bazic
• Proteinele au pI rezultat din toate
grupele ionizabile ale tuturor
aminoacizilor
• Proteinele considerate neutre au pI de
obicei între pH 6 și 7,5
Comentariu
La pH fiziologic (7,4) este
încărcată negativ →
migrează spre anod la
electroforeză.
Are echilibru între
reziduuri acide și bazice
→ neutră la pH ≈ 7.
Foarte aproape de pH-ul
fiziologic, ușor negativă la
pH 7,4.
La pH fiziologic este
încărcat pozitiv →
migrează spre catod.
Extrem de bazice, bogate
în Lys/Arg → leagă ADNul (negativ).
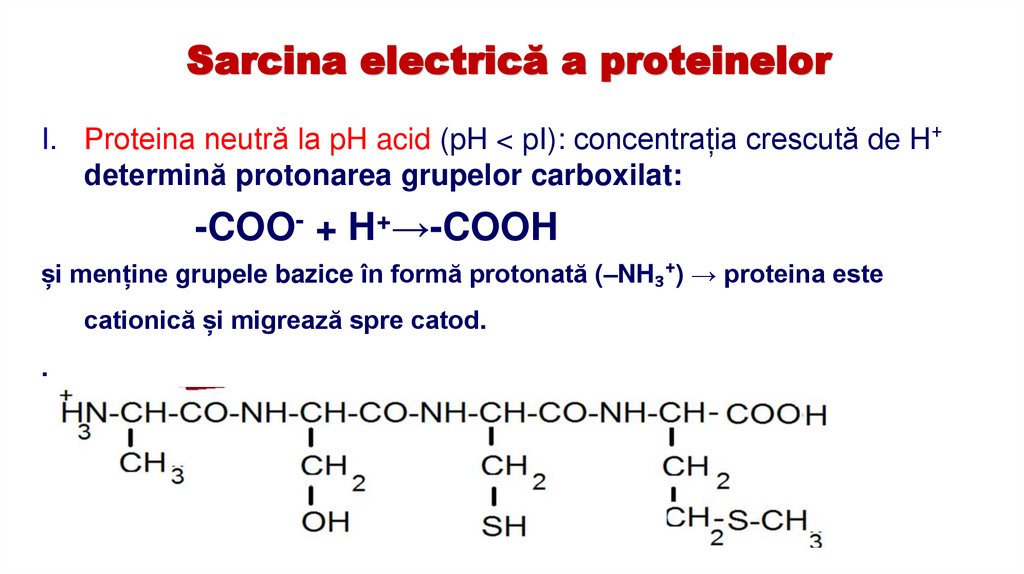
14.
Sarcina electrică a proteinelorI. Proteina neutră la pH acid (pH < pI): concentrația crescută de H⁺
determină protonarea grupelor carboxilat:
-COO- + H+→-COOH
și menține grupele bazice în formă protonată (–NH₃⁺) → proteina este
cationică și migrează spre catod.
.
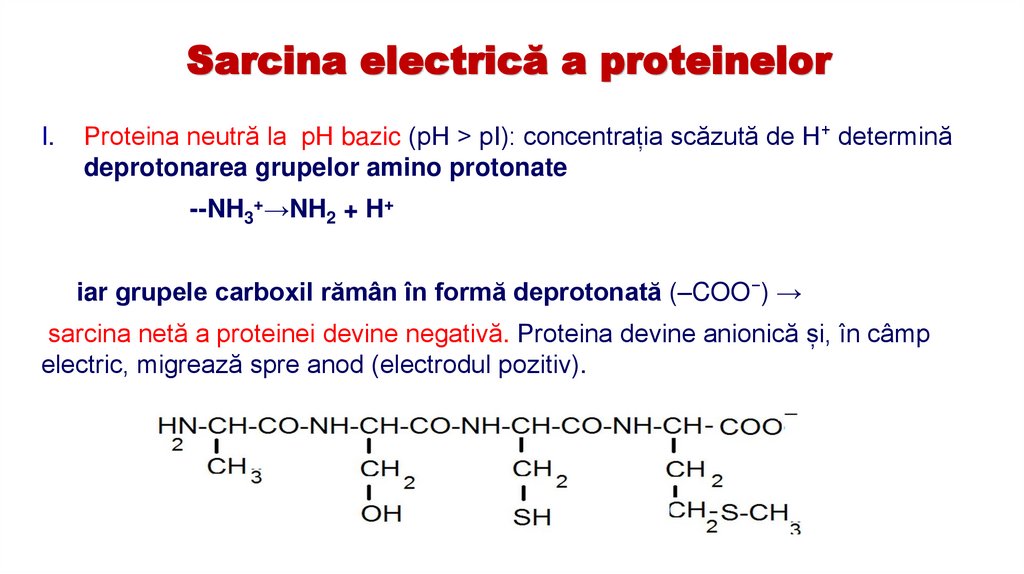
15.
Sarcina electrică a proteinelorI.
Proteina neutră la pH bazic (pH > pI): concentrația scăzută de H⁺ determină
deprotonarea grupelor amino protonate
--NH3+→NH2 + H+
iar grupele carboxil rămân în formă deprotonată (–COO⁻) →
sarcina netă a proteinei devine negativă. Proteina devine anionică și, în câmp
electric, migrează spre anod (electrodul pozitiv).
16. CONCLUZIE:
• A. Proteina neutră• În soluție acidă - sarcina sumară va fi pozitivă (cation)
• În soluție bazică - sarcina sumară va fi negativă (anion)
Datorită acestui fapt la trecerea unui curent electric în soluţie, proteina
neutră va migra:
în mediu acid spre catod (-),
în mediu alcalin spre anod(+).
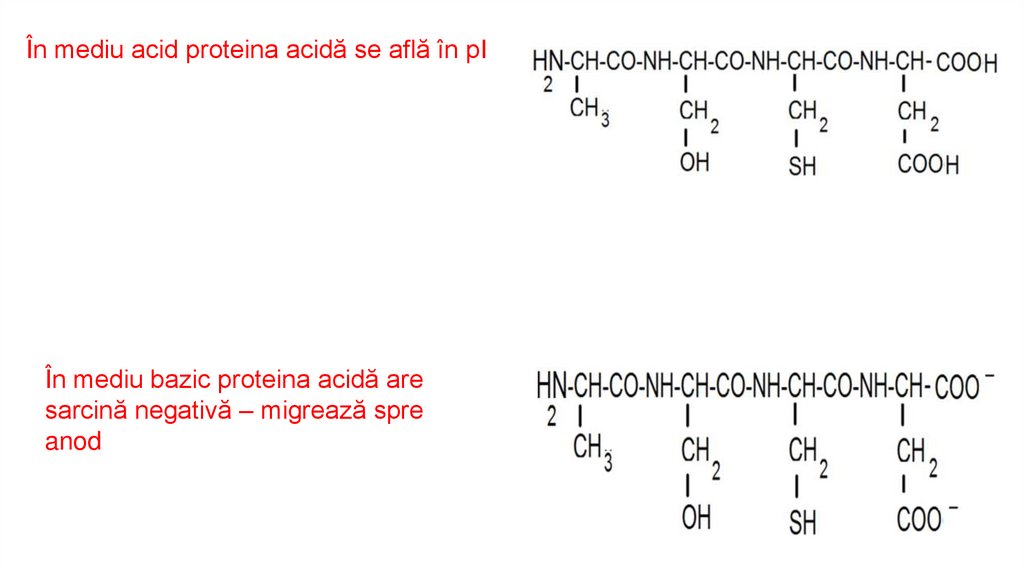
17.
În mediu acid proteina acidă se află în pIÎn mediu bazic proteina acidă are
sarcină negativă – migrează spre
anod
18.
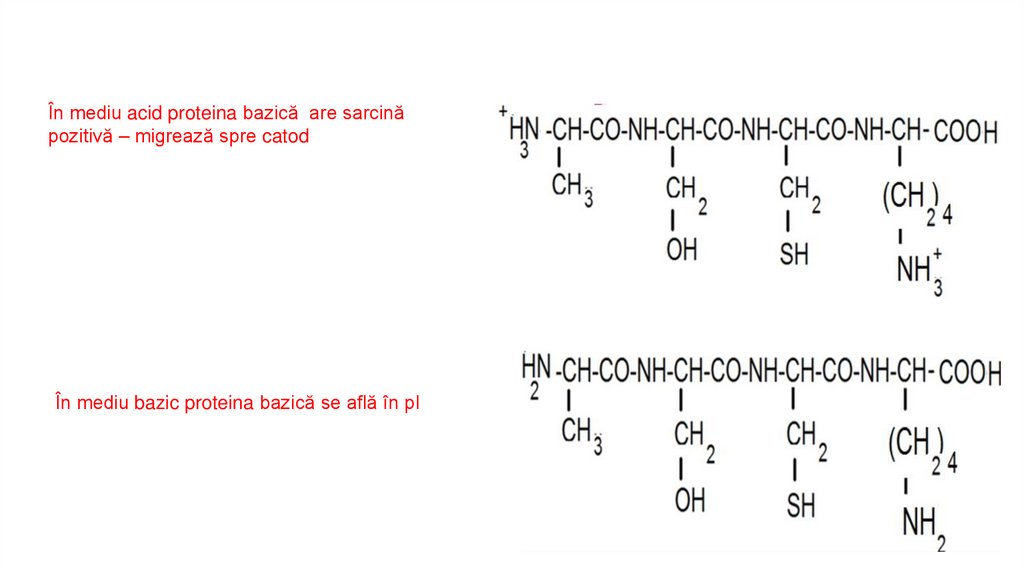
În mediu acid proteina bazică are sarcinăpozitivă – migrează spre catod
În mediu bazic proteina bazică se află în pI
19. CONCLUZIE:
Sarcina proteinei• La un pH mai acid ca valoarea pI - proteina capătă o sarcină
pozitivă (cation) şi migrează spre catod(-);
• la PH mai mare ca pI - proteina capătă o sarcină negativă şi
migrează spre anod(+)
20. Spre care electrod vor migra peptidele prezentate la pH-ul =7?
21. Spre care electrod vor migra peptidele prezentate la pH-ul =7?
22. SOLUBILITATEA PROTEINELOR
• Majoritatea proteinelor sunt compuși hidrofili și sunt solubile în apă.• Apa interacționează cu grupările polare ale proteinelor și formează o
membrană apoasă la suprafața proteinei .
23. MEMBRANA APOASĂ (APA FIXATĂ)
Se formează la interacţiunea grupelor ionogene ce fixează dipolii de apă:Gruparea COO- fixează 4 mol de H2O,
NH2- fixează 3 molecule de H2O;
OH şi NH – câte 2 molecule de H2O.
• Apa ce intră în componenţa membranei apoase e numită “apă legată”
24. PROPRIETĂŢILE APEI FIXATE
1. moleculele ei au o dispunere mai compactă, ce o apropie de un corp solid2. proprietăţile ei de solvent sunt reduse
3. îngheaţă la temperaturi joase ( -40C)
4. constanta dielectrică (forţa de atracţie dintre ionii încărcaţi opus) este de 2,8,
pe când la H2O obişnuită este de 8
25. SOLUBILITATEA ESTE DETEMINATĂ DE:
Componenţa aminoacidică (AA hidrofili)Sarcina proteinei (prezența grupelor polare, inclusiv cu sarcină electrică)
Forma moleculei (proteinele globulare sunt mai solublile decât cele fibrilare);
Natura solventului (de exemplu: albuminele sunt solubile atât în apă, cât și în soluții saline de
diferite concentrații, iar globulinele nu sunt solubile în apă, dar sunt solubile numai în soluții saline
slabe).
pH-ul solventului (pH-ul influențează asupra sarcinii proteinei; în punctul isoelectric solubilitatea
scade)
Temperatura solventului
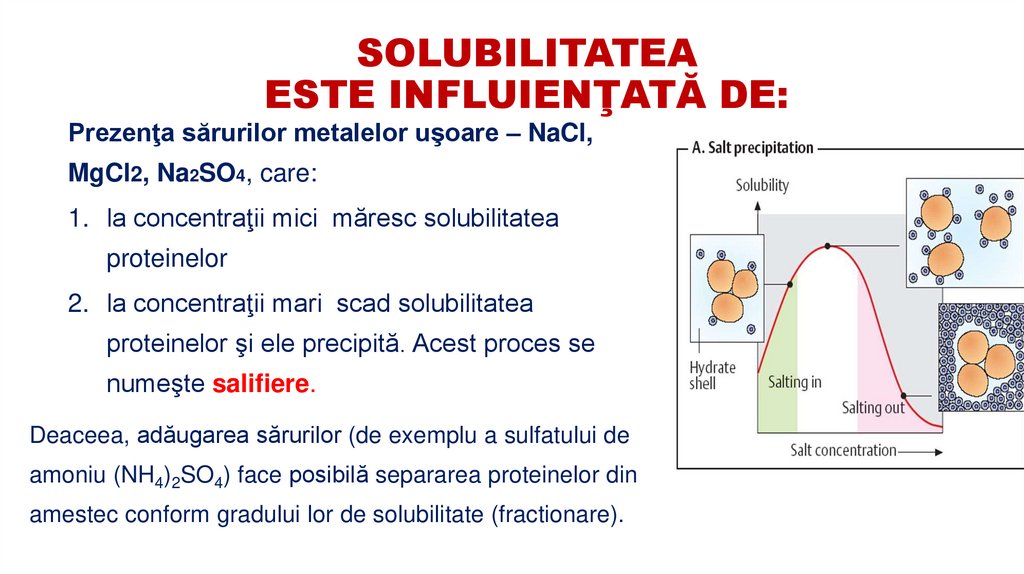
26. SOLUBILITATEA ESTE INFLUIENŢATĂ DE:
Prezenţa sărurilor metalelor uşoare – NaCl,MgCl2, Na2SO4, care:
1. la concentraţii mici măresc solubilitatea
proteinelor
2. la concentraţii mari scad solubilitatea
proteinelor şi ele precipită. Acest proces se
numeşte salifiere.
Deaceea, adăugarea sărurilor (de exemplu a sulfatului de
amoniu (NH4)2SO4) face posibilă separarea proteinelor din
amestec conform gradului lor de solubilitate (fractionare).
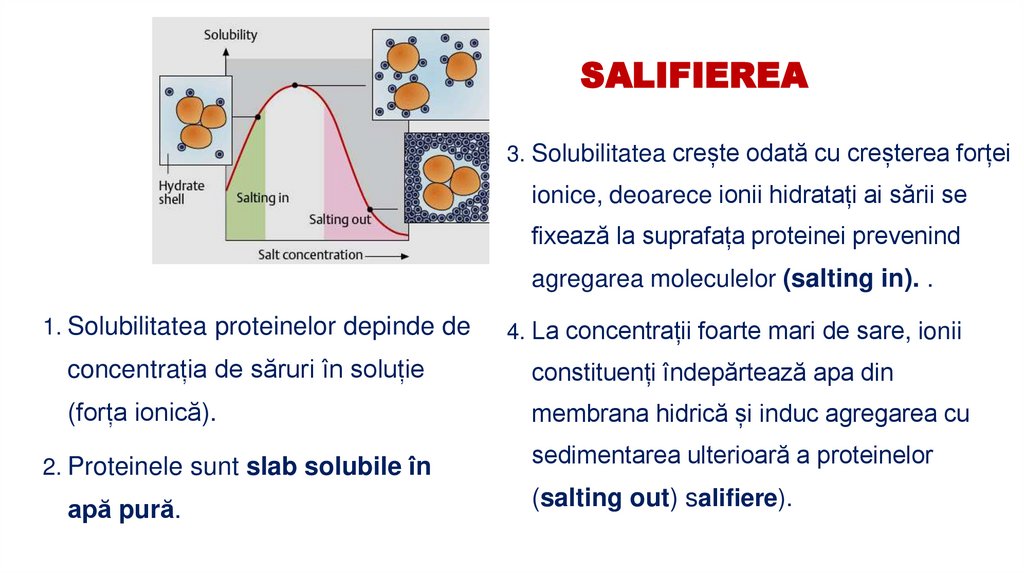
27. SALIFIEREA
3. Solubilitatea crește odată cu creșterea forțeiionice, deoarece ionii hidratați ai sării se
fixează la suprafața proteinei prevenind
agregarea moleculelor (salting in). .
1. Solubilitatea proteinelor depinde de
4. La concentrații foarte mari de sare, ionii
concentrația de săruri în soluție
constituenți îndepărtează apa din
(forța ionică).
membrana hidrică și induc agregarea cu
2. Proteinele sunt slab solubile în
apă pură.
sedimentarea ulterioară a proteinelor
(salting out) salifiere).
28. STABILITATEA SOLUŢIEI PROTEICE E DETERMINATĂ DE 2 FACTORI:
• sarcina electrică – determină respingerea moleculelor proteiceîncărcate pozitiv sau negativ.
• membrana apoasă care îndepărtează moleculele proteice una faţă de
alta impiedicând agregarea şi precipitarea lor.
29. PROPRIETĂŢILE COLOIDALE ŞI OSMOTICE ALE PROTEINELOR
Proteinele sunt substanţe macromoleculare,solubile, la dizolvarea cărora seformează soluţii coloidale proteice.
Spre deosebire de soluţiile coloidale obişnuite, soluţiile proteice nu necesită
prezenţa stabilizatorului. Soluţiile proteice sunt stabile şi cu timpul nu se precipită.
30. SOLUŢIILE PROTEICE POSEDĂ PROPRIETĂŢI CARACTERISTICE SOLUŢIILOR COLOIDALE:
• Proprietăţile optice (efectul Tindal)• Viteză de difuzie mică.
• Viscozitate mare
• Proprietăţi osmotice
• Proprietatea de a forma geluri
31. PROPRIETĂŢILE OPTICE
La iluminarea laterală a soluţiei proteice raza de lumină în ea devine vizibilă, formând
conul de lumină- efectul Tindal. Acest efect de dispersie a luminii se explică prin
difracţia razelor de lumină de către particule în soluţie.
Capacitatea proteinelor de a dispersa lumina este folosită:
1.
la determinarea cantitativă a proteinelor prin metoda nefelometrică
2.
la studierea microscopică a structurilor celulare.
32. VITEZĂ DE DIFUZIE MICĂ
• Difuzie – deplasarea spontană a moleculelor substanţei dizolvate datorităgradientului de concentraţie (de la zone cu concentraţii mai mare spre cele cu
concentraţie scăzută).
• Viteza de difuzie a proteinelor depinde mai mult de forma moleculei, decât de
masa ei.
• Repartizarea intracelulară a proteinelor din locul de sinteză (ribosomi) are loc prin
difuzie.
• Deoarece viteza de difuzie e mică are loc limitarea vitezei proceselor dependente
de funcţiile proteinelor difuzabile în sectorul respectiv.
33. VISCOZITATE MARE –
e dependentă de masa şi forma moleculelor.
Mărirea c% proteinei conduce şi la mărirea viscozităţii soluţiei (se măresc
forţele de coeziune între moleculele proteice).
Proteinele fibrilare sunt mai vâscoase comparativ cu cele globulare.
Viscozitatea e dependentă de:
1. temperatură- ↑ t0 – viscozitatea scade
2. prezenţa electroliţilor (ex. sărurile de Ca 2+măresc viscozitatea prin
formarea punţilor de calciu)
34. PROPRIETĂŢI OSMOTICE
• proteine fiind macromolecule – nu difundează prin membranesemipermiabile ceea ce are ca urmare apariţia fenomenului de osmoză
(deplasarea moleculelor de H2O prin membrană în soluţia proteică).
• Deplasarea apei este limitată de presiunea hidrostatică (presiunea coloanei
de apă) şi se numeşte presiune osmotică;
• Presiunea osmotică depinde de concentraţia molară a proteinei şi de
temperatură.
• Presiunea osmotică determinată de proteine – presiune oncotică.
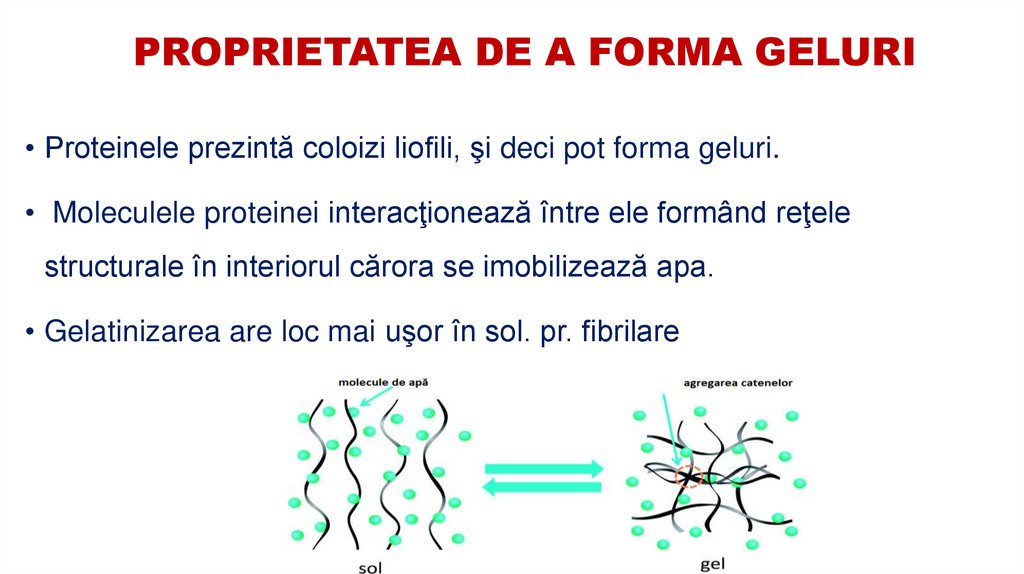
35. PROPRIETATEA DE A FORMA GELURI
• Proteinele prezintă coloizi liofili, şi deci pot forma geluri.• Moleculele proteinei interacţionează între ele formând reţele
structurale în interiorul cărora se imobilizează apa.
• Gelatinizarea are loc mai uşor în sol. pr. fibrilare
36. PROPRIETATEA DE A FORMA GELURI
• Formarea de gel se observă la coagularea sângelui (formarea reţelei de fibrină).• La învechirea gelurilor are loc sinerezisa – expulzarea apei, datoprită contracţiei
mol din reţea şi eliminarea apei.
Formarea gelului depinde de :
• concentraţia soluţiei (odată cu creșterea c%);
• temperatură (crește la scăderea temperaturii);
• concentraţia ionilor de hidrogen (în punctul izoelectric se observă o viteză maximă de formare a
gelului);
• prezenţa electroliţilor (ionul SO42- contribuie în mod preferat la transformarea solului în gel).
37. XEROGEL
• este gelul secat (uscat) - lipsit de apă.• se capătă prin secare liofilă a soluţiilor coloidale
• Secarea liofilă constă în îndepărtarea apei în vid din soluţia coloidală
îngheţată.
• se păstrează un timp mai îndelungat ceea ce prezintă importanţă practică în
industria de preparare a medicamentelor de origine proteică.
• Ex: deferite proteine (albumina, gama-globulinele şi altele).
38. TERMOLABILITATEA PROTEINELOR
• Proteinele sunt molecule termolabile• La temperaturi de 20-40⁰C - proteinele sunt stabile și funcțional
active
• La temperaturi joase ele își mențin structura, dar capacitatea lor de
mișcare în soluții este mică, ce împiedică îndeplinirea funcțiilor
• Creșterea temperaturii peste 50⁰C determină pierderea activității
proteinei, datorită denaturării termice
39. DENATURAREA PROTEINELOR
• este fenomenul de distrugere a nivelurilor superioare deorganizare structurală (cuaternară, terțiară și secundară) în
afară de structura primară cu pierderea proprietăţilor fizico-
chimice şi activității biologice ale proteinei
40. DENATURAREA
A) Denaturarea poate fi produsă de factori:1. fizici – temperatură înaltă (peste 50⁰C), radiație
ionizantă, raze UV etc.;
2. chimici – acizi și baze concentrate, detergenți,
alcooli, săruri ale metalelor grele etc.
B) Se aplică în medicină pentru sterilizarea
1. instrumentarului, utilajului, încăperilor
2. câmpului de operație
3. locului injectării medicamentelor
41. TRĂSĂTURILE PROTEINEI DENATURATE:
• pierderea activităţii biologice• micşorarea solubilităţii
• schimbarea formei şi mărimii moleculelor
• creşterea reactibilităţii unor grupe
• pierderea capacităţii de a se cristaliza
42. SUBSTANŢELE CE POT ÎMPEDICA DENATURAREA
• soluţii de glucide• glicerina
• a. graşi
• Pentru a evita denaturarea proteina se păstrează la rece, în
soluţii concentrate de săruri la un pH anumit
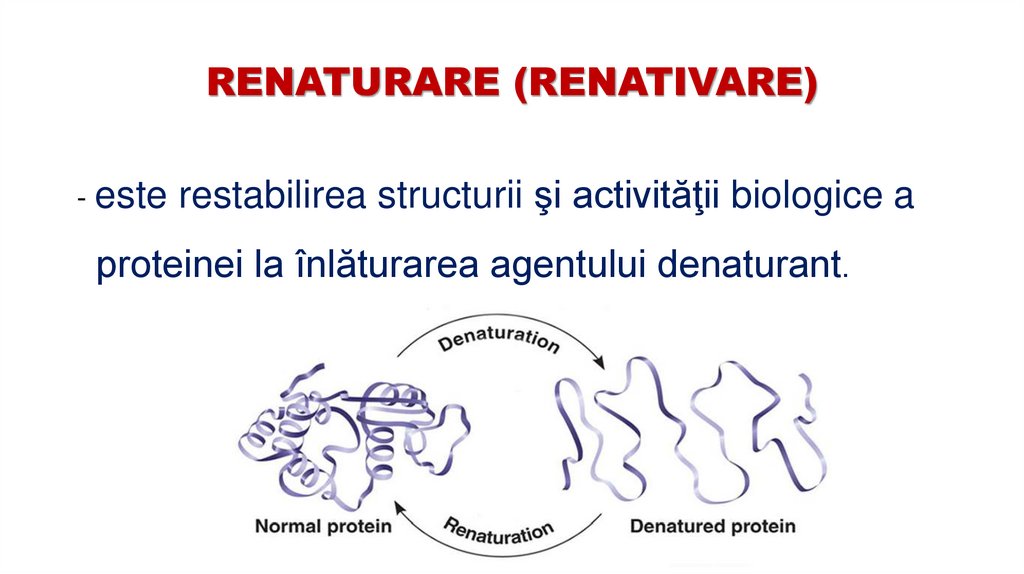
43. RENATURARE (RENATIVARE)
- este restabilirea structurii şi activităţii biologice aproteinei la înlăturarea agentului denaturant.
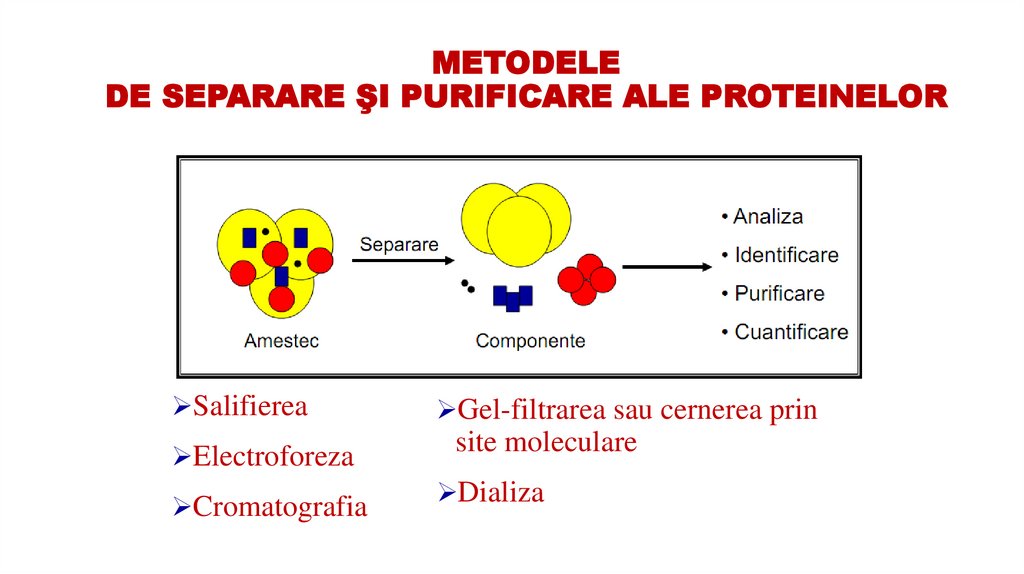
44. METODELE DE SEPARARE ŞI PURIFICARE ALE PROTEINELOR
SalifiereaElectroforeza
Cromatografia
Gel-filtrarea sau cernerea prin
site moleculare
Dializa
45.
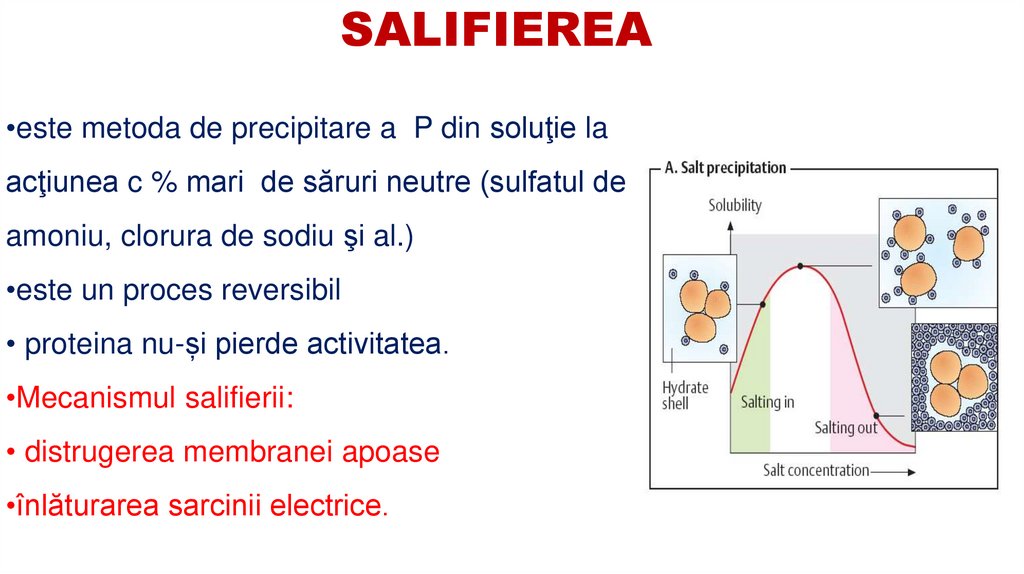
SALIFIEREA•este metoda de precipitare a P din soluţie la
acţiunea c % mari de săruri neutre (sulfatul de
amoniu, clorura de sodiu şi al.)
•este un proces reversibil
• proteina nu-și pierde activitatea.
•Mecanismul salifierii:
• distrugerea membranei apoase
•înlăturarea sarcinii electrice.
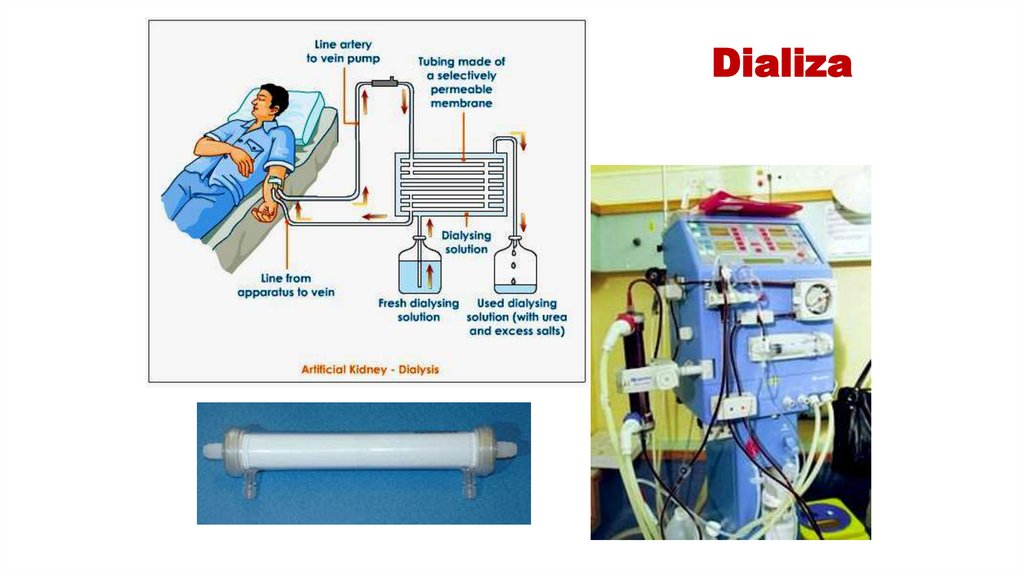
46. DIALIZA PROTEINELOR
• Dializa – metoda de separare şi purificare a substanţelormacromoleculare de substanţe micromoleculare cu
ajutorul membranelor semipermeabile (celofan,
pergament etc.).
• Prin porii acestor membrane pot trece numai substanţele
micromoleculare, ce au masă moleculară şi dimensiuni
mici.
47. DIALIZA PROTEINELOR
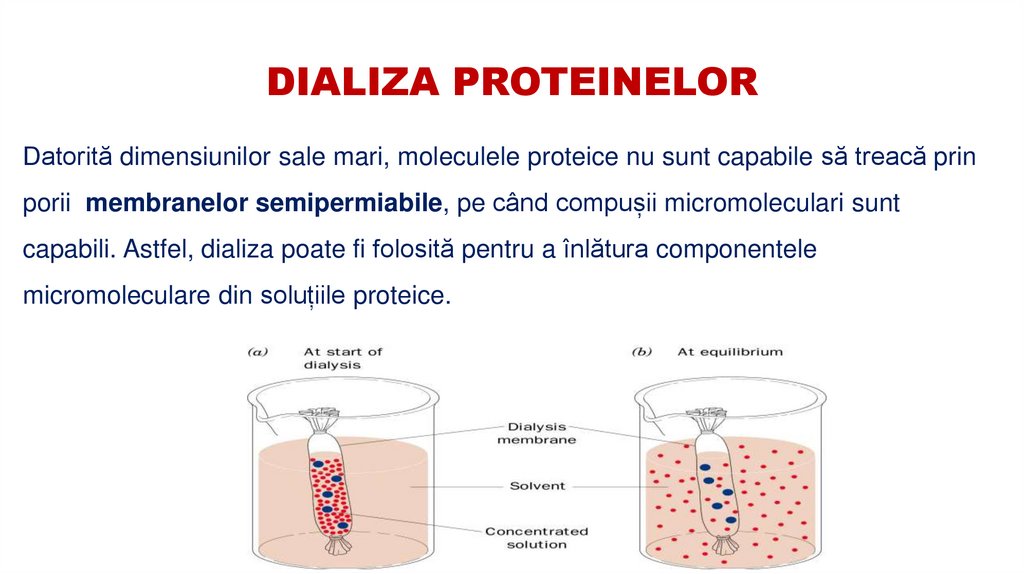
Datorită dimensiunilor sale mari, moleculele proteice nu sunt capabile să treacă prinporii membranelor semipermiabile, pe când compușii micromoleculari sunt
capabili. Astfel, dializa poate fi folosită pentru a înlătura componentele
micromoleculare din soluțiile proteice.
48. Dializa
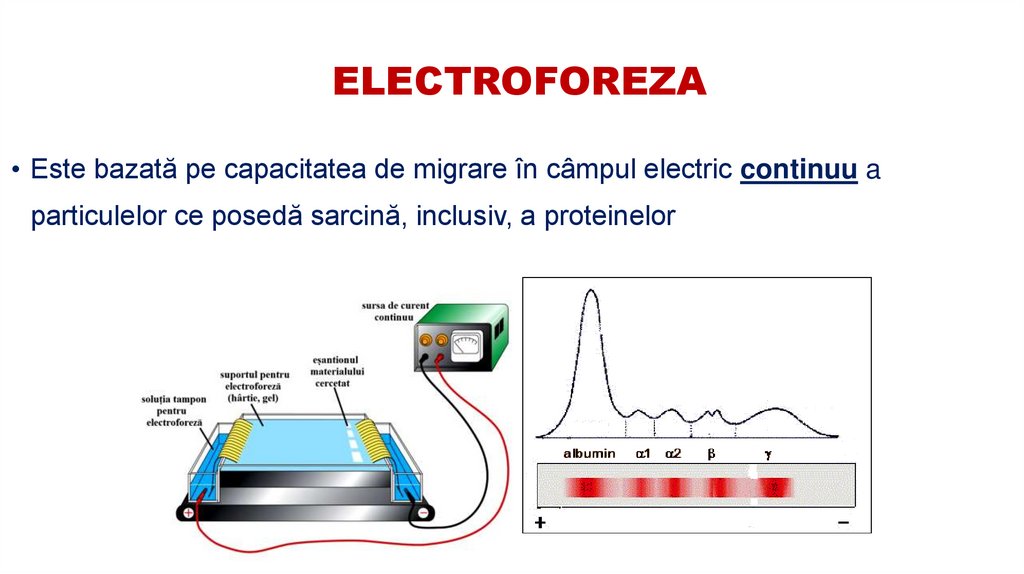
49. ELECTROFOREZA
• Este bazată pe capacitatea de migrare în câmpul electric continuu aparticulelor ce posedă sarcină, inclusiv, a proteinelor
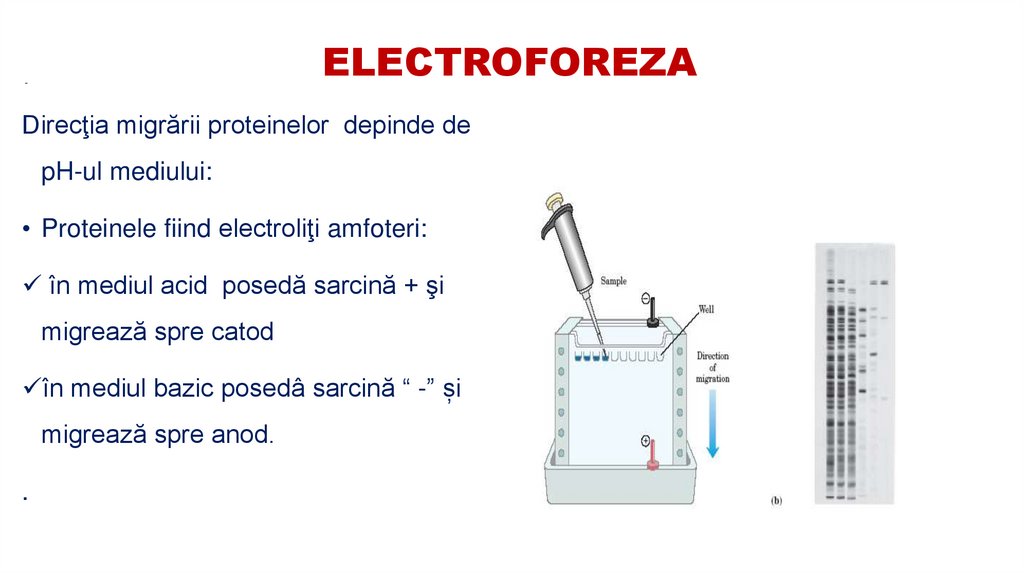
50. ELECTROFOREZA
-Direcţia migrării proteinelor depinde de
pH-ul mediului:
• Proteinele fiind electroliţi amfoteri:
în mediul acid posedă sarcină + şi
migrează spre catod
în mediul bazic posedâ sarcină “ -” și
migrează spre anod.
.
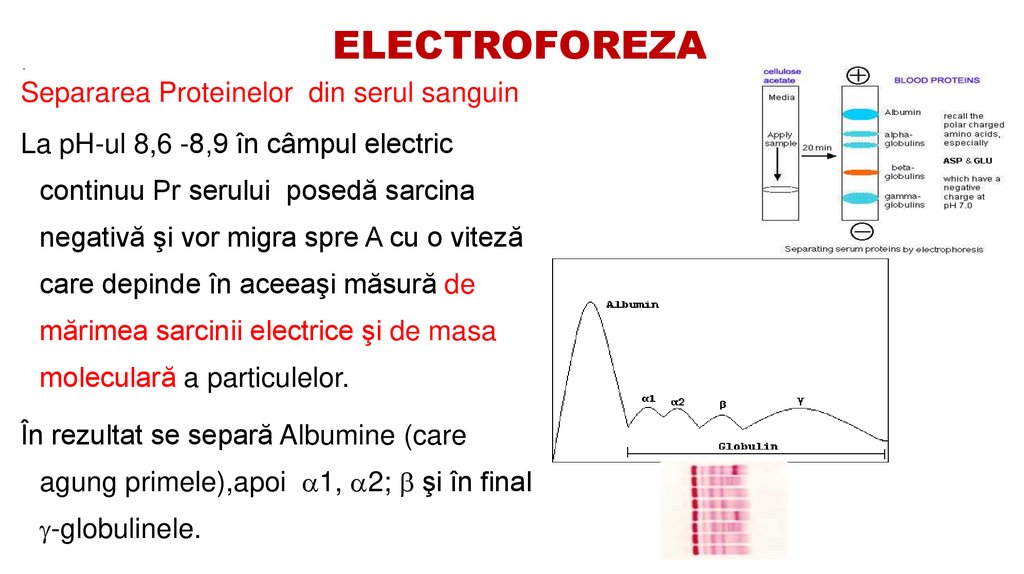
51. ELECTROFOREZA
-Separarea Proteinelor din serul sanguin
La pH-ul 8,6 -8,9 în câmpul electric
continuu Pr serului posedă sarcina
negativă şi vor migra spre A cu o viteză
care depinde în aceeaşi măsură de
mărimea sarcinii electrice şi de masa
moleculară a particulelor.
În rezultat se separă Albumine (care
agung primele),apoi 1, 2; şi în final
-globulinele.
52. CROMATOGRAFIA
Cromatografia este utilizată pentru a separa amestecurile în compușii constituenți.
Toate tipurile de cromatografie se bazează pe același principiu:
faza mobilă se mișcă prin faza staționară și poartă cu ea compușii din amestec care trebuie
separați.
în funcție de proprietăți (masa moleculară, sarcină, polaritate etc.) diferiți compuși se mișcă
cu viteză diferită și, astfel, se separă din amestec.
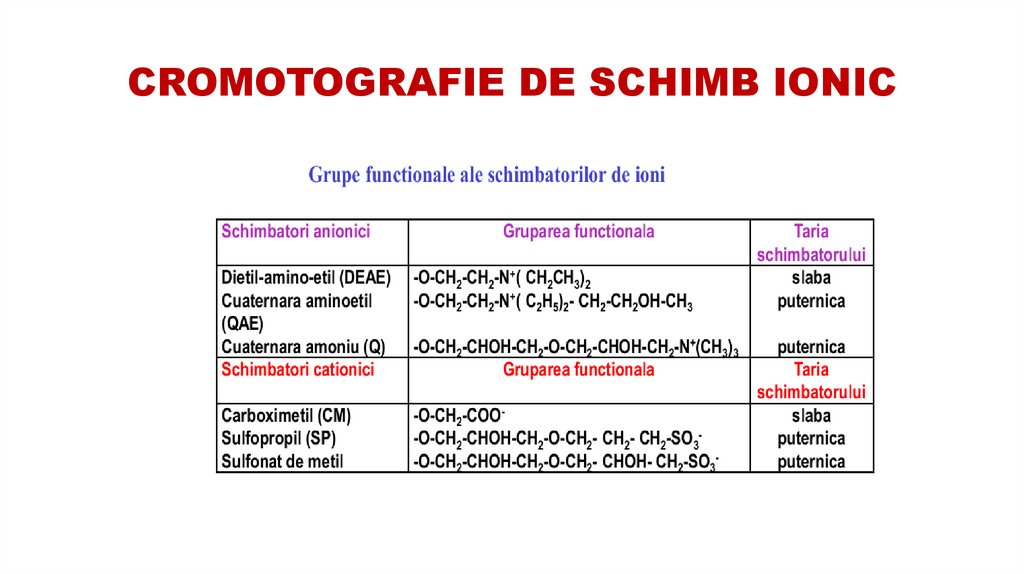
53. CROMOTOGRAFIE DE SCHIMB IONIC
se bazează pe fenomenele reversibile de adsorbţie/desorbţie - respectiv schimb ionic a ionilor dinsoluţie şi grupările ionice ale unei matrici solide sau reţea polimerică.
Un sorbent capabil sa schimbe anionii proprii cu cei ai probei se numeste anionit.
Faza mobilă este formată dintr-un electrolit având o anumită forţă ionică şi un anunmit pH, astfel
încât să favorizeze un număr maxim de legături între faza staţionară şi proteina de interes.
Proteinele contaminante trebuie să se lege mai puţin puternic, astfel încât să treacă mai repede
prin coloană. Proteina de interes este apoi eluată cu o altă soluţie tampon care să favorizeze
desorbţia.
54. CROMOTOGRAFIE DE SCHIMB IONIC
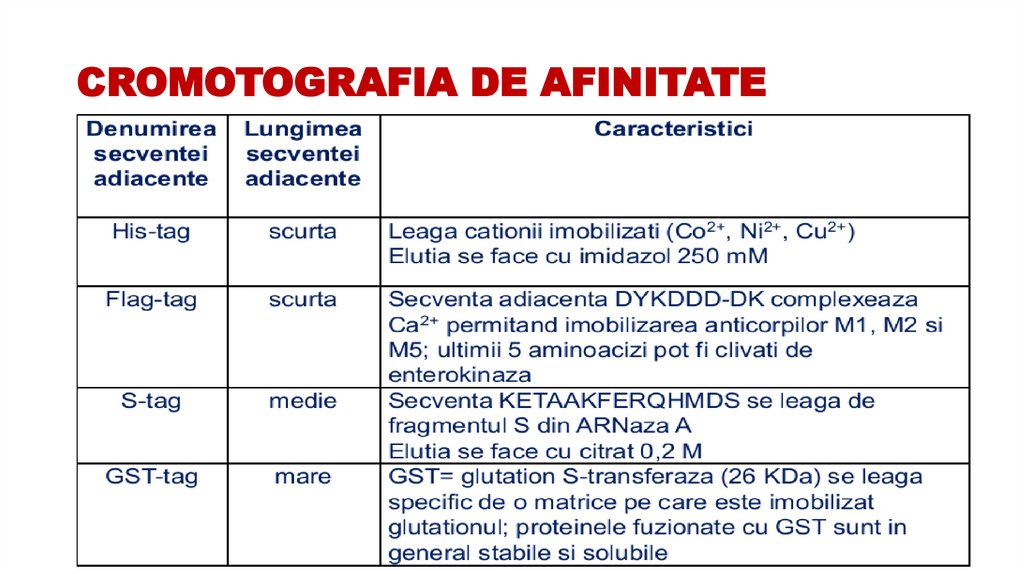
55. CROMOTOGRAFIA DE AFINITATE
• ca fază staţionară se utilizează suporţi solizi de care se leagă chimic-covalent un ligand.• Ligandul este o moleculă care prezintă afinitate specifică pentru o proteină dată.
• Proba de analizat este trecută prin coloană, iar proteina de interes este reţinută pe suprafaţa
sorbentului, în timp ce proteinele contaminante trec nereţinute.
• Proteina de interes este apoi eluată cu o soluţie tampon care favorizează desorbţia.
• Această tehnică este cea mai eficientă metodă de separare a proteinelor individuale dintr-un
amestec de proteine, dar este şi cea mai scumpă metodă, deoarece necesită coloane cu
faze staţionare specifice
56. CROMOTOGRAFIA DE AFINITATE
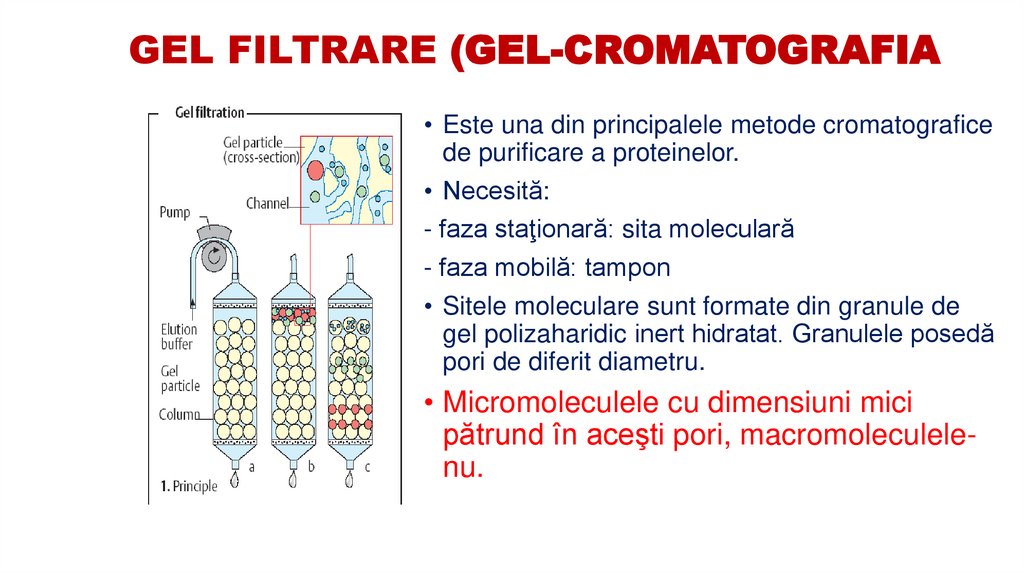
57. GEL FILTRARE (GEL-CROMATOGRAFIA
• Este una din principalele metode cromatograficede purificare a proteinelor.
• Necesită:
- faza staţionară: sita moleculară
- faza mobilă: tampon
• Sitele moleculare sunt formate din granule de
gel polizaharidic inert hidratat. Granulele posedă
pori de diferit diametru.
• Micromoleculele cu dimensiuni mici
pătrund în aceşti pori, macromoleculelenu.
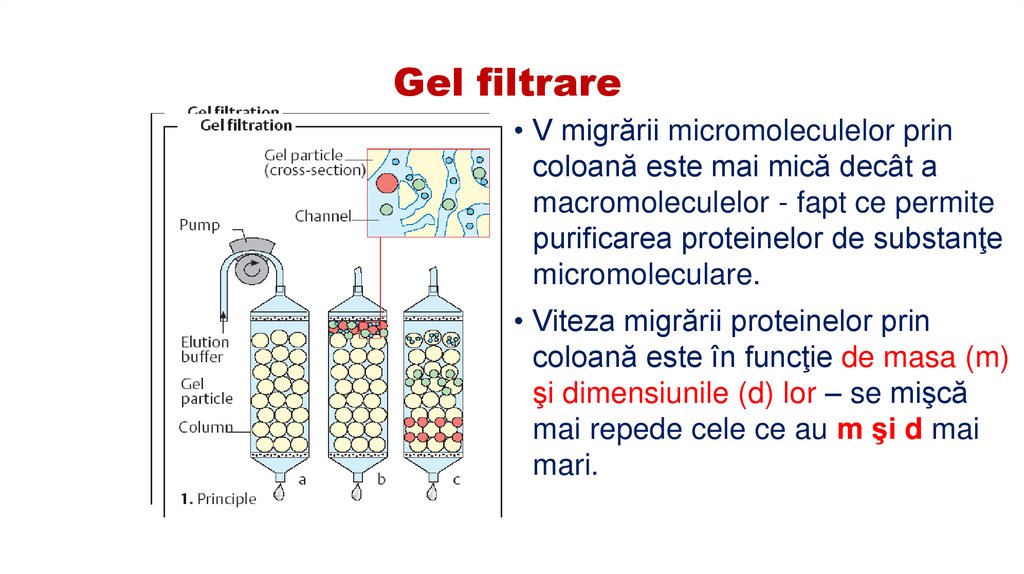
58. Gel filtrare
• V migrării micromoleculelor princoloană este mai mică decât a
macromoleculelor - fapt ce permite
purificarea proteinelor de substanţe
micromoleculare.
• Viteza migrării proteinelor prin
coloană este în funcţie de masa (m)
şi dimensiunile (d) lor – se mişcă
mai repede cele ce au m şi d mai
mari.


































 Биология
Биология



