Похожие презентации:
Химический состав клетки. Вода и минеральные соли
1. Химический состав клетки. Вода и минеральные соли
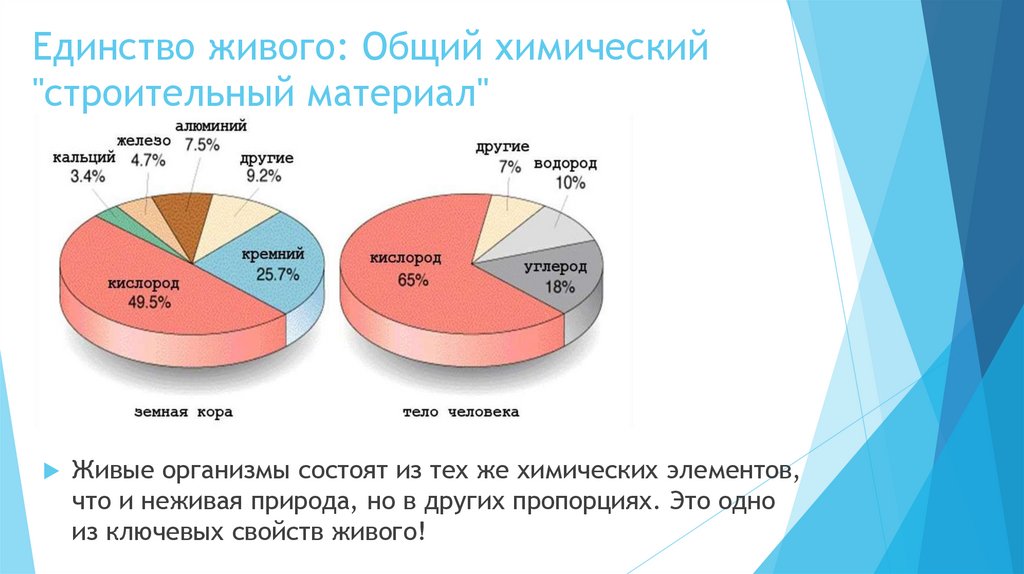
2. Единство живого: Общий химический "строительный материал"
Единство живого: Общий химический"строительный материал"
Живые организмы состоят из тех же химических элементов,
что и неживая природа, но в других пропорциях. Это одно
из ключевых свойств живого!
3. Классификация химических элементов в клетке
Элементы-биогены: Основа жизни (O, C,H, N).
Макроэлементы: Присутствуют в клетке
в значительных количествах (более
0,001%). Они составляют основную массу
клетки (K, Na, Ca, Mg, P, S, Cl).
Микроэлементы: Содержатся в очень
малых количествах (менее 0,00001%), но
играют важнейшую роль в процессах
жизнедеятельности (Fe, Cu, Zn, Mn, I, F,
Co).
Ультрамикроэлементы: Присутствуют в
следовых количествах.
4.
Роль макроэлементовРоль микроэлементов
Кислород (O) и Углерод (C): Основа органических Железо (Fe): Компонент
молекул (белков, жиров, углеводов, нуклеиновых
гемоглобина (транспорт
кислот).
кислорода) и многих ферментов.
Водород (H): Участвует в образовании воды и
органических молекул, является источником
энергии.
Медь (Cu): Участвует в
кроветворении, входит в состав
некоторых ферментов.
Азот (N): Ключевой компонент белков и
нуклеиновых кислот.
Фосфор (P): Входит в состав нуклеиновых кислот,
АТФ (энергетической валюты клетки) и
фосфолипидов клеточных мембран.
Цинк (Zn): Необходим для работы
многих ферментов, участвует в
синтезе нуклеиновых кислот.
Калий (K) и Натрий (Na): Важны для поддержания
осмотического давления и нервной проводимости.
Йод (I): Входит в состав гормонов
щитовидной железы,
регулирующих обмен веществ.
Кальций (Ca): Участвует в построении костей,
работе мышц, свертывании крови.
Фтор (F): Важен для здоровья
зубов и костей.
Марганец (Mn): Участвует в
фотосинтезе и работе
ферментов.
Магний (Mg): Компонент хлорофилла, входит в
состав многих ферментов.
Сера (S): Входит в состав некоторых аминокислот
(метионин, цистеин) и витаминов.
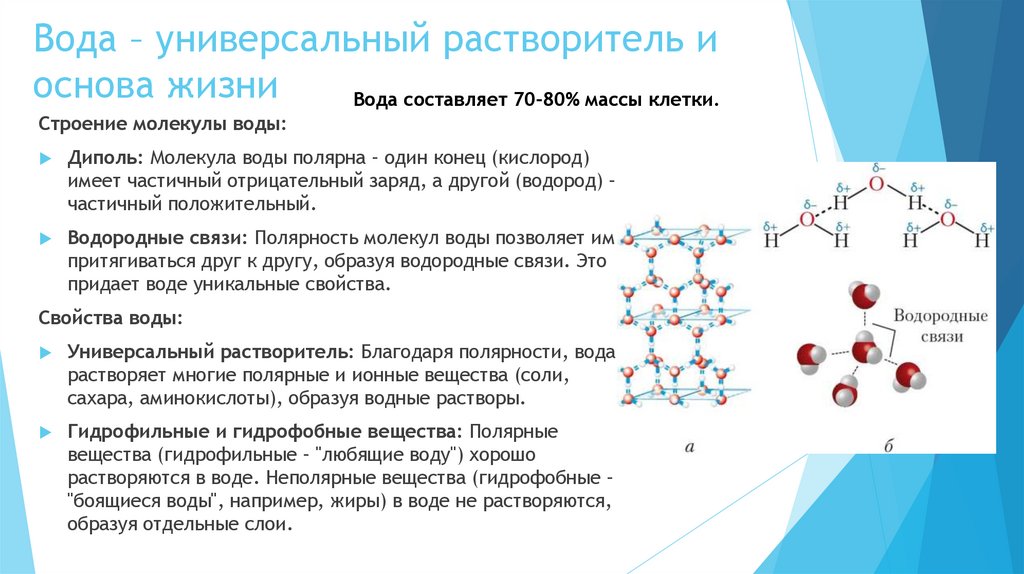
5. Вода – универсальный растворитель и основа жизни
Вода составляет 70-80% массы клетки.Строение молекулы воды:
Диполь: Молекула воды полярна – один конец (кислород)
имеет частичный отрицательный заряд, а другой (водород) –
частичный положительный.
Водородные связи: Полярность молекул воды позволяет им
притягиваться друг к другу, образуя водородные связи. Это
придает воде уникальные свойства.
Свойства воды:
Универсальный растворитель: Благодаря полярности, вода
растворяет многие полярные и ионные вещества (соли,
сахара, аминокислоты), образуя водные растворы.
Гидрофильные и гидрофобные вещества: Полярные
вещества (гидрофильные – "любящие воду") хорошо
растворяются в воде. Неполярные вещества (гидрофобные –
"боящиеся воды", например, жиры) в воде не растворяются,
образуя отдельные слои.
6. Функции воды в клетке
Среда для протекания биохимических реакций: Всереакции происходят в водной среде.
Транспортная функция: Переносит вещества внутри
клетки и между клетками.
Терморегуляция: Вода имеет высокую теплоемкость,
что помогает поддерживать постоянную температуру
клетки.
Поддержание формы клетки: Водный тургор придает
клеткам упругость.
Поддержание осмотического баланса: Вода
постоянно перемещается между клеткой и
окружающей средой, стремясь выровнять
концентрацию растворенных веществ.
Участие в химических реакциях: Вода является
реагентом в реакциях гидролиза (расщепления) и
продуктом реакций синтеза.
7. Минеральные соли:
Минеральные вещества – это растворенные в воде ионы(заряженные частицы).
Функции минеральных солей:
Поддержание осмотического баланса: Концентрация
растворенных солей влияет на движение воды.
Регуляция кислотно-щелочного равновесия (pH):
Буферные системы, состоящие из минеральных солей,
предотвращают резкие изменения pH.
Участие в построении сложных молекул: (например,
фосфаты в нуклеиновых кислотах).
Активация ферментов: Многие ионы металлов (Mg, Ca,
Zn) являются кофакторами ферментов.
Передача нервных импульсов: Ионы Na+ и K+ играют
ключевую роль в этом процессе.
Структурная функция: Ионы Ca2+ и фосфат-ионы –
основа костной ткани.
8. Связь строения и функции
Пример 1: Молекула воды. Ее полярность (строение) определяет еесвойства растворителя и способность образовывать водородные связи, что
критично для всех ее функций.
Пример 2: Ионы натрия и калия. Их заряд и размер (строение) позволяют
им перемещаться через мембрану клетки, обеспечивая нервную
проводимость (функция).
Пример 3: Фосфатная группа. Ее наличие в АТФ (строение) позволяет
накапливать и отдавать энергию (функция).
Вывод: Изучая структуру молекул и ионов, мы можем понять, почему они
так важны для жизнедеятельности клетки.
9. Заключение. Вода и минеральные соли – фундамент жизни
Единство химического состава – одно из свойств живого.Макро- и микроэлементы выполняют критически важные функции.
Вода – универсальный растворитель и среда для всех биохимических
процессов.
Минеральные соли регулируют осмотический баланс, pH, участвуют в
передаче сигналов и построении структур.
Строение молекулы напрямую определяет ее функцию в клетке.
10. Вопросы для закрепления
Перечислите основные элементы-биогены.Какие элементы относятся к макроэлементам, а какие – к
микроэлементам? Приведите примеры.
Каковы основные функции воды в клетке?
Какую роль играют минеральные соли в поддержании осмотического
баланса?








 Химия
Химия








