Похожие презентации:
Электролитическая диссоциация. Молекула воды
1.
ЭЛЕКТРОЛИТИЧЕСКАЯДИССОЦИАЦИЯ
2.
Домашнее задание:1. параграф 4,5
2. выучить конспект урока!!!
3. Письменно выполнить задание со
следующего слайда!
3.
Разделите вещества из данного перечня на 3 группы:Запишите вещества в виде формул!
неэлектролиты
сильные эл-ты
слабые эл-ты
оксид меди (II),
гидроксид лития,
Хлорид бария,
оксид железа (II),
сульфат железа (II),
раствор глюкозы
хлорид серебра
раствор аммиака,
нитрат серебра,
никель,
раствор сахара
азотная кислота,
гидроксид кальция,
аммиак (газообразный),
угольная кислота,
фосфат калия,
гидроксид хрома,
серная кислота,
азотистая кислота,
азотистая кислота,
соляная кислота,
сульфид свинца
сероводородная кислота
фтороводородная кислота,
4.
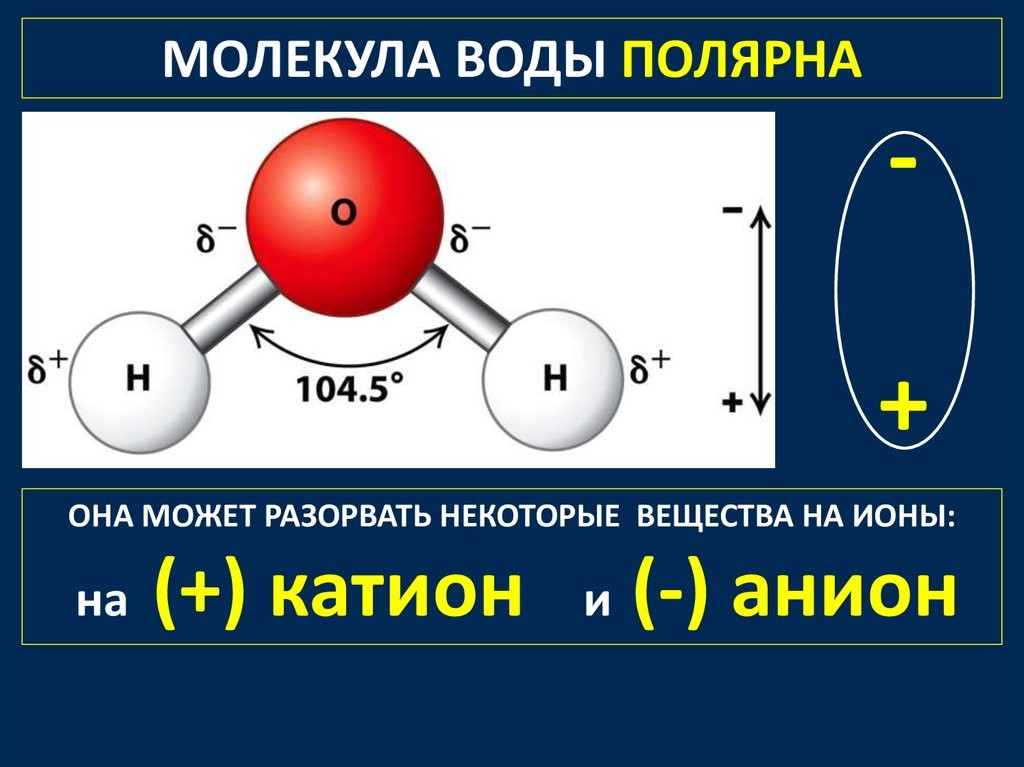
МОЛЕКУЛА ВОДЫ ПОЛЯРНА+
ОНА МОЖЕТ РАЗОРВАТЬ НЕКОТОРЫЕ ВЕЩЕСТВА НА ИОНЫ:
на
(+) катион и (-) анион
5.
Диссоциация – процесс распада молекулвещества на ионы под действием температуры
или растворителя.
Электролиты – вещества, проводящие
электрический ток за счет распада на ионы
в растворе или в расплаве.
в рамках школьной программы
считаем электролитами только
кислоты, соли и основания
(+ раствор аммиака NH3 · H2O )
6.
СТЕПЕНЬ ДИССОЦИАЦИИ ЭЛЕКТРОЛИТА– отношение числа молекул,
распавшихся на ионы,
к общему числу его молекул
в данном растворе.
СИЛА ЭЛЕКТРОЛИТА –
это показатель того,
насколько легко он
распадается на ионы
7.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ:1. Все растворимые соли
2. Все растворимые основания + Са(ОН)2 = щелочи =
гидроксиды щелочных и щелочноземельных
металлов
N.B.!!!!
HF – слабая кислота
3. Кислоты HCl, HBr, HI
и кислоты по правилу Полинга:
кислота НxЭОy сильная, если y – x ≥ 2
HNO3, H2SO4, HMnO4, HClO3, HClO4, HBrO3, HBrO4, HlO3, HlO4
ВСЕ ОСТАЛЬНЫЕ СЧИТАЕМ
СЛАБЫМИ ЭЛЕКТРОЛИТАМИ
8.
Сильные электролиты диссоциируютполностью и необратимо (ставим знак =)
НNO3
=
+
Н + NO3
Слабые – частично и обратимо
(ставим знак ↔)
НNO2
↔ Н+ + NO2-
9.
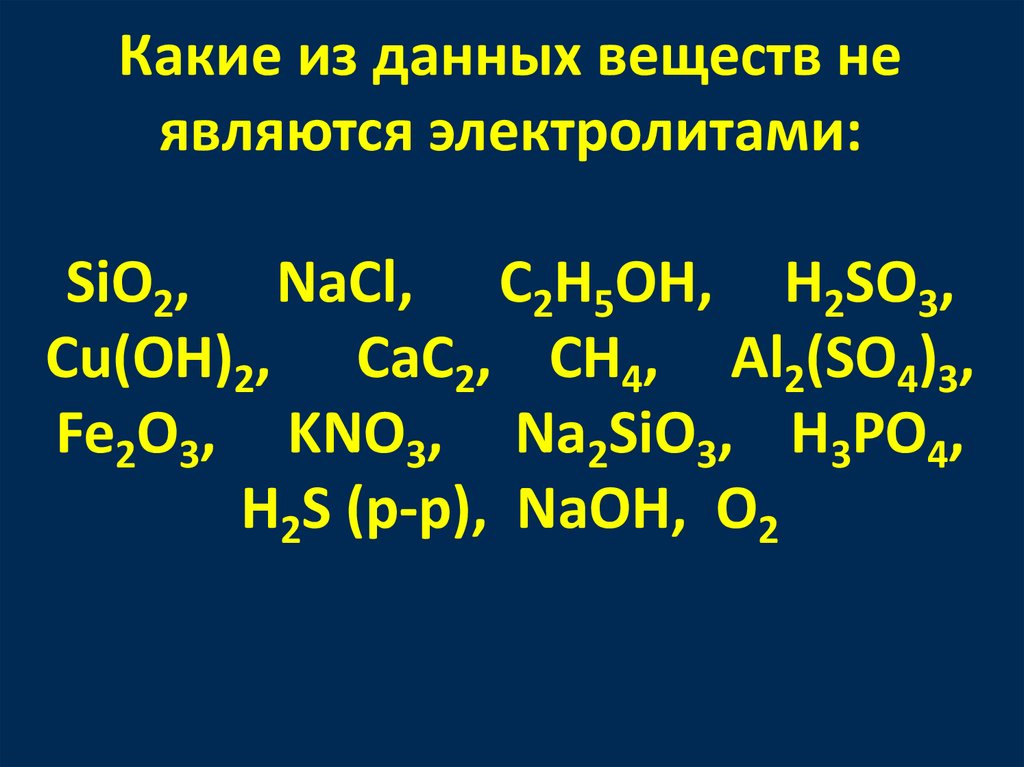
Какие из данных веществ неявляются электролитами:
SiO2, NaCl, C2H5OH, H2SO3,
Cu(OH)2, CaC2, CH4, Al2(SO4)3,
Fe2O3, KNO3, Na2SiO3, H3PO4,
H2S (p-p), NaOH, O2
10.
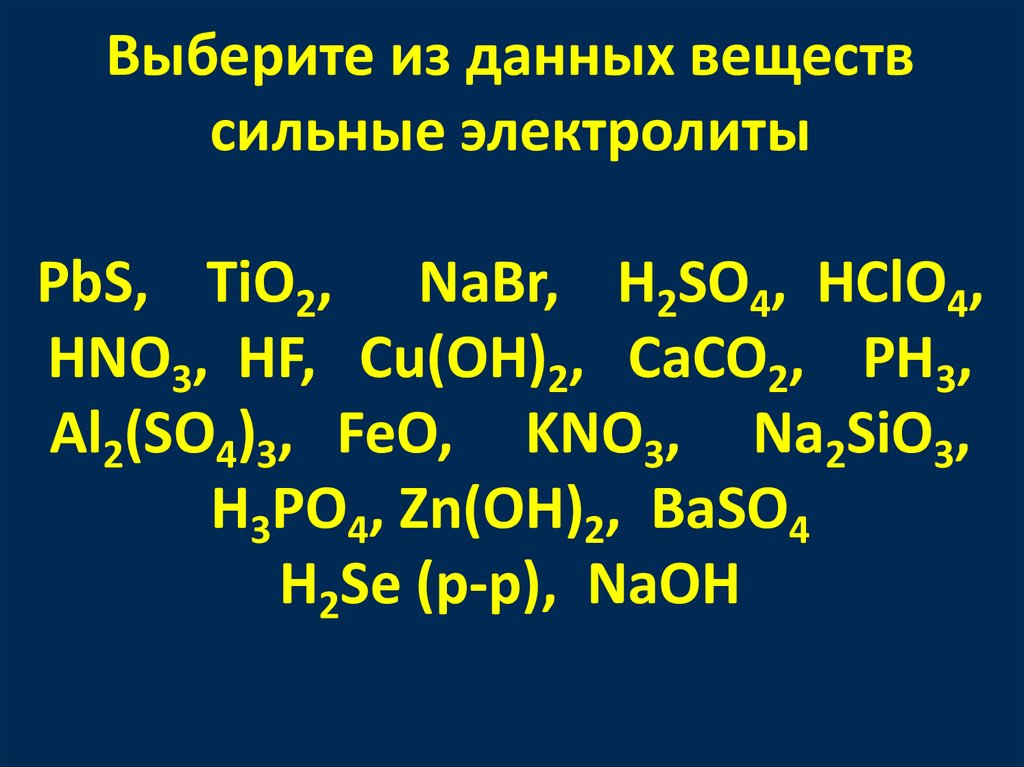
Выберите из данных веществсильные электролиты
PbS, TiO2, NaBr, H2SO4, HClO4,
HNO3, HF, Cu(OH)2, CaCO2, PH3,
Al2(SO4)3, FeO, KNO3, Na2SiO3,
H3PO4, Zn(OH)2, BaSO4
H2Se (p-p), NaOH
11.
ИОННЫЕ УРАВНЕНИЯРЕАКЦИЙ
12.
Домашнее задание:1. параграфы 4,5 и прикрепленную
презентацию (слайды 11-19 выучить)
2. выучить конспект урока!!!
3. оценитe возможность протекания реакций
и запишите их уравнения в молекулярной,
полной и сокращенной ионной формах:
1. BaCl2 + Na2SO4 =
2. LiOH + NH4NO3 =
3. BaCO3 + NaCl =
4. CuSO4 + KOH =
5.Na2SO3 + HCl =
6. AgCl + NaOH =
13.
Сильные электролитырвем на ионы
(пишем в виде ионов),
слабые и неэлектролиты
– пишем целиком
14.
хлорид натрия,оксид алюминия,
гидроксид натрия,
плавиковая кислота,
бромоводородная кислота,
оксид железа (III),
раствор аммиака,
гидроксид бериллия,
аммиак (газообразный),
серная кислота,
этиловый спирт,
сульфат меди (II),
хлорид серебра,
угольная кислота,
фосфорная кислота,
гидроксид кальция,
раствор глюкозы
железо,
азотная кислота,
фосфат калия,
азотистая кислота,
сульфид цинка
15.
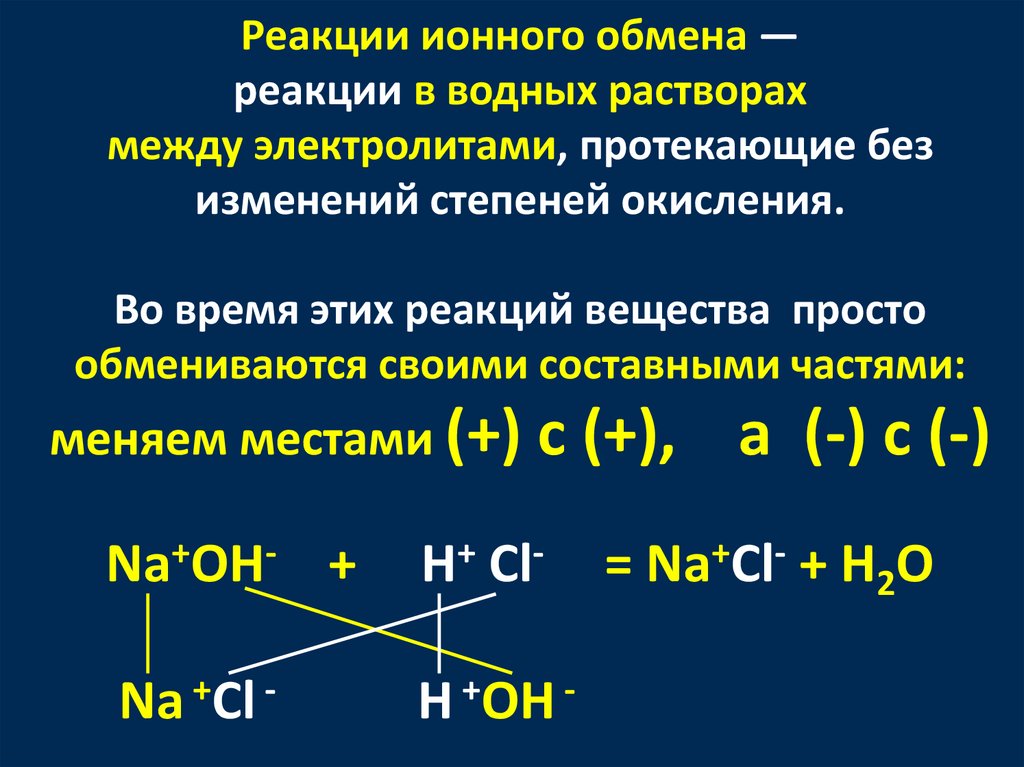
Реакции ионного обмена —реакции в водных растворах
между электролитами, протекающие без
изменений степеней окисления.
Во время этих реакций вещества просто
обмениваются своими составными частями:
меняем местами (+) с (+),
Na+OH- +
H+ Cl-
Na +Cl -
H +OH -
а (-) с (-)
= Na+Cl- + H2O
16.
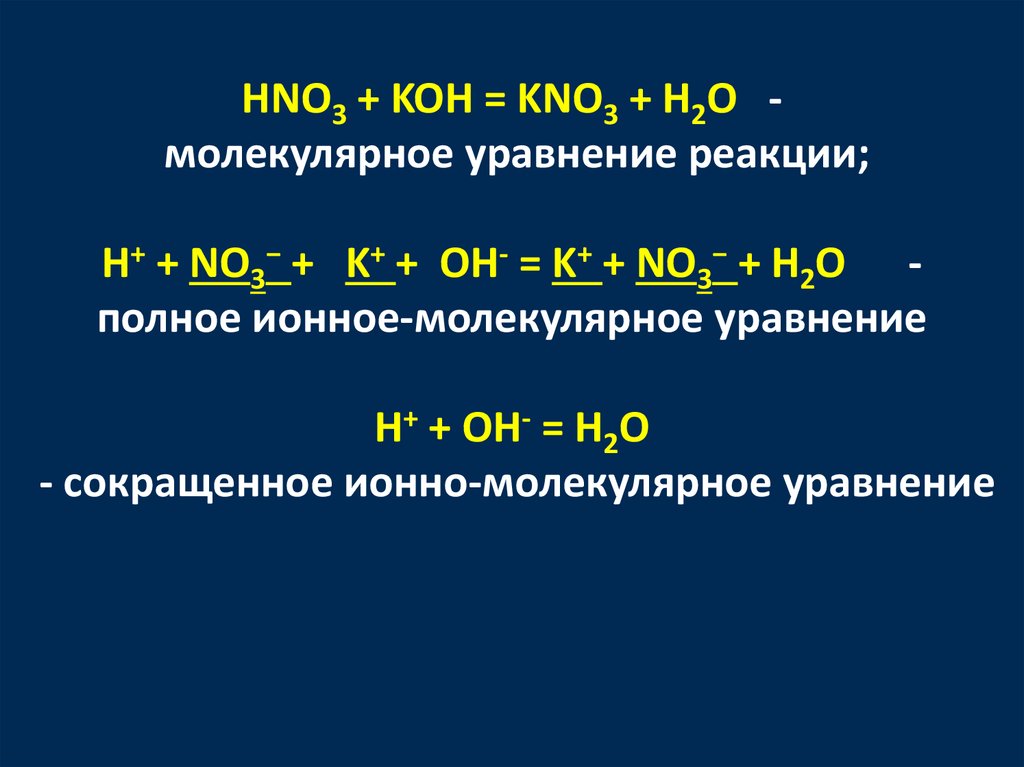
HNO3 + KOH = KNO3 + H2O молекулярное уравнение реакции;H+ + NO3− + K+ + OH- = K+ + NO3− + H2O полное ионное-молекулярное уравнение
H+ + OH- = H2O
- сокращенное ионно-молекулярное уравнение
17.
Реакция возможна,если образуется слабый электролит=
= малодиссоциирующее вещество
(вода, слабая кислота, раствор
аммиака),
осадок (по таблице растворимости)
газ (SO2, CO2, H2S, NH3).
18.
В реакцияхСОЛЬ + СОЛЬ
СОЛЬ + ОСНОВАНИЕ
добавляется еще одно условие:
реакция идет только если
ОБА РЕАГЕНТА РАСТВОРИМЫ
19.
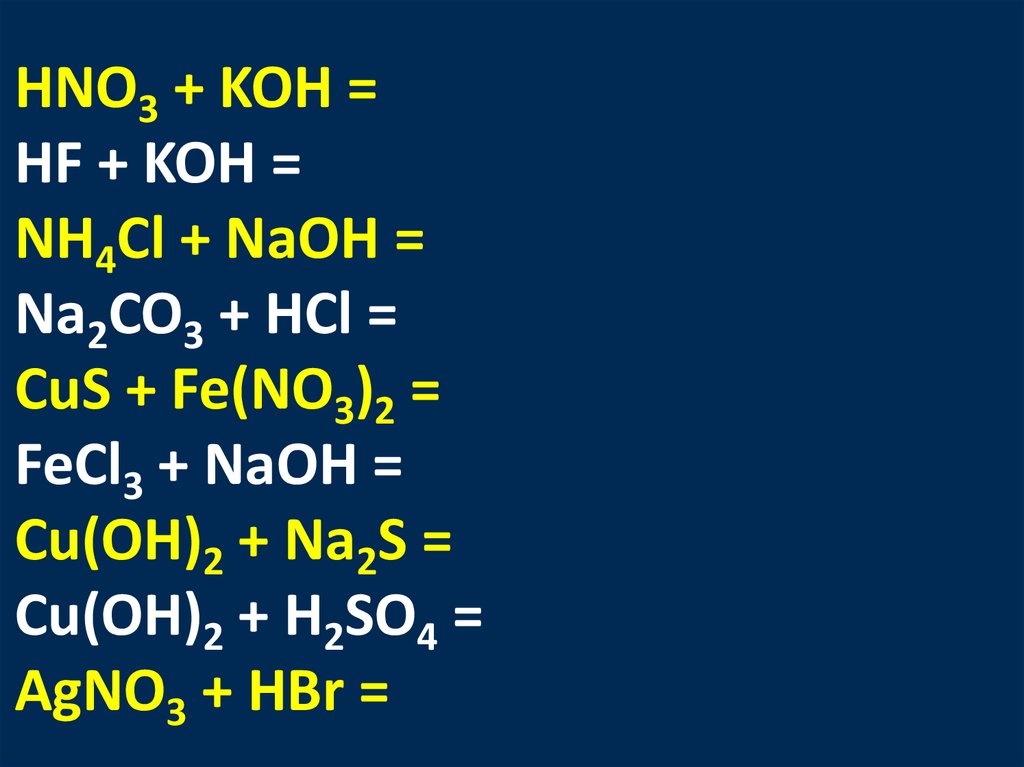
HNO3 + KOH =НF + KOH =
NH4Cl + NaOH =
Na2CO3 + HCl =
CuS + Fe(NO3)2 =
FeCl3 + NaOH =
Cu(OH)2 + Na2S =
Cu(OH)2 + H2SO4 =
АgNO3 + HBr =
20.
ХИМИЧЕСКИЕСВОЙСТВА КИСЛОТ И
ОСНОВАНИЙ как
ЭЛЕКТРОЛИТОВ
21.
Домашнее задание:1. параграфы 6,7. Прикрепленная презентация –
слайды 20-29
2. Конспект урока выучить!!! Знать изменение
окраски индикаторов.
3. оценитe возможность протекания реакций и
запишите их уравнения в молекулярной, полной и
сокращенной ионной формах:
1. NaCl + HNO3 =
2. H3PO4 + KOH(избыток)
3. Zn(OH)2 + HCl =
4. NaOH + CaO =
5. Ca(OH)2 + CO2=
6. Li(OH) + H2SO4=
22.
ЛАКМУСМЕТИЛОРАНЖ
ФЕНОЛФТАЛЕИН
УНИВЕРСАЛЬНЫЙ
23.
Получил Аррениус сложное задание:Он диссоциацию изучал, и мучался.
Если гидроксид-ион – это основание,
Если же Н+ (протон) нашел –
кислота получится.
24.
кислоты – электролиты, диссоциирующие врастворах с образованием
ионов водорода Н+ = протонов
HCl = H+ + Cl-
СИЛЬНЫЕ КИСЛОТЫ ПИШЕМ В ВИДЕ
ИОНОВ, СЛАБЫЕ - ЦЕЛИКОМ
25.
КЛАССИФИКАЦИЯ КИСЛОТ1. бескислородные HF, HCl, HBr, HI, H2S и
кислородсодержащие – кислотные гидроксиды
2. Одно-, двух и трехосновные (по количеству Н+ при
диссоциации)
2-х и 3-х основные диссоциируют ступенчато
3.Сильные и слабые
сильные диссоциируют полностью и необратимо
сильные кислоты вытесняют слабые из их солей
4. Стойкие и нестойкие
CO2 + H2O = H2CO3;
SO2 + H2O = H2SO3;
5. Летучие и нелетучие (Н2SO4, H3PO4, H2SiO3)
нелетучие вытесняют летучие из их твердых солей
26.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ1. Способность к диссоциации
2. Взаимодействие с металлами
Металлы левее водорода вытесняют водород из кислот при
условии, что образующаяся соль будет растворима.
3. С основными и амфотерными оксидами
H2SO4 + ZnO = ZnSO4 + H2O
6HNO3 + Fe2O3 = 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
Продуктами будут соль и вода
Кремниевая кислота только с оксидами ЩМ и ЩЗМ.
27.
4.с
основными
гидроксидами:
и
амфотерными
Продуктами будут соль и вода
HCl + NaOH = H2O + NaCl
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
5. с солями
если образуется
ОСАДОК, ГАЗ, или МАЛОДИССОЦИИРУЮЩЕЕ ВЕЩЕСТВО
(слабая кислота).
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
2НСl + Na2SO3 = 2NaCl + SO2↑ + H2O
NaNO2 + HCl = HNO2 + NaCl
СИЛЬНЫЕ КИСЛОТЫ ВЫТЕСНЯЮТ СЛАБЫЕ ИЗ ИХ СОЛЕЙ
28.
ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ АРРЕНИУСАоснования – электролиты, диссоциирующие в растворах
с образованием гидроксид-ионов ОН-
КОН = К+ + ОН1.
2.
КЛАССИФИКАЦИЯ
Одно-, двух- и трехкислотные – по
количеству –ОН групп
По силе:
сильные - щелочи – гидроксиды ЩМ и ЩЗМ
слабые
3. По растворимости
29.
ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ АРРЕНИУСАпрочность связи металл-кислород близка к
прочности связи водород-кислород,
поэтому они диссоциируют как по типу кислоты, так и
по типу основания.
Zn(OH)2
=
H2ZnO2
Al(OH)3 = H3AlO3 = HAlO2 + H2O
амфотерными электролитами являются
гидроксиды металлов в С.О. +3 и +4,
а также Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2
Ве, цинкум, станнум и свинец,
А кто запомнил – молодец!
30.
31.
ХИМИЧЕСКИЕСВОЙСТВА СОЛЕЙ как
ЭЛЕКТРОЛИТОВ
32.
ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ АРРЕНИУСАсоли – электролиты, диссоциирующие в растворах на
катионы металла (или аммония NH4+) и анионы
кислотного остатка
Na2CO3 = 2Na+ + CO32NH4NO3 = NH4+ + NO3−
соли – электролиты, диссоциирующие в растворах на
катионы, но не Н+ и анионы, но не ОН-
растворимые соли – сильные эдектролиты,
диссоциируют полностью, а не ступенчато
33.
AgNO3 + HCl= AgCl ↓ + HNO3
Ag+ + NO3- + H+ + Cl- = AgCl ↓
+ NO3- + H+
Ag+ + Cl- = AgCl ↓
Образование белого творожистого осадка хлорида
серебра будет происходить всегда, когда в растворе
одновременно окажутся ионы Ag+ + Cl- .
Это качественная реакция
на ионы хлора и на ионы серебра
Сокращенные ионно-молекулярные уравнения реакций
отражают суть процессов, происходящих в растворе между
электролитами.
Одному уравнению может соответствовать множество реакций.
34.
ЦВЕТА И ХАРАКТЕР ОСАДКОВZnBr2 + 2KOH = Zn(OH)2↓ + 2KBr
Zn2+ 2OH- = Zn(OH)2↓
белый
Образуется всегда при
встрече Zn2+ и OH-
студенистый
(аморфный)
CuCl2 + 2KOH = Cu(OH)2 ↓ + 2KCl
Сu2+ 2OH- = Cu(OH)2↓ голубой
Образуется всегда при
встрече Сu2+ и OH-
студенистый
(аморфный)
35.
ЦВЕТА И ХАРАКТЕР ОСАДКОВFeCl3 + 3KOH = Fe(OH)3↓ + 3KCl
Fe3+ + 3OH- = Fe(OH)3↓ бурый
Образуется всегда при
встрече Fe3+ и OH-
студенистый
(аморфный)
FeSO4 + 2KOH = Fe(OH)2 ↓ + K2SO4
Fe2+ 2OH- = Fe(OH)2↓ зеленый
Образуется всегда при
встрече Fe2+ и OH-
студенистый
(аморфный)
36.
ЦВЕТА И ХАРАКТЕР ОСАДКОВAlCl3 + 3KOH = Al(OH)3↓ + 3KCl
Al3+ + 3OH- = Al(OH)3↓
белый
Образуется всегда при
встрече Al3+ и OH-
студенистый
(аморфный)
Сr2(SO4)3 + 6KOH = 2Cr(OH)3↓ + 3K2SO4
Cr3+ + 3OH- = Cr(OH)3↓ серо-зеленый
Образуется всегда при
встрече Cr3+ и OH-
аморфный
37.
ЦВЕТА И ХАРАКТЕР ОСАДКОВКCl + AgNO3 = KNO3 + AgCl↓
Ag+ + Cl- = AgCl↓
Белый
Образуется всегда при
встрече Ag+ и Cl-
творожистый
КBr + AgNO3 = KNO3 + AgBr↓
Ag+ + Br- = AgBr↓
желтоватый
Образуется всегда при
встрече Ag+ и Br-
творожистый
КI + AgNO3 = KNO3 + AgI↓
Ag+ + I- = AgI↓
желтый
Образуется всегда при
встрече Ag+ и I -
творожистый
AgCl AgBr AgI
38.
ЦВЕТА И ХАРАКТЕР ОСАДКОВ2КCl + Pb(NO3)2 = 2KNO3 + PbCl2↓
Pb2+ + 2Cl- = PbCl2↓
Белый
Образуется всегда при
встрече Pb2+ и Cl-
2КBr + Pb(NO3)2 = 2KNO3 + PbBr2↓
Pb2+ + 2Br- = PbBr2↓
Белый
Образуется всегда при
встрече Pb2+ и Br -
2КBr + Pb(NO3)2 = 2KNO3 + PbI2↓
Pb2+ + 2I- = PbI2↓
ЯркоОбразуется всегда при
встрече Pb2+ и I -
желтый
39.
ДИССОЦИАЦИЯ ВОДЫ.ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
40.
ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.Вода очень слабо диссоциирует
на ионы Н+ и ОН-.
константа
[Н+] [ОН-]
диссоциации К =
[Н2О]
воды
При с.у.
[Н+] = [ОН-] =10-7/л
[Н+] [ОН-] = 10-14/л
Растворы, в которых концентрация ионов Н+ и ОНравны , называют нейтральными
при добавлении кислоты [Н+] > 10-7/л - кислый р-р
при добавлении щелочи [Н+] < 10-7/л - щелочной р-р
Степень (десятичный логарифм), взятую с обратным знаком.
называют ВОДОРОДНЫМ ПОКАЗАТЕЛЕМ и обозначают рН.
рН < 7 – кислая среда,
рН=7 – нейтральная, рН >7 - щелочная
41.
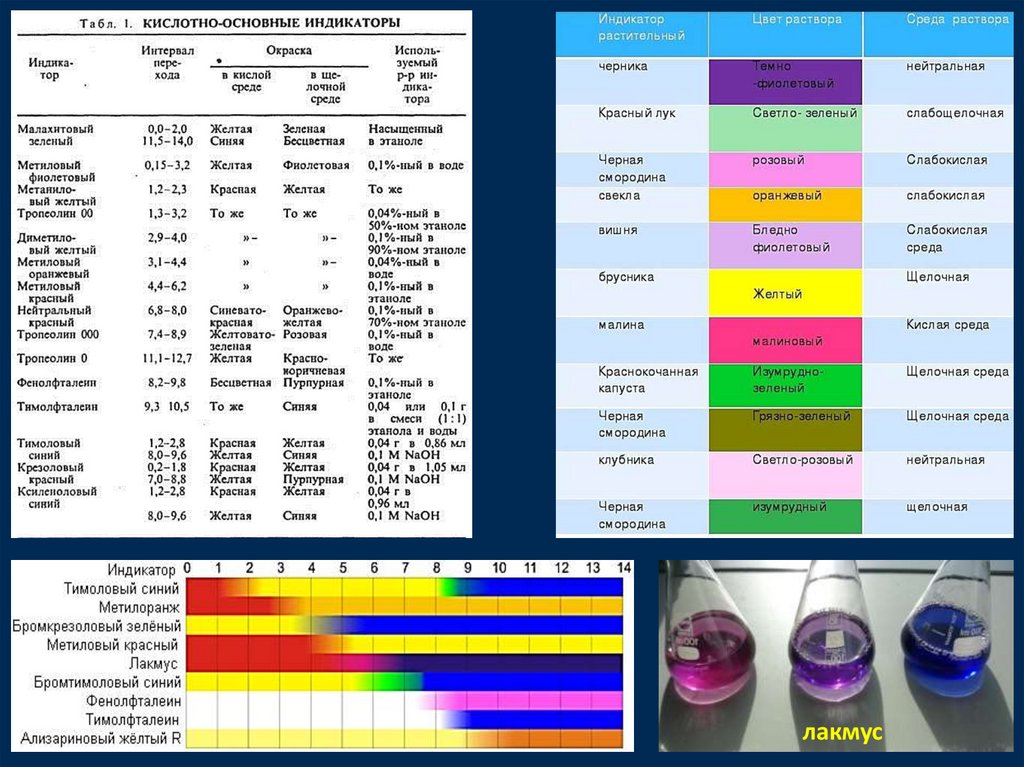
Определение рН раствора.Приближенно реакцию раствора можно определить с помощью
специальных реактивов - ИНДИКАТОРОВ, меняющих окраску в
зависимости от концентрации ионов водорода
42.
лакмус43.
Каждый индикаторхарактеризуется
интервалом перехода интервалом рН, в котором
происходит изменение
цвета .
Изменение окраски
происходит из-за
превращения
молекулярной формы
индикатора в ионную
(или анионной в
катионную).
По мере понижения
кислотности среды (с
ростом рН) концентрация
ионной формы
повышается,
молекулярной –
падает.
ЛАКМУС
ФЕНОЛФТАЛЕИН
МЕТИЛОРАНЖ
УНИВЕРСАЛЬНЫЙ




































 Химия
Химия








