Похожие презентации:
Закон постоянства состава веществ. Химические формулы. Валентность атомов химических элементов
1.
Тема урока:Закон постоянства
состава веществ.
Химические формулы.
Валентность атомов
химических элементов
2.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВ(справедлив только для веществ молекулярного строения)
Каждое химически чистое
вещество независимо
от места нахождения
и способа получения
имеет один и тот же
постоянный состав
Жозеф Луи Пруст
(1754-1826)
3.
Вода может быть получена врезультате следующих
химических реакций:
2Н2 + O2 = 2Н2O
Cu(OH) = H2O + CuO
Са(ОН)2 + H2SO4 = CaSO4 + 2Н2O
4.
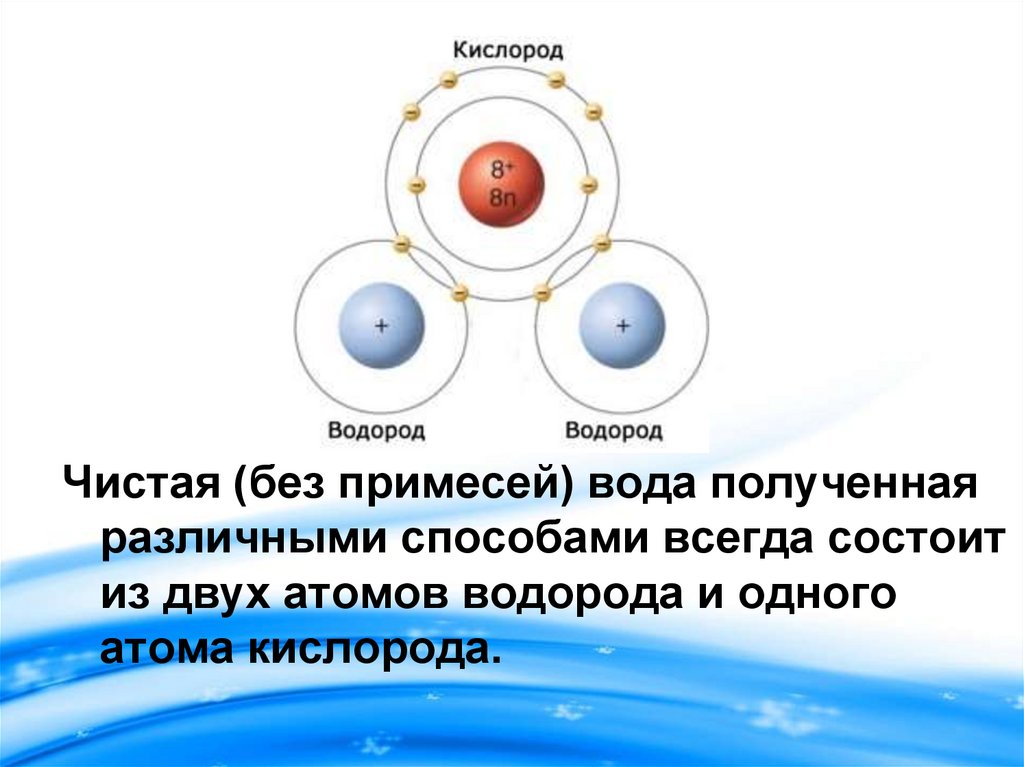
Чистая (без примесей) вода полученнаяразличными способами всегда состоит
из двух атомов водорода и одного
атома кислорода.
5.
Из каких атомов состоит это вещество?FeS
Найдите в ПСХЭ значение
относительных атомных масс железа и
серы.
Вычислите соотношение масс железа и
серы.
6.
Ar (Fe) = 56Ar (S) = 32
Соотношение масс:
Ar (Fe) : Ar(S) = 56 : 32 = 7 : 4
Вывод:
Чтобы получить
сульфид железа
надо смешать железо и серу в массовых соотношениях
7:4
Если порошка железа взять 9 г, а серы 4 г,
химическая реакция произойдет, избыточные 2 г
железа в реакцию не вступят.
7. Задание
Сколько грамм железа нужно взять,чтобы прореагировало 2г серы?
8. Практикум
Известно вещество, в котором на 2атома меди приходится 1 атом серы.
В каких массовых отношениях нужно
взять медь и серу, чтобы оба вещества
полностью вступили в реакцию?
9. Находим:
2 Ar(Cu)= 64 х 2 = 128Ar(S) = 32
Медь и серу необходимо смешать в
соотношении 128 : 32
или 4 : 1
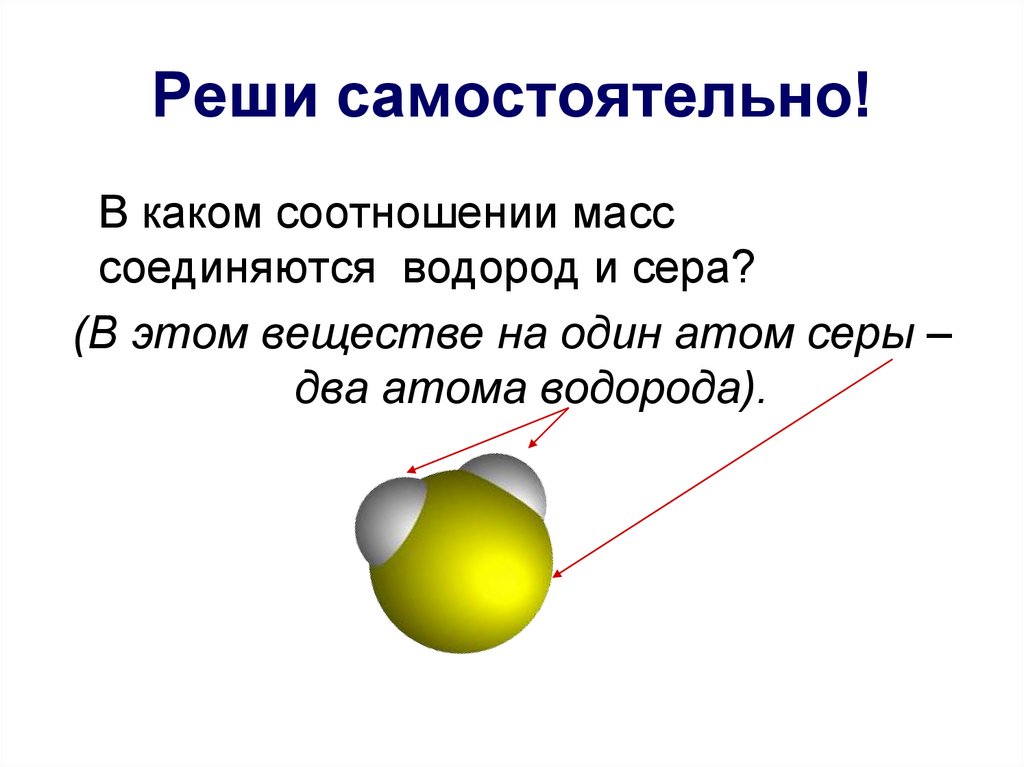
10. Реши самостоятельно!
В каком соотношении масссоединяются водород и сера?
(В этом веществе на один атом серы –
два атома водорода).
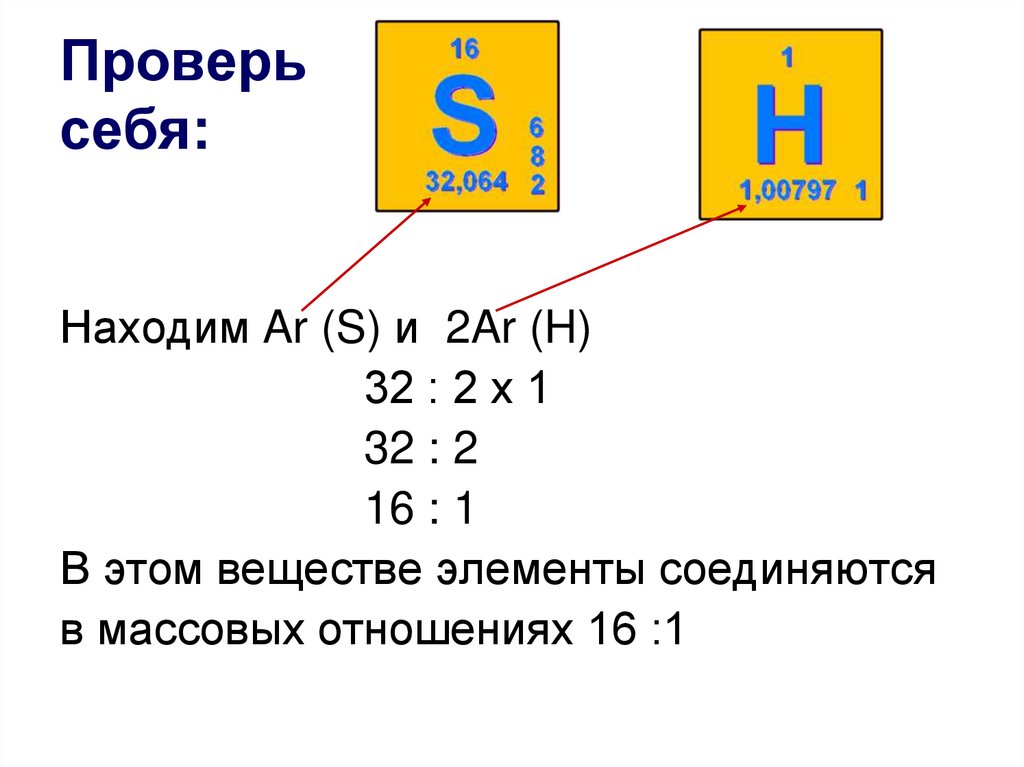
11. Проверь себя:
Находим Ar (S) и 2Ar (H)32 : 2 х 1
32 : 2
16 : 1
В этом веществе элементы соединяются
в массовых отношениях 16 :1
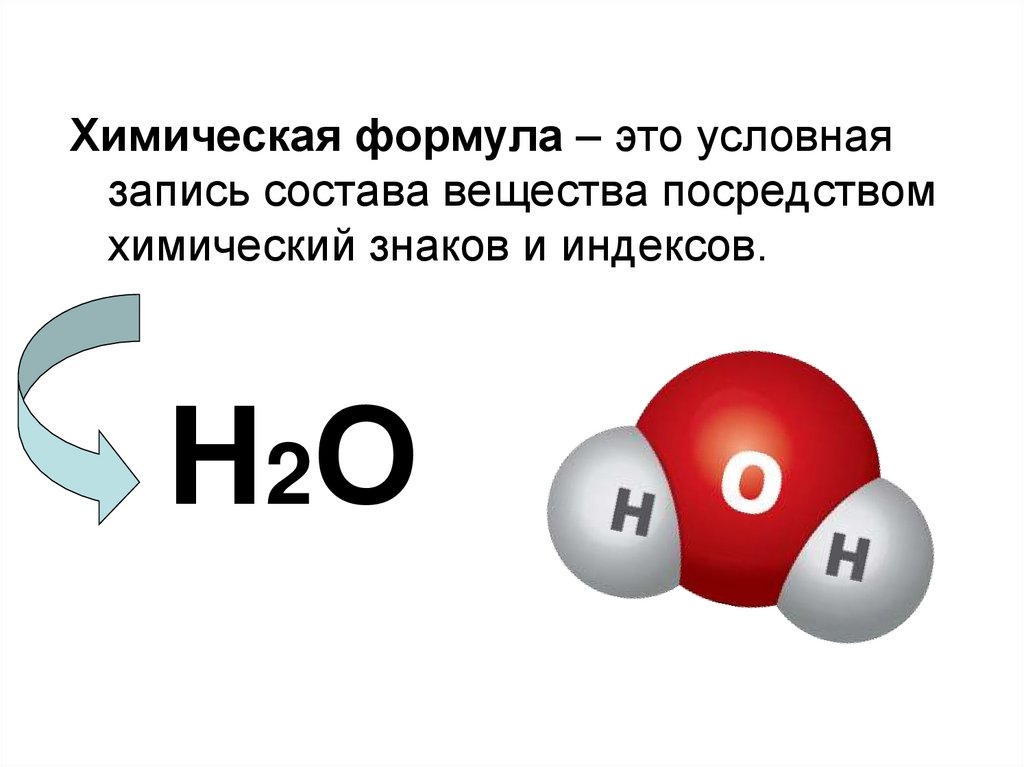
12.
Химическая формула – это условнаязапись состава вещества посредством
химический знаков и индексов.
Н 2О
13. ХИМИЧЕСКАЯ ФОРМУЛА ВОДЫ
НО2
Индекс 2 (обозначает 2 атома водорода в
составе молекулы воды).
Индекс 1 не пишут (обозначает 1 атом
кислорода в составе молекулы воды).
Индекс обозначает число атомов элемента,
входящих в состав данного вещества.
14. ХИМИЧЕСКАЯ ФОРМУЛА ВОДЫ
2 Н2ОКоэффициент 2 (показывает 2
молекулы воды).
Коэффициент
обозначает число молекул
(или отдельных атомов)
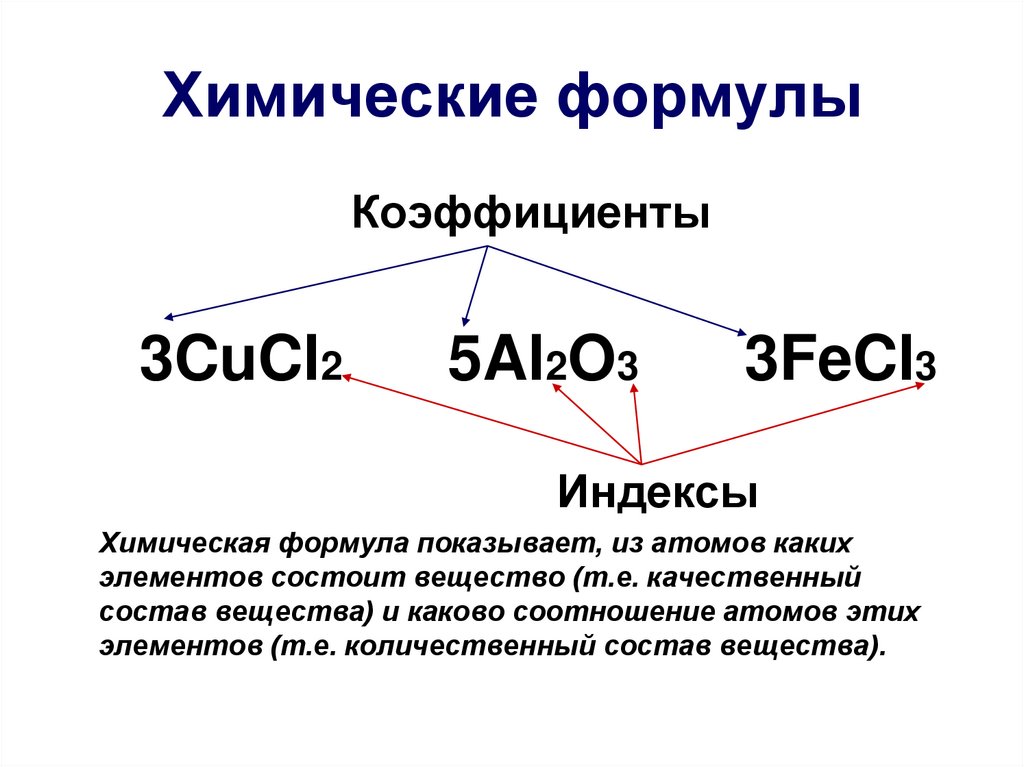
15. Химические формулы
Коэффициенты3CuCl2
5Al2O3
3FeCl3
Индексы
Химическая формула показывает, из атомов каких
элементов состоит вещество (т.е. качественный
состав вещества) и каково соотношение атомов этих
элементов (т.е. количественный состав вещества).
16. Подумай, выполни, ответь…
Что означают формулы?3Н2О
5Fe
Как читаются эти записи?
Напишите следующую формулу: пять
молекул воды образованны десятью атомами
водорода и пятью атомами кислорода.
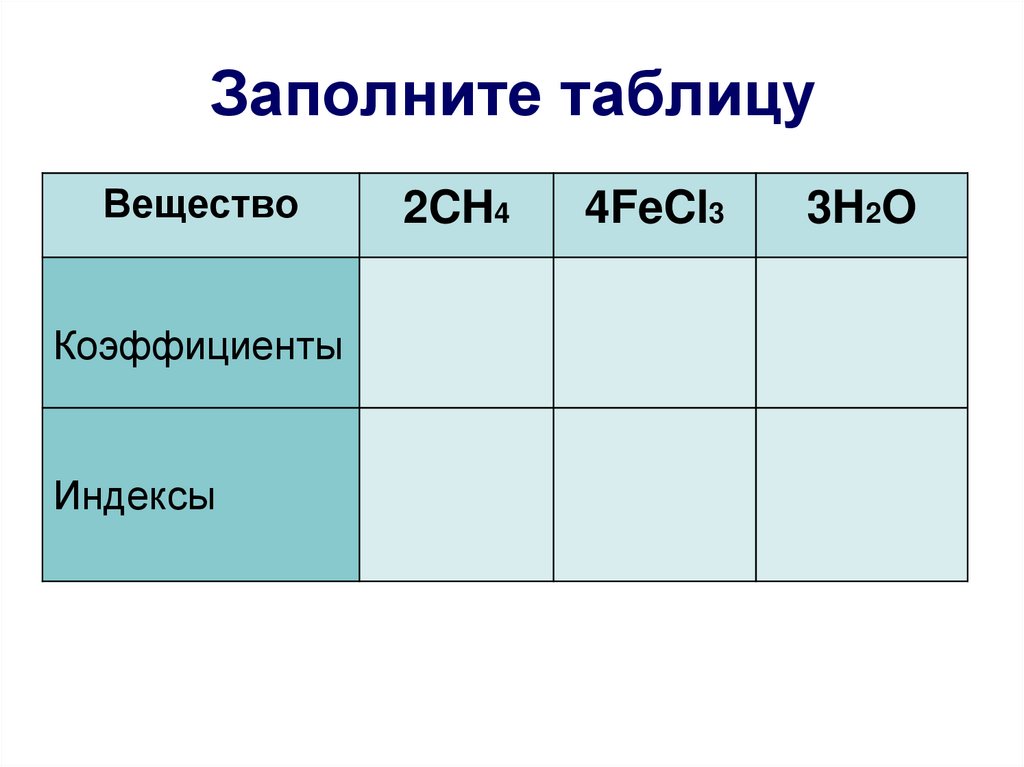
17. Заполните таблицу
ВеществоКоэффициенты
Индексы
2CH4
4FeCl3
3H2O
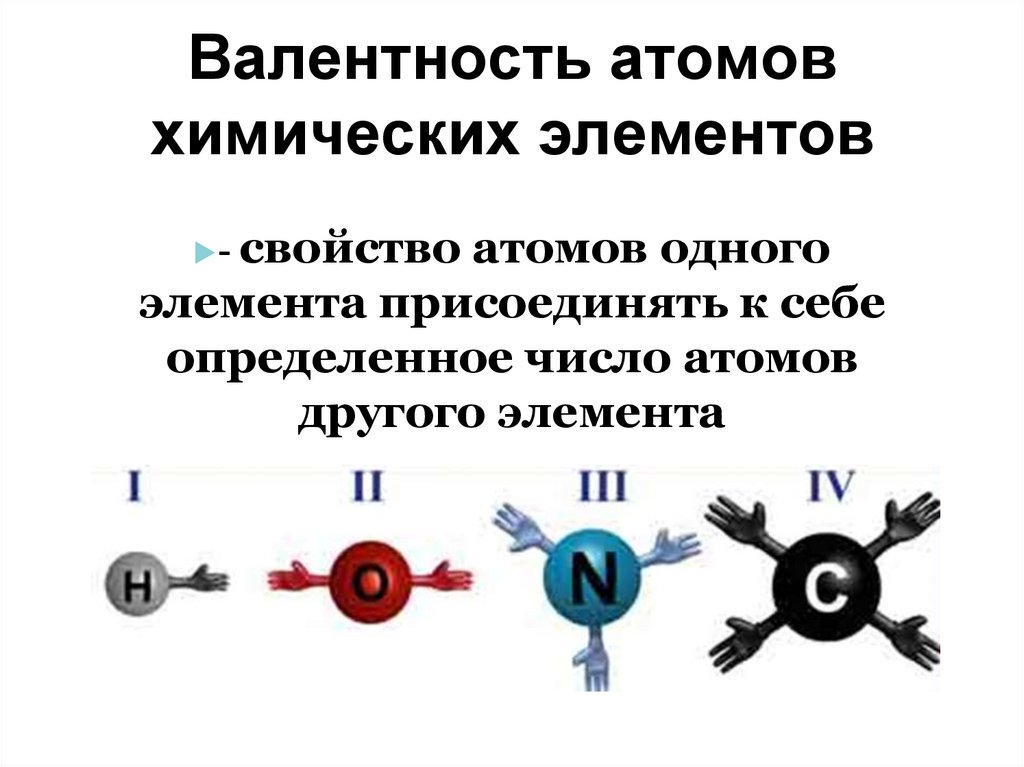
18. Валентность атомов химических элементов
свойство атомов одногоэлемента присоединять к себе
определенное число атомов
другого элемента
-
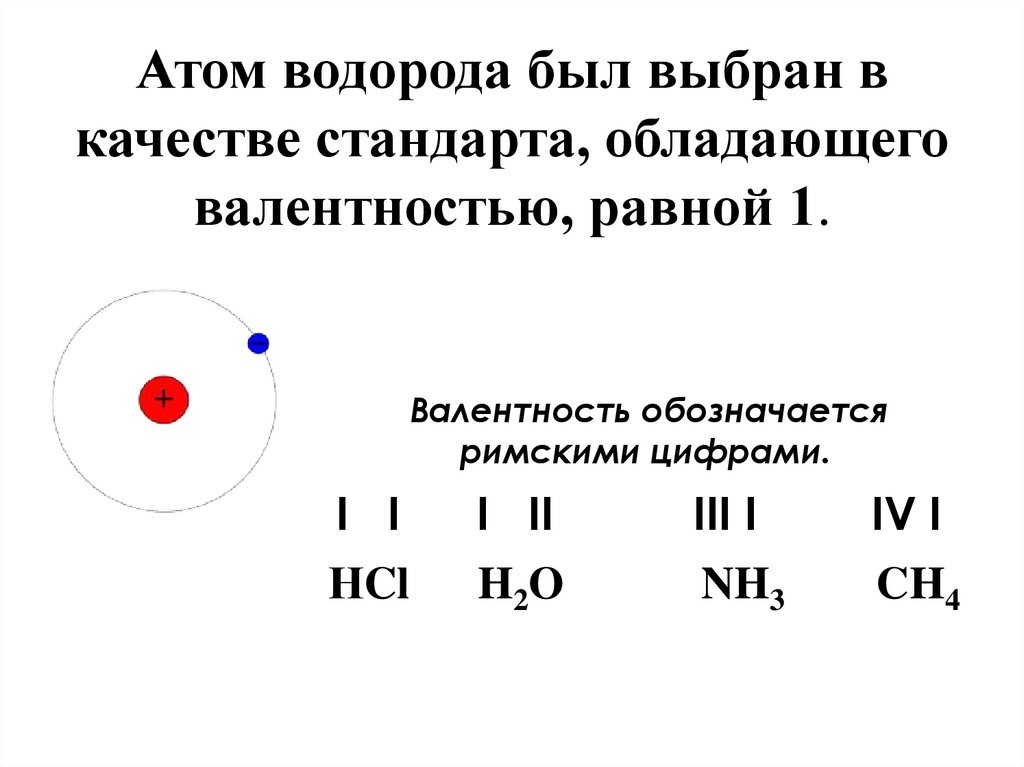
19.
Атом водорода был выбран вкачестве стандарта, обладающего
валентностью, равной 1.
Валентность обозначается
римскими цифрами.
I I
I II
III I
IV I
НCl
H 2O
NH3
CH4
20. Переменная и постоянная валентность
Есть элементы, которыеимеют постоянную
валентность:
H, Li, Na, К, Rb, Cs, F, Ag
I
О, Be, Mg, Ca, Sr, Ba, Zn, Cd
II
B, Al
III
21. Элементы с переменной валентностью
Cu, HgI,II
Fe, Co, Ni
II, III
Sn, Pb, C
II, IV
P, As
III, V
S
II, IV, VI
Cr
II, III, VI
Mn
II, IV, VI, VII
Cl, Br, I
I, III, V, VII
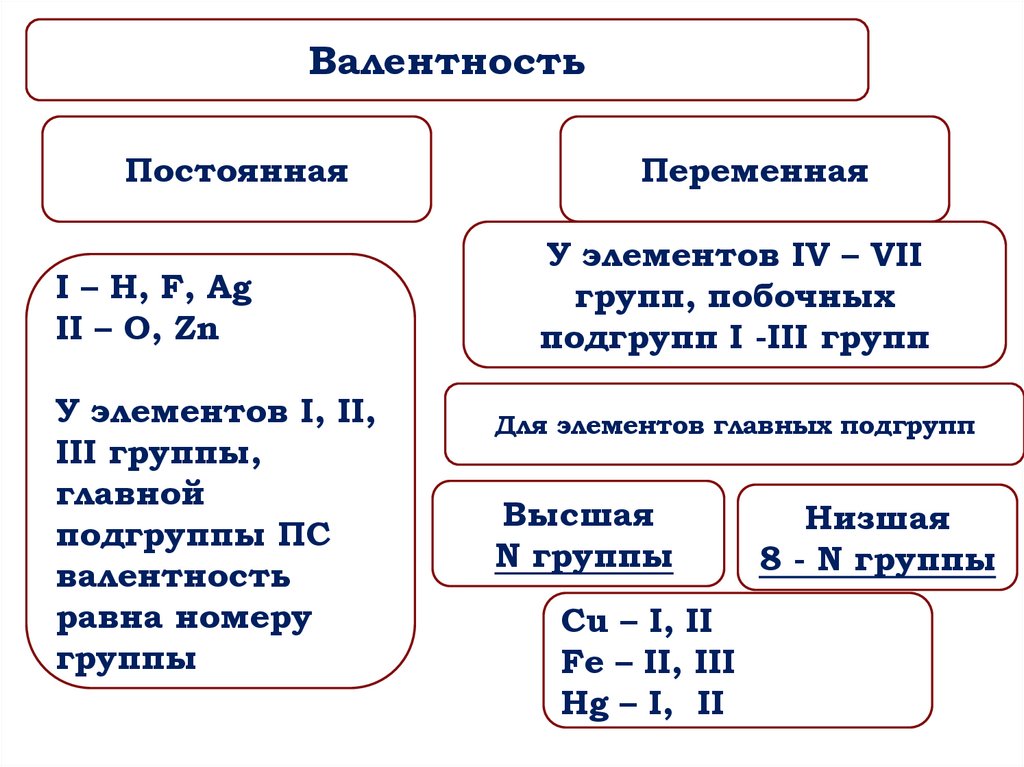
22.
ВалентностьПостоянная
I – H, F, Ag
II – O, Zn
У элементов I, II,
III группы,
главной
подгруппы ПС
валентность
равна номеру
группы
Переменная
У элементов IV – VII
групп, побочных
подгрупп I -III групп
Для элементов главных подгрупп
Высшая
N группы
Cu – I, II
Fe – II, III
Hg – I, II
Низшая
8 - N группы
23.
Алгоритм определениявалентности элемента по
формуле вещества:
1. над символами химических элементов с постоянной
валентностью надписать валентность элемента
? II
Fe2O3
2. умножить валентность на число атомов этого элемента
IIx3=6
3.разделить полученное число на число атомов элемента с
неизвестной валентностью; частное является значением
валентности данного элемента
6:2=III
III II
Fe2O3
24.
«КРЕСТИКИ-НОЛИКИ»ВЫИГРЫШНЫЙ ПУТЬ: ОДНОВАЛЕНТНЫЕ МЕТАЛЛЫ.
ВЫИГРЫШНЫЙ ПУТЬ: ТРЁХВАЛЕНТНЫЕ МЕТАЛЛЫ.
25.
Задание 1: определитевалентность элементов по
формулам следующих веществ
1-вариант
PH3
CuO
Mn2O7
SiH4
P2O5
2-вариант
SO2
26.
Алгоритм составленияформулы вещества по
валентности элементов
1. над символами элементов надписать валентности
элементов
VI II
S O
2.найти НОК для чисел валентности:
3. разделить НОК на значение валентности этих
элементов:
S (6 : VI=1);
6
O (6 : II=3)
4.полученные числа это индексы этих элементов в
формуле:
SO3
27.
Задание 2: составить формулывеществ по известным
валентностям элементов
1-вариант:
2-вариант:
II I
III I
III II
CaCl
PCl
NO
III II
II
I
III I
СrO
BaCl
AlH


















 Химия
Химия








