Похожие презентации:
Органические вещества клетки. Аминокислоты, белки, ферменты. Лекция 8
1. Органические вещества клетки. Аминокислоты, белки, ферменты.
Лекция 82. Белки
Белки (протеины) – это высокомолекулярные непериодическиеполимерные соединения, мономерами которых служат аминокислоты.
В организмах – 170 видов аминокислот
В составе белков – 20 видов аминокислот
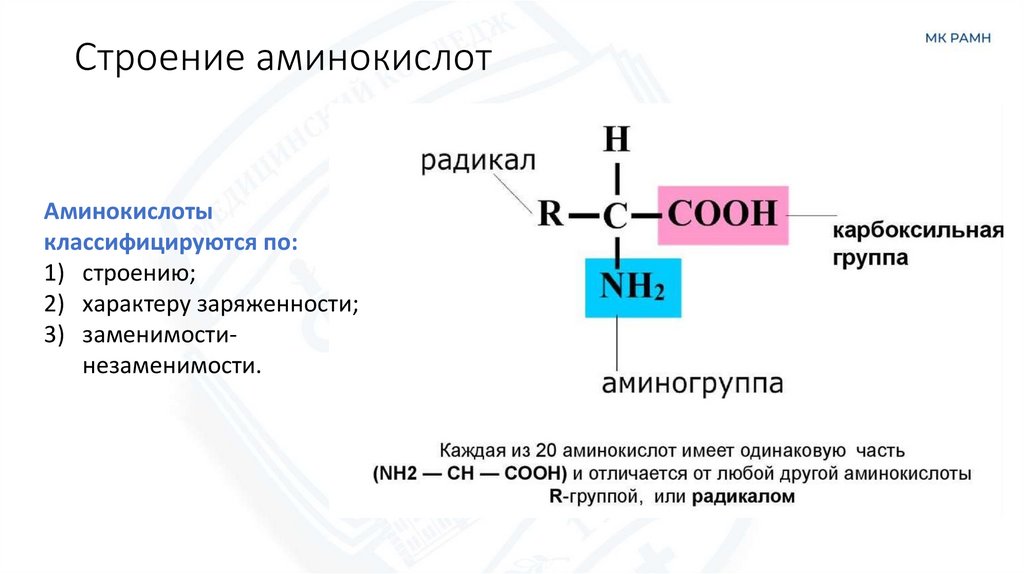
Аминокислоты (аминокарбоновые кислоты) — полярные (амфотерные)
соединения, содержащие аминогруппу (-NH2) и карбоксильную группу
(-COOH), обеспечивающую свойства кислоты.
3. Строение аминокислот
Аминокислотыклассифицируются по:
1) строению;
2) характеру заряженности;
3) заменимостинезаменимости.
4.
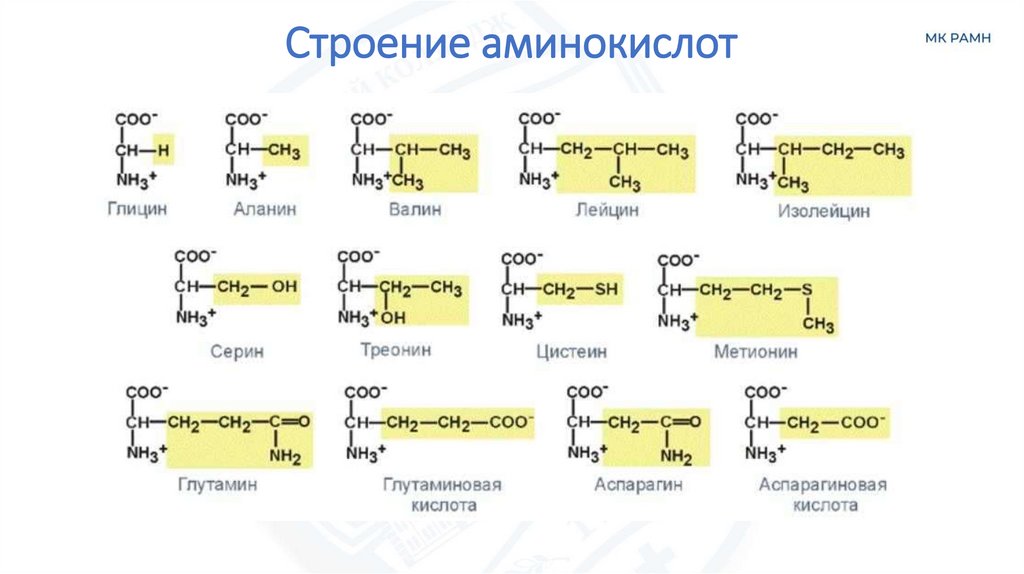
Строение аминокислот5.
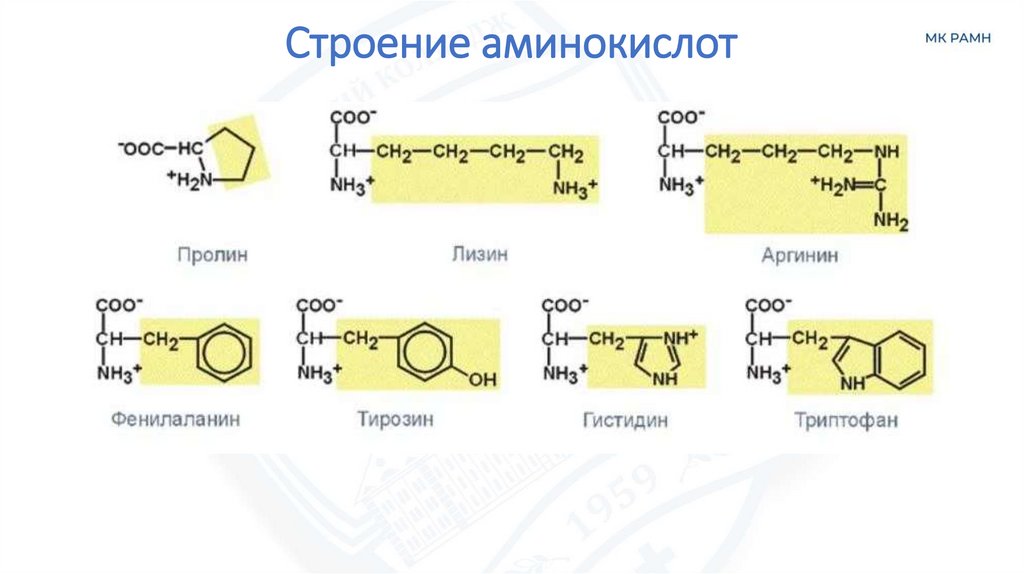
Строение аминокислот6.
АминокислотыЗаменимые
Незаменимые
• Глицин
• Аспарагиновая
кислота
• Аланин
• Пролин
• Серин
• Аргинин
• Цистеин
• Тирозин
• Глутамин
• Гистидин
• Глутаминовая
кислота
• Аспарагин
• Валин
• Лейцин
• Изолейцин
• Лизин
• Метионин
• Треонин
• Триптофан
• Фенилаланин
Синтезируются в организме
Поступают только с пищей
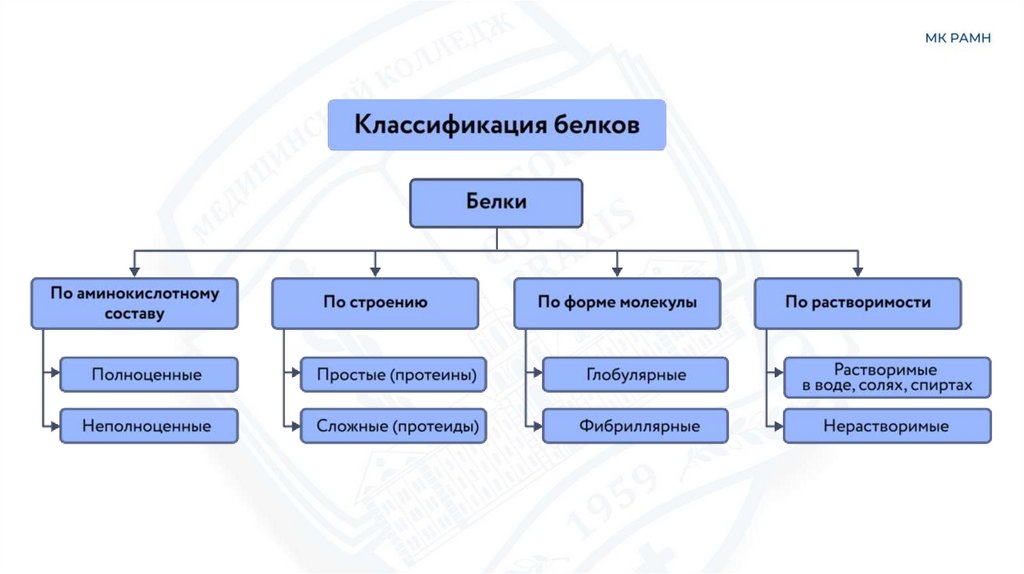
В зависимости от аминокислотного состава, белки бывают:
1.Полноценными – белки, содержащие весь набор аминокислот (20 разных аминокислот);
2. Неполноценными – белки, в составе которых какие-то аминокислоты отсутствуют.
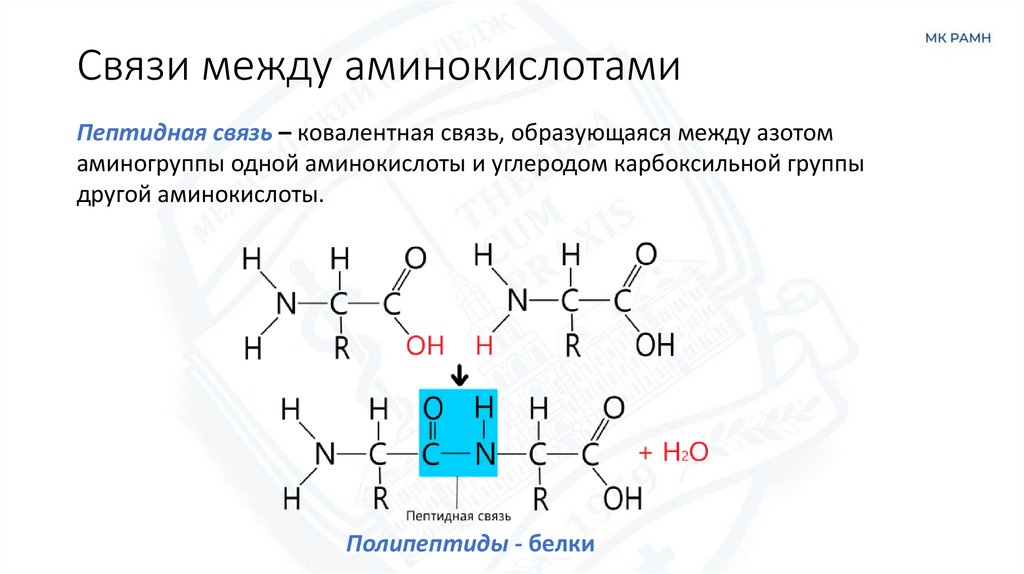
7. Связи между аминокислотами
Пептидная связь – ковалентная связь, образующаяся между азотомаминогруппы одной аминокислоты и углеродом карбоксильной группы
другой аминокислоты.
Полипептиды - белки
8. Структуры белка
Первичная структура белка - специфическая аминокислотнаяпоследовательность, т.е. порядок чередования аминокислотных остатков
в полипептидной цепи. Образована пептидными связями.
9.
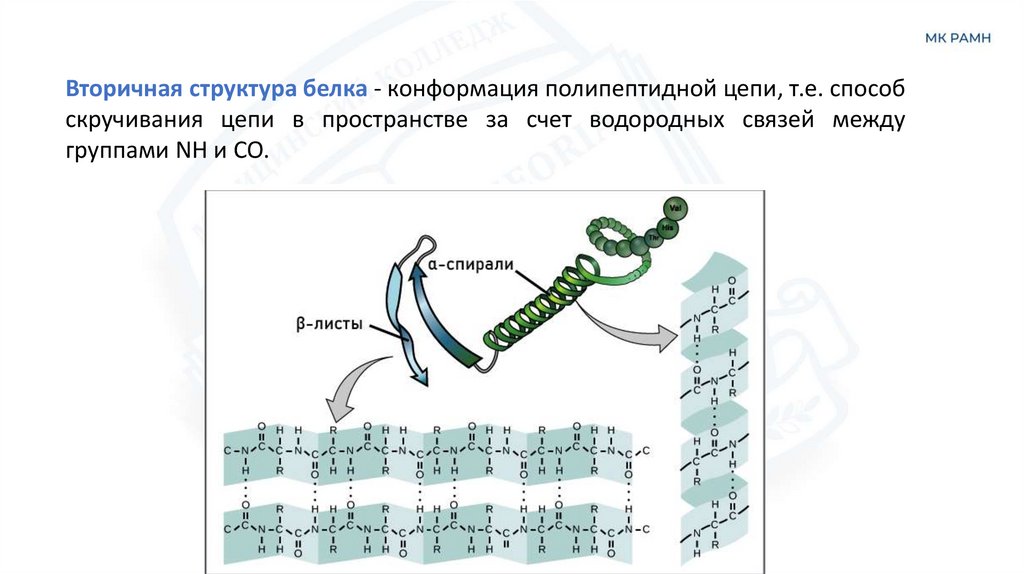
Вторичная структура белка - конформация полипептидной цепи, т.е. способскручивания цепи в пространстве за счет водородных связей между
группами NH и CO.
10.
Третичная структура белка - форма закрученной спирали в пространстве,образованная главным образом за счет дисульфидных мостиков,
водородных связей, гидрофобных и ионных взаимодействий.
11.
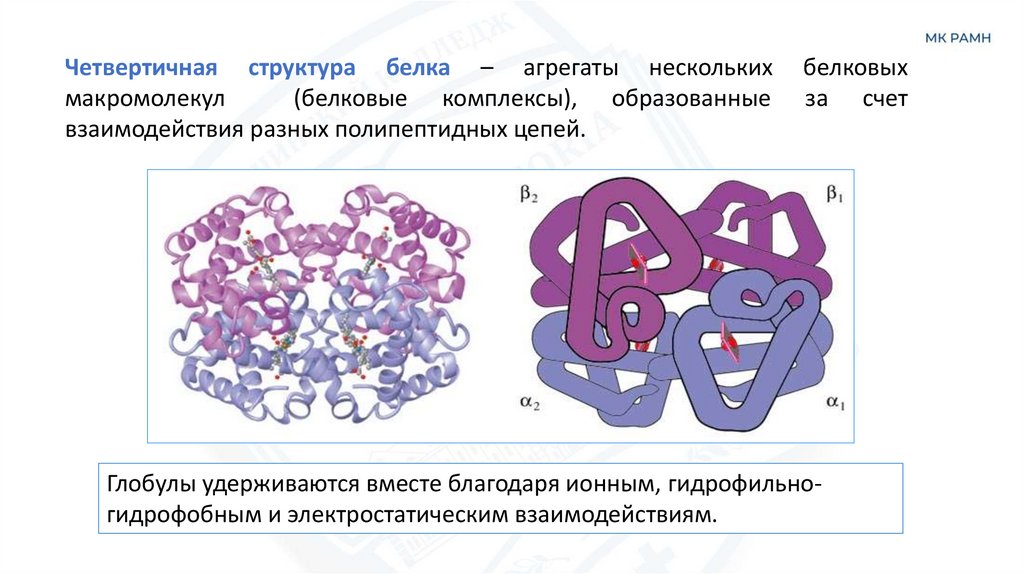
Четвертичная структура белка – агрегаты несколькихмакромолекул
(белковые комплексы), образованные
взаимодействия разных полипептидных цепей.
белковых
за счет
Глобулы удерживаются вместе благодаря ионным, гидрофильногидрофобным и электростатическим взаимодействиям.
12. Свойства белков
• Буферность - способность растворов препятствовать изменению придобавлении кислоты или щёлочи. Благодаря этому свойству белков в
организме поддерживается кислотно-щелочной баланс.
• Денатурация (коагуляция) белка - разрушение вторичной и третичной
структуры белка с сохранением первичной структуры под действием
различных факторов. Денатурация белка сопровождается потерей его
биологических свойств.
• Растворимость - глобулярные белки, как правило, лучше растворимы,
чем фибриллярные.
• Ренатурация - процесс последовательного восстановления вторичной,
третичной и четвертичной структур белка, сопровождающийся
восстановлением биологических свойств белка.
13. Денатурация и ренатурация белков
Денатурацию белка вызывают различные физические и химические факторы.К физическим факторам относятся:
• высокие температуры; часть белков подвергается денатурации уже при
градусах;
• ультрафиолетовое облучение;
• рентгеновское и радиоактивное облучение;
• ультразвук;
• механическое воздействие (например, вибрация).
Химические факторы связаны с действием:
• концентрированных кислот и щелочей;
• солей тяжёлых металлов (например, );
• органических растворителей (этиловый спирт, ацетон)
• солей щелочных и щёлочноземельных металлов ()
Указанные факторы могут вызвать обратимую или необратимую денатурацию.
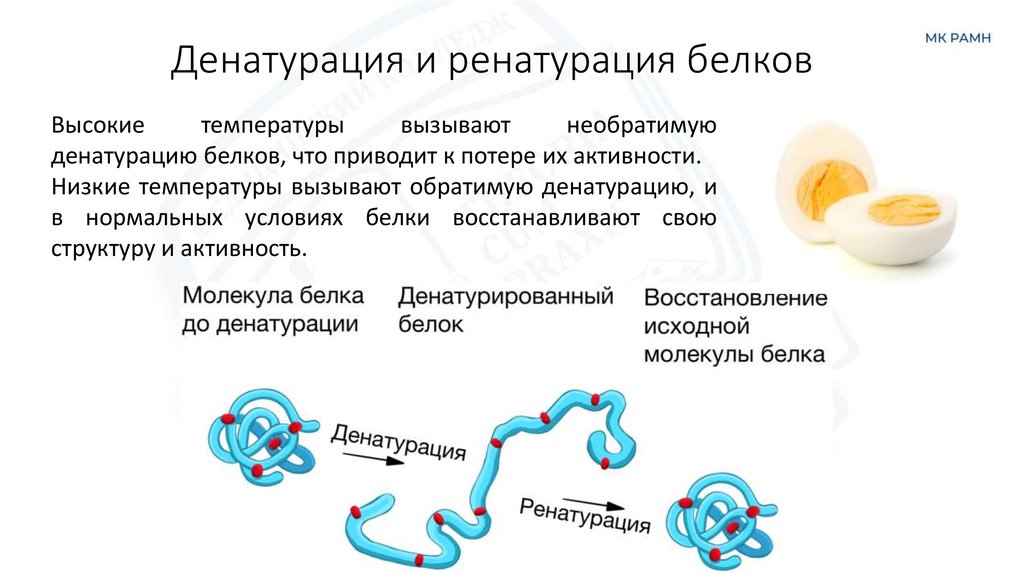
14. Денатурация и ренатурация белков
Высокиетемпературы
вызывают
необратимую
денатурацию белков, что приводит к потере их активности.
Низкие температуры вызывают обратимую денатурацию, и
в нормальных условиях белки восстанавливают свою
структуру и активность.
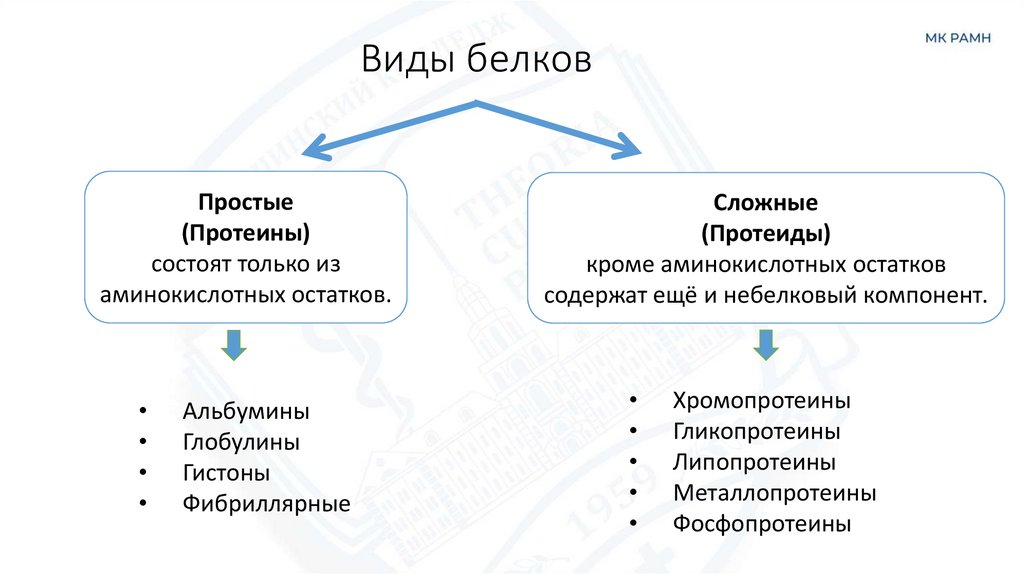
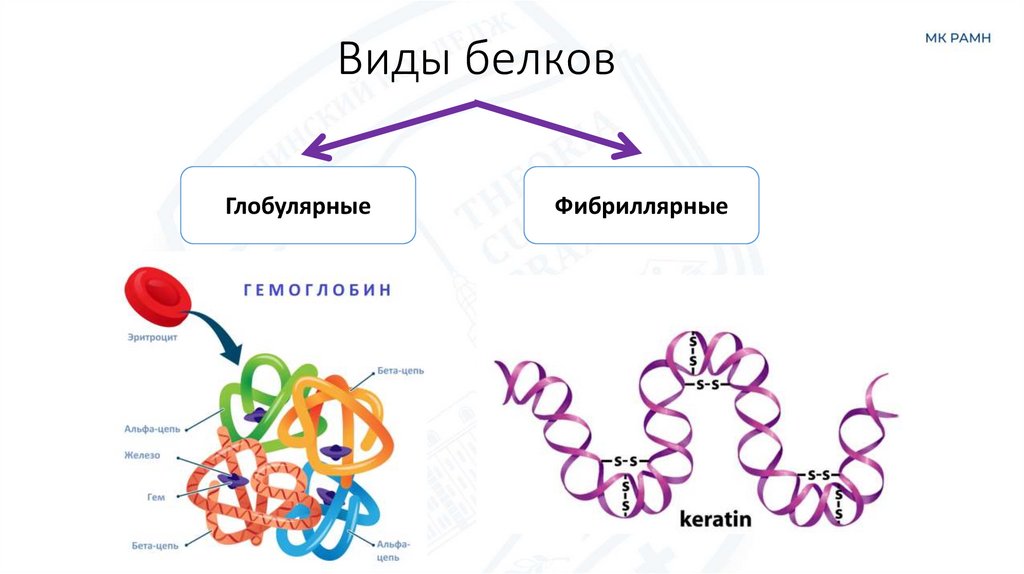
15. Виды белков
Простые(Протеины)
состоят только из
аминокислотных остатков.
Альбумины
Глобулины
Гистоны
Фибриллярные
Сложные
(Протеиды)
кроме аминокислотных остатков
содержат ещё и небелковый компонент.
Хромопротеины
Гликопротеины
Липопротеины
Металлопротеины
Фосфопротеины
16. Виды белков
ГлобулярныеФибриллярные
17.
18. Функции белков
19.
СтроительнаяБелки участвуют в образовании всех мембран и органоидов
клетки.
белок
кератин
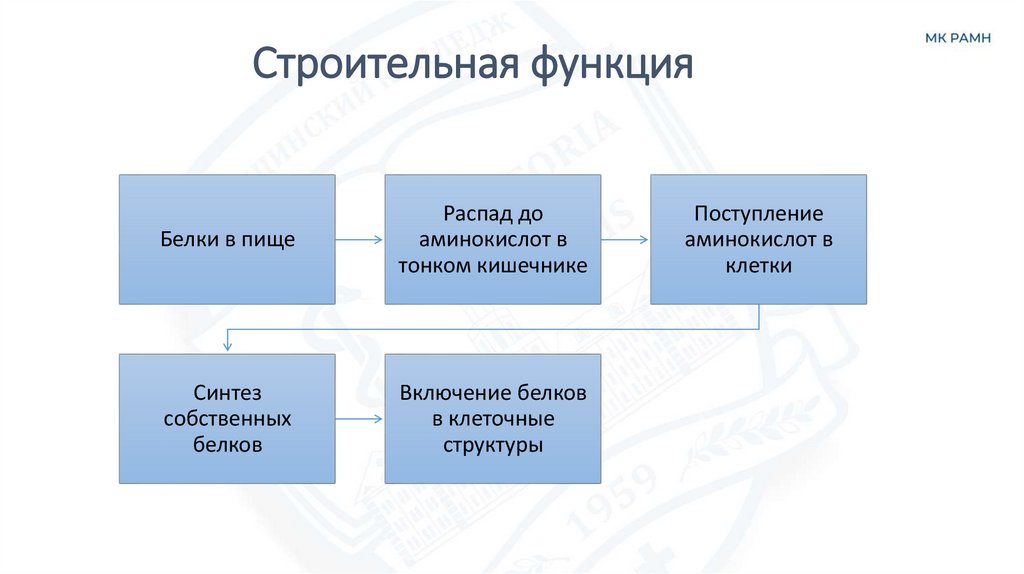
20. Строительная функция
Белки в пищеРаспад до
аминокислот в
тонком кишечнике
Синтез
собственных
белков
Включение белков
в клеточные
структуры
Поступление
аминокислот в
клетки
21.
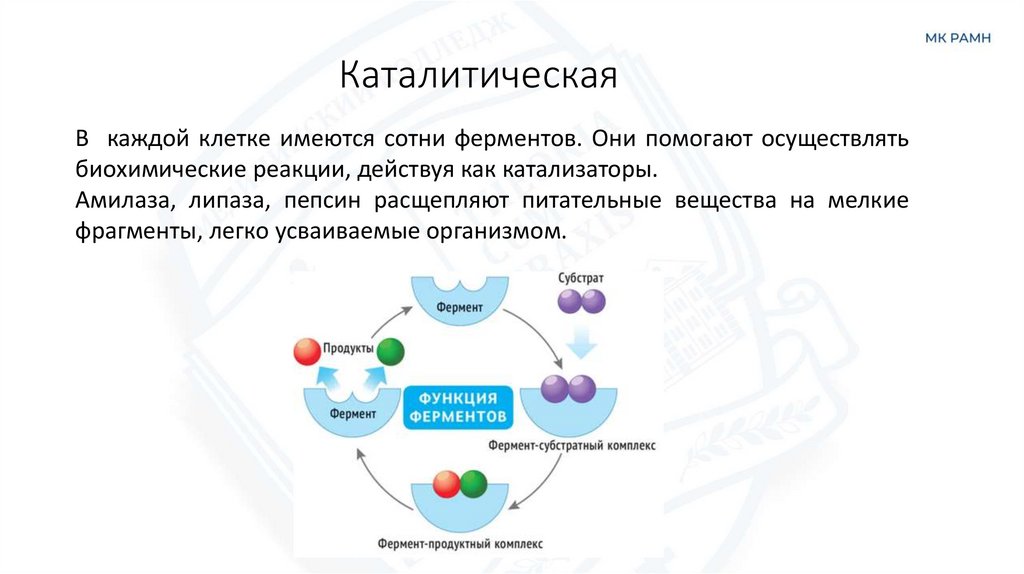
КаталитическаяВ каждой клетке имеются сотни ферментов. Они помогают осуществлять
биохимические реакции, действуя как катализаторы.
Амилаза, липаза, пепсин расщепляют питательные вещества на мелкие
фрагменты, легко усваиваемые организмом.
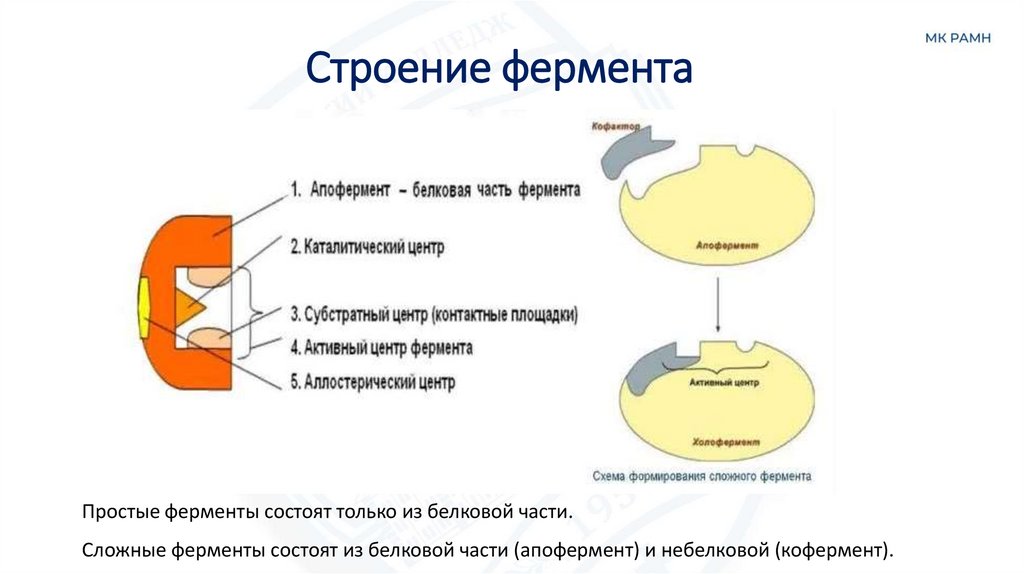
22. Строение фермента
Простые ферменты состоят только из белковой части.Сложные ферменты состоят из белковой части (апофермент) и небелковой (кофермент).
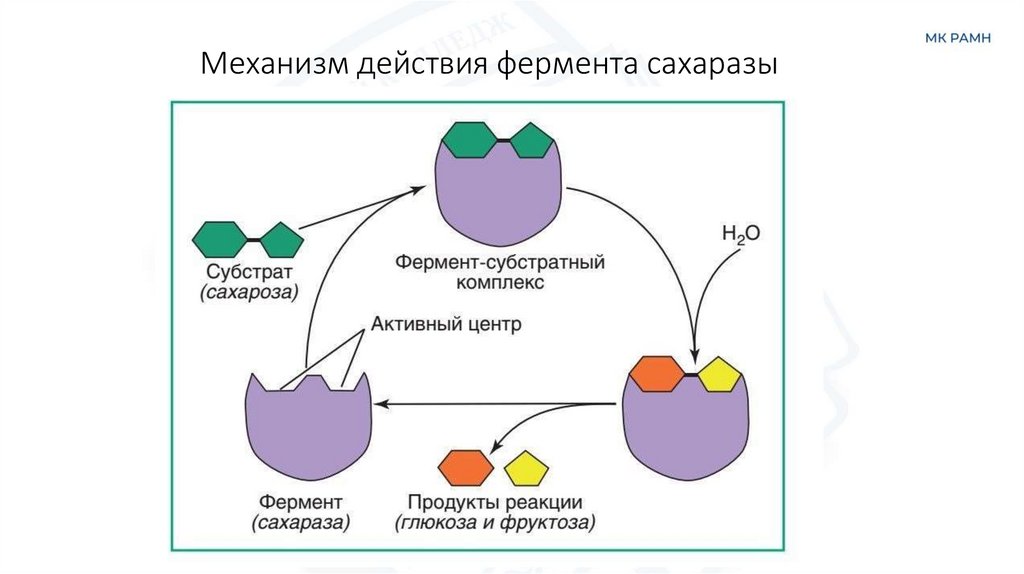
23.
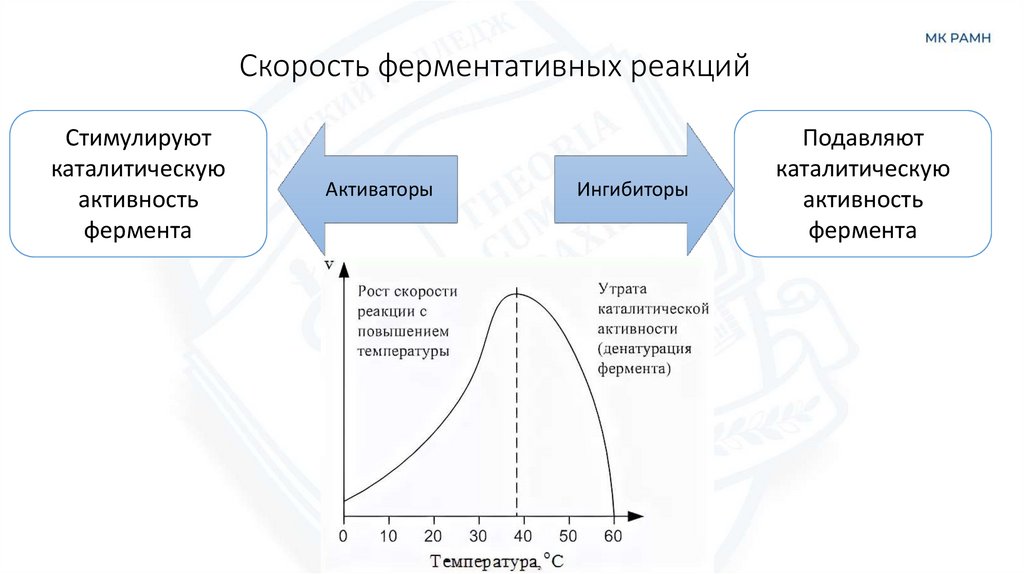
Механизм действия фермента сахаразы24. Скорость ферментативных реакций
Стимулируюткаталитическую
активность
фермента
Активаторы
Ингибиторы
Подавляют
каталитическую
активность
фермента
25.
ТранспортнаяБелки связывают и переносят различные вещества и внутри
клетки, и по всему организму.
Например, гемоглобин
переносит кислород в крови
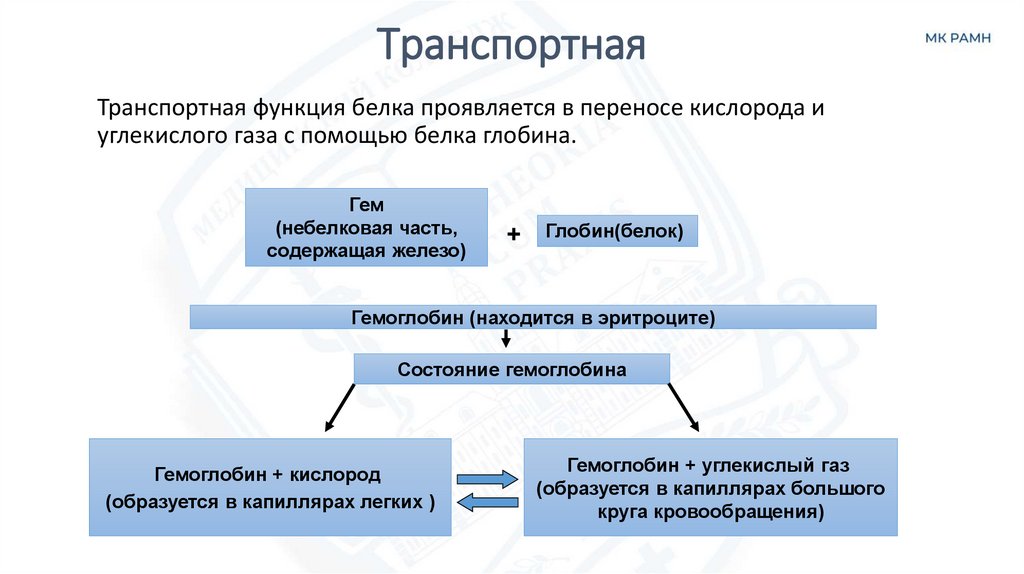
26. Транспортная
Транспортная функция белка проявляется в переносe кислорода иуглекислого газа с помощью белка глобина.
Гем
(небелковая часть,
содержащая железо)
+
Глобин(белок)
Гемоглобин (находится в эритроците)
Состояние гемоглобина
Гемоглобин + кислород
(образуется в капиллярах легких )
Гемоглобин + углекислый газ
(образуется в капиллярах большого
круга кровообращения)
27.
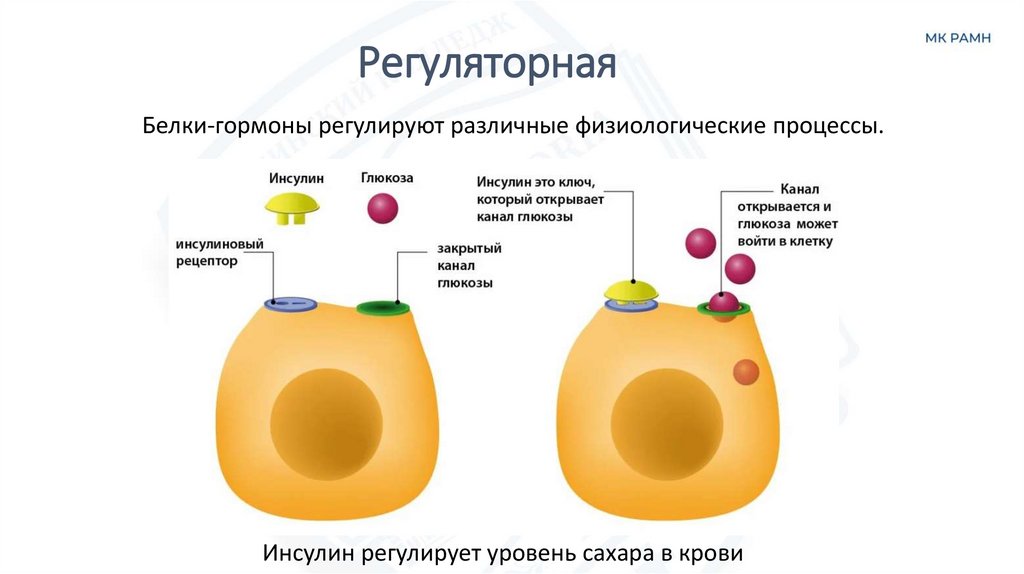
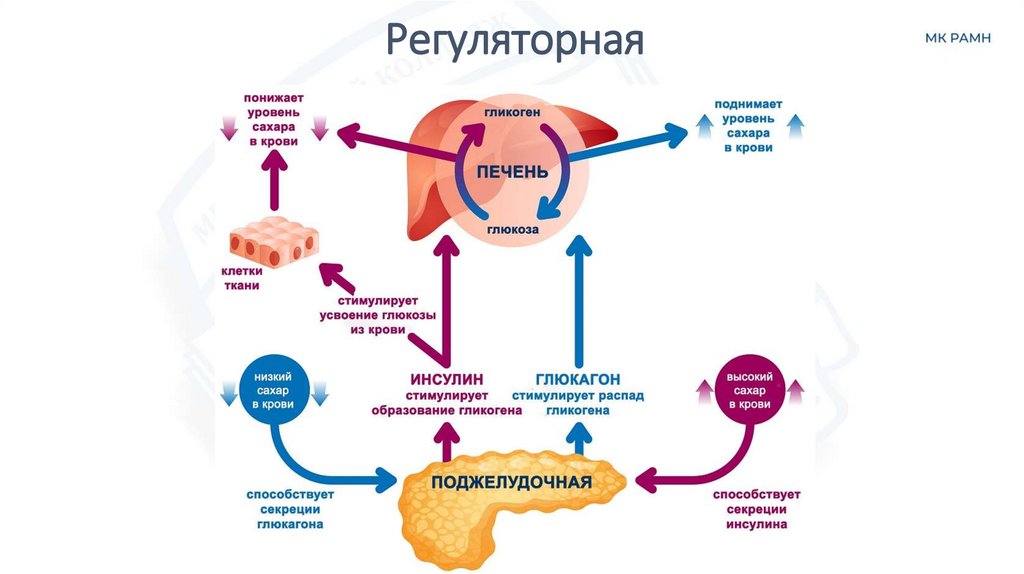
РегуляторнаяБелки-гормоны регулируют различные физиологические процессы.
Инсулин регулирует уровень сахара в крови
28. Регуляторная
29.
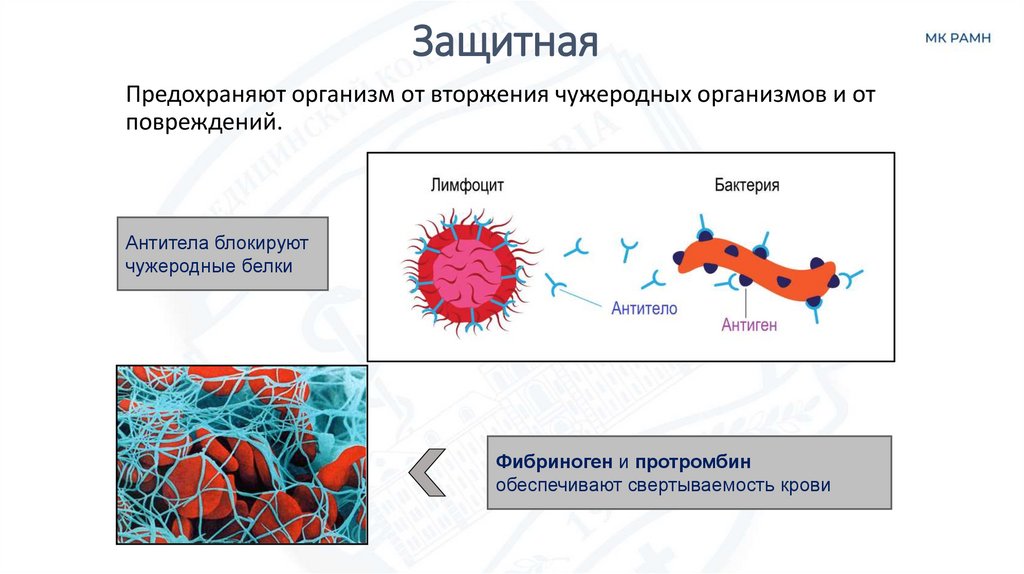
ЗащитнаяПредохраняют организм от вторжения чужеродных организмов и от
повреждений.
Антитела блокируют
чужеродные белки
Фибриноген и протромбин
обеспечивают свертываемость крови
30. Защитная
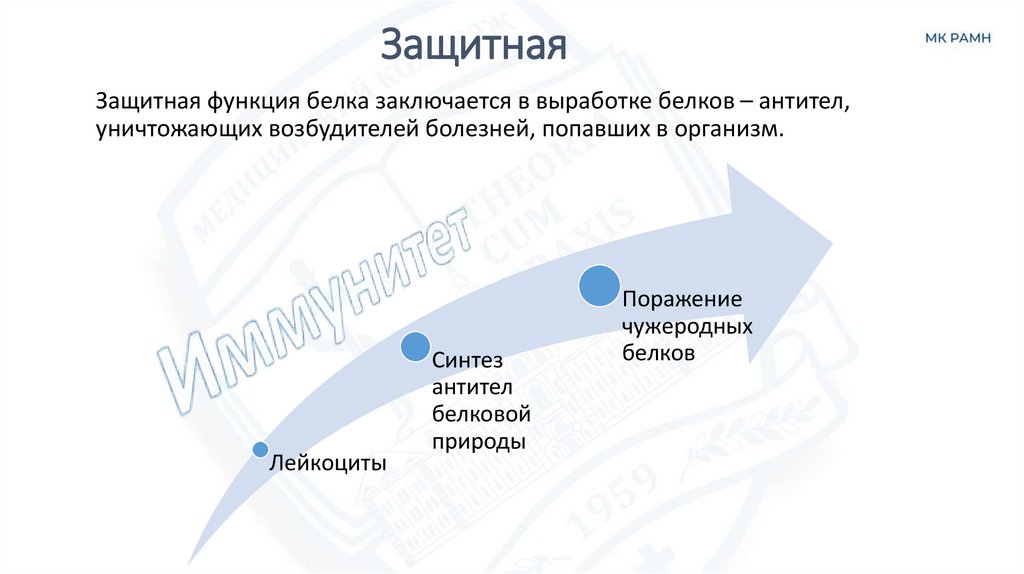
Защитная функция белка заключается в выработке белков – антител,уничтожающих возбудителей болезней, попавших в организм.
Лейкоциты
Синтез
антител
белковой
природы
Поражение
чужеродных
белков
31.
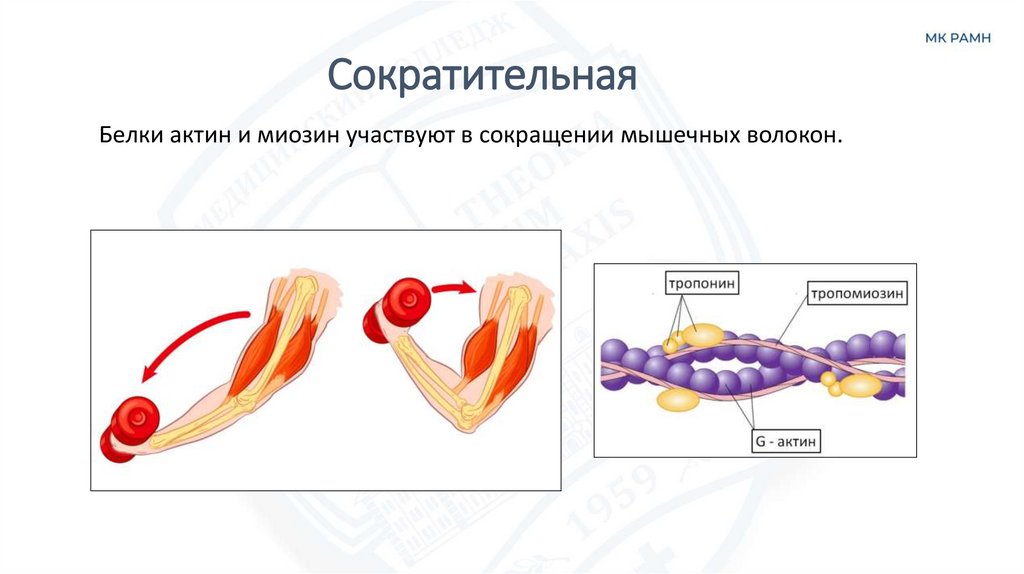
СократительнаяБелки актин и миозин участвуют в сокращении мышечных волокон.
32.
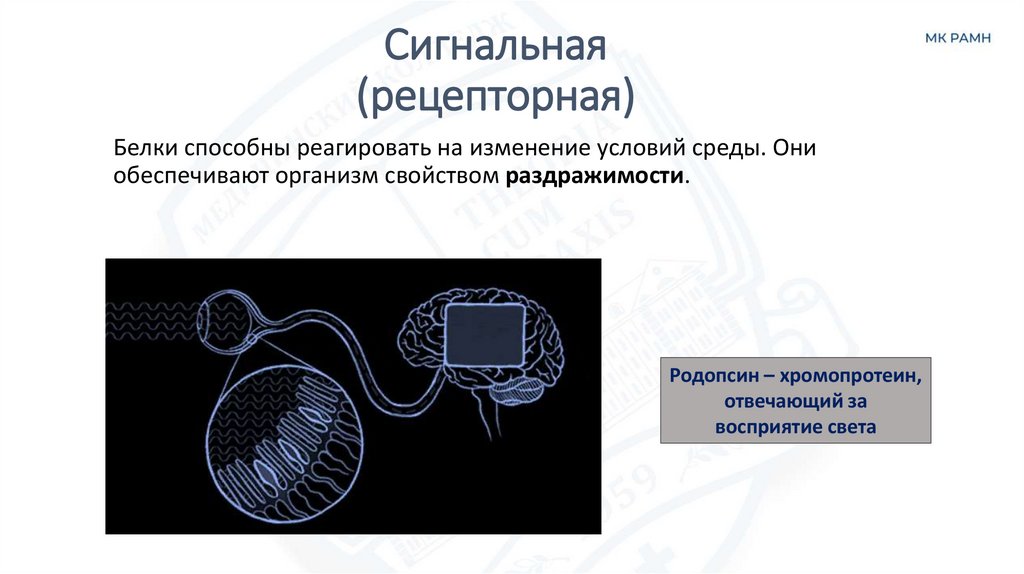
Сигнальная(рецепторная)
Белки способны реагировать на изменение условий среды. Они
обеспечивают организм свойством раздражимости.
Родопсин – хромопротеин,
отвечающий за
восприятие света
33.
ЭнергетическаяПри недостатке углеводов или жиров окисляются молекулы
аминокислот.
При полном расщеплении белка до конечных продуктов выделяется
энергия:
1г белка - 17.6 кДж
В качестве источника энергии белки используются крайне редко.











 Биология
Биология








