Похожие презентации:
Типы химических реакций 1
1. Типы химических реакций
2. Степень окисления
Порядок выставления с. о. в химических формулах: вверху надсимволом элемента, причем вначале пишется заряд («+» или «-»),
а затем число (1, 2, 3).
1. На первом месте находится элемент с положительной степенью
окисления.
2. На последнем месте находится элемент с отрицательной степенью
окисления.
3. Постоянная степень окисления
У металлов степень окисления всегда положительна и равнаномеру группы (для металлов главных подгрупп).
1. У металлов I группы С.О.= +1
2. У металлов II группы С.О.= +2
3. У металлов III группы С.О.= +3
Степень окисления фтора (F) всегда равна -1
4. Запомнить правила
• У атомов кислорода с.о. всегда -2. (кроме соединений со фтором (+2)O+2F2-1 и в пероксидах (-1) H2+1O2-1 )
• У атомов водорода с.о. +1, с металлами -1.(у атома водорода степень
окисления равна (+1) Н2+1О-2 , соединений с металлами (-1)
Na+1H-1)
• У металлов в соединениях с.о. всегда "+". Значение равно номеру группы.
• У свободных атомов и простых веществ с.о. равна 0.
• У неметаллов в соединениях с.о. с металлами всегда «-» и равна значению
«8-№ группы»
• Суммарная с.о. атомов в соединении равна «0»
5. Названия бинарных соединений
Названия элементов с отрицательной степенью окисления:• Cl - хлорид
• O - оксид
• H - гидрид
• S - сульфид
• N - нитрид
• P - фосфид
• C - карбид
• Br - бромид
6. Что такое химическая реакция?
Химические реакции илихимические явления – это
процессы, в результате
которых из одних веществ
образуются другие.
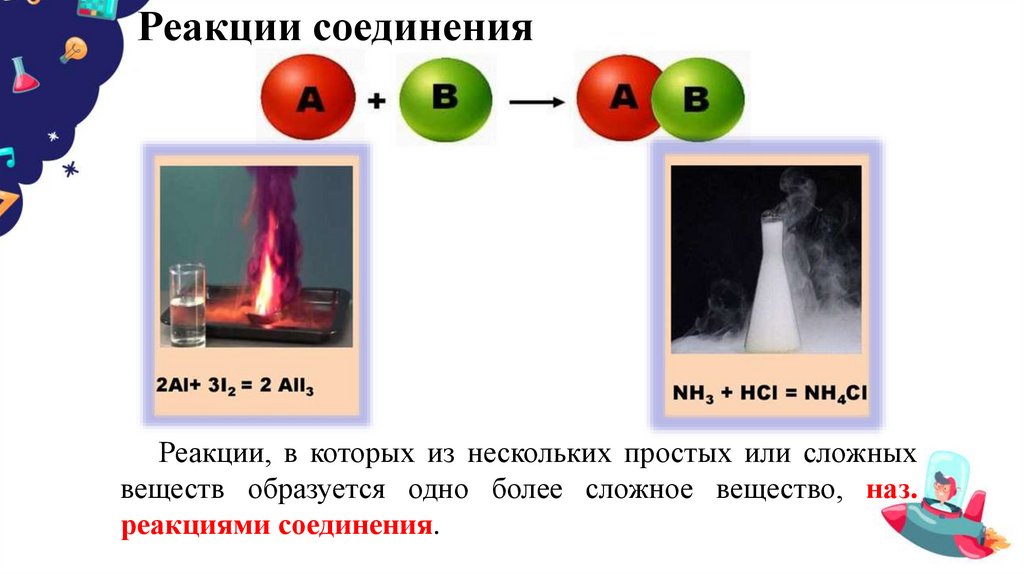
7. Реакции соединения
Реакции, в которых из нескольких простых или сложныхвеществ образуется одно более сложное вещество, наз.
реакциями соединения.
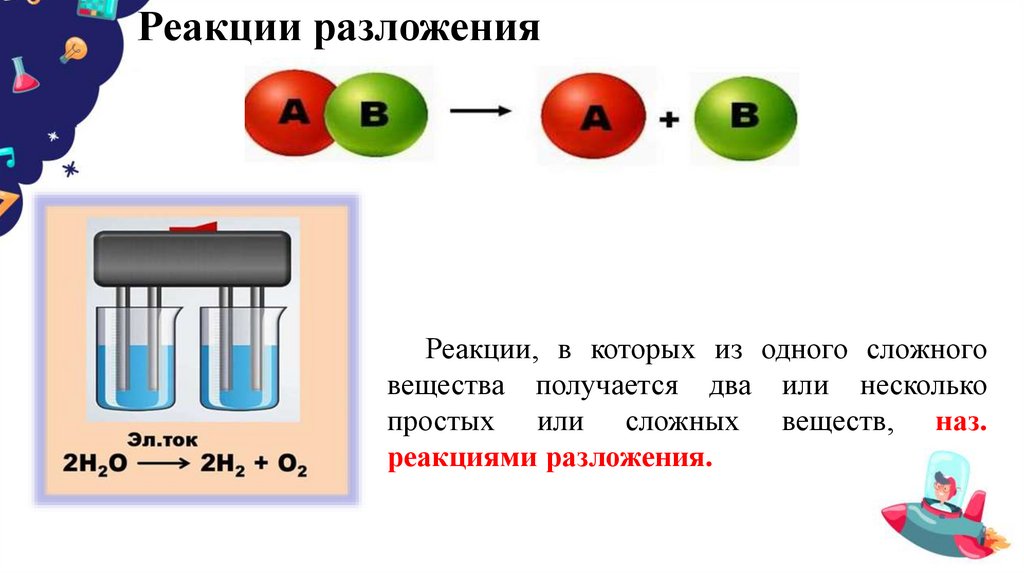
8. Реакции разложения
Реакции, в которых из одного сложноговещества получается два или несколько
простых или сложных веществ, наз.
реакциями разложения.
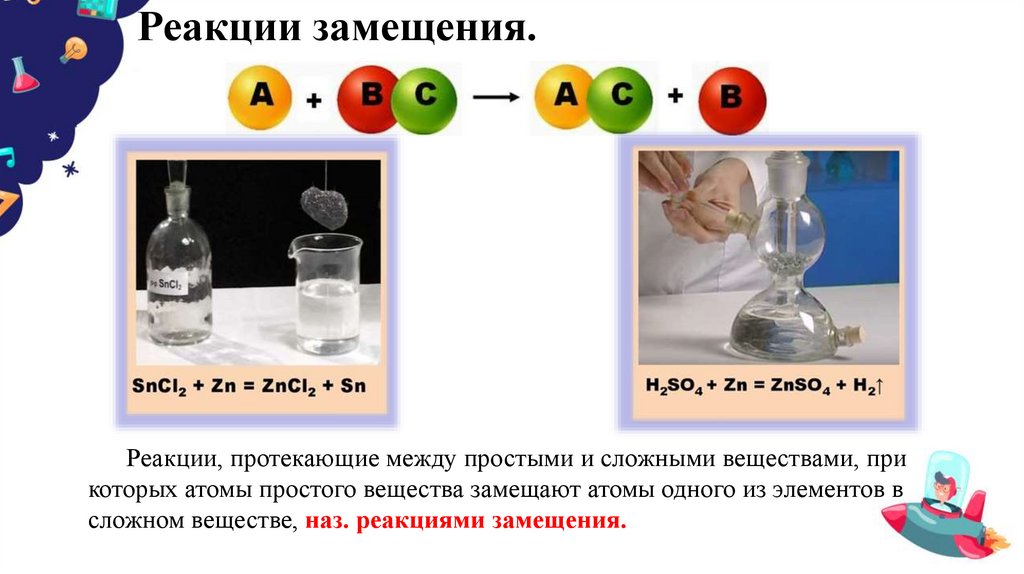
9. Реакции замещения.
Реакции, протекающие между простыми и сложными веществами, прикоторых атомы простого вещества замещают атомы одного из элементов в
сложном веществе, наз. реакциями замещения.
10. Реакции обмена
Реакции, происходящие между сложными веществами, врезультате которых они меняются своими составными частями,
наз. реакциями обмена.
11. По каким признакам можно определить химические реакции?
Выделение газа;Образование осадка;
Появление или изменение запаха;
Изменение цвета.
12. Количественные отношения в химии
13. Количество вещества. Моль. Число Авогадро
• Количество вещества - величина, характеризующая число порцийвещества
• Количество вещества обозначается буквой n
• Единица измерения количества вещества - 1 моль
• 1 моль - такая порция вещества, которая содержит 6,02 * 1023 частиц
вещества
• Это число частиц получило название число Авогадро













 Химия
Химия