Похожие презентации:
9_Скорость химической реакции
1. Понятие о скорости химической реакции. Понятие о гомогенных и гетерогенных реакциях
2. Скорость химической реакции
Скорость химической реакции – это изменение концентрации вещества вединицу времени.
Концентрация показывает какое количество вещества находится в единице
объёма.
Раздел химии, изучающий скорость химической реакции, называется
химической кинетикой.
моль
л с
v — скорость реакции;
с — изменение концентрации
вещества (реагента или продукта);
t — промежуток времени, за
который произошло данное
изменение концентрации.
3. Решите задачи
1. При реакции вещества А в течение 10 минут исчезло 0,02 моль.Найдите среднюю скорость реакции в этот промежуток времени.
2. При реакции A + B → C было получено 1,5 моль продукта C за 5 минут.
Найдите среднюю скорость реакции в этот промежуток времени.
4. Ответ
1. Δс = 0,02 мольΔt = 10 мин = 10 × 60 = 600 сек.
v = 0,02 моль : 600 сек. ≈ 3,33 × 10−5 моль/сек.
2. Δс = 1,5 моль
Δt = 5 мин = 5 × 60 = 300 сек.
v = 1,5 моль : 300 сек. = 0,005 моль/сек.
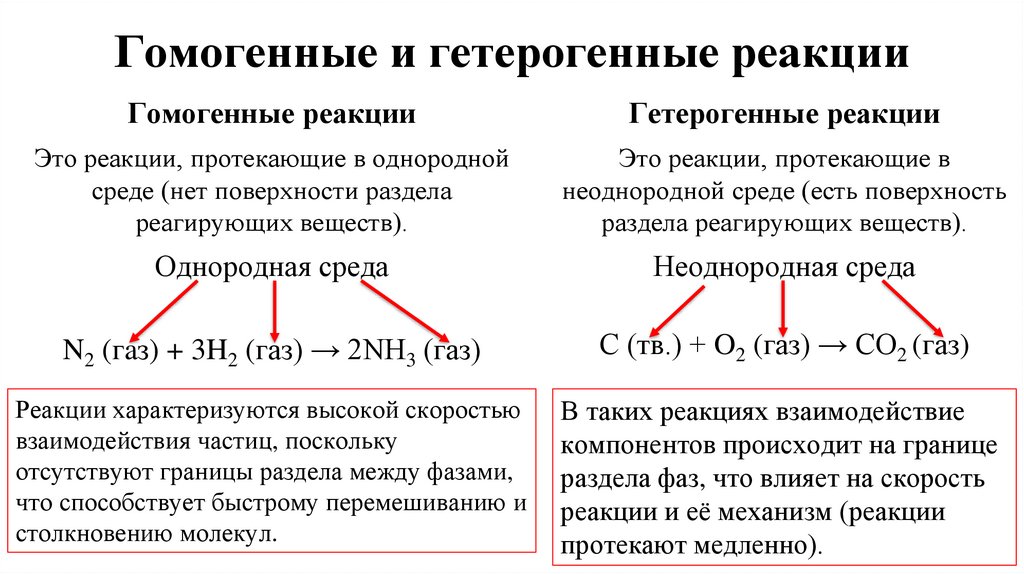
5. Гомогенные и гетерогенные реакции
Гомогенные реакцииГетерогенные реакции
Это реакции, протекающие в однородной
среде (нет поверхности раздела
реагирующих веществ).
Это реакции, протекающие в
неоднородной среде (есть поверхность
раздела реагирующих веществ).
Однородная среда
Неоднородная среда
N2 (гaз) + 3H2 (газ) → 2NH3 (газ)
С (тв.) + O2 (газ) → CO2 (газ)
Реакции характеризуются высокой скоростью
взаимодействия частиц, поскольку
отсутствуют границы раздела между фазами,
что способствует быстрому перемешиванию и
столкновению молекул.
В таких реакциях взаимодействие
компонентов происходит на границе
раздела фаз, что влияет на скорость
реакции и её механизм (реакции
протекают медленно).
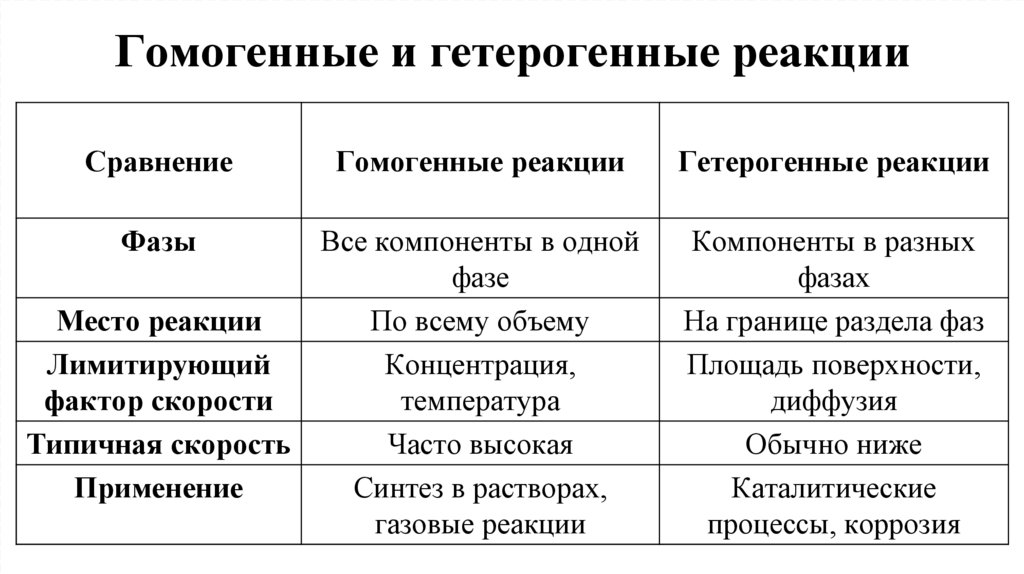
6. Гомогенные и гетерогенные реакции
СравнениеГомогенные реакции
Гетерогенные реакции
Все компоненты в одной
фазе
Место реакции
По всему объему
Лимитирующий
Концентрация,
фактор скорости
температура
Типичная скорость
Часто высокая
Применение
Синтез в растворах,
газовые реакции
Компоненты в разных
фазах
На границе раздела фаз
Площадь поверхности,
диффузия
Обычно ниже
Каталитические
процессы, коррозия
Фазы
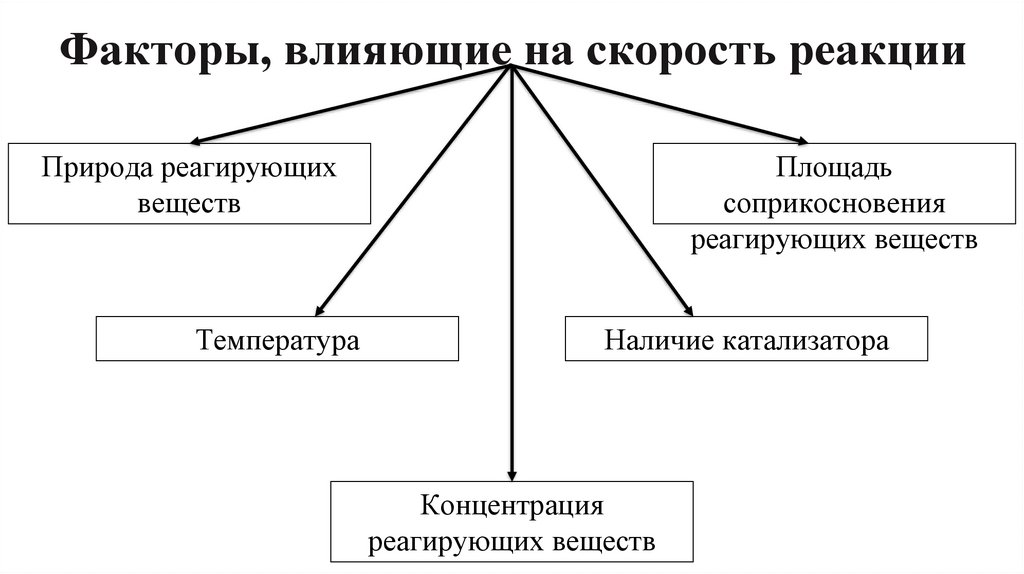
7. Факторы, влияющие на скорость реакции
Природа реагирующихвеществ
Температура
Площадь
соприкосновения
реагирующих веществ
Наличие катализатора
Концентрация
реагирующих веществ
8. Природа реагирующих веществ
Mg + 2HCl = MgCl2 + H2↑Zn + 2HCl = ZnCl2 + H2
Более активный металл
HCl – сильная
кислота
Менее активный металл
CH3COOH –
слабая кислота
Fe + HCl = FeCl2 + H2
Zn + 2CH3COOH = (CH3COO)2Zn + H2↑
Реакция с магнием протекает
быстрее, чем с железом, так как
магний более активный металл, чем
железо.
Реакция с соляной кислотой протекает
быстрее, чем с уксусной кислотой, так как
соляная кислота относится к сильным
кислотам, а уксусная к слабым кислотам.
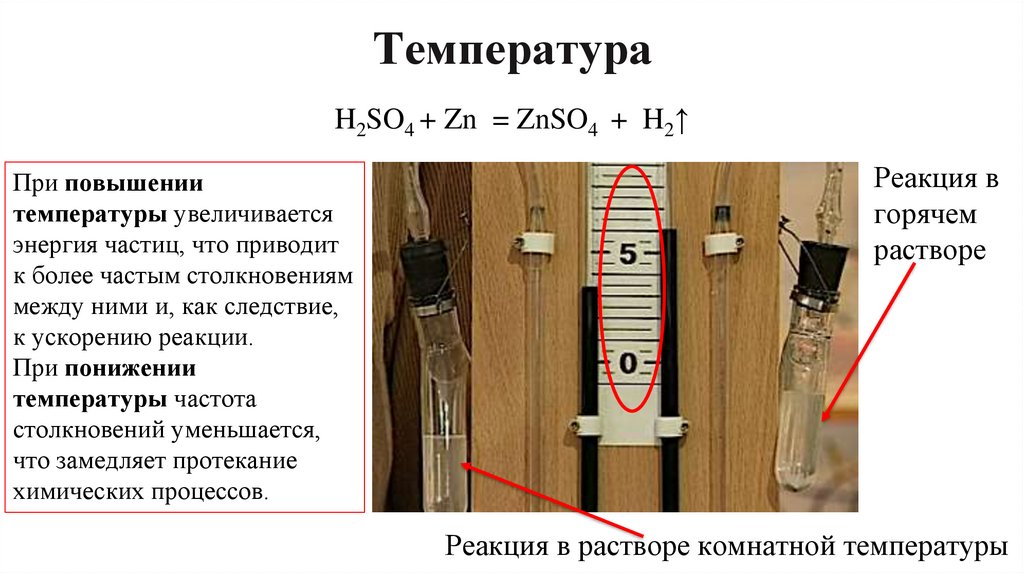
9. Температура
H2SO4 + Zn = ZnSO4 + H2↑При повышении
температуры увеличивается
энергия частиц, что приводит
к более частым столкновениям
между ними и, как следствие,
к ускорению реакции.
При понижении
температуры частота
столкновений уменьшается,
что замедляет протекание
химических процессов.
Реакция в
горячем
растворе
Реакция в растворе комнатной температуры
10. Концентрация реагирующих веществ
H2SO4 + Zn = ZnSO4 + H2↑При увеличении
концентрации реагирующих
веществ скорость реакции
возрастает, так как
повышается вероятность
столкновений между
частицами. Это особенно
заметно в гомогенных
реакциях, где реагенты
равномерно распределены в
одной фазе.
Концентрация
кислоты ниже
Концентрация кислоты выше
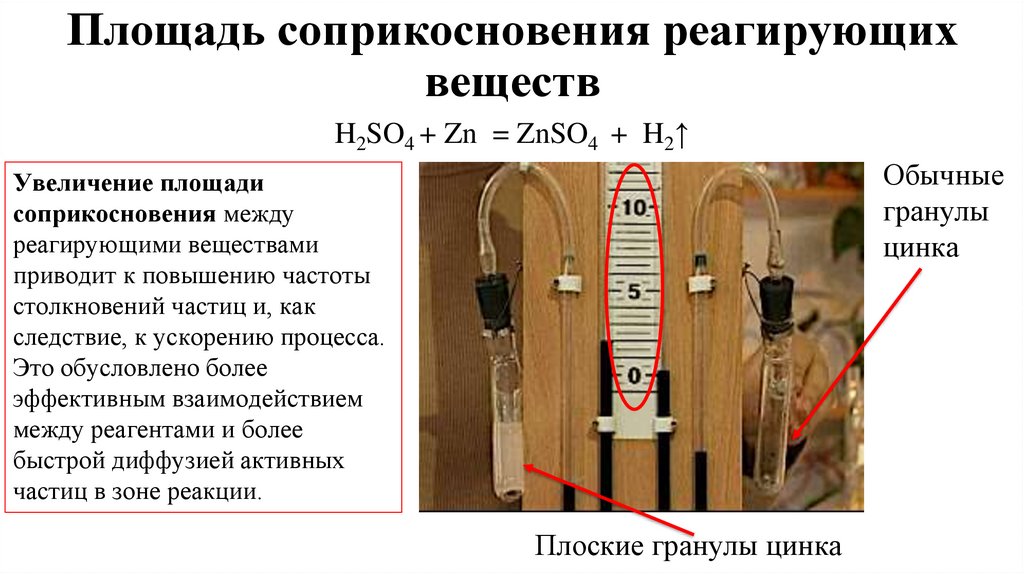
11. Площадь соприкосновения реагирующих веществ
H2SO4 + Zn = ZnSO4 + H2↑Обычные
гранулы
цинка
Увеличение площади
соприкосновения между
реагирующими веществами
приводит к повышению частоты
столкновений частиц и, как
следствие, к ускорению процесса.
Это обусловлено более
эффективным взаимодействием
между реагентами и более
быстрой диффузией активных
частиц в зоне реакции.
Плоские гранулы цинка
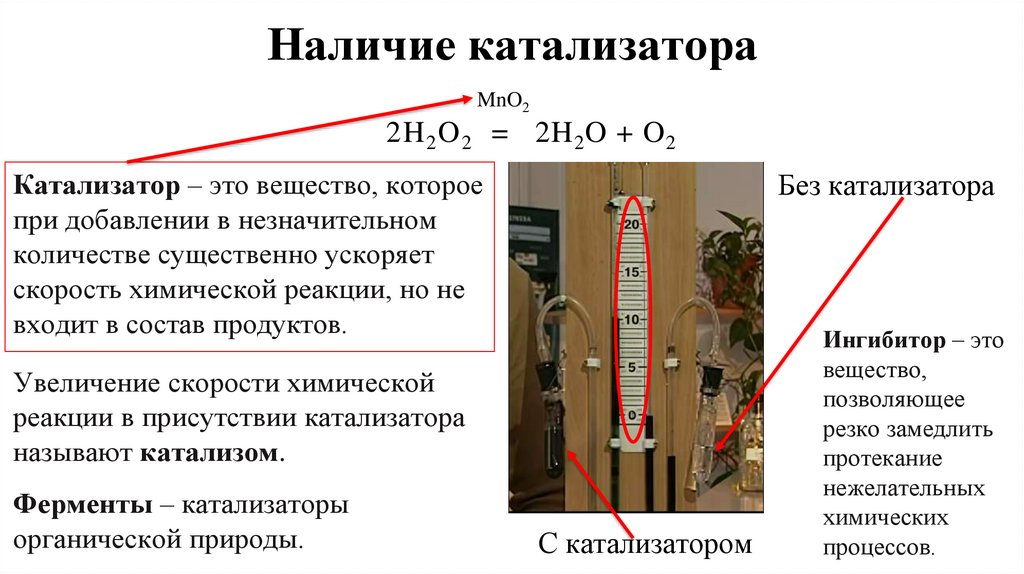
12. Наличие катализатора
MnO22H 2 O 2 = 2H 2O + O 2
Катализатор – это вещество, которое
при добавлении в незначительном
количестве существенно ускоряет
скорость химической реакции, но не
входит в состав продуктов.
Без катализатора
Увеличение скорости химической
реакции в присутствии катализатора
называют катализом.
Ферменты – катализаторы
органической природы.
С катализатором
Ингибитор – это
вещество,
позволяющее
резко замедлить
протекание
нежелательных
химических
процессов.
13. Практическое применение
1. Скорость химической реакции имеетважное значение в промышленности,
например, при производстве пластмасс и
лекарств, где необходимо оптимизировать
условия для повышения эффективности
процессов.
2. Понимание гомогенных и гетерогенных
реакций позволяет разрабатывать новые
катализаторы и улучшать технологические
схемы.
3. Применение этих знаний также важно в
лабораторных исследованиях для контроля и
управления химическими превращениями.
14. Выберите верные варианты ответов
Какие из перечисленных факторов увеличивают скорость химическойреакции?
1. Увеличение температуры
2. Уменьшение концентрации реагентов
3. Увеличение площади соприкосновения реагирующих веществ
4. Использование катализаторов
5. Уменьшение температуры
6. Использование ингибиторов
7. Использование менее активных веществ
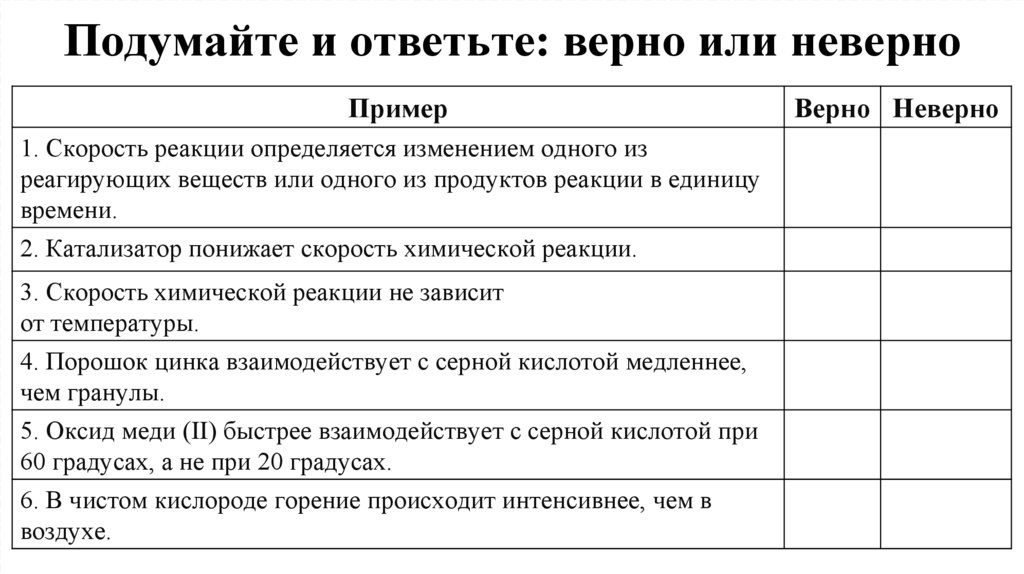
15. Подумайте и ответьте: верно или неверно
Пример1. Скорость реакции определяется изменением одного из
реагирующих веществ или одного из продуктов реакции в единицу
времени.
2. Катализатор понижает скорость химической реакции.
3. Скорость химической реакции не зависит
от температуры.
4. Порошок цинка взаимодействует с серной кислотой медленнее,
чем гранулы.
5. Оксид меди (II) быстрее взаимодействует с серной кислотой при
60 градусах, а не при 20 градусах.
6. В чистом кислороде горение происходит интенсивнее, чем в
воздухе.
Верно Неверно
16. Подумайте и решите задания
1. Объясните, как изменение концентрации реагента влияет на скоростьреакции. Если концентрацию вещества увеличить в 2 раза, что произойдет со
скоростью реакции? Почему?
2. Объясните, почему при приготовлении выпечки тесто нужно нагревать?
Свяжите это с факторами, влияющими на скорость химической реакции.
3. Представьте, что у вас есть раствор реагента, и он реагирует медленно.
Какие меры вы предпримете, чтобы ускорить реакцию? Обоснуйте свой
выбор.









 Химия
Химия








