Похожие презентации:
Презентация по химии 8 класс по теме _Валентность химических элементов_ (1)
1. ВАЛЕНТНОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Урок химии,8 классМБОУ «Лицей
«Бригантина»
ОстермиллерТ.В.
21.10.2019.
2. Цель:
• сформировать понятие валентности• умение определять валентность по
химическим формулам и составлять
химические формулы по валентности.
3. Что показывает химическая формула?
•NH ,H O,HCL,CH4.3
2
• Кем и когда был открыт закон
постоянства состава вещества?
4. Как можно определить формулу сложного вещества?
• Решить …• Используя понятие «…»
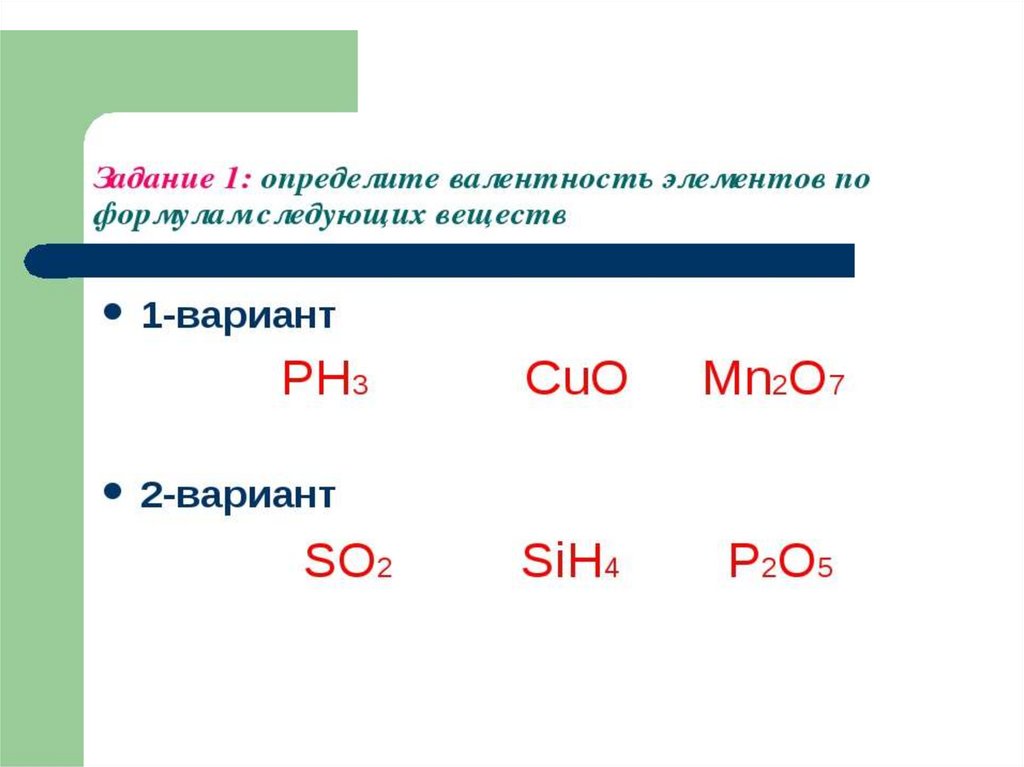
5. РЕШИТЕ ЗАДАЧУ:
*Установите молекулярную формулууглеводорода, если W(С)=82%,а
W(Н)=18%,молекулярная масса
углеводорода составляет 44 а.е.м..
6.
• Валентность – это способностьатомов удерживать при себе
определенное число атомов
других элементов.
7.
• Валентность – способность атомаэлемента образовывать связь с
другими атомами за счёт
электронов, находящихся на
внешнем энергетическом уровне.
8. ИЗ ИСТОРИИ ПОНЯТИЯ «ВАЛЕНТНОСТЬ»
• В начале XIX века Дж. Дальтоном был сформулирован законкратных отношений, из которого следовало, что каждый атом
одного элемента может соединяться с одним, двумя, тремя и
т.д. атомами другого элемента. В середине XIX века, когда были
определены точные относительные веса атомов (И.Я.
Берцелиус и др.), стало ясно, что наибольшее число атомов, с
которыми может соединяться данный атом, не превышает
определённой величины, зависящей от его природы. Эта
способность связывать или замещать определённое число
других атомов и была названа Э.Франклендом в 1853 г.
“валентность”. Поскольку в то время для водорода не были
известны соединения, где он был бы связан более чем с одним
атомом любого другого элемента, атом водорода был выбран в
качестве стандарта, обладающего валентностью, равной 1.
9.
10. Валентность элементов
• Все элементы можно разделить на тригруппы:
• с постоянной валентностью;
• с переменной валентностью;
• с нулевой валентностью.
• Постоянная валентность химических
элементов не меняется:
• у щелочных металлов, фтора (I);
• у щелочноземельных металлов, кислорода (II);
• у алюминия (III).
11. Как определить валентность других элементов?
• Запоминать валентность каждого элементанеобязательно. Достаточно посмотреть в
таблицу Менделеева. В периодической
таблице высшей валентности соответствует
номер группы. Низшую валентность можно
узнать, отняв от восьми номер группы.
12.
13.
14.
15.
16. Упражнение 1.
• Валентность элементов в соединениях скислородом уменьшается в ряду веществ,
формулы которых:
• 1) Cr2O3 → MgO → СаО
2) К2О → ВаО → Cu2O
3) NO2 → NO → N2O
4) CuO → Cu2O → Mn2O7
17. Упражнение 2.
• Валентность элементов в соединениях скислородом увеличивается в ряду веществ,
формулы которых:
• 1) CrO3 → Cr2O3 → CrO
2) N2O3 → NO → N2O
3) СО2 → SiO2 → РbO2;
4) Na2O → MgO → Al2O3
18. Упражнение 3.
• Валентность II сера имеет в каждом из двухвеществ, формулы которых:
• 1) SO2 и SO3
2) Н2S и СS2
3) SCl6 и SCl4
19. Упражнение 4.
• Валентность III азот имеет в каждом издвух веществ, формулы которых:
• 1) NO2 и N2О3
2) NH3 и K3N
3) Са3N2 и N2O
4) NCl3 и N2O5
20. Упражнение 5.
• Составьте формулы соединений азота сметаллами, в которых азот проявляет
валентность III:
• 1) литием
2) кальцием
3) алюминием
21. Упражнение 6.
• Составьте формулы соединений серы сметаллами, в которых сера проявляет
валентность II:
• 1) калием
2) магнием
3) железом (III)
22. Домашнее задание:
• П.16,17.• Составить формулы веществ элементов
• II и III периодов:
• А. с кислородом
• Б. с азотом(III)
• *Почему H-постоянно I-валентен?
• *Почему О-постоянно II-валентен?
• *Почему S-переменно II,IV,VI-валентна?
23. ИТОГИ УРОКА:
• ЧТО Я УЗНАЛ СЕГОДНЯ НА УРОКЕ?• ЧТО Придется УТОЧНИТЬ?
• ЧТО ОСТАЛОСЬ СОВСЕМ НЕПОНЯТНО?





















 Химия
Химия








