Похожие презентации:
9_Производство серной кислоты
1. Химические реакции, лежащие в основе промышленного способа получения серной кислоты.
2. Вспомните!
Задание. Охарактеризуйте физическиесвойства серной кислоты
3. Проверь себя!
Физические свойствасерной кислоты
• Жидкость
• Без цвета
• Хорошо растворима в воде
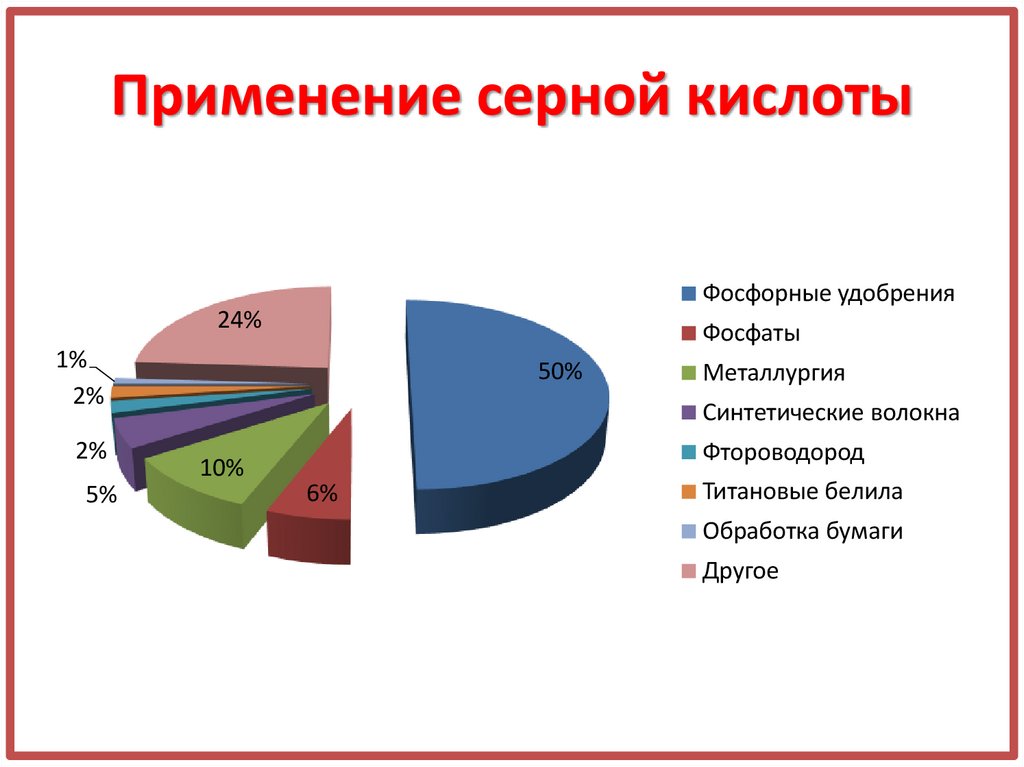
4. Применение серной кислоты
Фосфорные удобрения24%
Фосфаты
1%
2%
2%
5%
50%
Металлургия
Синтетические волокна
10%
Фтороводород
6%
Титановые белила
Обработка бумаги
Другое
5. Производство серной кислоты
Более 300 000 000 тоннежегодно
Чтобы перевезти их
нужен поезд длиной
примерно с экватор
6. Завод по производству серной кислоты
7. Сырьё
Пирит (FeS2)Сера (S)
8. 1 стадия Задание. Закончите уравнения химических реакций. Расставьте коэффициенты
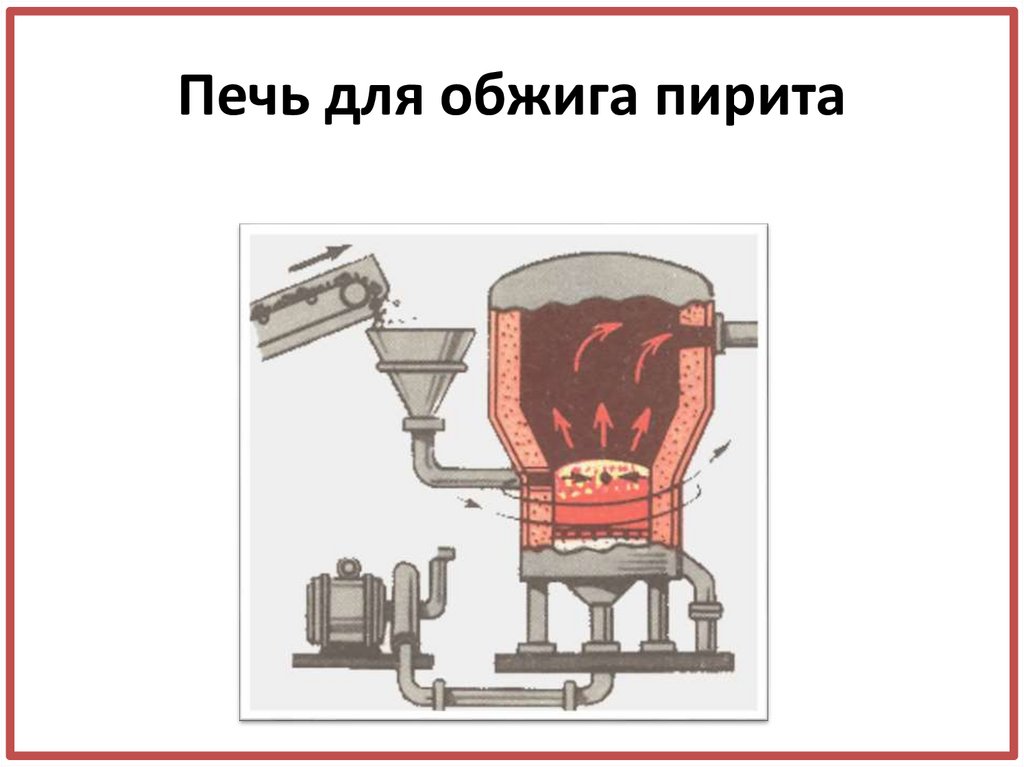
• Обжиг пиритаFeS2 + O2 = …
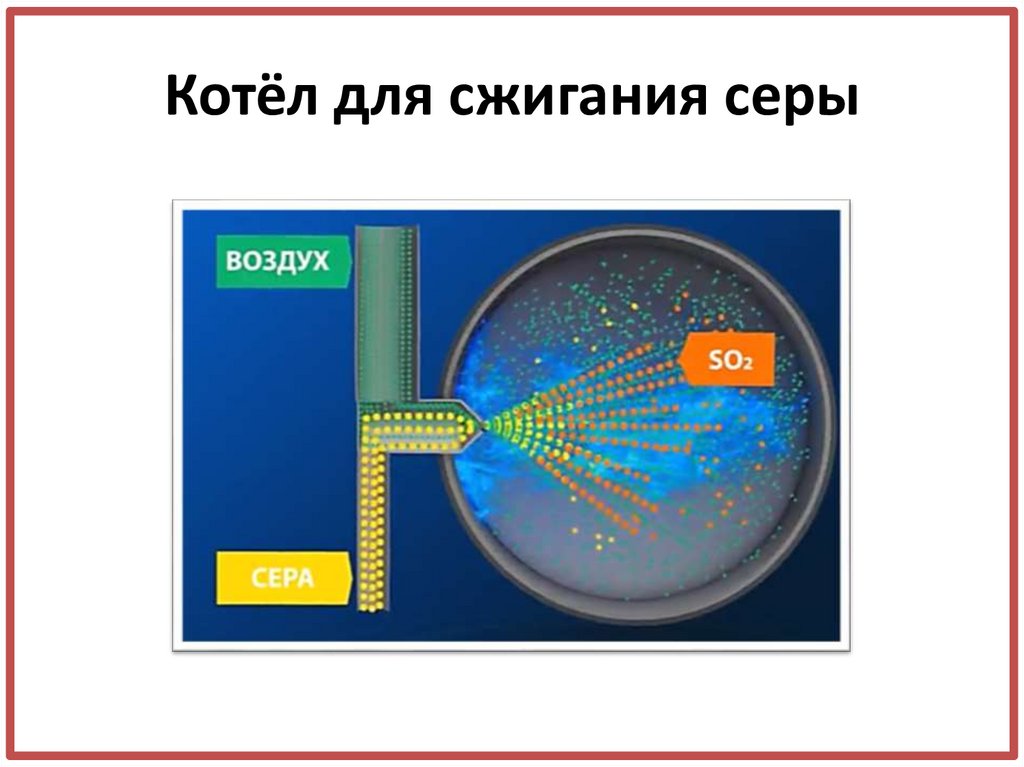
• Сжигание серы
S + O2 = …
9. 1 стадия Проверь себя!
• Обжиг пирита4FeS2 + 11O2 = 2Fe2O3 + 8SO2
• Сжигание серы
S + O2 = SO2
10. Печь для обжига пирита
11. Котёл для сжигания серы
12. 2 стадия Задание. Закончите уравнение химической реакции. Расставьте коэффициенты
Окисление оксида серы (IV) (сернистого газа)SO2 + O2 = …
13. 2 стадия Проверь себя!
Окисление оксида серы (IV) (сернистого газа)2SO2 + O2 = 2SO3
14. Задание. Охарактеризуйте химическую реакцию по всем признакам
2SO2(г) + O2(г)кат
2SO3(г) + 198 кДж
• По числу и составу реагентов и продуктов реакции.
• По обратимости.
• По агрегатному состоянию реагентов и продуктов
реакции.
• По тепловому эффекту.
• По наличию катализатора.
• По изменению степени окисления химических
элементов.
15. Проверь себя!
2SO2(г) + O2(г)кат
2SO3(г) + 198 кДж
1. Реакция соединения
2. Обратимая
3. Гомогенная
4. Экзотермическая
5. Каталитическая
6. Окислительно-восстановительная
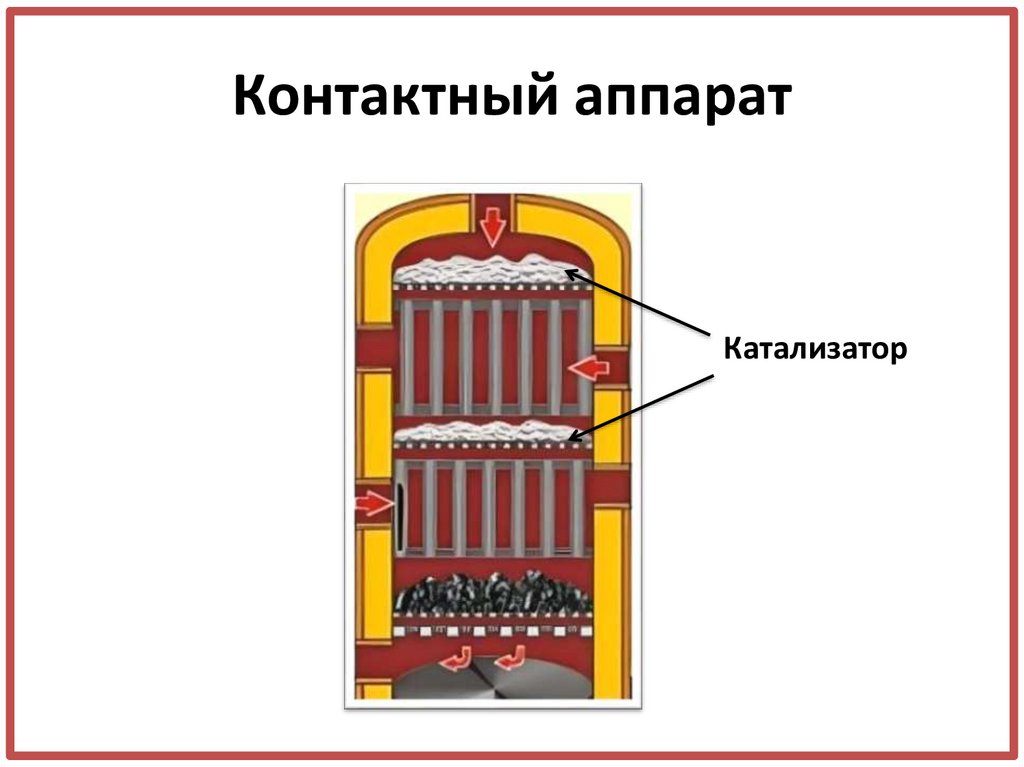
16. Контактный аппарат
Катализатор17. 3 стадия Задание. Составьте уравнение химической реакций.
Взаимодействие оксида серы (VI) с водой18. 3 стадия Проверь себя!
Взаимодействие оксида серы (VI) с водойSO3 + H2O = H2SO4
19. Поглотительная башня
20. Обобщим
1 стадия 4FeS2 + 11O2 = 2Fe2O3 + 8SO2или S + O2 = SO2
2 стадия 2SO2 + O2 = 2SO3
3 стадия SO3 + H2O = H2SO4
21.
Химическое загрязнениеокружающей среды
соединениями серы.
22. Оксид серы (IV) (сернистый газ)
• Попадание в атмосферу SO2связано
с
нарушением
герметичности установок.
• Сернистый газ способствует
повышению
кислотности
клеточного сока растений, что
приводит к физиологическим
нарушениям.
Обесцвечивание хлорофилла
- пожелтение листьев и
возникновение бурой или
красной окраски.
• Также
проявляется
замедлением роста растений.
• Кислотные дожди.
23. Отработанный пирит
Загрязнение атмосферноговоздуха также происходит изза накопления отработанного
пирита.
Над ним периодически
превышается
предельнодопустимая
концентрации
сернистого
газа
и
хлороводорода.
24.
Способы защиты• Специальные
очистные
установки для улавливания
отходящих газов.
• Применение технологических
схем, снижающих загрязнение
атмосферы:
• непрерывность процесса,
• циркуляционные
процессы,
• принцип противотока,
• комплексное
использование сырья и
другие.




















 Химия
Химия








