Похожие презентации:
Занятия №16 Гидролиз СОЛЕЙ +
1. Гидролиз СОЛИ
Гидролиз солей - это химическоевзаимодействие ионов соли с ионами
воды, приводящее к образованию слабого
электролита.
(от греческих слов: «гидро» - вода и «лизис» разложение).
С точки зрения гидролиза, все соли – продукты
взаимодействия кислот и оснований.
2. При гидролизе солей молекулы воды диссоциируют на ионы: Н2О = Н++ОН-
При гидролизе солей молекулыводы диссоциируют на ионы:
+
Н2О = Н +ОН
ОН - щелочная среда;
Н+ - кислая среда
Гидролиз – обратимая реакция,
которая сводится к взаимодействию иона слабого
электролита соли
с ионами воды (H+ или OH-).
3. Чтобы определить, будет ли соль гидролизоваться, необходимо знать
Кислотные остатки сильных кислот:2NO , SO , l , Cl , Br , ClO
3
4
4
щелочные и щелочноземельные металлы:
Li, K, Na, Rb, Ca, Ba, Sr, Cs, Fr, Ra
Все остальные кислоты и основания являются
слабыми.
4. Соли образованы катионами металлов+ и кислотными остатками-
Соли образованы катионами металлов+и кислотными остаткамиЩелочные или
щелочноземельные
металлы
Металлы нерастворимых
оснований,
(не щелочные, не
щелочноземельные)
Кислотные
остатки сильных
кислот
Нет гидролиза
1 тип:
3 тип:
Кислотные
остатки слабых
кислот
2 тип:
4 тип: нет гидролиза у
нерастворимых солей
5. Соли образованы катионами металлов+ и кислотными остатками-
Соли образованы катионами металлов+и кислотными остаткамиЩелочные или
щелочноземельные
металлы
Кислотные
остатки
сильных
кислот
Кислотные
остатки
слабых кислот
Металлы нерастворимых
оснований
1 тип: NaCl, NaI,
3 тип: AlCl3,
BaCl2, KNO3, KClO4 Cu(ClO4)2, Cr2(SO4)3,
Нет гидролиза
Pb(NO3)2
2 тип: K2CO3,
Na2SO3, Li2S,
4 тип: Cr2S3,
Cu3(РО4)2, FeCO3
6.
… - 1 тип солей, гидролиза нет7.
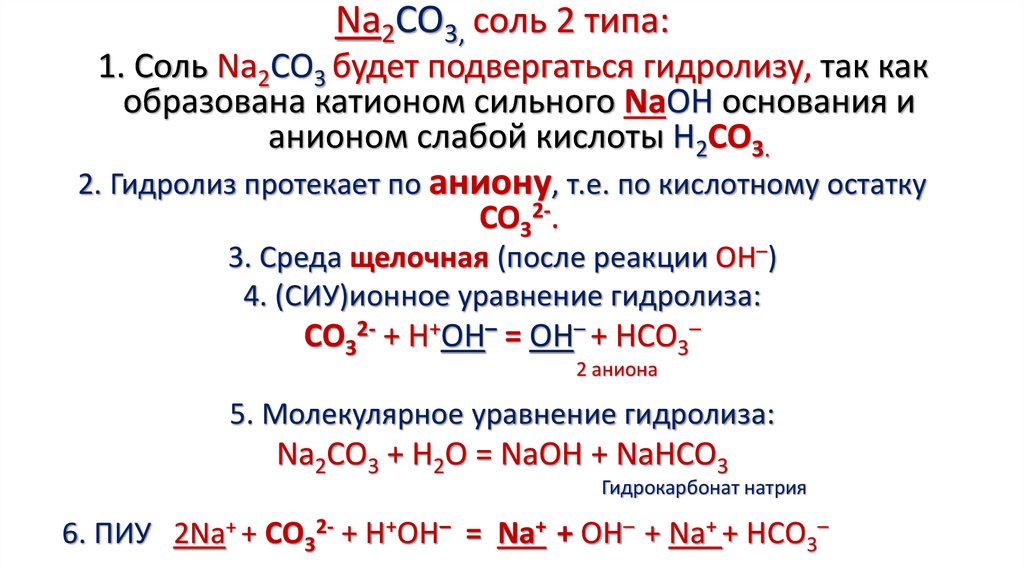
Na2CO3, соль 2 типа:1. Соль Na2CO3 будет подвергаться гидролизу, так как
образована катионом сильного NaOH основания и
анионом слабой кислоты H2CO3.
2. Гидролиз протекает по аниону, т.е. по кислотному остатку
CO32-.
3. Среда щелочная (после реакции OH–)
4. (СИУ)ионное уравнение гидролиза:
CO32- + H+OH– = OH– + HCO3–
2 аниона
5. Молекулярное уравнение гидролиза:
Na2CO3 + H2O = NaOH + NaHCO3
Гидрокарбонат натрия
6. ПИУ 2Na+ + CO32- + H+OH– = Na+ + OH– + Na+ + HCO3–
8. AlCl3, соль 3 типа:
1. Соль AlCl3 будет подвергаться гидролизу, так как образованакатионом слабого основания Al(OH)3 и анионом сильной
кислоты HCl.
2. Гидролиз протекает по катиону, т.е. металлу Аl3+
3. Среда кислая (после реакции H+).
4. (СИУ) ионное уравнение гидролиза:
Al3+ + H+OH– = H+ + AlOH2+
5. Молекулярное уравнение гидролиза:
AlCl3 + H2O = HCl + AlOHCl2
Гидроксохлорид алюминия
6. ПИУ Al3+ +3Cl- + H+OH– = H++Cl- + AlOH2+ +2Cl-
9.
МУ молекулярное уравнениеПИУ полное ионное уравнение
СИУ сокращенное ионное уравнение
10. Гидролиз по слабому иону
(СОЛЬ) 2 тип солей:1. Гидролиз есть
2. Гидролиз по аниону …..(кислотному остатку);
3. Среда щелочная, после реакции ОН ;
4. СИУ (без металла);
5. МУ - (добавляем Ме+ ко всем ионам), после
реакции = щелочь + кислая соль.
6. ПИУ
11.
(СОЛЬ) - 3 тип солей:1. Гидролиз есть
2. Гидролиз по катиону ….. (Ме+);
3. Среда кислая, после реакции Н+;
4. СИУ (без кислотного остатка);
5. МУ- (добавляем кислотный остаток ко всем
ионам), после реакции - кислота + основная
соль;
6. ПИУ
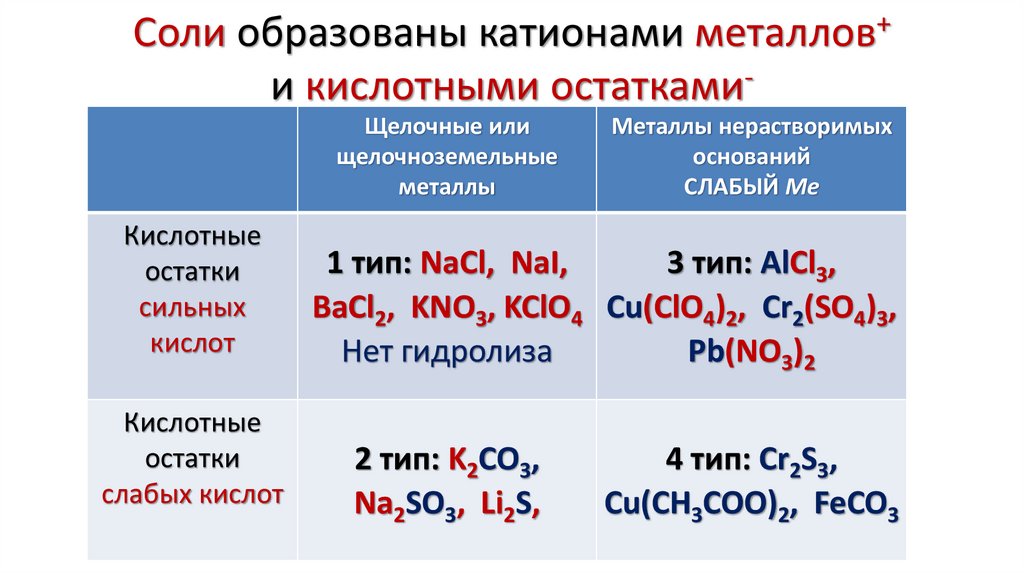
12. Соли образованы катионами металлов+ и кислотными остатками-
Соли образованы катионами металлов+и кислотными остаткамиЩелочные или
щелочноземельные
металлы
Кислотные
остатки
сильных
кислот
Кислотные
остатки
слабых кислот
Металлы нерастворимых
оснований
СЛАБЫЙ Ме
1 тип: NaCl, NaI,
3 тип: AlCl3,
BaCl2, KNO3, KClO4 Cu(ClO4)2, Cr2(SO4)3,
Нет гидролиза
Pb(NO3)2
2 тип: K2CO3,
Na2SO3, Li2S,
4 тип: Cr2S3,
Cu(CH3COO)2, FeCO3
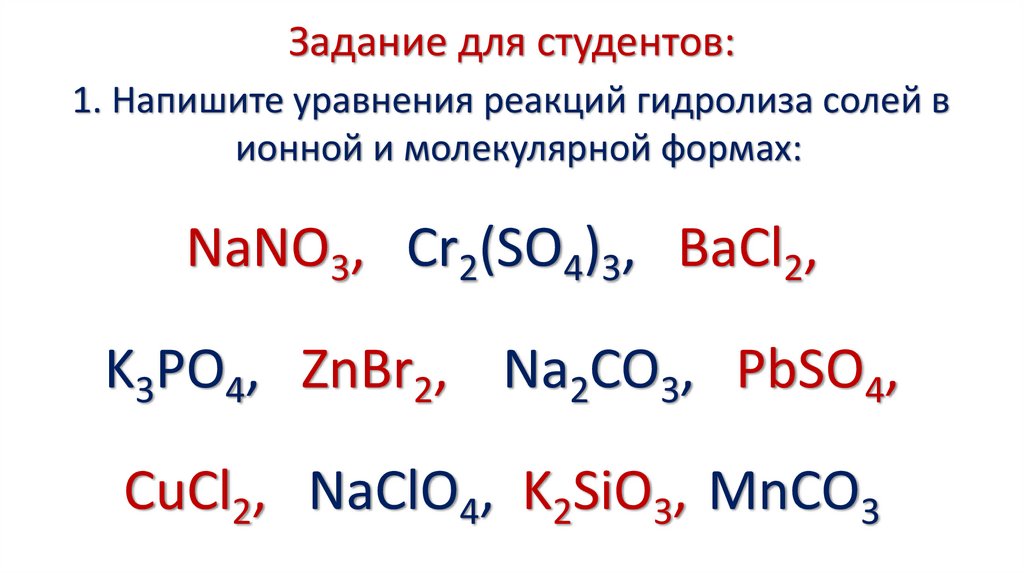
13. Задание для студентов:
1. Напишите уравнения реакций гидролиза солей вионной и молекулярной формах:
NaNO3, Cr2(SO4)3, BaCl2,
K3PO4, ZnBr2, Na2CO3, PbSO4,
CuCl2, NaClO4, K2SiO3, МnCO3











 Химия
Химия








