Похожие презентации:
Химиялық байланыс
1. ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ ҚАРАҒАНДЫ МЕМЛЕКЕТТІК ТЕХНИКАЛЫҚ УНИВЕРСИТЕТІ «Химия» пәні дәріс тақырыбы:
Химиялық байланыс табиғаты. Молекула құрылысы жәнетүзілуі. Валенттік байланыс және молекулалық орбиталь
әдістері. Орбитальдардың гибридтелуі
ҚАРАҒАНДЫ 2019
2.
Дәрістің мақсаты: Студенттерді заттардыңәрекеттесу
табиғатымен,
химиялық
байланыстың түрлерімен және олардың түзілуі
мен құрамына, құрылысына
әсерімен
таныстыру.
Химиялық байланыс — атомдардың
химиялық қосылыс түзіп әрекеттесуі.
XIX-XX ғғ. К. Бертолле, Й.Я. Берцеллиус,
А.Н. Бутлеров, В. Коссель, А.Н. Бутлеров, Г.
Льюис
химиялық
байланыс
түзілуінің
гравитациялық, электрхимиялық теорияларын,
заттардың
химиялық
құрылыс
теориясы
мен электрондық теорияларын ұсынды
3.
1916 жылы неміс ғалымы В.Коссельатомдар
мен
молекулалардың
электрстатикалық теориясын құрды:
Инертті газдардың атомдарында екі
немесе сегіз электронды тұрақты сыртқы
қабаты болады;
Басқа элементтердің атомдарында екіден
немесе сегізден аз электронды қабаты болады.
Олардың электрондық қабаттары (қауыздары)
тұрақсыздау;
Молекулалардың түзілуі бір элементтің
(металдың) атомынан белгілі бір сандағы
электрондарды
басқа
элементтің
(бейметалдың) атомына беруі салдарынан іске
асады.
4.
Бұл кезде металл атомы оң зарядты, албейметалл - теріс зарядты қабылдайды.
Олардың
арасындағы
қосылыс
электрстатuкалық
тартылу
күштерімен
байланысты. В.Коссель идеясы байланыстың иондық
теориясын жасауға негізгі тірек болды.
1916 жылы американдық ғалым
Г.Льюис
«Молекулалардағы тұрақты сыртқы электрондық
конфигурациялардың пайда болуы екі атом арасында
ортақ, ол екеуіне де бірдей жалпыланған
электрондардың түзілуінен болуы мүмкін» деген
болжам жасады. Яғни, электрондық жұпқа әрбір
атом өзінің сыртқы электрондық қабатынан бір
электроннан береді» деді. Бұл байланысты
ковалентті деп атады.
5.
Химиялық байланыс түзілуіне қарайтөртке бөлінеді:
Иондық химиялық байланыс;
Ковалентті химиялық байланыс;
Металдық химиялық байланыс;
Сутектік химиялық байланыс
6. ИОНДЫҚ ХИМИЯЛЫҚ БАЙЛАНЫС
Иондық химиялық байланыс металл менбейметалл атомдары арасында түзіледі. Химиялық
әрекеттескенде
металл
атомдары
валенттік
электрондарын
беріп,
оң
зарядты
иондарға
(катиондарға): К - ē К+; ал бейметалл атомдары
электрондарды қосып алып, теріс зарядты иондарға
(аниондарға) айналады: Cl + ē Cl־. Иондық
химиялық байланыс қарама-қарсы зарядталған
иондардың электрстатикалық тартылысы нәтижесінде
жүзеге асады: K+ + Cl- = KCl. Иондар түзілу арқылы
жүзеге асатын байланыстарды иондық байланыс
деп атайды. Иондық қосылыстардың қайнау, балқу
температуралары жоғары, қызуға тұрақты болады;
ерітінділері электр тогын жақсы өткізеді.
7. КОВАЛЕНТТІК ХИМИЯЛЫҚ БАЙЛАНЫС
Жалпы (екеуіне ортақ) электрондықжұптар арқылы іске асатын химиялық
байланысты коваленттік байланыс деп атайды.
Электртерістіктері бірдей атомдардың
арасындағы байланыс ковалентті полюссіз
байланыс деп аталады.
Әрекеттесуші
атомдардың
арасында
электртерістігі басым элемент атомына қарай
ығыса орналасқан байланыс ковалентті полюсті
байланыс деп аталады.
8.
Электртерістіктері бірдей элемент атомдарының арасында(Н2, О2, N2, F2, СІ2, Br2, J2, РНз, CS2 және т.б.) ковалентті
полюссіз байланыс түзіледі (Н:Н, :О::О:, :N:::N:).
Коваленттік полюсті байланыста байланыстырушы
электрон жұбының бұлты электртерістігі басым элемент
атомына қарай ығыса орналасады.
9.
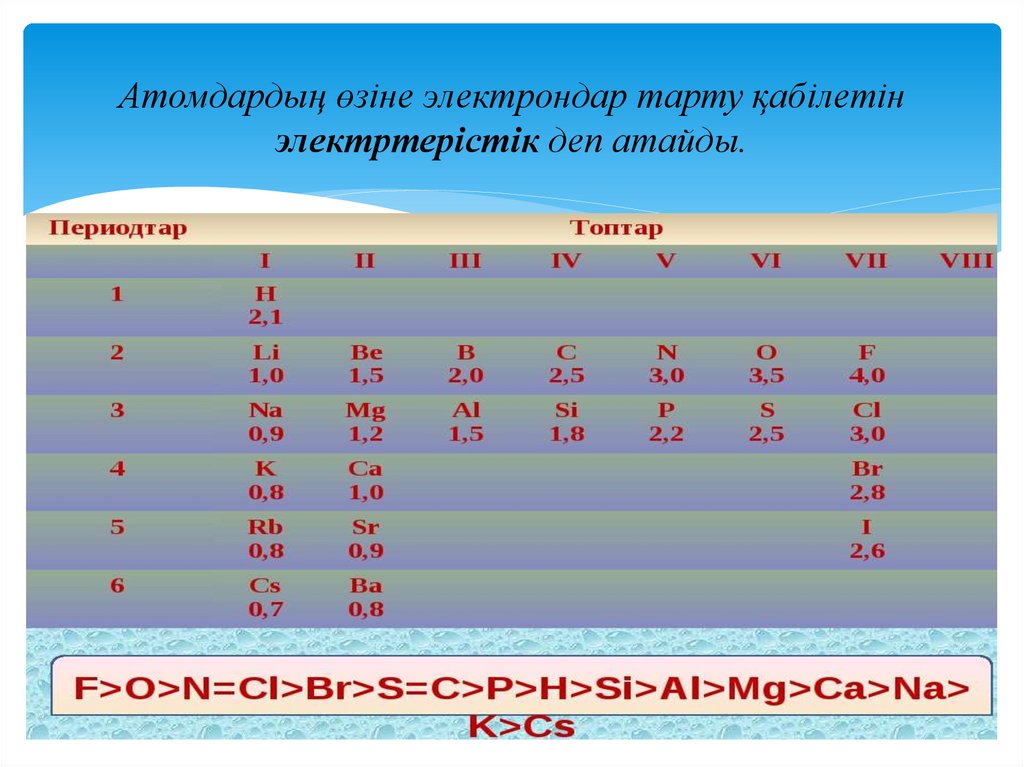
Атомдардың өзіне электрондар тарту қабілетінэлектртерістік деп атайды.
10. МЕТАЛДЫҚ ЖӘНЕ СУТЕКТІК БАЙЛАНЫС
Металлиондары
мен
электрондар
арасында түзілетін байланысты металдық
байланыс деп атайды .
Сутектік байланыс сутек атомы мен
электртерістігі күшті, бөлінбеген электрон
жұбы бар (көбіне F, О, N, кейде CI, S) атомдар
арасында түзіледі.
11.
Ковалентті байланыстың табиғатын түсіндіруүшін химиялық байланыстың екі түрлі теориясы
кеңінен қолданылады: валенттік байланыс теориясы
(ВБТ) және молекулалық орбитальдар теориясы
(МОТ).
МОТ негізгі қағидасы:
1. Молекула өзінің дербестілігін сақтайтын атомдардың
жиынтығы ретінде емес, ол ядро мен электрондардың біріккен
жүйесі ретінде қарастырылады;
2. Молекулалардағы электрондар молекулалық орбитальдар
бойынша таралады, олар атомдық орбитальдар (АО) сияқты
белгілі энергиямен және түрпішінімен сипатталады;
3. Молекулалық орбитальдар екі- немесе көпцентрлік болады.
12.
ВБТ негізгі қағидалары:1.Ортақ электрондық жұптар екі атомды байланыстырады, олар
екі атомның электрон бұлттарының бүркесуі нәтижесінде
түзіледі және атомдардың ядро аралығында шоғырланады;
2. Тек жалқы электрондар ғана жұптасады;
3.Жалқы электрондар арасындағы байланыс тек спиндер қарамақарсы жаққа бағытталғанда ғана түзіледі;
4.Ядро аралығында электрон тығыздығының концентрациясы
өскенде байланыс түзіледі;
5.Түзілген байланыс – екі орталықты байланысқа жатады,
электрон жұптары молекулаға ортақ энергетикалық деңгейде
орналасады;
6. Жалпы жұп электрондар – химиялық байланыстың бірлігі,
берілген атомның басқа атомдармен ортақ электрон жұптарының
саны валенттік байланыстың санын анықтайды
13. ОРБИТАЛЬДАРДЫҢ ГИБРИДТЕЛУІ
Атом басқа атомдармен химиялық байланысқа түсу үшінөзінің s, p, d, f АО-дарын өзара араластырып, жаңа sp, pd және
т.б. орбитальдар құрса, ондай АО гибридті орбиталь деп
аталады.
sp - гибридтелу – BeH2, BeCl2 …
sp2 – гибридтелу – BF3, BCl3, AlF3 …
sp3 – гибридтелу - CH4, CCl4 …
Гибридтелу
дегеніміз
әр
түрлі
атомдық
орбитальдардың араласып, энергиялық жағынан тиімді біркелкі
АО-дың түзілуі.
14.
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ:1.Патсаев Ә.Қ., Жайлау С.Ж., Махатов Б.Қ., Мамытова В.К.
Бейорганикалық химия, оқулық, Шымкент 2008ж.
2. Патсаев Ә.Қ., Мамытова В.К., Серимбетова К.М., Бухарбаева
А.Е. «Бейорганикалық химия пәнінен практикум» оқу әдістемелік құрал, Шымкент, 2012ж.
3. Пірәлиев С.Ж., Жайлау С.Ж., Бутин Б.М. Жалпы химия.
Алматы І-ІІ-ІІІ , 2003ж.
4. Бірімжанов Б.А., Жалпы химия. –Алматы, 2001ж.
5. Аханбаев К.А. Химия негіздері, Алматы, 1998ж.












 Химия
Химия








