Похожие презентации:
термодин.заңы 2020
1. ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ ҚАРАҒАНДЫ ТЕХНИКАЛЫҚ УНИВЕРСИТЕТІ «Химия» пәні дәріс тақырыбы:
ТЕРМОДИНАМИКА ЗАҢДАРЫдайындағандар:
аға оқытушы Қайырбаева М.Ж.
аға оқытушы Жорабек А.А.
ҚАРАҒАНДЫ 2020
2. Дәрісіміздің мақсаты
Термодинамика туралы негізгі ұғымдар ментүсініктермен танысу
Жүйедегі процесстерді сипаттайтын
функциялар: Энтальпия, Энтропия, Ішкі
энергия, Гиббстің еркін энергиясы туралы
білу және есептер шығарып үйрену.
3.
ДӘРІС ЖОСПАРЫ:1.Негізгі ұғымдар
2.Термодинамиканыі 1ші – заңы
3.Энтальпия,энтропия
4.Термодинамиканың 2-ші – заңы
5.Термодинамиканың 3-ші заңы
6.Жүйедегі процесстерді сипаттайтын функциялар:
Энтальпия, Энтропия, Ішкі энергия, Гиббстің еркін
энергиясы.
4. Негізгі түсініктер
Термодинамика – термо грекше – жылу,температура, динамика – күш, жұмыс,
қозғалыс деп аталады.
ТЕРМОДИНАМИКА
ФИЗИКАЛЫҚ
ХИМИЯЛЫҚ
ТЕХНИКАЛЫҚ
5. Термодинамика және жүйе
Жүйе – кеңістікте белгілі көлемді алыпжататын және қоршаған ортадан ойша
немесе іс жүзінде оқшауланған зат
немесе заттар жиынтығы.
ЖҮЙЕ
ОҚШАУЛАНҒАН
АШЫҚ
ЖАБЫҚ
6. Жүйедегі процесстерді сипаттайтын параметрлер
Н - ЭНТАЛЬПИЯS - ЭНТРОПИЯ
U – ІШКІ ЭНЕРГИЯ
G – ГИББСТІҢ ЕРКІН
ЭНЕРГИЯСЫ
7.
Термодинамика – әр түрлі энергия формаларының бірбіріне айналуы жәнеосы түрленудің заңдары туралы
ғылым. Жүйе күйі – ол жүйенің параметрлік жинағы. (Р, V, Т,
С)
1. Жүйенің стандартты күйі – стандартты жағдайда алынған
параметрлер:
Т0=273+25=298К;
P0=1атм= 101,3кПа
Газ заңдарына қарағанда Т0 өзгереді, Р0 өзгерген жоқ.
2. Кейбір параметрлерді соnst (тұрақты) ретінде алуға болады.
Химиялық термодинамикада энергияның өзгеруін
А) Р = соnst изобара; Б) V = соnst изохора; В) Т = соnst изотерма;
Г) Q = соnst адиабаталық; жүйеде зерттейді.
Жүйенің толық энергиясы туралы түсінік мына теңдеуде
көрсетілген: Е = К + П + U, мұнда
К - кинетикалық энергия;
П - потенциалдық энергия; U - ішкі энергия.
8.
Термодинамикалық жүйедегі тыныштық күйде (К=0),жүйеге сыртқы жағдайдың әсері аз (П=0),
сондықтан: Е = U, мұндағы:
E – толық энергия;
U ішкі энергия.
Жүйенің ішкі энергиясының абсолюттік мәнін есептеу
мүмкін емес, сондықтан алғашқы және соңғы ішкі энергиялар
айырмасымен сипаттайды, яғни ∆U=U2-U1, мұндағы: U1 –
жүйенің алғашқы күйіндегі ішкі энергия; U2 – жүйенің соңғы
күйіндегі ішкі энергия.
Термодинамиканың бірінші заңы:
Жүйеге берілген жылу мөлшері оның ішкі
энергиясының өзгеруіне және жүйенің сыртқы денелермен
атқаратын жұмысына жұмсалады:
Q=∆U+A
мұндағы:
Q – жылу (энергия);
∆U - ішкі энергияның өзгеруі;
А – сыртқы дененің атқарған жұмысы.
9. Изохоралық процесс
Егер процесс тұрақты көлемде іске асса(V=const) онда жүйеде ешқандай жұмыс
істелмейді (А=0), жүйеге берілетін жылу
ішкі
энергия
өзгерісіне
тең:
Qv = ∆U, мұндағы Qv - тұрақты көлемдегі
жылу; ∆U - жүйенің ішкі энергия өзгерісі.
Бұл процесс изохоралық процесс деп
аталады.
10.
11. Изобаралық процесс
Изобаралық үрдісте (р = const): Егер жүйежылуды тұрақты қысымда сіңірсе, онда
жүйеде энтальпия артады.
∆U=Qр-А,
∆U+А=∆H
болғандықтан,
Qр=∆H, мұндағы: Qр - тұрақты қысымдағы
жылу; ∆H - энтальпия.
- Жылу эффектісінің шамасы энтальпия
өзгерісіне тең. Qр=∆H
12. Изобаралық процесс
13. Изотермиялық процесс
Егер процесс тұрақты температурадажүзеге асса T = const, онда жүйенің ішкі
энергиясы өзгермейді ∆U = 0, олай болса
QТ = A. Процесс изотермиялық деп аталады.
14. Термохимиялық теңдеулер
Термодинамиканың 1-ші заңын пайдалана отырыптермохимиялық теңдеулерді жазуға болады.
Термохимиялық теңдеулер деп – заттардың
химиялық формулаларымен қоса, заттардың жылу
эффектілері көрсетілген химиялық теідеулерді
айтады.
Термохимиялық теңдеулерде реакцияға қатысушы
реагенттер мен өнімдердің агрегаттық күйі
сіңірілген немесе бөлініп шығатын жылу мөлшері
көрсетіліп жазылады.
15. Жылу эффектісі
Термохимиялық реакцияның жылуэффектісі
Химиялық реакцияның
теңдеуіне кіреді:
Термодинамикалық реакцияның жылу
эффектісі
химиялық реакцияның
теңдеуінен кейін бөлек жазылады:
16. Гесс заңы
Орыс химигі-Петербург ғылымиакадеиясының академигі.
Термодинамиканың 1-ші заңына
сүйеніп 1840 жылы орыс
ғалымы Г.И. Гесс тұрақты
қысым мен көлемде көптеген
химиялық реакциялардың жылу
эффектілерін анықтады.
Нәтижесінде өз заңын
07.08.1802 – 12.12.1850
тұжырымдады.
17. Гесс заңы
Тұрақты қысым мен көлемде жүретін реакциялардыңжылу эффектісі оның жүру жолына тәуелсіз, тек жүйенің
бастапқы және соңғы күйіне ғана тәуелді болады.
Гесс заңын былай да тұжырымдауға болады:
Химиялық реакция тікелей жүрсін не бірнеше сатыда
өтсін, бәрібір оған сай жылудың мөлшері тұрақты.
Термохимиялық белгілер термодинамикаға қарағанда
өзгешелеу. Реакция барысында жылу шығарылса жылу
эффектісінің мәні оң болады және экзотермиялық деп
аталады, ал сіңірілсе эндотермиялық деп аталады және
жылу эффектісінің мәні теріс деп саналады.
18. Гесс заңының салдары
Гесс заңының маңызды екі салдары бар:1 салдары: Химиялық реакцияның жылу
эффектісі
реакция
өнімдерінің
түзілу
жылуларының
қосындысынан
бастапқы
реагенттердің
түзілу
жылуларының
қосындысын алып тастағандағы айырымға тең:
Түзілген жылуы 1 моль күрделі зат түзілгенде
бөлінетін не сіңірілетін жылу мөлшері.
19. Гесс заңының салдары
мұндағы: ∆H 0 - жүйе энтальпиясы өзгеруі; ∑∆H 0 өнімдер -өнімдерэнтальпиясының қосындысы; ∑∆H 0реагенттер - реагенттер энтальпиясының
қосындысы.
20.
Реакцияның жылу эффектісі – химиялық реакцияның нәтижесінде бөлінетінжәне сіңірілетін жылу мөлшері. Бұл (Р,Т=const) немесе U (V,T = const)
болуы мүмкін.
Егер реакцияның нәтижесінде жылу бөлініп жүйеде энтальпия кем болса,
( Н 0), экзотермиялық процесс деп аталады.
Реакция жылу сіңіре жүрсе, сондай-ақ, жүйеде энтальпия өсуі болса ( Н 0),
онда ол эндотермиялық процесс деп аталады.
Басқа да күй функциясы сияқты, энтальпия заттың мөлшеріне байланысты,
сондықтан оның шамасын ( Н) әдетте заттың 1 моліне шағып есептейді және
өлшемі кДж/моль болады. Әдетте жүйенің функциясын стандартты жағдайда
анықтайды, мұнда параметрдің стандартты жағдайынан басқа, стандартты
температура T = 298,15 К (25C) кіреді. Температураны төменгі индекс түрінде
көрсетеді .
Реакцияның термохимиялық теңдеуі – жылу эффектісін, заттың реакциялық
жағдайы мен агрегаттық күйін көрсететін теңдеу. Әдетте жылу эффектісі
ретінде реакция энтальпиясын көрсетеді.
21.
C(графит) + O2 (газ) = CO2 (газ) ,Н0298 = 396 кДж.
Жылу эффектісін реакция теңдеуінде жазуға болады:
C(графит) + O2 (газ) = CO2 (газ) + 396 кДж
Термохимиялық теңдеудің басты ерекшеліктері:
1) Жылу эффектісі реакциядағы заттар массасына байланысты, сондықтан ол
әдетте бір мольге есептеледі. Сол себепті, термохимиялық теңдеуде бөлшектік
коэффициенттер қолдануға болады. Мысалы, бір моль хлорлы сутек
түзілуінің термохимиялық теңдеуі былай жазылады:
½H2 + ½Cl2 = HCl,
H0298 = 92 кДж
немесе Н2 + Cl2 = 2HСl, H0298 = 184 кДж.
2) Жылу эффектісі реагенттің агрегаттық күйіне байланысты; ол
термохимиялық теңдеудің индексін көрсетеді: с – сұйық, г – газ тәріздес, қ –
қатты, к -–кристалдық, е – ерітілген.
Мысалы :
H2 + ½ O2 = H2О(с), Н0298 = -285,8 кДж.
H2 + ½ О2 = H2О(г) , Н0298 = 241,8 кДж.
3) Термохимиялық теңдеулермен алгебралық әрекеттер жасауға болады .
Термохимиялық теңдеулер реакцияда жүретін өзгерістерді әдеттегі теңдеуден
толығырақ көрсетеді – олар тек реагент пен өнімнің сапалық және сандық
құрамын ғана көрсетпейді, сонымен қатар, берілген реакциядағы энергияның
сандық өзгеруімен жүреді.
22.
Термодинамиканың ІІ заңы үрдістің өздігімен жүрумүмкіндігін қарастырады:
Энергетикалық қоры өзгермей өз бетімен жүретін
үрдістер тек энтропияның ұлғаю бағытына қарай жүреді
(∆S).
∆S0298 -энтропия жүйедегі ретсіздік өлшемін көрсететін функция
(Дж\моль К).
Бұл заңға жаңа термодинамикалық функция енгіземіз –
еркін Гиббс энергиясы, өлшем бірлігі кДж, ол үрдістің бағытын
білдіреді.
Табиғаттағы барлық үрдістер энтальпияның азаюымен
және энтропияның өсуімен жүреді.
∆Q0298 =∆H0-T∆S0, мұндағы ∆H
энергия қоры,
энтальпиялық фактор; ∆S -ретсіздік, энтропиялық фактор.
23.
Процесстердің өздігінен жүру жарты ретіндеекі факторды да (энатльпия және энтропия)
әсерін ескеретін жүйе күйінің функциясы
Гиббстің бос энергиясы алынады.
∆Q0298 =∆H0-T∆S0
Гиббстің бос энергиясы ∆Q0 – жүйенің
берілген
процесте
атқара
алатын
максималды пайдалы жұмысына абсолюттік
мәні жағынан тең таңбасы жағынан қарамаөарсы болатын термодинамикалық жүйе
күйінің функциясы. ∆G= - Amax
24.
Практикалық есептеулер үшін:,
мұндағы, ∆G - еркін Гиббс энергиясының өзгеруі;
∑∆G0өнімдер - өнімдердің еркін Гиббс энергиясының
қосындысы;
∑∆G0реагенттер- реагенттердің еркін Гиббс энергиясының
қосындысы.
Үрдістің бағытын ∆G 0 мәні арқылы анықтаймыз:
1) ∆G=0 , үрдіс қарама-қарсы бағыттарда жүреді;
2) ∆G 0 , тура реакция жүреді;
3) ∆G 0 , кері реакция жүреді.
25.
∆G 0 298 = ∑∆G 0 өнімдер - ∑∆G0реагенттермұндағы:
қосындысы;
қосындысы.
∆G 0 298 - еркін Гиббс энергиясының өзгеруі;
∑∆G0өнімдер - өнімдердің еркін Гиббс энергиясының
∑∆G0реагенттер- реагенттер еркін Гиббс энергиясының
26.
Термодинамиканың ІІI заңы абсолюттік нөлге жуық температурамаңында, реакцияның жылу эффектісі мен максимал жұмысты сипаттайтын
қисық сызықтар өзара бірігіп кетеді, ал олардың ортақ жанамасы температуа
осіне параллель болады
∆G=0 болғанда, қайтымсыз үрдістер үшін тепе-теңдік кезде оның
шамасы өте аз болады, ал VT=const болғанда үрдістің бағыты мен тепетеңдігін изохора, изотермиялық потенциал сипаттайды:
∆G = ∆H –T∆S
Изобара, изотермиялық үрдістер жұмыстың максимал болғандағы
реакция жолына тәуелді емес және реакция үрдісінің өзгерісін анықтайды:
Amax=∆G.
тұрақты температурада идеал газ ұлғайғанда немесе сығылғанда ∆G мәні келесі
теңдеумен сипатталады:
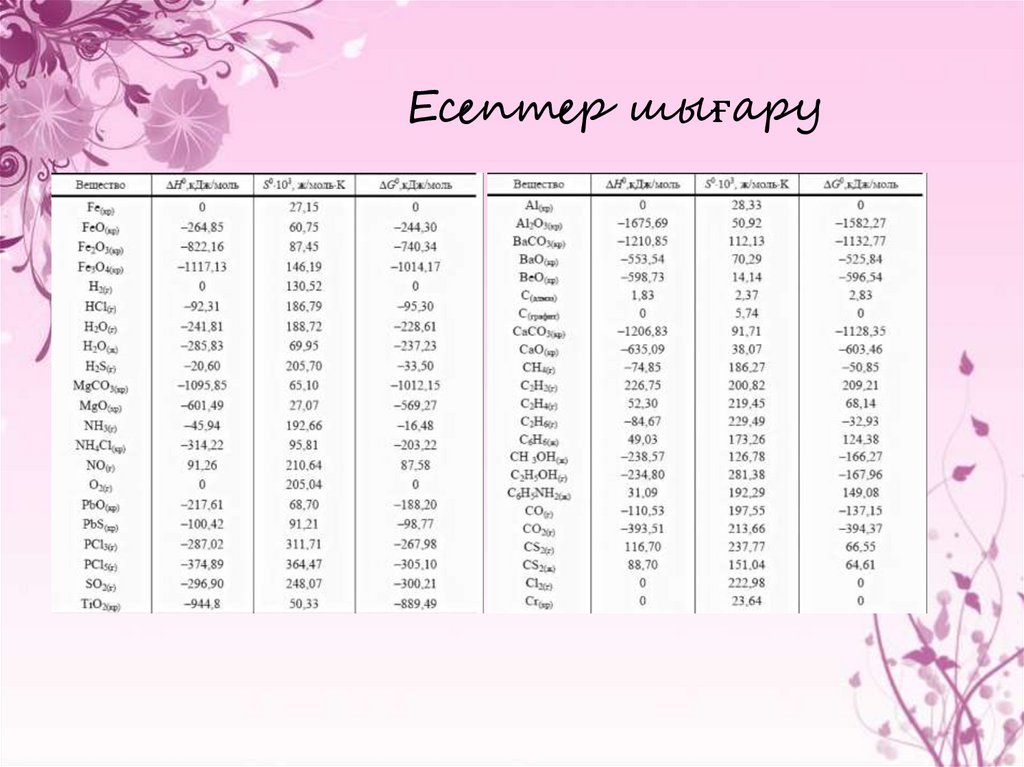
27. Есептер шығару
28. Есептер шығару жолдары
1- мысал. 2Mg(к.)+СО2(г)=2MgO(к)+С(графит) реакцияның ∆Hесепте.
Шешімі. Тұрақты мәліметтері бойынша стандартты түзілу
энтальпиясы CO2 және MgO, сәйкесінше -393,5 және -601,8кДж/моль
(еске түсірсек, жай заттардың түзілу стандартты энтальпиясы нөлге
тең). Теңдеу арқылы реакцияның стандартты энтальпиясын табамыз:
∆H0=2∆H0MgO - ∆H0CO2 =-601,8·2+393,5=-810,1кДж.
2-мысал. Этанол реакциясының дегидратациялық жылу эффектісін
анықтаймыз. Егер,
H0жану (C2H4) = 1422,8; H0сг (H2О) = 0;
Н0жану (C2H5OH) = 1234,7 (кДж/моль).
Шешімі. Реакцияны жазамыз C2H5OH(ж) = C2H4 + H2O. Екінші салдар
бойынша кестеде көрсетілгендей жану жылулары бойынша жылу
эффектісін анықтаймыз.
H0298 х.р = H0сг(C2H5OH) H0сг(C2H4) H0сг(H2O) = 1234,7 +
1422,8 = 188,1 кДж/моль.
29. Бақылау сұрақтар
1.Термодинамиканың негізгі түсініктері2.Жүйе күйі функциялары
3.Термодинамика заңдары
4.Типтік есептер шығару
30.
Ұсынылатын әдебиеттер тізімі:1. Глинка Н.Л. Общая химия.-Москва: Интеграл- Пресс, 2003,728с.
2. Коровин Н. В. Общая химия: - Москва: Высшая школа, 2000,
-557 с.
3. Лучинский Г.П. Курс химии . - Москва: Высшая школа, 1985. 258 с.
4. Дробышева Т.И. Общая химия.-Ростов н/Д: Феникс, 2004.448с.
5. Коржуков Н.Г. Общая и неорганическая химия.- Москва:
МИСИС:
ИНФРА-М, 2004-512с.
6. Гольдбрайх З.Е.Сборник задач и упражнений по химии.Москва: ООО Издательство «Астрель», 2004,-383с.
7. Зайцев О.С.Задачи, упражнения и вопросы по химии.-Москва,
Химия, 1996.-432с.
8. Коровин Н.В., Мингулина Э.И., Рыжова Н.Г.Лабораторные
работы по химии.-Москва: Высшая школа, 2001.-256с.





























 Химия
Химия








