Похожие презентации:
лекция 13
1.
Свойства растворов ВМС:особенности растворения,
реологические свойства, осмос.
Устойчивость растворов ВМС.
Химия
Институт фундаментальных основ и информационных технологий в
медицине
Автор: старший преподаватель
Махачкеева Татьяна Александровна
2.
ПЛАН ЛЕКЦИИ1. Сходства и различия растворов ВМС и коллоидных растворов.
2. Факторы устойчивости растворов ВМС.
3. Особенность растворения ВМС: ограниченное и неограниченное набухание;
количественная характеристика набухания.
4. Свойства растворов ВМС
- коагуляция
- коацервация
- высаливание
- застудневание
- вязкость
- осмос.
5. Онкотическое давление крови.
6. Мембранное равновесие Доннана.
3.
Высокомолекулярные соединения…… вещества, молекулярная масса которых, по данным
одних авторов составляет от 104 до 106 Д, по данным других,
от 103 до 1010 Д.
К числу природных ВМС, играющих важную роль в
жизнедеятельности человека, следует отнести белки, НК,
полисахариды.
4.
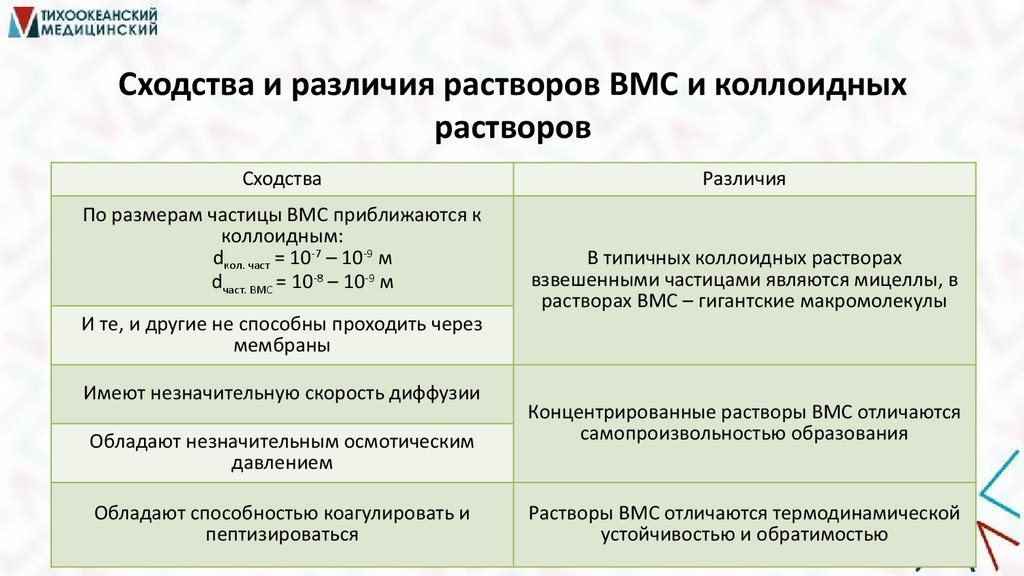
Сходства и различия растворов ВМС и коллоидныхрастворов
Сходства
По размерам частицы ВМС приближаются к
коллоидным:
dкол. част = 10-7 – 10-9 м
dчаст. ВМС = 10-8 – 10-9 м
И те, и другие не способны проходить через
мембраны
Имеют незначительную скорость диффузии
Обладают незначительным осмотическим
давлением
Обладают способностью коагулировать и
пептизироваться
Различия
В типичных коллоидных растворах
взвешенными частицами являются мицеллы, в
растворах ВМС – гигантские макромолекулы
Концентрированные растворы ВМС отличаются
самопроизвольностью образования
Растворы ВМС отличаются термодинамической
устойчивостью и обратимостью
5.
Растворы ВМС …• …
лиофильные
коллоидные
системы,
термодинамически устойчивые и обратимые;
• … молекулярнодисперсные системы, в которых
взвешенными частицами являются не мицеллы с
их ядерным строением, а молекулы гигантских
размеров.
6.
Строение (структура) ВМСлинейная
пространственная
разветвлённая
Специфические свойства ВМС обусловлены их способностью принимать
различные конформации (глобулы, клубки или растянутые формы).
Конформации – энергетически неравноценные формы макромолекул,
возникающие при простом повороте звеньев без разрыва химической
связи.
7.
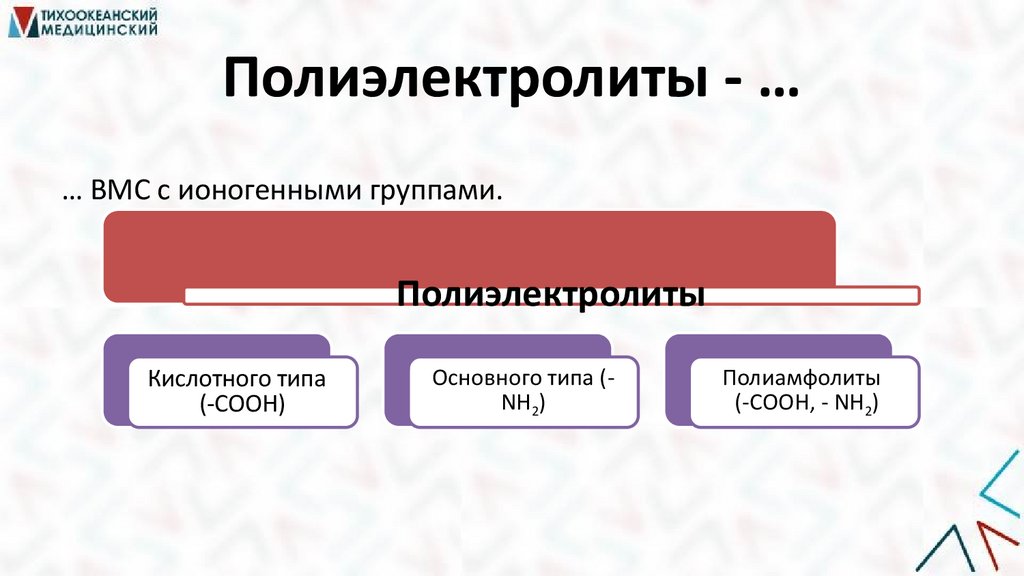
Полиэлектролиты - …… ВМС с ионогенными группами.
Полиэлектролиты
Кислотного типа
(-СООН)
Основного типа (NH2)
Полиамфолиты
(-СООН, - NH2)
8.
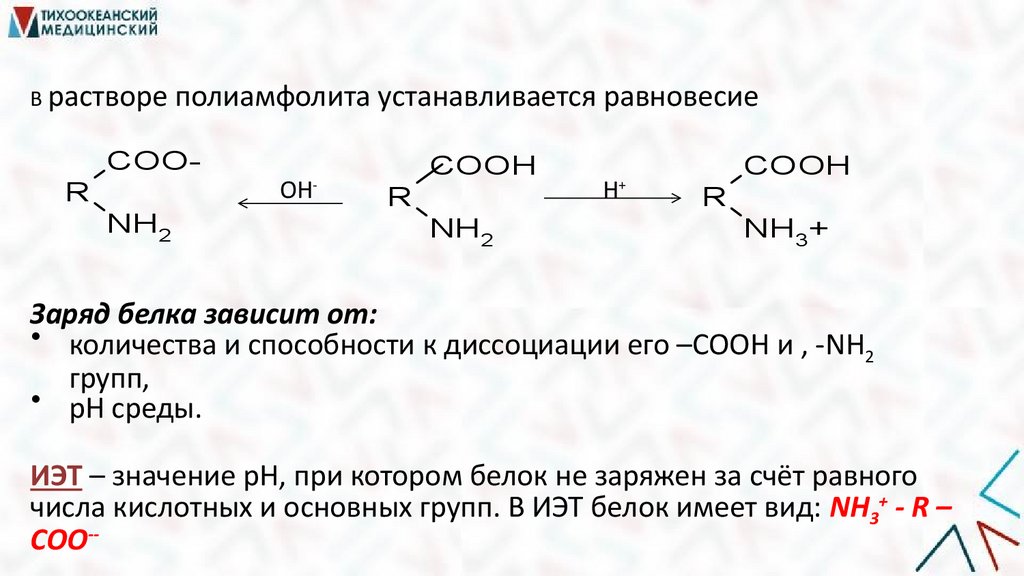
В растворе полиамфолита устанавливается равновесиеCOO-
ОН
-
R
NH2
COOH
R
NH2
Н
+
COOH
R
NH3+
Заряд белка зависит от:
• количества и способности к диссоциации его –СООН и , -NH2
групп,
• рН среды.
ИЭТ – значение рН, при котором белок не заряжен за счёт равного
числа кислотных и основных групп. В ИЭТ белок имеет вид: NH3+ - R –
COO--
9.
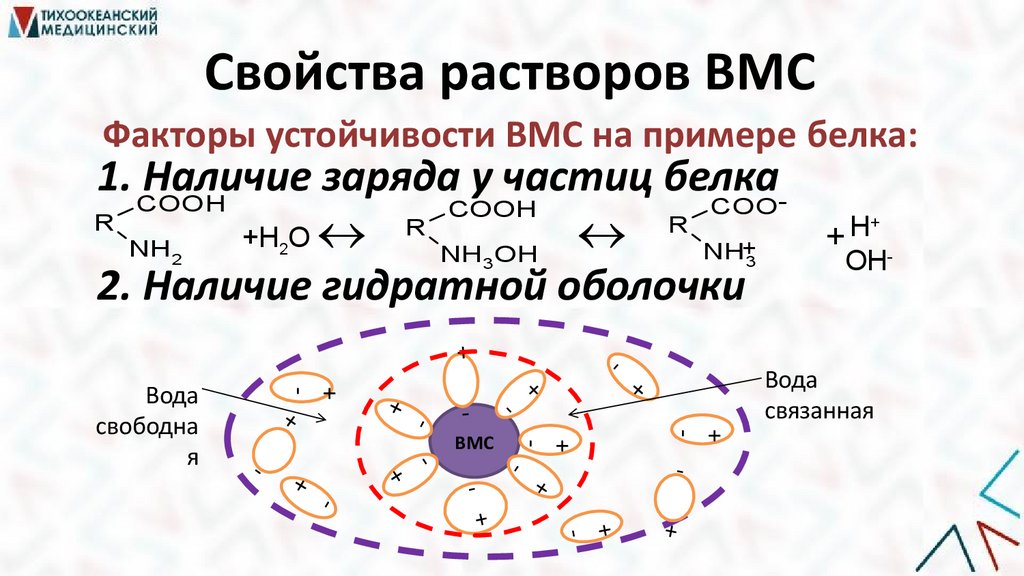
Свойства растворов ВМСФакторы устойчивости ВМС на примере белка:
1. COOH
Наличие заряда у частиц белкаCOO
COOH
R
R
R
+Н
О
NH
NH+
NH OH
2. Наличие гидратной оболочки
2
2
3
3
+
+
-
+
- +
-
+
-
+
+
+
-
+
+
- -
ВМС
-
-
+
ОН
Вода
связанная
+
+
-
Вода
свободна
я
-
+
+Н -
+
10.
Пути коагуляции растворов ВМСК коагуляции растворов приводит:
• одновременная нейтрализация заряда частицы ВМС
и полное разрушение всей гидратной оболочки.
1. Электролитом нейтрализовать заряд и добавить
дегидратирующее вещество (спирт, ацетон, танин и
др.).
2. В начале провести дегидратацию, а затем
нейтрализовать заряд частицы ВМС.
Данные схемы предложены учёным Кройтом.
11.
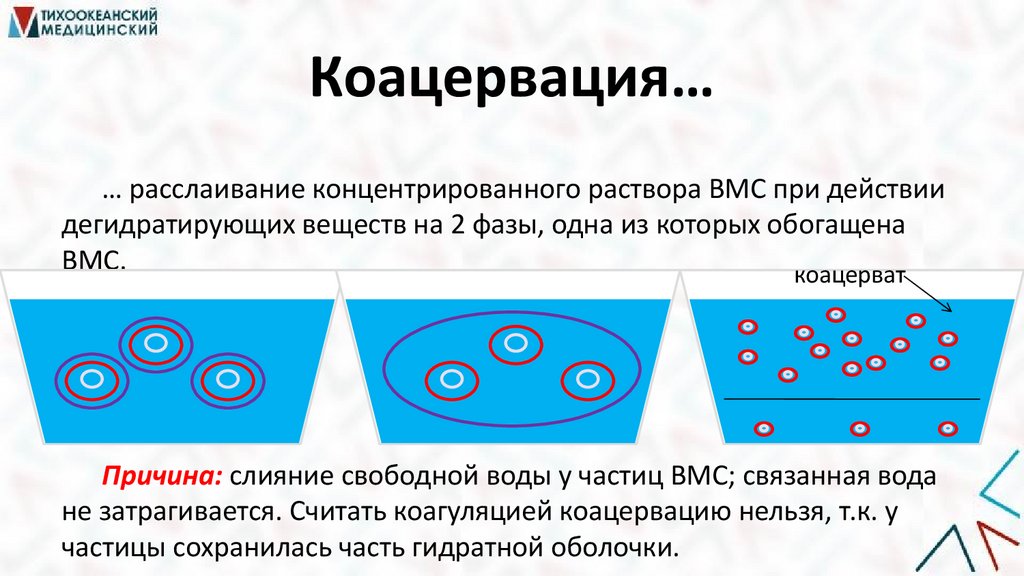
Коацервация…… расслаивание концентрированного раствора ВМС при действии
дегидратирующих веществ на 2 фазы, одна из которых обогащена
ВМС.
коацерват
Причина: слияние свободной воды у частиц ВМС; связанная вода
не затрагивается. Считать коагуляцией коацервацию нельзя, т.к. у
частицы сохранилась часть гидратной оболочки.
12.
Высаливание……нарушение устойчивости растворов ВМС при действии
неорганических солей.
Высаливающее действие соли заключается в её
собственной гидратации за счёт дегидратации коллоидных
частичек ВМС и понижения их растворимости. Для
фракционирования белков чаще используют раствор
(NH4)2SO4.
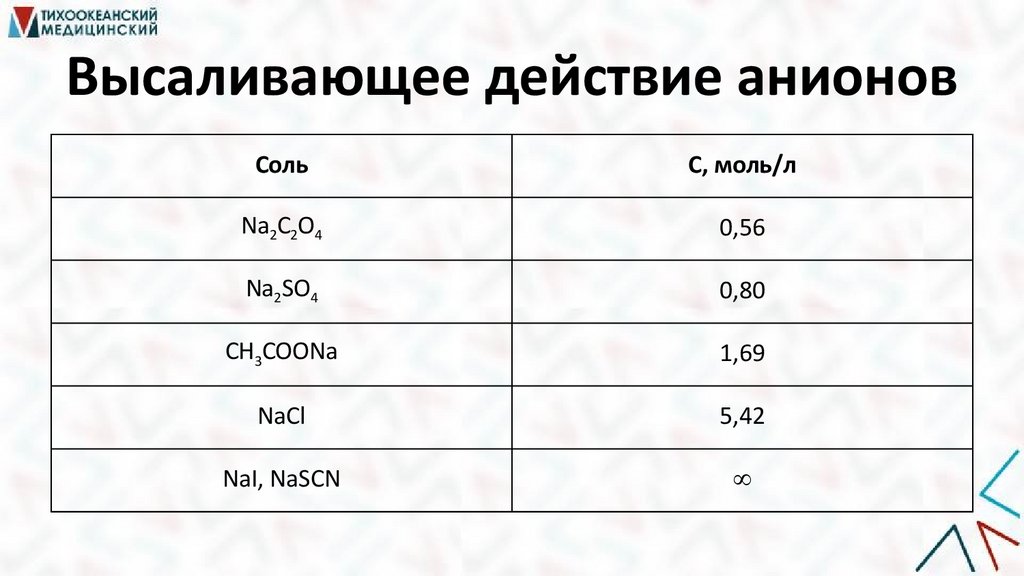
13.
Высаливающее действие анионовСоль
С, моль/л
Na2C2O4
0,56
Na2SO4
0,80
CH3COONa
1,69
NaCl
5,42
NaI, NaSCN
14.
Ряды ГофмейстераC2O42- > SO42- > CH3COO- > Cl- > NO3- > I- > SCN-
высаливающее действие
повышают устойчивость
коллоидов ВМС
Большое влияние на процесс высаливания оказывает длина
макромолекулы и молекулярная масса ВМС: чем они больше,
тем легче идёт высаливание. На этом принципе основано
фракционное высаливание, сущность которого заключается в
том, что добавляя к растворам ВМС возрастающие
концентрации соли можно выделить отдельные фракции
белков.
15.
Особенности растворения ВМСВзаимодействие ВМС с водой начинается с процесса
набухания.
Набухание – самопроизвольный процесс поглощения ВМС
низкомолекулярной жидкости, сопровождающийся
увеличением массы и объёма.
Причина набухания – различия в размерах и подвижности
молекул: молекулы ВМС велики и малоподвижны, молекулы
НМС малы и очень подвижны.
Различают 2 вида набухания: ограниченное и
неограниченное.
16.
Ограниченное набуханиеСопровождается образованием студня.
Студень – пространственная сетка из
цепей макромолекул, заполненная НМС.
Оно характерно для ВМС, отдельные цепи
которых связаны так называемыми
«мостичными» связями (типа водородной,
бисульфидной и др.).
17.
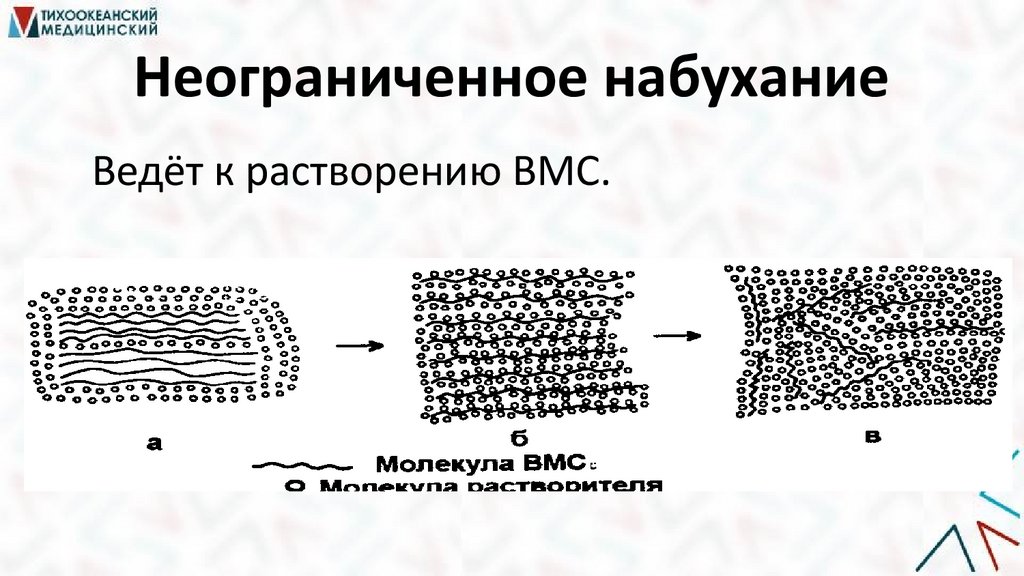
Неограниченное набуханиеВедёт к растворению ВМС.
18.
Количественная оценка набуханиянабухания
m - mСтепень
V - V0
0
α=
α=
m0
V0
где m0, V0 – масса и объём ВМС до набухания.
m, V – масса и объём после набухания.
Факторы, влияющие на набухание:
Обращённый ряд Гофмейстера
SCN->I- >NO3- >Cl- >CH3COO- >SO42- >C2O42-
•Температура
•Электролиты
•рН
19.
Застудневание растворов ВМС - …… переход растворов к нетекучей, эластичной
форме.
Образование студня может быть вызвано двумя
способами:
рр
В
М
С
СТУДЕНЬ
твё
рд
ый
ВМ
С
20.
Основу студня составляет пространственная сетка из цепейполимера, заполненная молекулами НМС.
Студни со слабыми связями (водородными или дипольными)
между
цепями
полимера
имеют
малую
прочность
и
подвергаются тиксотропии – обратимому разрушению при
механическом воздействии.
Студни
с
прочные.
сильными
связями
(химическими)
достаточно
21.
Старение студней…Синерезис – уплотнение пространственной сетки студня за
счёт выдавливания части НМС; гель при этом уменьшается в
объёме, но сохраняет исходную форму.
Синерезис в живых тканях указывает на
старение организма: потеря воды приводит
к утоньшению костей, сухости кожи,
уменьшению эластичности тканей.
22.
Вязкость растворов ВМС ( ) …… внутреннее трение между слоями ВМС, движущимися
относительно друг друга.
Величина вязкости определяется силами молекулярного
притяжения, поэтому
1. в растворах полярных веществ;
2. в растворах с размерами частиц, превышающими размеры
частиц растворителя;
3. на величину вязкости оказывает влияние форма частиц ( , ಟ,
ಯ, Ο и др);
4. с увеличением молекулярной массы растворённого
вещества;
5. с увеличением концентрации частиц вещества.
23.
Уравнение Эйнштейна= 0(1+α )
- вязкость раствора
0 – вязкость растворителя
α – коэффициент, зависящий от
формы частиц
- объёмная доля частиц
Эйнштейн Альберт
14.III 1879 — 18.IV 1955
Недостаток: не учитывает наличие различных
слоёв у частиц (сольватных, адсорбционных,
электрических),
создающих
дополнительные
вязкостные эффекты.
24.
Виды вязкости• Относительная -
t- время истечения объёма жидкости через капиллярную трубку (t-раствора, t0 –
растворителя)
• Удельная -
Зависит от концентрации, характеризовать вещество не может.
Для разбавленных растворов ВМС Штаудингер
получил уравнение:
К- константа
М- молекулярная масса
с– массовая концентрация.
25.
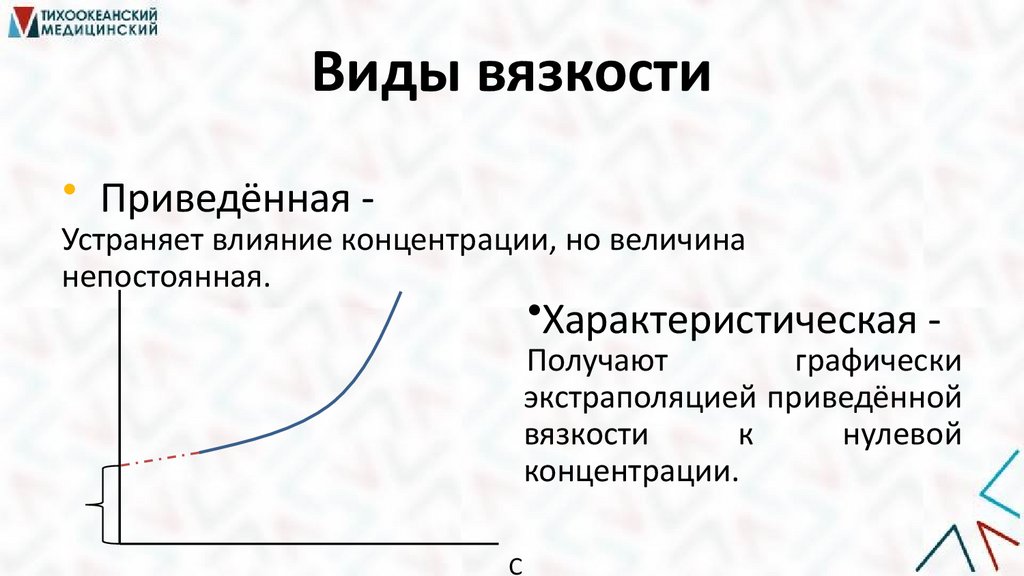
Виды вязкости• Приведённая -
Устраняет влияние концентрации, но величина
непостоянная.
•Характеристическая -
Получают
графически
экстраполяцией приведённой
вязкости
к
нулевой
концентрации.
С
26.
Модифицированное уравнениеШтаудингера
Позволяет рассчитать
К – константа
α – характеризует форму частиц ½ ≤ α ≤ 1
27.
Вязкость кровиВ норме для плазмы крови и лимфы =1,4∙10 -3Па∙См
(t=37 С).
• концентрации форменных элементов и белков
.
• На влияет и состояние мембран эритроцитов
(до 45% объёма крови): в норме высокая
эластичность, потеря или снижение которой ведёт
к крови.
28.
Осмотическое давление растворов ВМС ( )…
… существенно и может быть измерено с
достаточной точностью по закону Вант-Гоффа.
, где
с – весовая концентрация полимера, г/л;
М- молекулярная масса полимера
Закон выполняется при двух условиях:
• низкая концентрация полимера;
• глобулярная форма молекул.
29.
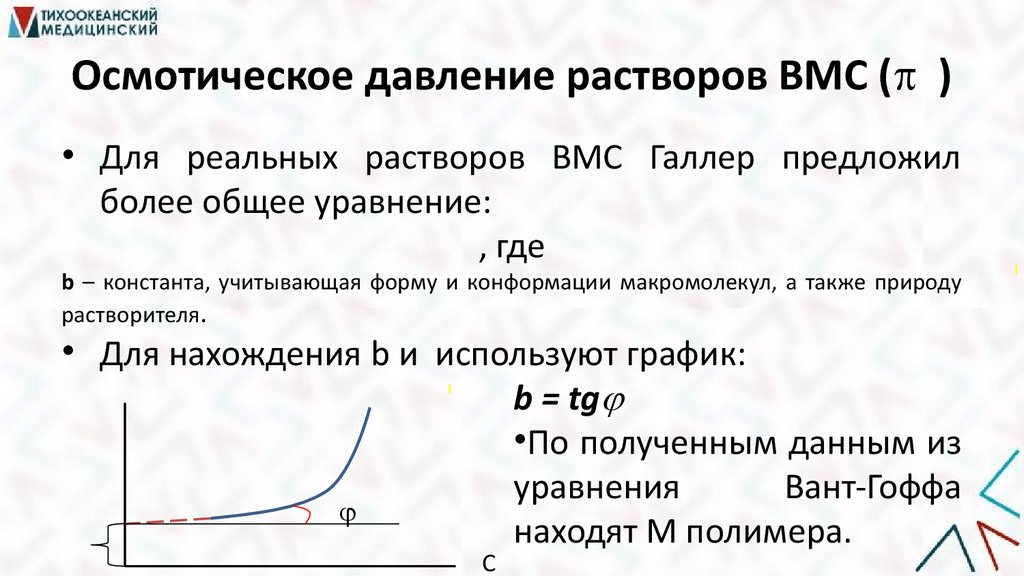
Осмотическое давление растворов ВМС ( )• Для реальных растворов ВМС Галлер предложил
более общее уравнение:
, где
b – константа, учитывающая форму и конформации макромолекул, а также природу
растворителя.
• Для нахождения b и используют график:
b = tg
•По полученным данным из
уравнения
Вант-Гоффа
находят М полимера.
C
30.
Онкотическое давление( онк) ……часть осмотического давления крови, обусловленная наличием белков и их отдельных
сегментов коллоидного размера.
В норме 3,1 кПа. Отклонение этой величины от нормы приводит к серьёзным нарушениям
функционирования организма.
Причина: на кровь в капилляре действуют гидростатическое давление (р гидр.) 4,5 кПа и
онкотическое давление. Стенка капилляра представляет собой мембрану, непроницаемую для
белка, но проницаемую для воды и безбелковой части плазмы.
ргидр способствут выдавливанию воды и безбелковой части плазмы в межклеточную
жидкость. онк способствует всасыванию воды из ткани в капилляр.
31.
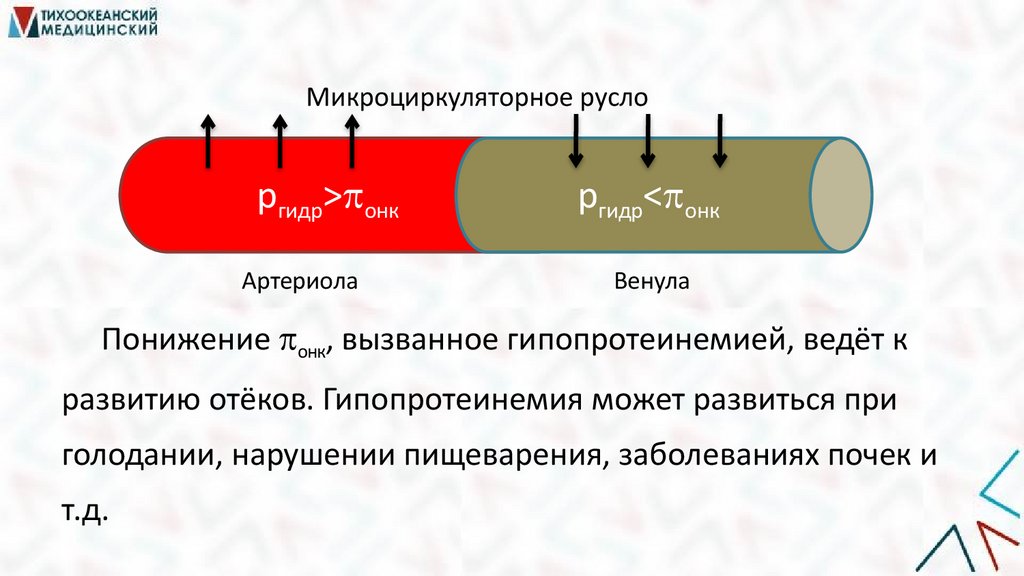
Микроциркуляторное руслоргидр> онк
Артериола
ргидр< онк
Венула
Понижение онк, вызванное гипопротеинемией, ведёт к
развитию отёков. Гипопротеинемия может развиться при
голодании, нарушении пищеварения, заболеваниях почек и
т.д.
32.
Мембранное равновесие ДоннанаОписывает распределение электролитов по обе стороны
клеточной мембраны.
2
c out
x=
c in + 2c out
сout – концентрация ионов в межклеточной жидкости;
сin – концентрация ионов внутри клетки;
х – количество ионов, перешедших в клетку из
межклеточной жидкости.
33.
Анализ уравнения Доннана• Возможны 3 варианта распределения ионов:
1) cout > cin
x=
c out
2
2) cin > cout в клетку перейдёт малое число ионов
3) cin = cout
x=
c out
3
Вывод: концентрация ионов в клетке будет всегда выше, чем в
межклеточной жидкости.
34.
Причина мембранного равновесия• избирательная проницаемость клеточных мембран, из-за
которой соли белка всегда остаются в клетке и способствуют
переходу ионов в клетку.
Значение равновесия Доннана в жизнедеятельности: in > out
поддержание тургора клеток даже в изотонических
растворах.
35.
ЗАКЛЮЧЕНИЕ1. По размеру частиц и основным свойствам растворы ВМС могут быть отнесены к лиофильным
коллоидным системам.
2. Лиофильность ВМС придает гидратная оболочка, состоящая из свободной и связанной воды.
3. Наличие гидратной оболочки такого строения объясняет особенности растворов ВМС
возможность проведения коагуляции с предварительной дегидратацией
коацервацию с сохранением у частиц ВМС части гидратной оболочки, что препятствует коагуляции
высаливание за счет дегидратации частиц ВМС и понижения их растворимости при действии солей
вязкость за счет наличия у частиц большой молекулярной массы слоев (гидратных, электрических),
создающих дополнительные вязкостные эффекты.
4. Онкотическое давление крови, обусловленное наличием белков и их отдельных сегментов
коллоидного характера, препятствует образованию отеков и нормализует функционирование
организма.
5. Белки, создавая избыточную концентрацию частиц в клетке, способствуют поддержанию тургора
клетки даже в изотонических растворах.


























 Химия
Химия








