Похожие презентации:
4. оксиды серы и серная кислота
1. Убийственные ароматы
Урок 4А.Г.Волкова
1
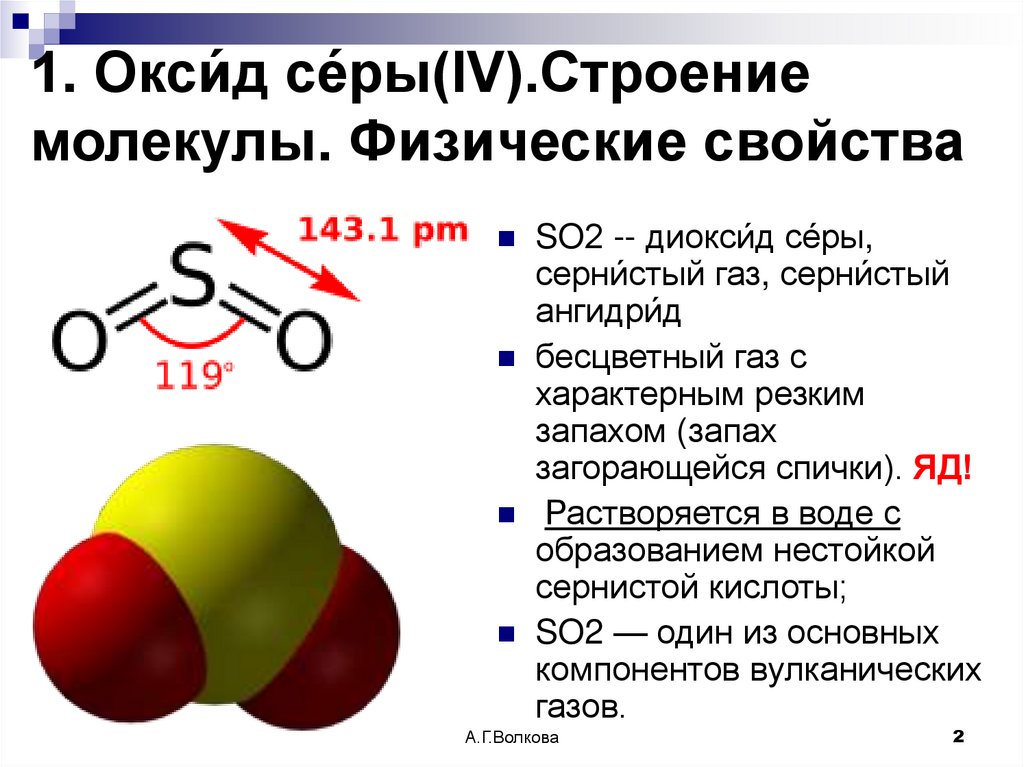
2. 1. Окси́д се́ры(IV).Строение молекулы. Физические свойства
SO2 -- диокси́д се́ры,серни́стый газ, серни́стый
ангидри́д
бесцветный газ с
характерным резким
запахом (запах
загорающейся спички). ЯД!
Растворяется в воде с
образованием нестойкой
сернистой кислоты;
SO2 — один из основных
компонентов вулканических
газов.
А.Г.Волкова
2
3. Получение SO2
1.Промышленный способ получения — сжигание
серы или обжиг сульфидов, в основном — пирита:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑ + Q.
В лабораторных условиях получают
воздействием:
сильных кислот на сульфиты и гидросульфиты:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑.
Также можно получить действием
концентрированной серной кислоты на
малоактивные металлы при нагревании:
2H2SO4 (конц.) + Cu → CuSO4 + SO2↑ + 2H2O.
2.
А.Г.Волкова
3
4. Химические свойства
Кислотный оксид.Общие с другими кислотными оксидами:
1. Растворяется в воде с образованием
сернистой кислоты
(при обычных условиях реакция обратима):
SO2 + H2O ↔ H2SO3
2. Реагирует с основными оксидами:
SO2 + CaO =CaSO3
3. Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O
А.Г.Волкова
4
5. Химические свойства
Специфические (химическая активность SO2велика) :
1. Наиболее ярко выражены восстановительные
свойства, степень окисления серы в таких реакциях
повышается:
2SO2 + O2 → 2SO3
(требуется катализатор V2O5 и температура 450°)
2. Обесцвечивание фиолетового раствор
перманганата является качественной реакцией на
сульфит-ион и на SO2.
3. Окислительные свойства (слабые) в присутствии
сильных восстановителей
SO2 + 2CO → 2CO2 + S↓.
А.Г.Волкова
5
6. Применение
Производство серной кислотыДезинфицирующее средство
(окуривание овощехранилищ и складов
для сохранности плодов и овощей)
Отбеливание соломы, шелка, шерсти
Консервирование фруктов, соков и вин
Получение сульфитов
А.Г.Волкова
6
7. Физиологическое действие
SO2 токсичен. Симптомы при отравлении сернистымгазом — насморк, кашель, охриплость, першение в
горле. При вдыхании сернистого газа более высокой
концентрации — удушье, расстройство речи,
затруднение глотания, рвота, возможен острый отёк
лёгких.
Интересно, что чувствительность по отношению к
SO2 весьма различна как у людей, так и у растений.
Наиболее устойчивы по отношению к сернистому
газу берёза и дуб, наименее — сосна и ель.
Наиболее чувствительными к SO2 являются розы.
При попадании на них сернистого газа они
моментально белеют.
А.Г.Волкова
7
8. Экологическое воздействие
Кислотные дождиподкисление почв
обострение дыхательных заболевания
человека
некроз растительности
Наибольших концентраций сернистый газ
достигает в северном полушарии, особенно
над территорией США, зарубежной Европы,
европейской части России, Украины. В южном
полушарии оно ниже.
А.Г.Волкова
8
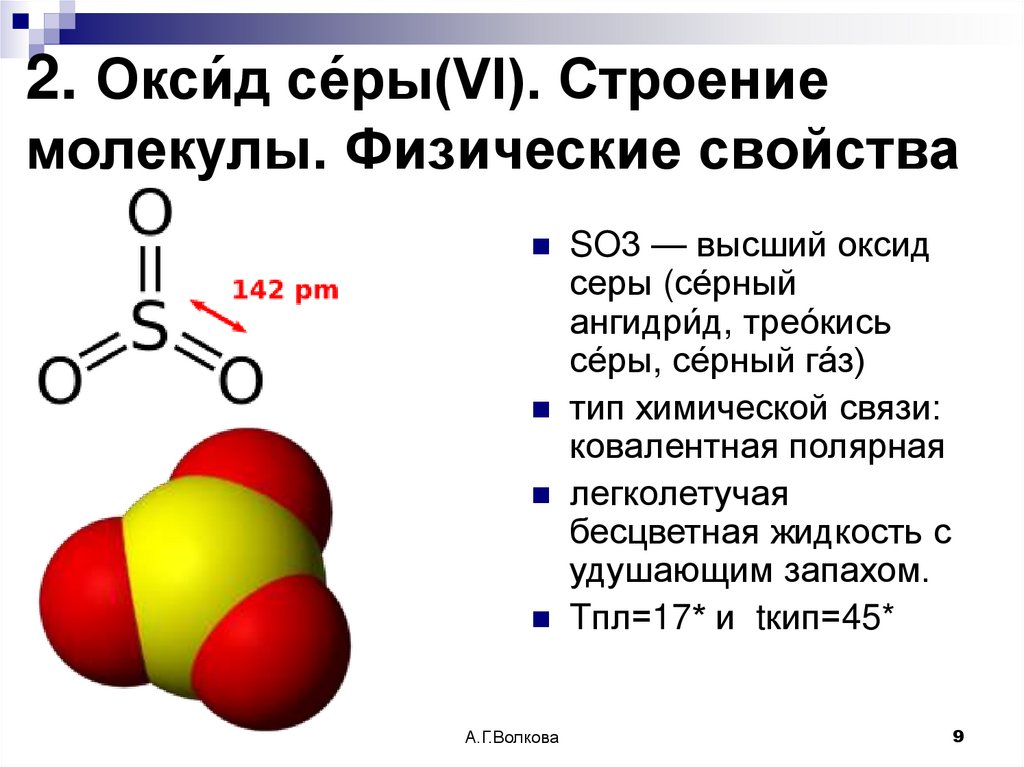
9. 2. Окси́д се́ры(VI). Строение молекулы. Физические свойства
SO3 — высший оксидсеры (се́рный
ангидри́д, трео́кись
се́ры, се́рный га́з)
тип химической связи:
ковалентная полярная
легколетучая
бесцветная жидкость с
удушающим запахом.
Tпл=17* и tкип=45*
А.Г.Волкова
9
10. Получение. Химические свойства
V2O5, t2SO2 + O2 2SO3 + Q.
Кислотный оксид:
SO3 + H2O ↔ H2SO4
SO3 + 2NaOH → Na2SO4 + H2O
Окислитель:
SO3 + P→ P2O5 + SO2
SO3 + H2S → SO2 + H2O
А.Г.Волкова
10
11. Сернистая кислота Н2SO3
Двухосновная, кислородосодержащая,слабая
Восстановитель
Для отбеливания материалов
А.Г.Волкова
11
12. Серная кислота Н2SO4
Двухосновная, кислородосодержащая,сильная
Бесцветная вязкая жидкость, хорошо
растворяется в воде (следует вливать
серную кислоту тоненькой струйкой
кислоту в воду, непрерывно
перемешивая раствор)
А.Г.Волкова
12
13. Химические свойства
Разбавленная кислота:Металлы (от Mg до Pb)
Оксиды металлов
Основания
Соли слабых кислот
Концентрированная – окислитель!
с металлами до Н2 S, SO2, H2S
с металлами после H2 SO2
Fe и Al пассируются
А.Г.Волкова
13
14. Соли
Сульфиты:сильные восстановители;
качественная реакция с соляной кислотой –
SO2
Сульфаты:
кристаллогидраты
качественная реакция с ионом бария – Ba2+
А.Г.Волкова
14
15. Домашнее задание
П.15Стр.85 упр. 6
А.Г.Волкова
15
16. Лабораторный опыт №4 «Качественная реакция на сульфат-ионы», стр. 85
А.Г.Волкова16














 Химия
Химия








