Похожие презентации:
Oksidy-sery-i-sernaya-kislota
1.
Оксиды серы и сернаякислота
Серные оксиды, особенно диоксид серы (SO2), играют ключевую
роль в формировании серной кислоты.
Серная кислота - это сильная кислота с широким спектром
применений, от производства удобрений до синтетических
материалов.
2.
Оксиды серы : SO2 и SO3Диоксид серы (SO2)
Триоксид серы (SO3)
Бесцветный газ с резким запахом. Ядовит,
Бесцветная жидкость, которая дымит на воздухе. При
растворяется в воде, образуя сернистую кислоту.
взаимодействии с водой образует серную кислоту.
3.
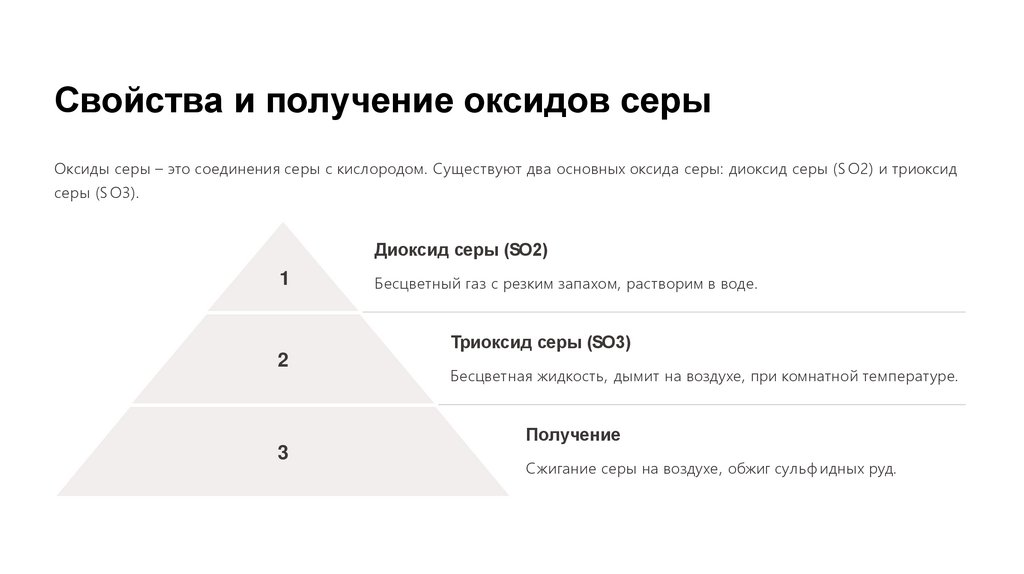
Свойства и получение оксидов серыОксиды серы – это соединения серы с кислородом. Существуют два основных оксида серы: диоксид серы (S O2) и триоксид
серы (S O3).
Диоксид серы (SO2)
1
Бесцветный газ с резким запахом, растворим в воде.
Триоксид серы (SO3)
2
Бесцветная жидкость, дымит на воздухе, при комнатной температуре.
Получение
3
Сжигание серы на воздухе, обжиг сульф идных руд.
4.
Окисл ение SO2 до SO3Оксид серы(IV) (S O2) является важным исходным веществом для производства серной кислоты. Превращение SO2 в SO3 осуществляется путем
каталитического окисления в присутствии катализатора - оксида ванадия(V) (V2O5).
1
2
3
4
Окисл ение SO2
SO2 + 1 /2O2 → SO3
Катал изатор
V2O5
Температура
400-500°C
Давл ение
1-2 атм
Этот процесс протекает в несколько стадий, каждая из которых имеет свои особенности. В целом, окисление SO2 до SO3 является сложной
химической реакцией, требующей определенных условий для достижения максимального выхода.
5.
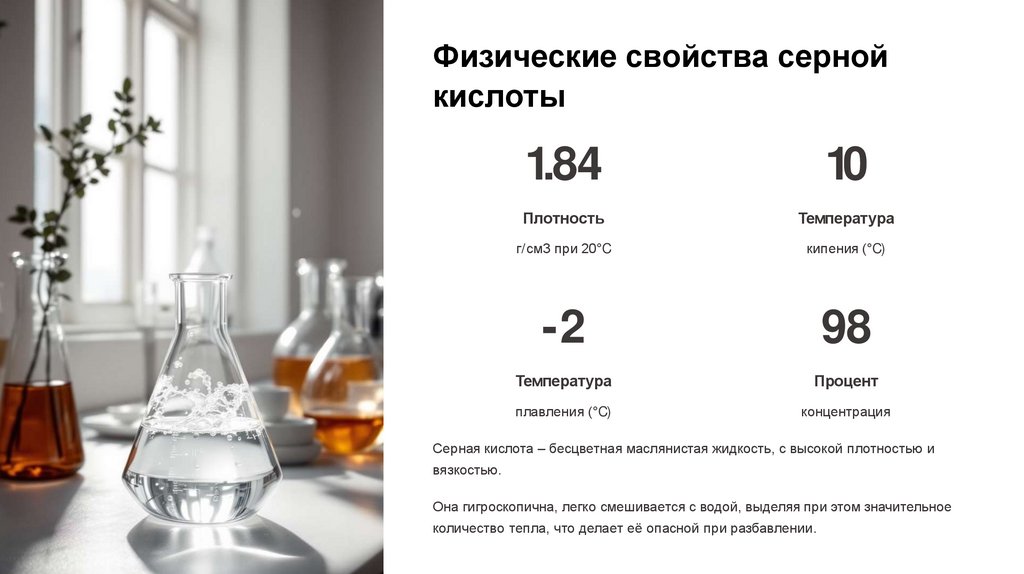
Физические свойства сернойкислоты
1.84
10
Плотность
Температура
г/ см3 при 20°C
кипения (°C)
-2
98
Температура
Процент
плавления (°C)
концентрация
Серная кислота – бесцветная маслянистая жидкость, с высокой плотностью и
вязкостью.
Она гигроскопична, легко смешивается с водой, выделяя при этом значительное
количество тепла, что делает её опасной при разбавлении.
6.
Химические свойствасерной кисл оты
Серная кислота — сильная двухосновная кислота. Она реагирует
с основаниями, основными оксидами, солями слабых кислот, а
также с металлами, стоящими в ряду активности металлов до
водорода.
При взаимодействии с водой выделяется значительное
количество тепла, поэтому, при разбавлении серной кислоты
водой, ее следует осторожно приливать к воде, а не наоборот,
чтобы избежать сильного разогрева и разбрызгивания.
7.
Концентрированная и разбавл енная серная кисл отаКонцентрированная серная кислота
Разбавл енная серная кислота
Разл ичия в свойствах
Разбавленная серная кислота - это водный
Концентрированная серная кислота
раствор H2SO4, который обладает высокой
содержит более 95% H2SO4. Она
реакционной способностью.
представляет собой маслянистую, тяжелую
жидкость, которая очень гигроскопична.
Концентрированная серная кислота сильный окислитель.
Разбавленная серная кислота типичная кислота, реагирует с
основаниями, оксидами металлов и
солями.
8.
Промышленное производство серной кислотыСтадия I: Получение сернистого газа (SO2)
Сернистый газ получают путем сжигания серы или обжига сульфидных руд.
Стадия II: Окисление SO2 до SO3
Сернистый газ окисляют до серного ангидрида (SO3) с помощью катализатора.
Стадия III: Абсорбция SO3
Серный ангидрид поглощают в концентрированной серной кислоте, образуя олеум (H2S2O7).
Стадия IV: Разбавление олеума
Олеум разбавляют водой, получая серную кислоту требуемой концентрации.
9.
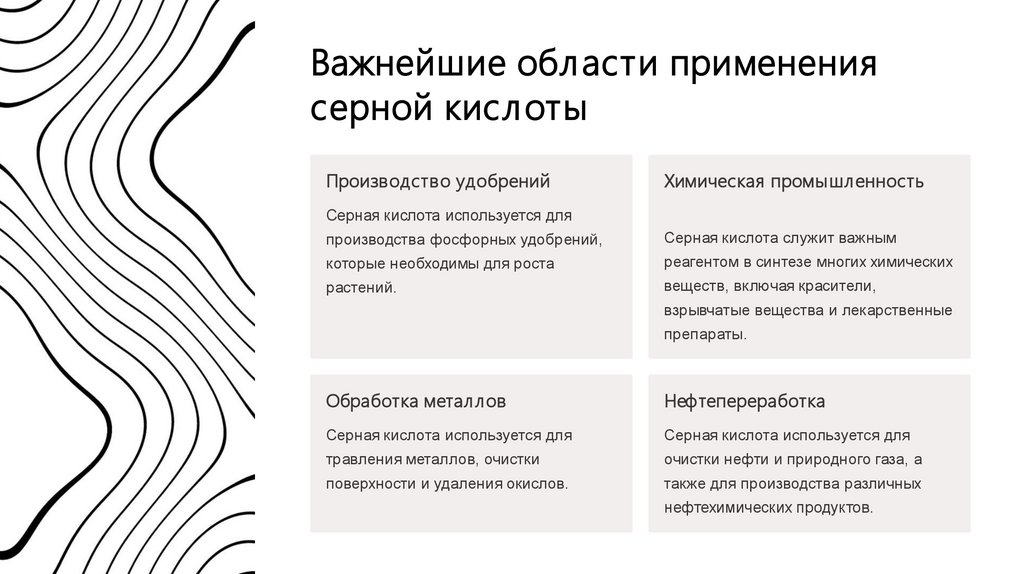
Важнейшие области применениясерной кислоты
Производство удобрений
Химическая промышл енность
Серная кислота используется для
производства фосфорных удобрений,
Серная кислота служит важным
которые необходимы для роста
реагентом в синтезе многих химических
растений.
веществ, включая красители,
взрывчатые вещества и лекарственные
препараты.
Обработка метал лов
Нефтепереработка
Серная кислота используется для
Серная кислота используется для
травления металлов, очистки
очистки нефти и природного газа, а
поверхности и удаления окислов.
также для производства различных
нефтехимических продуктов.
10.
Влияние серной кислоты на окружающую средуСерная кислота является сильным кислотным веществом,
которое может оказывать негативное воздействие на
окружающую среду. Она может вызывать кислотные
дожди, загрязнять водоемы и почву, повреждать растения
и животных.
Кислотные дожди образуются при взаимодействии
серной кислоты с водяным паром в атмосф ере. Они
могут вызывать коррозию зданий и сооружений,
повреждать леса, снижать урожайность
сельскохозяйственных культур.
Серная кислота может попадать в водоемы с
промышленными сточными водами или в результате
аварий. Она может убивать рыб, растения и другие
водные организмы, а также загрязнять питьевую воду.
11.
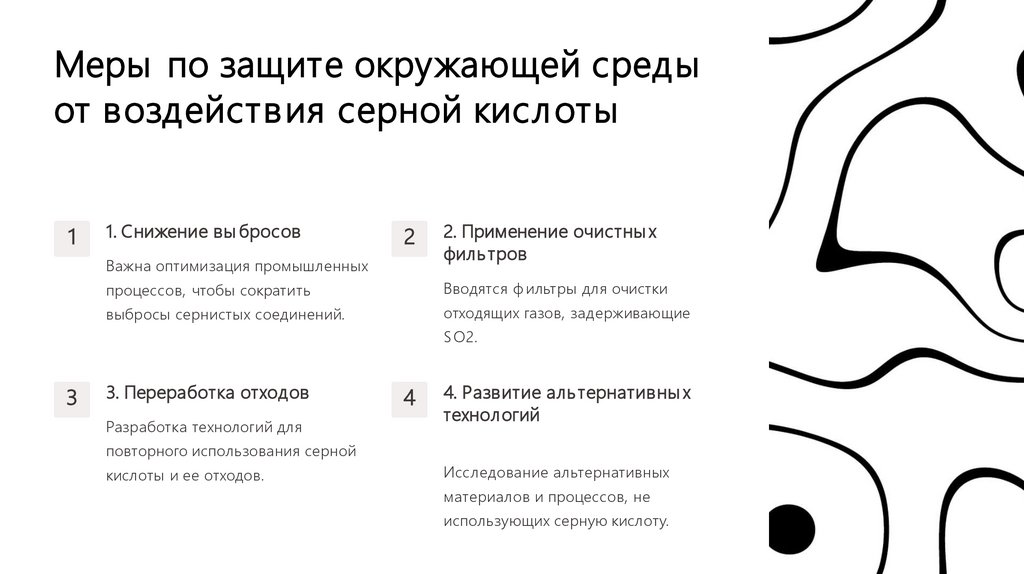
Меры по защите окружающей средыот воздействия серной кислоты
1
1. Снижение вы бросов
2
Важна оптимизация промышленных
2. Применение очистны х
филь тров
процессов, чтобы сократить
Вводятся ф ильтры для очистки
выбросы сернистых соединений.
отходящих газов, задерживающие
S O2.
3
3. Переработка отходов
Разработка технологий для
4
4. Развитие аль тернативны х
технологий
повторного использования серной
кислоты и ее отходов.
Исследование альтернативных
материалов и процессов, не
использующих серную кислоту.
12.
Заключение и основные выводыЗначение серной кислоты
Экологические аспекты
Серная кислота — ключевой химикат для многих
Важно помнить о негативном влиянии серной кислоты
промышленных процессов, от производства
на окружающую среду.
удобрений до переработки нефти.
Изучение её свойств важно для понимания её роли в
различных сферах жизни.
Необходимо внедрять технологии, минимизирующие
выбросы и эффективно утилизирующие отходы.








 Химия
Химия








