Похожие презентации:
Теоретические_основы_органической_химии
1. Лекция 1 Теоретические основы органической химии
ЛЕКЦИЯ 1ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
ОРГАНИЧЕСКОЙ ХИМИИ
Преподаватель: канд. с.-х. наук, доцент
Салтыкова Ольга Леонидовна
Салтыкова О.Л., 2024
2.
1. ПРЕДМЕТ И ЗАДАЧИ ОРГАНИЧЕСКОЙ ХИМИИОрганическая химия – наука, изучающая химические соединения, в
состав которых входят атомы углерода, соединения с атомами других
химических элементов.
Соединения углерода (кроме наиболее простых) получили название
органических веществ.
В связи с этим органическую химию называют также химией соединений
углерода.
Между органической и неорганической химией существуют естественные
диалектические переходы.
В частности, на границе между органическими и неорганическими
соединениями находятся такие вещества, как сода, сероуглерод, мочевина,
оксид углерода (IV) и т. д., которые можно с равным правом рассматривать в
качестве как органических, так и неорганических соединений.
3.
Место органической химии в ряду других наукИзучая сложнейшие органические вещества, играющие
важную роль в жизнедеятельности животных и
растительных организмов, органическая химия тесно
соприкасается и с биологией. В пограничной между
этими двумя науками области возникла и успешно
развивается новая молодая наука - биологическая
химия. Наконец, вследствие все расширяющегося в
настоящее время применения физических методов
исследования органических веществ теснее становится
связь органической химии с физикой.
4.
Важнейшие причины выделения органической химии в отдельнуюнауку
1. Число известных органических соединений (около 5 миллионов)
значительно превышает число соединений всех остальных элементов
периодической системы Менделеева.
В настоящее время известно около 650 тысяч неорганических соединений, примерно 200 тысяч
новых органических соединений получают сейчас в один год. Это объясняется не только тем, что
химики особенно интенсивно занимаются синтезом и исследованием органических соединений, но
и особой способностью элемента углерода давать соединения, содержащие практически
неограниченное число атомов углерода, связанных в цепи и циклы.
2. Органические вещества имеют исключительное значение вследствие их
крайне многообразного практического применения, а особенно потому, что
они играют важную роль в процессах жизнедеятельности организмов.
3. Имеются существенные отличия в свойствах и реакционной
способности органических соединений от неорганических, вследствие
чего возникла необходимость в развитии многих специфических методов
исследования органических соединений.
5.
Особенностям органических соединенийСуществование гомологических рядов, у которых каждый последующий член может быть
произведен от предыдущего добавлением одной определенной для данного ряда группы
атомов.
Например, в гомологическом ряду предельных углеводородов такой группой является СН2.
Гомологический ряд характеризуется общей формулой, например СnН2n+2, для предельных
углеводородов. Члены гомологического ряда имеют определенную общность в химических
свойствах. В то же время происходит закономерное изменение физических свойств элементов по
мере увеличения числа групп.
Для большинства органических соединений характерна относительно невысокая скорость
химических взаимодействий при обычных условиях. Это обусловлено высокой прочностью
ковалентной связи углерод - углерод и углерода с другими атомами и относительно малой
разностью энергии связи углерода с различными атомами. Большинство органических соединений
не способно к электролитической диссоциации. Температура плавления большинства органических
соединений относительно невысокая (до 100—200 °С). При высокой температуре они сгорают на
воздухе в основном до диоксида углерода и паров воды.
6.
2. Строение, классификация и номенклатура органических соединений1. Теория радикалов.
Фактическим основанием для создания теории радикалов послужили
исследования
соединений
циана
(Гей-Люссак,
1815).
Этими
исследованиями было впервые установлено, что при целом ряде
химических превращений группа из нескольких атомов в неизменном виде
переходит из молекулы одного вещества в молекулу другого, подобно тому,
как переходят из молекулы в молекулу атомы элементов. Такие
«неизменяемые» группы атомов получили название радикалов.
На определенном этапе развития органической химии теория радикалов
сыграла значительную роль, впервые дав химикам руководящую нить в
исследовании органического вещества. Это оказалось возможным потому,
что в основе теории радикалов лежало важное обобщение: при химических
реакциях группы, атомов (т. е. радикалы) в неизменном виде входят в
образующиеся при этих реакциях молекулы.
7.
2. Теория химического строения органических соединений А. М. Бутлерова.Основная идея теории А.М. Бутлерова сформулирована в 1861г. в статье «О
химическом строении вещества». В современной интерпретации основные положения
и следствия теории строения Бутлерова могут быть сформулированы следующим
образом:
1. Атомы в органической молекуле соединяются между собой в определенном порядке в
соответствии с их валентностью, что и обусловливает химическое строение молекул.
2. Молекулы с одинаковым составом могут иметь разное химическое строение и
соответственно обладать различными свойствами. Такие молекулы называют изомерами.
Для данной эмпирической формулы можно вывести определенное число теоретически
возможных изомеров.
3. Атомы в молекуле оказывают взаимное влияние друг на друга, т. е. свойства атома
могут изменяться в зависимости от природы других атомов соединения.
4. Каждое органическое соединение имеет лишь одну химическую формулу.
5. Так как при отдельных реакциях изменяются не все, а только некоторые части
молекул, то, изучая продукты химических превращения соединения, можно установить
его строение.
6. Химический характер (т. е. реакционная способность) атомов, входящих в молекулу,
меняется в зависимости от того, с какими атомами они связаны в данной молекуле. Это
изменение химического характера обусловливается главным образом взаимным
влиянием непосредственно связанных друг с другом атомов. Взаимное влияние атомов,
не связанных непосредственно, обычно проявляется значительно слабее.
8.
Изомерия.Различают структурную и пространственную изомерию.
Структурная изомерия обусловлена различным порядком связей
углеродных атомов (изомерия скелета) или различным расположением
функциональных групп или кратных связей (изомерия положения).
Виды изомерии органических соединений
Структурная
1. Изомерия основной углеродной цепи:
С4Н10
бутан
изобутан
9.
2. Изомерия положения:а) двойных или тройных (кратных) связей:
бутен-2
бутен-1
б) изомерия положения функциональных групп:
пропанол-1 (первичный спирт)
пропанол-2 (вторичный спирт)
3. Межклассовая изомерия:
бутин-2
бутадиен -1,3
10.
Пространственная изомерия обусловлена различным расположениемхимических связей атомов углерода в пространстве и включает
геометрическую,
оптическую
и
другие
виды
изомерии.
Пространственные изомеры называют стереоизомерами.
Пространственная изомерия:
1. Геометрическая ( «цис-транс»):
цис-изомер
транс-изомер
11.
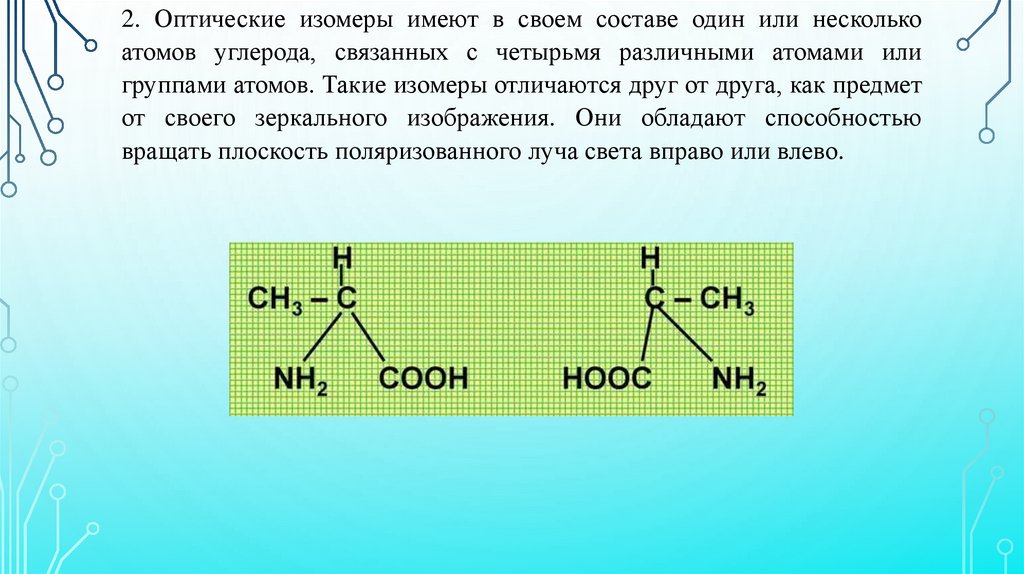
2. Оптические изомеры имеют в своем составе один или несколькоатомов углерода, связанных с четырьмя различными атомами или
группами атомов. Такие изомеры отличаются друг от друга, как предмет
от своего зеркального изображения. Они обладают способностью
вращать плоскость поляризованного луча света вправо или влево.
12.
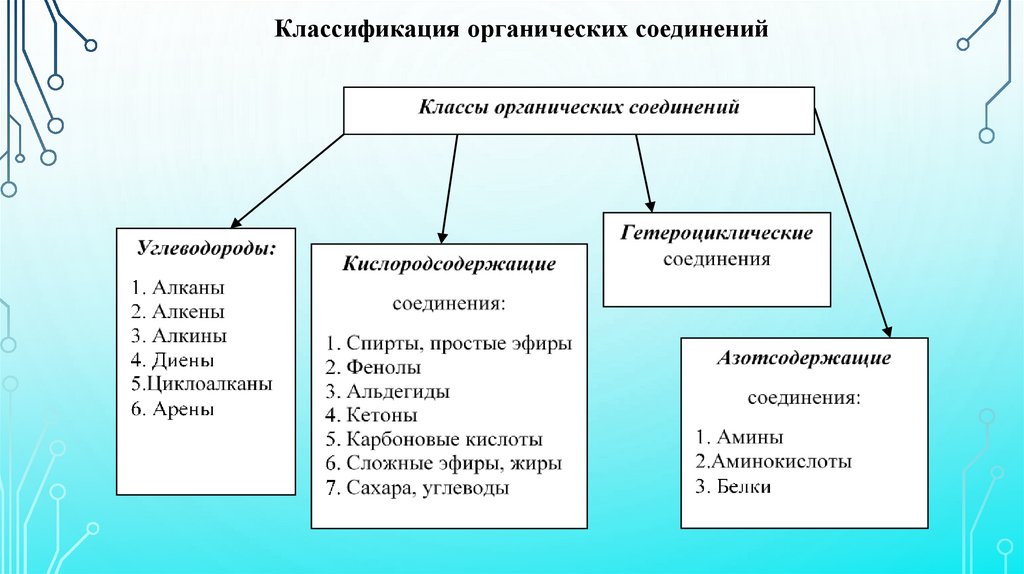
Классификация органических соединений13.
В зависимости от строения углеродной цепи органическиесоединения делят на ациклические и циклические.
Ациклические соединения – соединения с открытой
(незамкнутой)
углеродной
цепью.
Их
простейшими
представителями являются алифатические углеводороды.
Алифатические УВ содержат только атомы углерода и
водорода;
могут
быть
насыщенными,
предельными,
соединения с ординарными (не кратными) связями между
атомами углерода
(алканы);
и ненасыщенными,
непредельными соединениями с двойными или тройными
связями между атомами углерода (алкены, алкадиены, алкины).
14.
Циклические соединения – соединения с замкнутой цепью.Циклические соединения подразделяются
гетероциклические соединения.
на
карбо-
и
Кольца карбоциклических соединений содержат лишь атомы
углерода.
К карбоциклическим относятся ароматические и алициклические
соединения.
Кольца гетероциклических соединений наряду с углеродом
содержат другие атомы, например азот, кислород, серу, фосфор.
15.
Номенклатура органических соединенийТРИВИАЛЬНАЯ номенклатура (т.н.): в основе ее лежит название
соединения, которое связано с его местом нахождения или способом
получения:
O
O
H - C - OH
муравьиная кислота
H3C - CH - C - OH
OH
молочная кислота
16.
Номенклатура органических соединенийРАЦИОНАЛЬНАЯ номенклатура (р.н.): выбирается некоторая основа
(чаще всего первый представитель класса), затем называются радикалы,
находящиеся вокруг основы. В названии в начале перечисляются все
радикалы, а потом – основа.
H3C - CH2 - CH2 - CH3
метилуксусная кислота
метилэтилэтан
17.
МЕЖДУНАРОДНАЯ номенклатура (м.н.): выбирается самая длиннаяуглеродная
цепь,
содержащая
максимальное
количество
функциональных групп. Номеруется с того конца, к которому ближе
расположена старшая функциональная группа, затем называются
радикалы с указанием номера их расположения, потом называется
углеродная цепочка по количеству атомов углерода и добавляется
окончание, соответствующее наличию функциональной группы или
классовой принадлежности.
В соответствии с международной систематической номенклатурой
названия органических соединений слагаются из словесных
обозначений частей их структуры и знаков, указывающих способ связей
этих частей. Основная часть названия соединения состоит из названия
самой длинной неразветвленной цепи атомов углерода. Число
углеродных атомов в цепи (кольце) обозначаются греческими
числительными (кроме первых четырех, обозначаемых «мет» - 1, «эт» 2, «проп» - 3, «бут» - 4 атома), например «гекс» - 6, «окт» - 8.
18.
С помощью суффиксов или префиксов обозначают классы соединения.
Например, суффикс -ан входит в названия предельных соединений
(пропан, гептан), -ин — соединений с тройной связью в основной цепи
(пропин), -ол — спиртов, префикс -цикло — циклических соединений
С помощью суффикса -ил обозначают соответствующие радикалы
(например, С2Н5 — этил). Функциональным группам, входящим в состав
соединений, присвоены соответствующие названия, например: СООН- карбокси, SO3H - сульфо, ОН -гидрокси, NН2 - амино, NО - нитрозо. Число
одинаковых заменителей обозначают приставками (ди, три, тетра и т. д.), с
помощью цифр обозначают порядковые номера углеродных атомов, у
которых имеются боковые цепи или функциональные группы. (Для
обозначения боковых цепей и функциональных групп используются
дефисы, запятые, скобки.) Наряду с систематической существуют другие
виды номенклатур.
До сих пор используют тривиальные названия, которые исторически
получили те или иные соединения.
19.
Природа химических связей в углеводородахАтом углерода в возбужденном состоянии имеет четыре неспаренных
электрона. При образовании химических связей может происходить sp3-,
sp2- или sp-гибридизация атомных орбиталей углерода.
sp3-гибридизация
возникают четыре равноценные орбитали, расположенные в пространстве
относительно друг друга под углом 109,5°. Каждый атом углерода
образует четыре ковалентные связи с другими атомами углерода и с
атомами водорода.
В результате образуются предельные углеводороды
или алканы, у которых все валентности
углеродных атомов насыщены.
20.
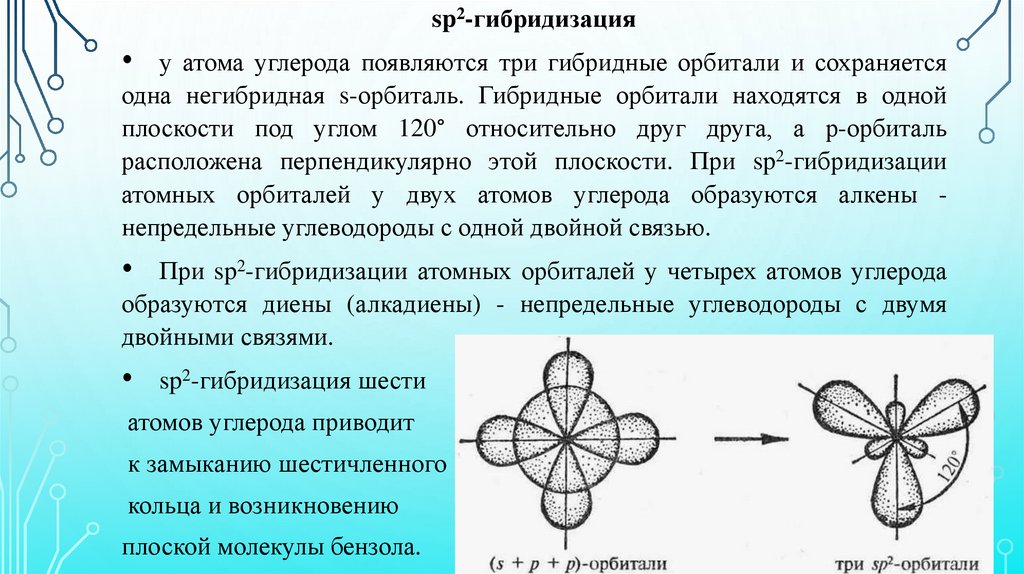
sp2-гибридизацияу атома углерода появляются три гибридные орбитали и сохраняется
одна негибридная s-орбиталь. Гибридные орбитали находятся в одной
плоскости под углом 120° относительно друг друга, а р-орбиталь
расположена перпендикулярно этой плоскости. При sp2-гибридизации
атомных орбиталей у двух атомов углерода образуются алкены непредельные углеводороды с одной двойной связью.
При sp2-гибридизации атомных орбиталей у четырех атомов углерода
образуются диены (алкадиены) - непредельные углеводороды с двумя
двойными связями.
• sp2-гибридизация шести
атомов углерода приводит
к замыканию шестичленного
кольца и возникновению
плоской молекулы бензола.
21.
sp-гибридизацияу атома углерода возникают две гибридные орбитали под углом 180°
относительно друг друга и сохраняются две негибридные р-орбитали,
расположенные под углом 90° друг к другу. Атом углерода образует две σсвязи с атомом углерода и (или) с атомом водорода и две π-связи с атомом
углерода, В результате образуется алкин - непредельный углеводород с
тройной связью.
22.
Электронные эффекты заместителейИндуктивный эффект (I – эффект) – изменение распределения электронной
плотности в молекуле из-за разницы электроотрицательности атомов.
23.
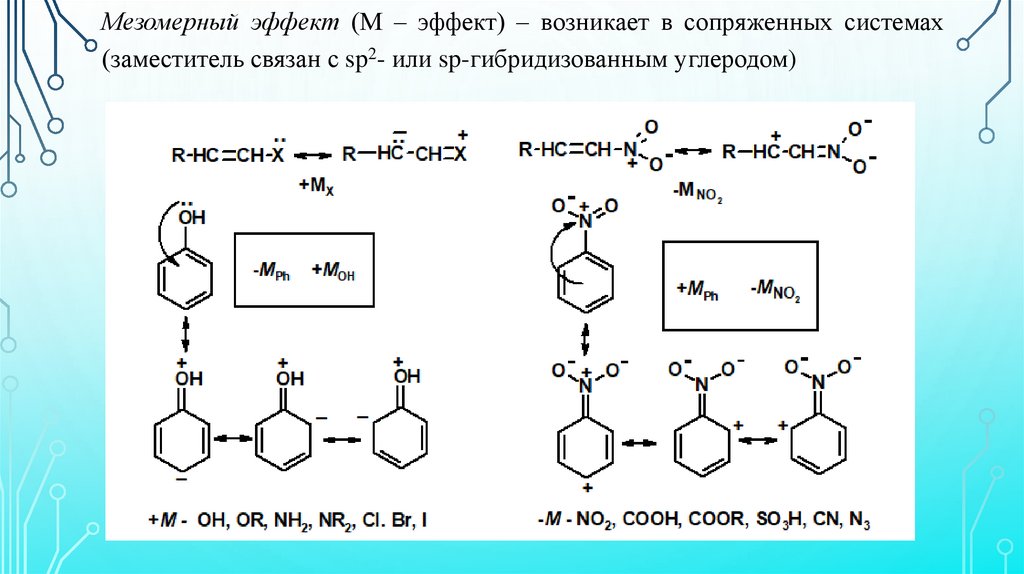
Мезомерный эффект (М – эффект) – возникает в сопряженных системах(заместитель связан с sp2- или sp-гибридизованным углеродом)
24.
Классификация химических реакций по характеру разрывахимической связи
При протекании химических реакций ковалентные связи в органических
соединениях
разрываются
либо
по
гомолитическому,
либо
гетеролитическому механизму.
При гомолитическом разрыве связи электронная пара распадается на
два электрона и соответственно возникают два атома (или две группы
атомов) с неспаренными электронами — радикалы. К гомолитическим
относятся реакции радикальной полимеризации, горения органических
соединений и др.
При гетеролитическом разрыве связи электронная пара переходит к
одному из атомов (или к одной из групп атомов), в результате этого
возникают катионы и анионы, которые принимают участие в
последующих
взаимодействиях.
Реакции,
возникающие
при
гетеролитическом разрыве связи, называются гетеролитическими или
ионными.
Большинство
органических
реакций
протекает
по
гетеролитическому механизму.
25.
Механизмы реакций в органической химииОрганические реакции можно подразделить на четыре основных типа:
1) замещение;
2) присоединение;
3) отщепление (элиминирование);
4) перегруппировка.
Иногда сложная суммарная реакция может включать несколько типовых реакций, однако
отдельные стадии суммарной реакции всегда можно отнести к одному из перечисленных
типов.
Как правило, основное органическое вещество, участвующее реакции, называют
«субстратом», тогда другой компонент реакции обычно условно рассматривают как
«реагент».
Распределение электронной плотности в реагирующей молекуле часто определяет тип
реагента, с которым основное органическое вещество (субстрат) будет реагировать. Так, в
бромистом этиле углеродный атом, связанный с атомом брома и имеющий низкую
электронную плотность, будет легко подвергаться атаке частицами, несущими
отрицательный заряд (NС-, НО-), или молекулами, в которых имеются центры с высокой
электронной плотностью (:NН3, :NR3):
δ+
δ-
СН3 - СН2→Вr + ОН- → СН3 - СН2 - ОН + ВrСубстрат
нуклеофил
26.
В этом случае реагент называют нуклеофильным реагентом илинуклеофилом, а реакция называется нуклеофильной реакцией.
Напротив, реагент с электронным дефицитом (чистый катион Н+, +NО2,
С6Н5N2+) или молекула, имеющая центр с низкой электронной плотностью SО3 и ВF3) будет реагировать с субстратом, в котором имеются центры с
высокой электронной плотностью/
Реагент такого типа называется электрофильным реагентом
электрофилом, а реакция называется электрофильной реакцией.
И
электрофильные,
и
нуклеофильные
гетеролитическими реакциями.
реакции
или
называются
Существуют реакции, в которых реагент является радикальной частицей,
несущей неспаренный электрон. Такие реакции называются радикальными
или гомолитическими реакциями.
27.
Реакция свободнорадикального замещения (галогенирование)28.
Электрофильное ароматическое замещение SEAr29.
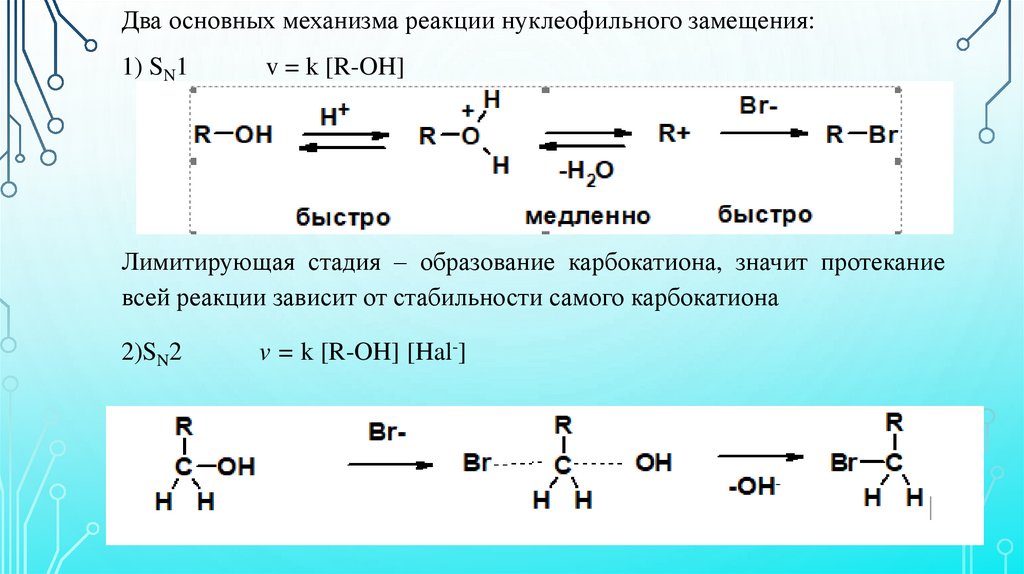
Два основных механизма реакции нуклеофильного замещения:1) SN1
v = k [R-OH]
Лимитирующая стадия – образование карбокатиона, значит протекание
всей реакции зависит от стабильности самого карбокатиона
2)SN2
v = k [R-OH] [Hal-]
30.
Источники органических соединений1. Важнейшим источником органических соединений является нефть. Она представляет собой смесь
органических веществ, главным образом углеводородов различных классов.
Так, например алканами наиболее богаты грозненская, дрогобычская, румынская пенсильванская (США)
нефти и некоторые виды мексиканской нефти; алициклические углеводороды в значительных количества:
встречаются в бакинской, эмбинской и калифорнийской нефти. Нефть, богатая ароматическими
углеводородами, встречается редко, особенно богаты ими нефти с островов Борнео и Суматра, а в СНГ пермская и майкопская.
Кроме углеводородов в нефти имеются небольшие количества соединений, содержащих кислород, серу,
азот и др. Нефть некоторые месторождений содержит значительные количества сернистых веществ
(башкирская и техасская нефти) или азотистых соединений (алжирская и калифорнийская нефти).
Продукты нефтепереработки все шире используются для получения органических соединений.
Все виды каменного угля содержат помимо элементарного углерода много сложных органических
соединений, содержащих С, Н, О, N и S. На коксохимических и газовых заводах при сухой перегонке
каменного угля получают в настоящее время примерно в 10 раз меньше органических веществ, чем из
нефти, однако большая часть ароматических соединений добывается из каменноугольного дегтя.
Довольно много органических веществ содержится в торфе и в битуминозных или горючих сланцах.
Огромное количество ценных органических материалов получают из основной части древесины целлюлозы. Одни из материалов такого рода («определенные сорта бумаги, картона) получаются
механической обработкой клетчатки, другие (искусственное волокно, спирт, порох, пластические массы) - с
помощью ее химической переработки.
Животное сырье хотя и в меньших количествах, но все же перерабатывается на аминокислоты, глицерин,
карбоновые кислоты другие продукты.
31.
Значение органической химии:1.
Использование добавок в комбикорма, биологически активных добавок,
2.
Использование полимеров;
3.
Обработка почв путем применения пестицидов и гербицидов;
4.
Применение лекарственных препаратов в ветеринарии;
5.
Использование удобрений;
6.
7.
Использование органических соединений
растительного сырья от вредителей;
для
защиты
кормов,
Применение органических соединений в производстве продуктов
сельского хозяйства: молока, мяса, шкур животных.



























 Химия
Химия








