Похожие презентации:
osnovy_termodinamiki
1. Основы т ермодинамики
Основытермодинамики
Урок физики в 10 классе
2. Основы термодинамики
_________Термодинамика – теория тепловых
процессов, в которой не учитывается
молекулярное строение тел.
3.
Внутренняя энергия• Определение:
Внутренняя энергия тела – это сумма
кинетической энергии хаотического
теплового движения частиц (атомов и молекул) тела и потенциальной энергии их
взаимодействия
• Обозначение:
• Единицы измерения:
U
[Дж]
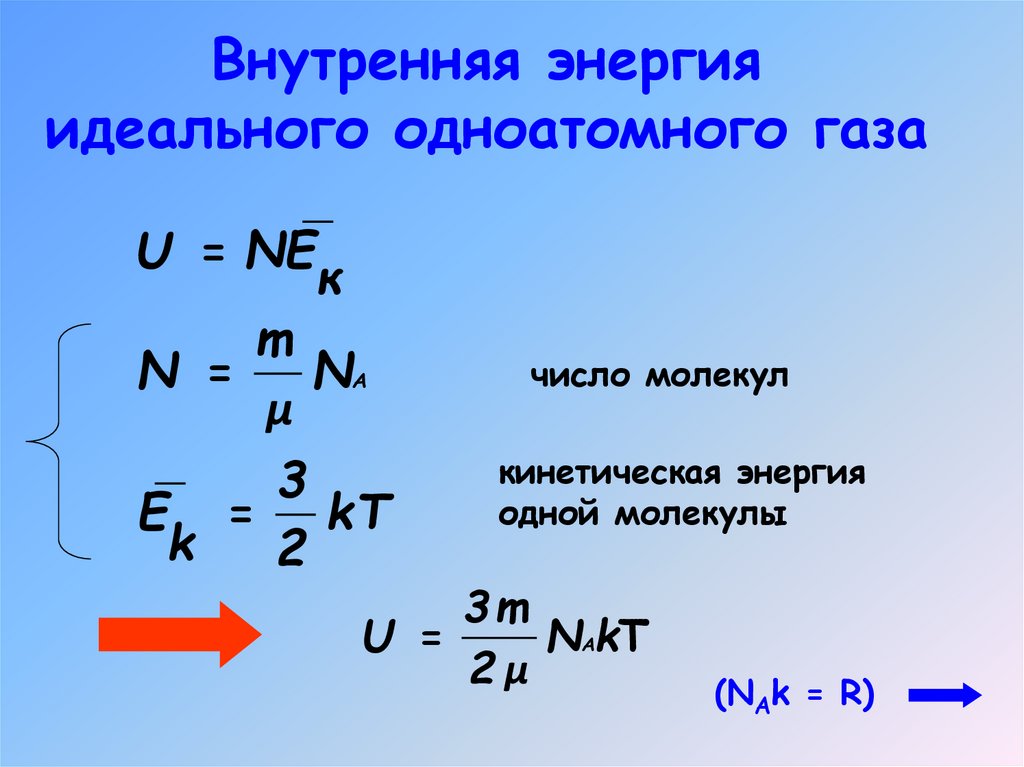
4. Внутренняя энергия
идеального одноатомного газаU = NE
к
m
N =
NА
μ
3
E = kT
k
2
число молекул
кинетическая энергия
одной молекулы
3m
U =
NАkT
2μ
(NAk = R)
5. Внутренняя энергия идеального одноатомного газа
3 mU =
RT
2 μ
Внутренняя энергия идеального одноатомного газа зависит лишь
от одного термодинамического параметра - температуры
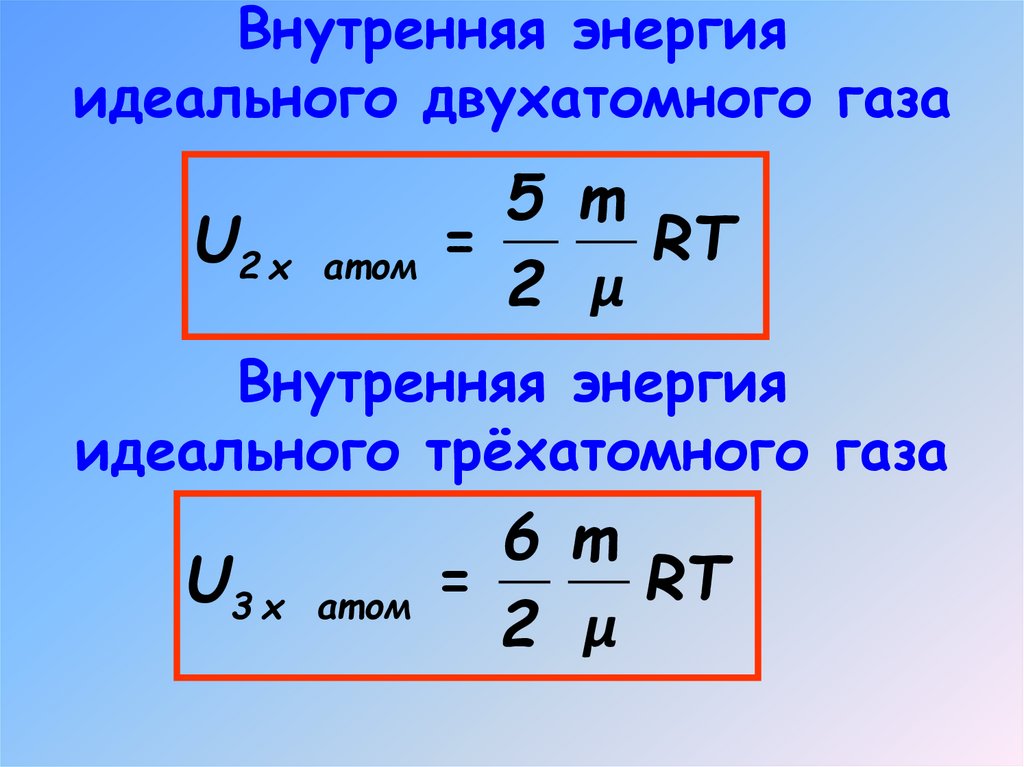
6. Внутренняя энергия идеального одноатомного газа
Внутренняя энергияидеального двухатомного газа
5 m
U2 х ат ом =
RT
2 μ
Внутренняя энергия
идеального трёхатомного газа
6 m
U3 х ат ом =
RT
2 μ
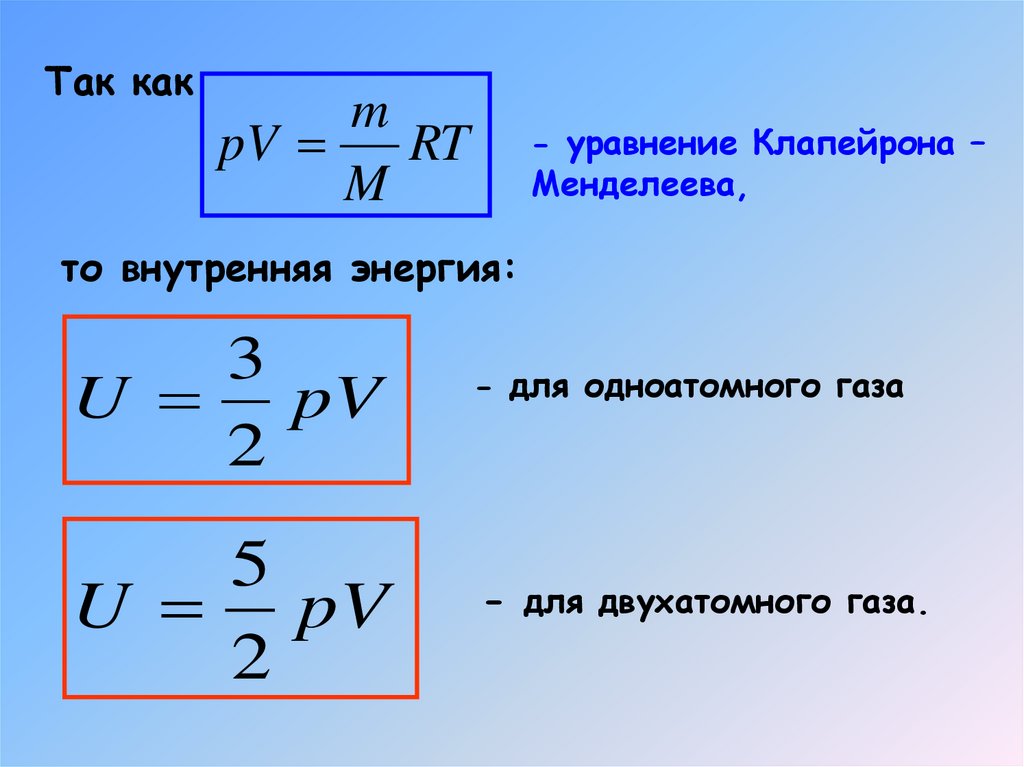
7. Внутренняя энергия идеального двухатомного газа
Так какm
pV
RT
M
- уравнение Клапейрона –
Менделеева,
то внутренняя энергия:
3
U pV
2
5
U pV
2
- для одноатомного газа
- для двухатомного газа.
8.
В общем виде:i m
i
U
RT pV
2M
2
где i – число степеней свободы молекул
газа (i = 3 для одноатомного газа и i = 5
для двухатомного газа), i = 6 для
трёхатомного газа),
9. В общем виде:
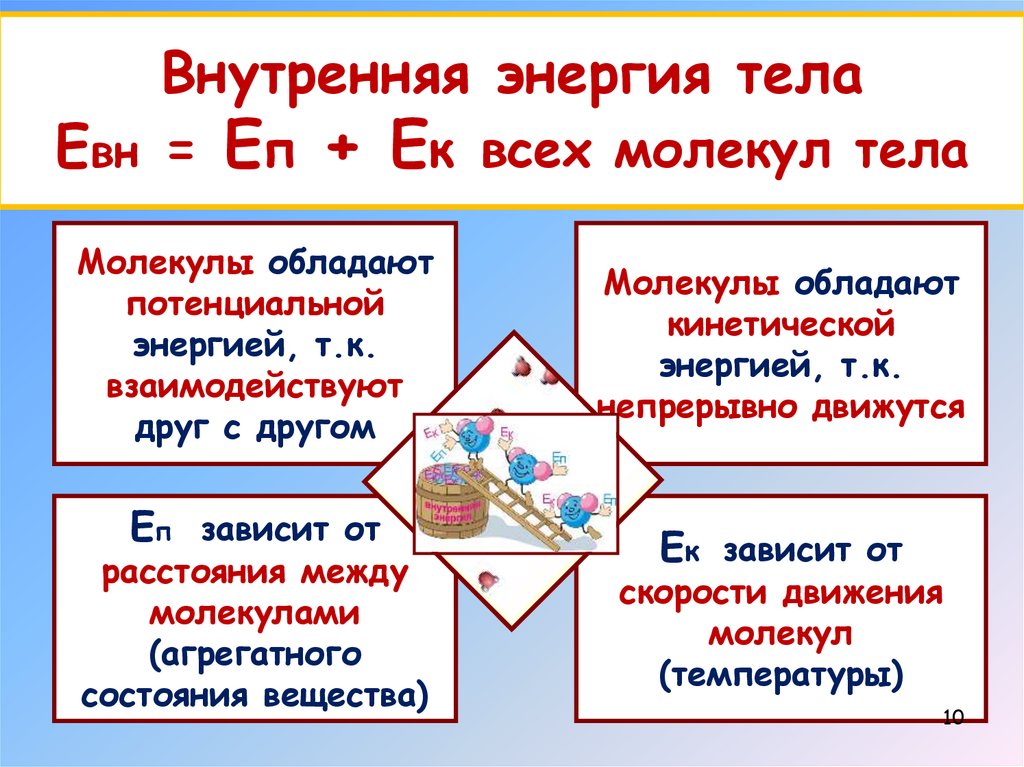
Внутренняя энергия телаЕвн = Еп + Ек всех молекул тела
Молекулы обладают
потенциальной
энергией, т.к.
взаимодействуют
друг с другом
Еп зависит от
расстояния между
молекулами
(агрегатного
состояния вещества)
Молекулы обладают
кинетической
энергией, т.к.
непрерывно движутся
Ек зависит от
скорости движения
молекул
(температуры)
10
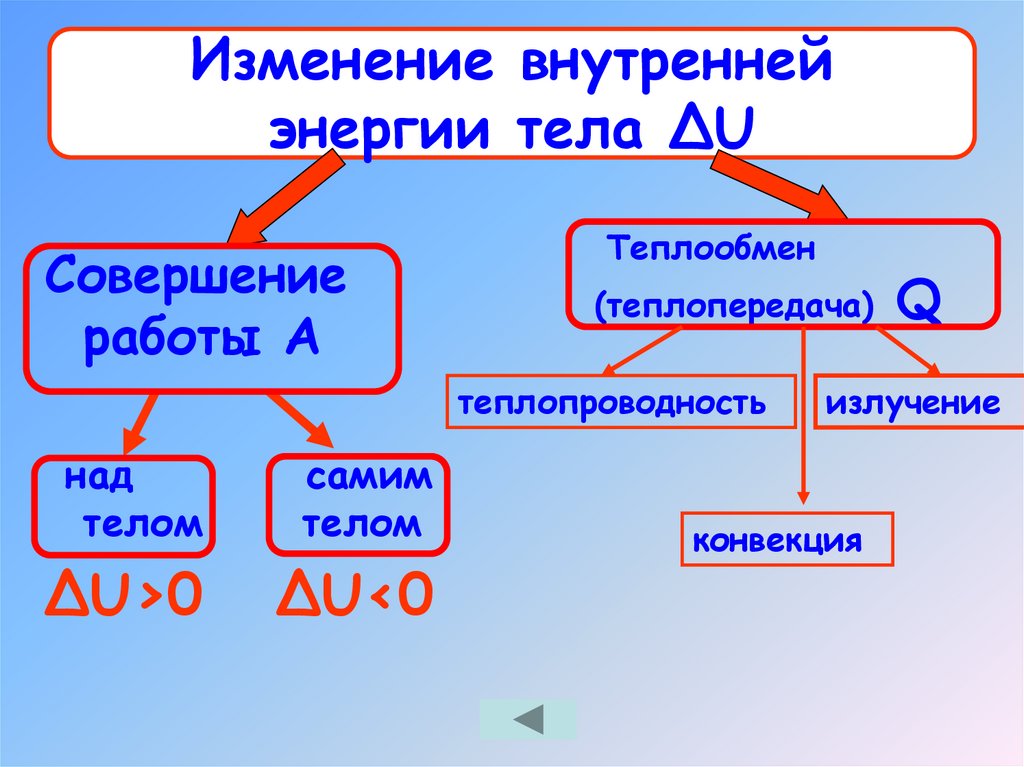
10.
Изменение внутреннейэнергии тела ΔU
Совершение
работы А
Теплообмен
(теплопередача) Q
теплопроводность
над
телом
самим
телом
ΔU>0
ΔU<0
излучение
конвекция
11. Изменение внутренней энергии тела ΔU
Процесс изменения внутренней энергии без совершенияработы над телом или самим
телом называется теплопередачей
12
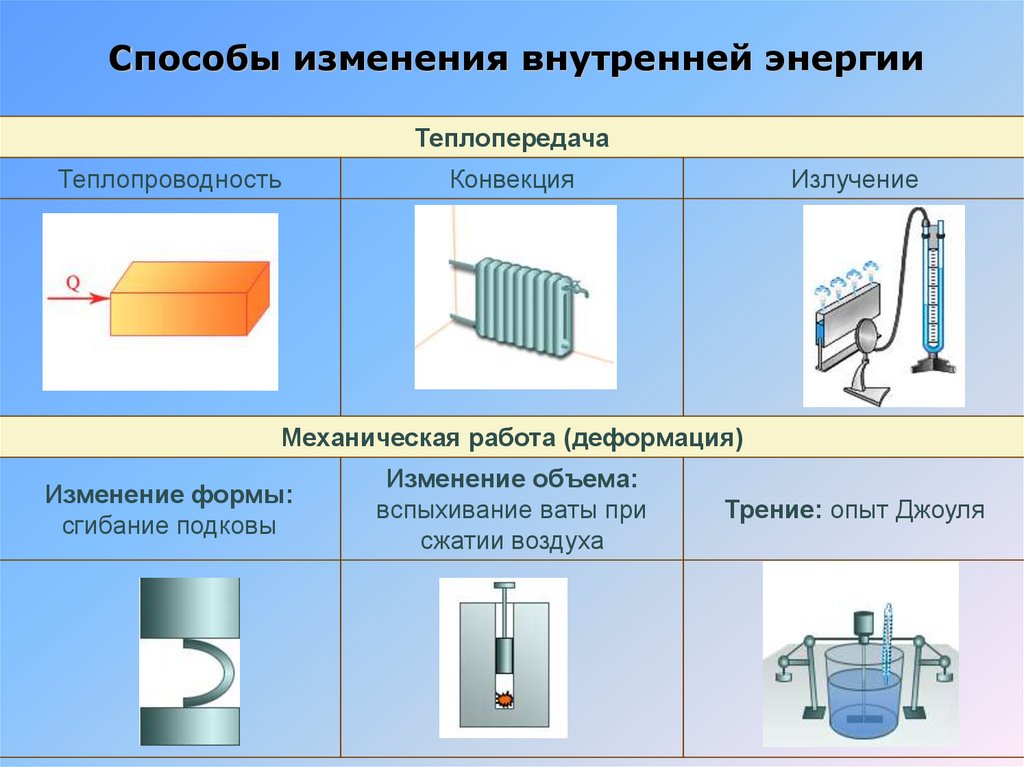
12.
Способы изменения внутренней энергииТеплопередача
Теплопроводность
Конвекция
Излучение
Механическая работа (деформация)
Изменение формы:
сгибание подковы
Изменение объема:
вспыхивание ваты при
сжатии воздуха
Трение: опыт Джоуля
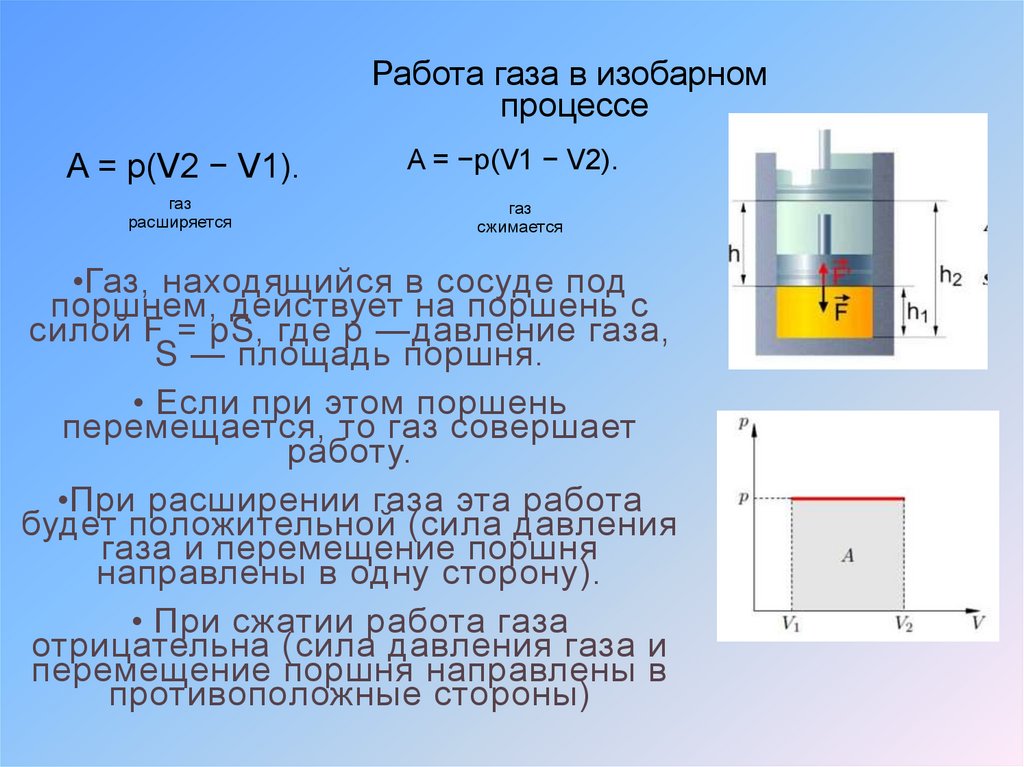
13.
Работа газа при изобарном процессеГаз до расширения и после
Работа газа при
изобарном процессе
Это работа, которую выполняла сила,
с которой газ действовал на поршень
По третьему закону Ньютона, эта сила
по модулю равна силе, с которой
поршень действовал на газ, и
противоположна ей по направлению.
Обозначим силу, действовавшую на
газ:
14.
Работа в термодинамике• Работа газа:
A p(V2 V1 ) p V
• Работа внешних сил:
A A
15. Работа в термодинамике
Работа газа в изобарномпроцессе
A = p(V2 − V1).
A = −p(V1 − V2).
газ
расширяется
газ
сжимается
•Газ, находящийся в сосуде под
поршнем, действует на поршень с
силой F = pS, где p —давление газа,
S — площадь поршня.
• Если при этом поршень
перемещается, то газ совершает
работу.
•При расширении газа эта работа
будет положительной (сила давления
газа и перемещение поршня
направлены в одну сторону).
• При сжатии работа газа
отрицательна (сила давления газа и
перемещение поршня направлены в
противоположные стороны)
16.
Работа газа при изопроцессах• При изохорном процессе (V=const):
ΔV = 0 работа газом не
совершается:
P
A = pΔV , ΔV = 0
A 0
V
Изохорное нагревание
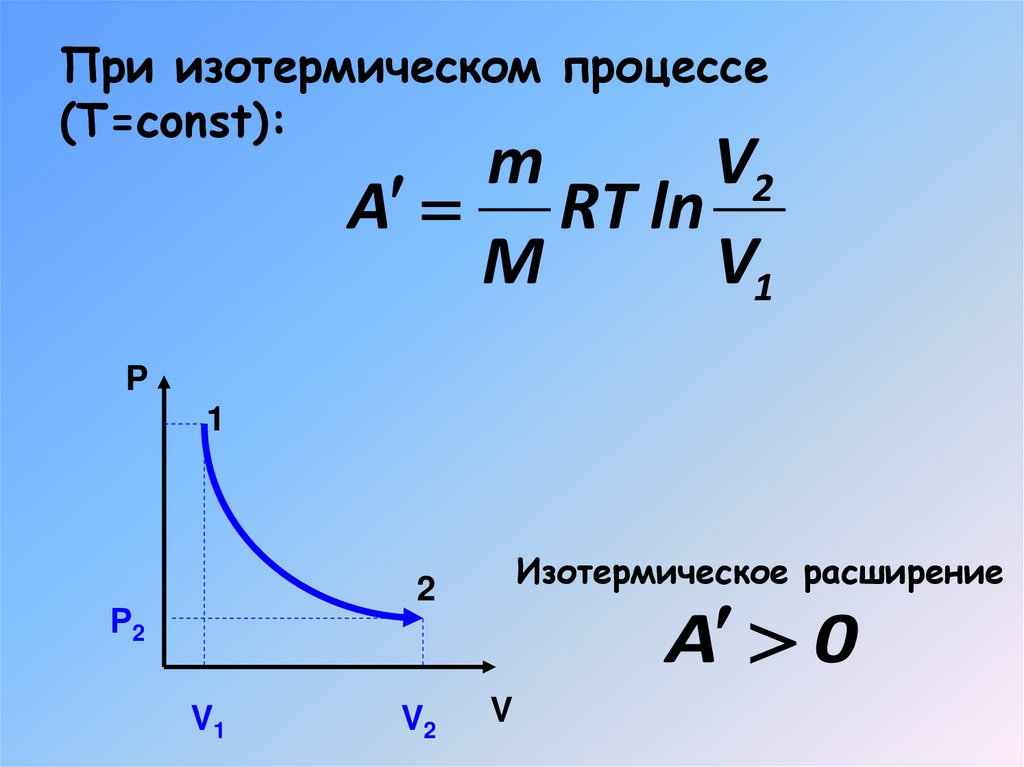
17. Работа газа при изопроцессах
При изотермическом процессе(Т=const):
m
V2
A RT ln
M
V1
P
1
Изотермическое расширение
2
Р2
V1
V2
A 0
V
18. При изотермическом процессе (Т=const):
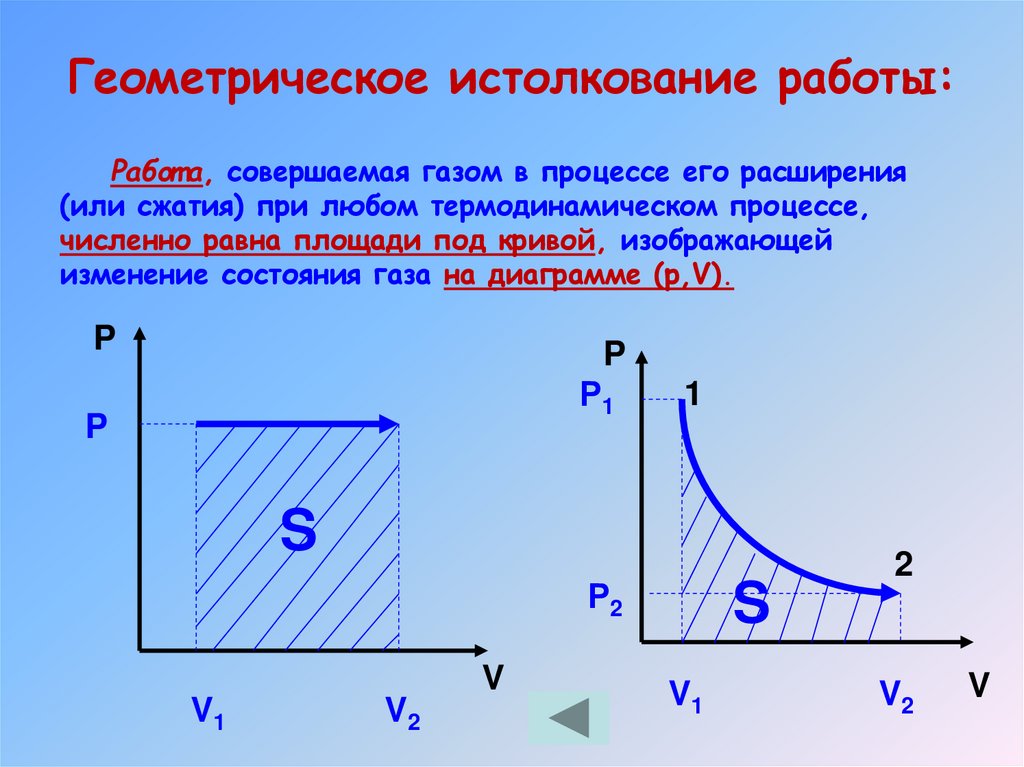
Геометрическое истолкование работы:Работ а, совершаемая газом в процессе его расширения
(или сжатия) при любом термодинамическом процессе,
численно равна площади под кривой, изображающей
изменение состояния газа на диаграмме (р,V).
P
P
Р1
P
1
S
Р2
V
V1
V2
S
V1
2
V2
V
19. Геометрическое истолкование работы:
Количество теплоты – часть внутреннейэнергии, которую тело получает или теряет при
теплопередаче
формула
Процесс
Нагревание или
охлаждение
Кипение или
конденсация
Q cm T
С – удельная теплоёмкость
вещества [ Дж/кг К], m –
масса [кг], ΔT – изменение
температуры [ K].
Q Lm rm
r – удельная теплота
парообразования [ Дж/кг ]
Плавление или
кристаллизация
Q m λ- удельная теплота
Сгорание
топлива
– удельная теплота сгорания
Q qm qтоплива
[ Дж/кг ]
плавления вещества [ Дж/кг ]
20. Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче
Анализ результатов опытов и наблюдений природныхявлений, выполненных к середине XIX века, привел
немецкого ученого Р. Майера, английского ученого
Д-Джоуля и немецкого ученого Г. Гельмгольца
к выводу о существовании закона сохранения энергии:
21.
22.
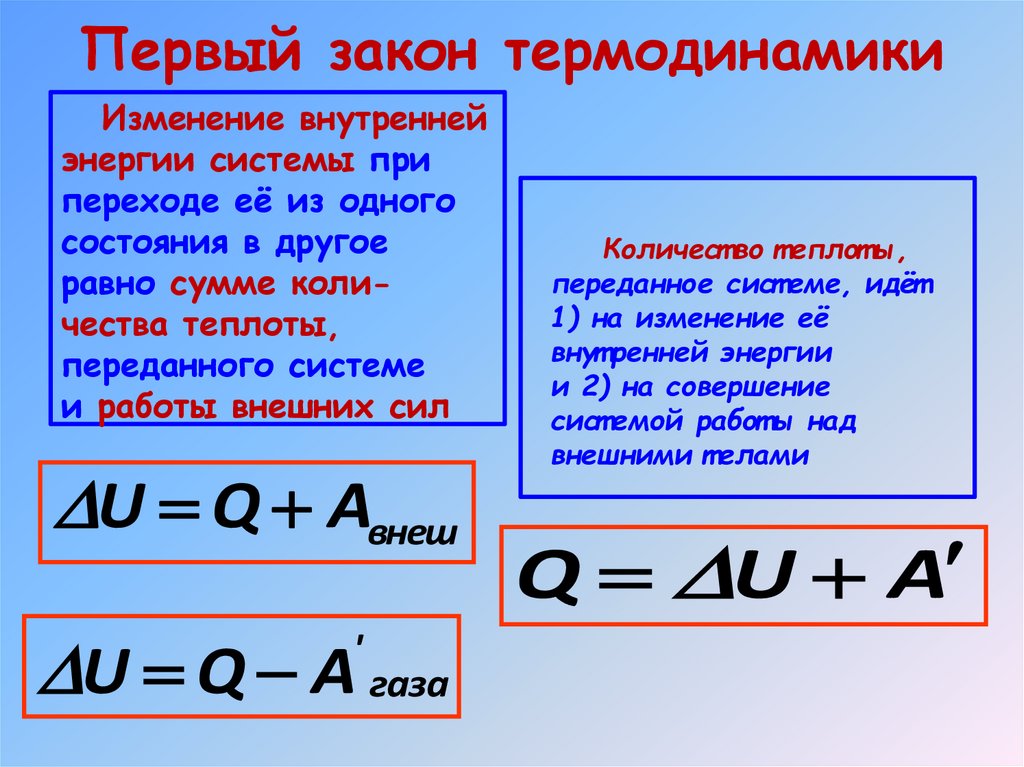
I закон термодинамикивнутренняя энергия
определяется только
состоянием системы,
причем изменение
внутренней энергии
системы при переходе
ее из одного состояния
в другое равно сумме
работы внешних сил и
количества теплоты,
переданного системе:
ΔU = Aвнешн + Q
23. I закон термодинамики
Если при нагревании газ расширяется ипри этом совершает работу A, то первый
закон термодинамики можно
сформулировать по-другому:
Q = ΔU + AI
Количество теплоты, переданное газу, равно
сумме изменения его внутренней энергии и
работы, совершенной газом.
Так как работа газа и работа внешних сил
вследствие
3-го закона Ньютона равны по модулю и
имеют противоположный знак:
Aвнешн = –AI
24. Если при нагревании газ расширяется и при этом совершает работу A, то первый закон термодинамики можно сформулировать
Первый закон термодинамикиИзменение внутренней
энергии системы при
переходе её из одного
состояния в другое
равно сумме количества теплоты,
переданного системе
и работы внешних сил
U Q Aвнеш
U Q A газа
'
Количест во т еплот ы,
переданное сист еме, идёт
1) на изменение её
внут ренней энергии
и 2) на совершение
сист емой работ ы над
внешними т елами
Q U A
25. Первый закон термодинамики
первый закон т ермодинамики - Закон сохраненияи превращения энергии, распространённый на
тепловые явления.
∆U=A+Q.
Если система замкнута работа внешней
силы
А=0,
теплообмен с окружающими телами не
происходит
Q=0,
внутренняя энергия изолированной
системы сохраняется
U1=U2.
26. первый закон т ермодинамики - Закон сохранения и превращения энергии, распространённый на тепловые явления.
Вечный двигатель—устройство, способноесовершать неограниченное количество работы без
затрат топлива или каких-либо других
материалов.
Если к системе не поступает теплота (Q=0 ), то
работа совершается только за счёт убыли
внутренней энергии:
A`=-∆U.
После того как запас энергии окажется
исчерпанным, двигатель перестанет работать.
Невозможность вечного двигателя!
27. Невозможность вечного двигателя!
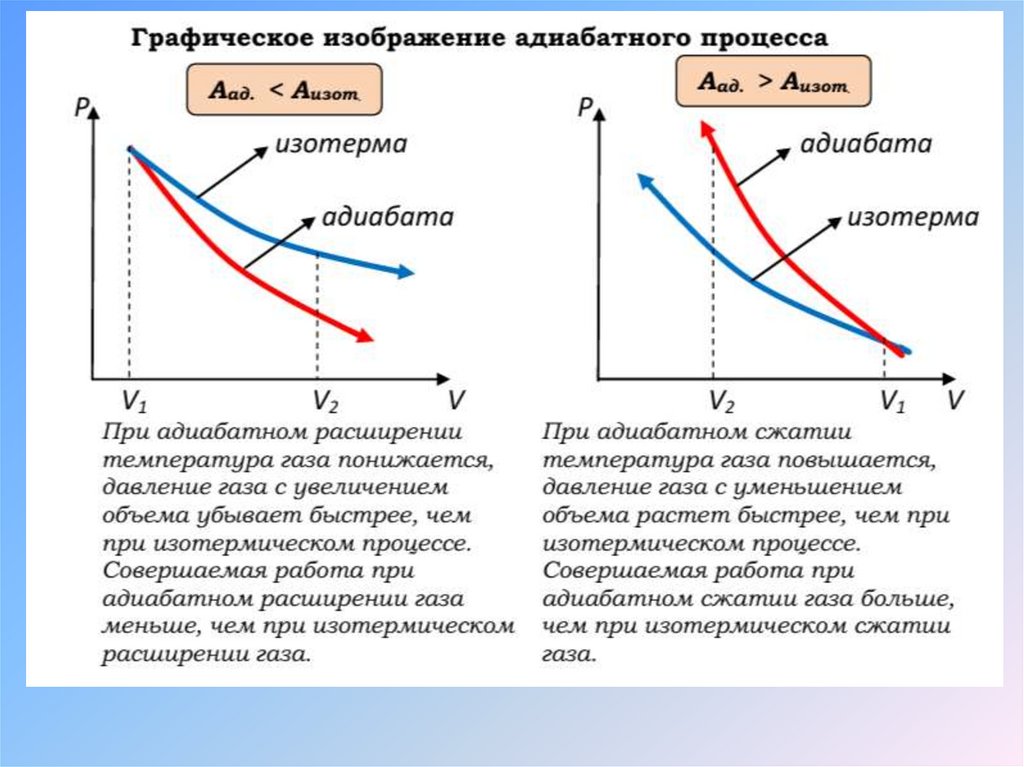
Адиабат ный процесс– это модель термодинамического процесса,
происходящего в системе без теплообмена
с окружающей средой.
28. Адиабат ный процесс
29.
30.
I закон термодинамики и изопроцессыНАЗВАНИЕ
ПРОЦЕССА
ГРАФИК
АДИАБАТНОЕ
РАСШИРЕНИЕ р
1
Q
УРАВНЕНИЕ I
ЗАКОНА ТД
ΔU<0 АI>0 Q=0
ΔU = -АI
ΔU = А
ΔU>0 АI<0 Q=0
ΔU = -АI
ΔU = А
ΔU
AI
2
V
АДИАБАТНОЕ
СЖАТИЕ
р 2
1
V
ИЗОТЕРМА
АДИАБАТА
31. I закон термодинамики и изопроцессы
НАЗВАНИЕПРОЦЕССА
ИЗОТЕРМ.
РАСШИРЕНИЕ
ГРАФИК
р 1
ΔU
AI
0
АI>0 Q>0
Q
УРАВНЕНИЕ I
ЗАКОНА ТД
Q = АI
2
V
ИЗОБАРИЧ.
РАСШИРЕНИЕ
р
1
2
ΔU>0 АI>0 Q>0
Q = АI+ ΔU
ΔU>0 АI=0 Q>0
Q = ΔU
V
ИЗОХОРНОЕ
НАГРЕВАНИЕ
р
2
1
V
32. I закон термодинамики и изопроцессы
НАЗВАНИЕПРОЦЕССА
ИЗОТЕРМ.
СЖАТИЕ
ГРАФИК
р 2
ΔU
AI
0
АI<0 Q<0
Q
УРАВНЕНИЕ I
ЗАКОНА ТД
Q = АI
1
V
ИЗОБАРИЧ.
СЖАТИЕ
р
2
1
ΔU<0 АI<0 Q<0
Q = АI+ ΔU
ΔU<0 АI=0 Q<0
Q = ΔU
V
ИЗОХОРНОЕ
ОХЛАЖДЕНИЕ
р
1
2
V
33. I закон термодинамики и изопроцессы
34.
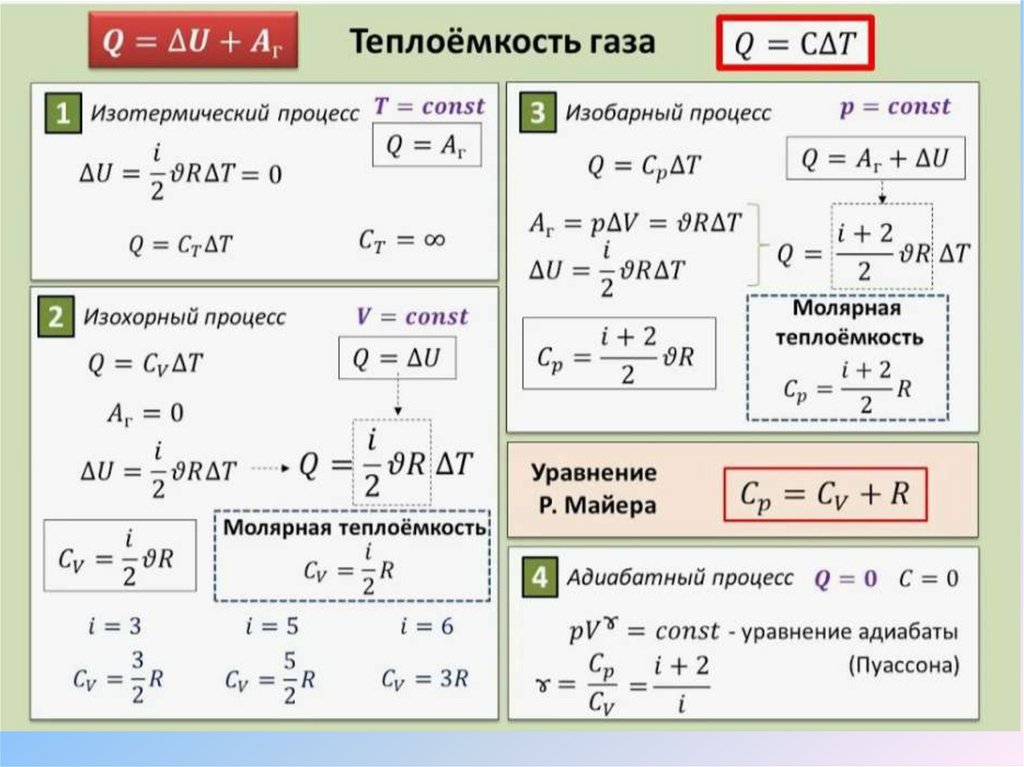
Теплоемкость молярная35. Теплоемкость молярная
Молярная теплоёмкость — физическаявеличина, которая характеризует способность
вещества поглощать или отдавать тепловую
энергию при изменении температуры на
единицу при постоянном давлении или
объёме. Определяется как количество тепла,
необходимое для изменения температуры
одного моля вещества на один градус.
36. Молярная теплоёмкость — физическая величина, которая характеризует способность вещества поглощать или отдавать тепловую энергию
37.
38.
39.
40.
Второй законтермодинамики
41. Второй закон термодинамики
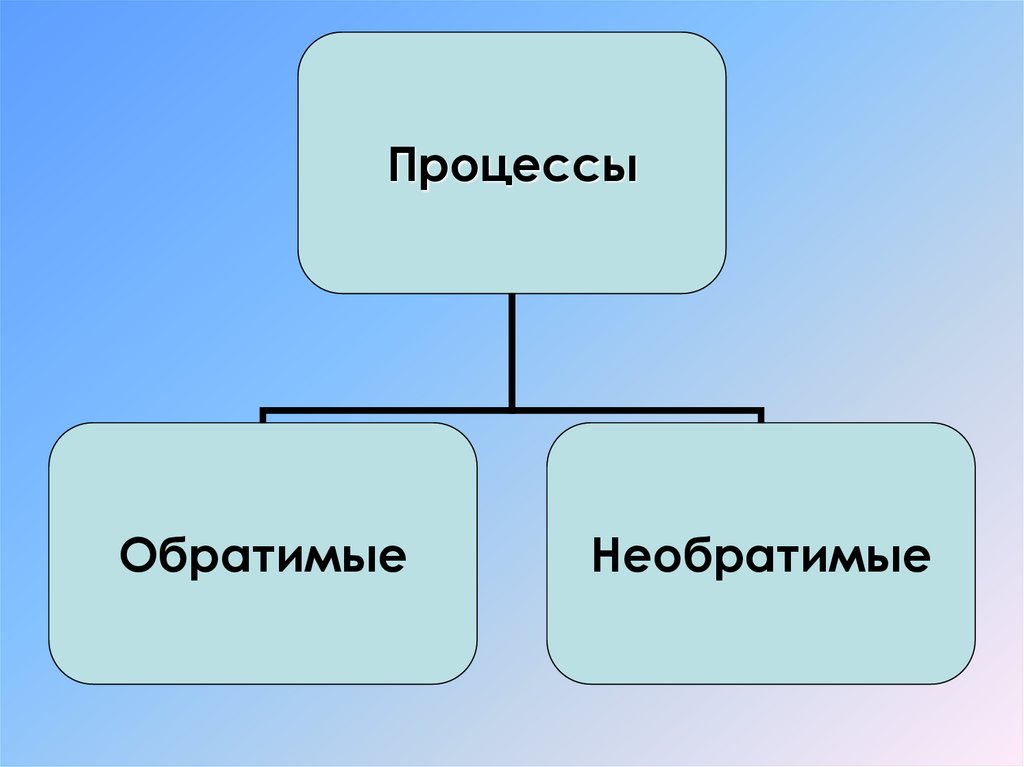
ПроцессыОбратимые
Необратимые
42.
Обратимый процесс• Это процесс, который может
происходить как в прямом, так и в
обратном направлении
• Обратимый процесс – это
идеализация реального процесса.
• Все макроскопические процессы
проходят в определенном
направлении
43. Обратимый процесс
Необратимый процесс• Процесс, обратный которому
самопроизвольно не происходит
• Все макроскопические процессы
являются необратимыми
44. Необратимый процесс
Примеры• Кусок льда, внесенный в комнату,
не отдает энергию окружающей
среде и не охлаждается
• Маятник самостоятельно не
наращивает амплитуду колебаний
45. Примеры
Ни охлаждение льда в первомслучае, ни увеличение
амплитуды во втором не
противоречит ни закону
сохранения энергии, ни
законам механики. Оно
противоречит лишь второму
закону термодинамики
46.
47.
48.
Второй закон термодинамикиВ циклически действующем
тепловом двигателе
невозможно преобразовать все
количество теплоты,
полученное от нагревателя, в
механическую работу
49. Второй закон термодинамики
Формулировка Р. Клаузиуса• Невозможно
перевести тепло
от более холодной
системы к более
горячей при
отсутствии
одновременных
изменений в обоих
системах или
окружающих
телах
50. Формулировка Р. Клаузиуса
Формулировка У. Кельвина• Невозможно
осуществить такой
периодический
процесс,
единственным
результатом которого
было бы совершение
работы за счет
теплоты взятой от
одного источника
51. Формулировка У. Кельвина
Статистическое истолкованиевторого закона термодинамики
Изолированная система
самопроизвольно переходит из менее
вероятного состояния в более
вероятное, или
Замкнутая система многих частиц
самопроизвольно переходит из более
упорядоченного состояния в менее
упорядоченное
52. Статистическое истолкование второго закона термодинамики
53.
54.
55.
56.
57.
58.
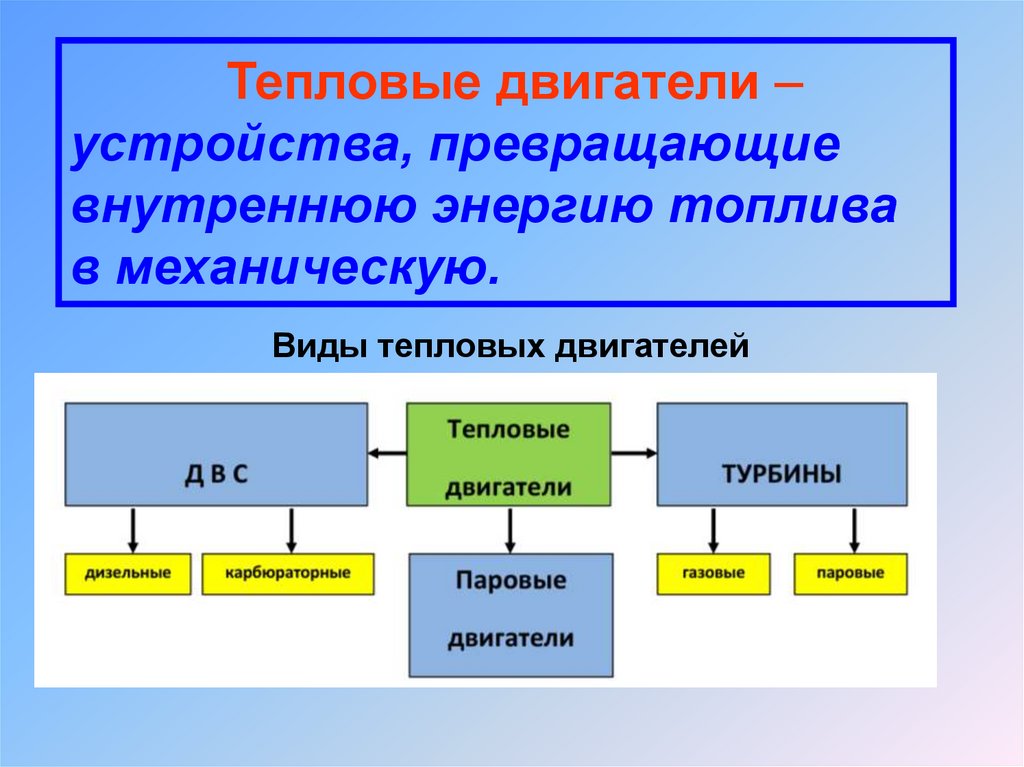
Тепловые двигатели –устройства, превращающие
внутреннюю энергию топлива
в механическую.
Виды тепловых двигателей
59.
Тепловые машины бывают двух видов — взависимости от направления протекающих в них
процессов.
1. Тепловые двигатели преобразуют теплоту,
поступающую от внешнего источника, в механическую
работу. Автомобильный двигатель внутреннего
сгорания — это пример теплового двигателя. В нѐм
происходит преобразование тепла, выделяющегося
при сгорании топлива, в механическую энергию
автомобиля.
2. Холодильные машины передают тепло от менее
нагретого тела к более нагретому за счѐт
механической работы внешнего источника. В бытовом
холодильнике - тепло отводится от холодильной
камеры и передаѐтся в окружающее пространство.
60.
61.
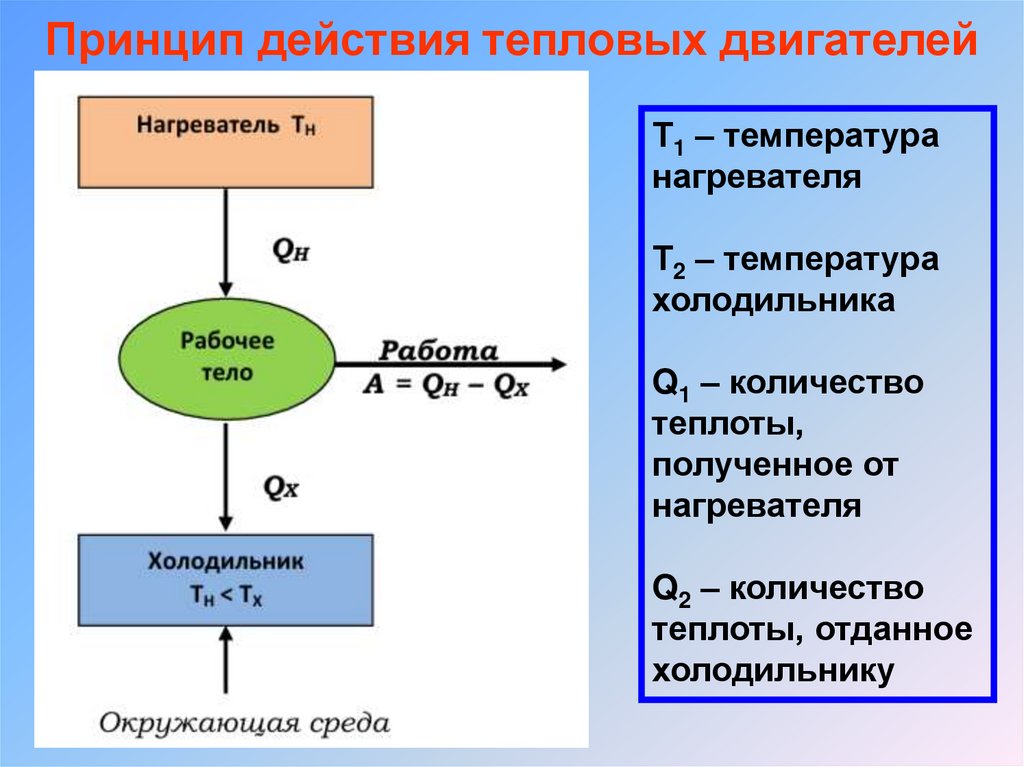
Принцип действия тепловых двигателейТ1 – температура
нагревателя
Т2 – температура
холодильника
Q1 – количество
теплоты,
полученное от
нагревателя
Q2 – количество
теплоты, отданное
холодильнику
62.
63.
Коэффициент полезногодействия (КПД) теплового
двигателя –
отношение работы А’, совершаемой двигателем, к
количеству теплоты, полученному от
нагревателя:
А
Q1
64.
гдеА Q1 Q2 -работа, совершаемая
двигателем
тогда
Q1 Q2
1
При
Q1
1
Q2
Q1
КПД всегда меньше единицы, так
как у всех двигателей некоторое
количество теплоты
передаётся холодильнику
Т1 Т 2 0 двигатель не может работать
65.
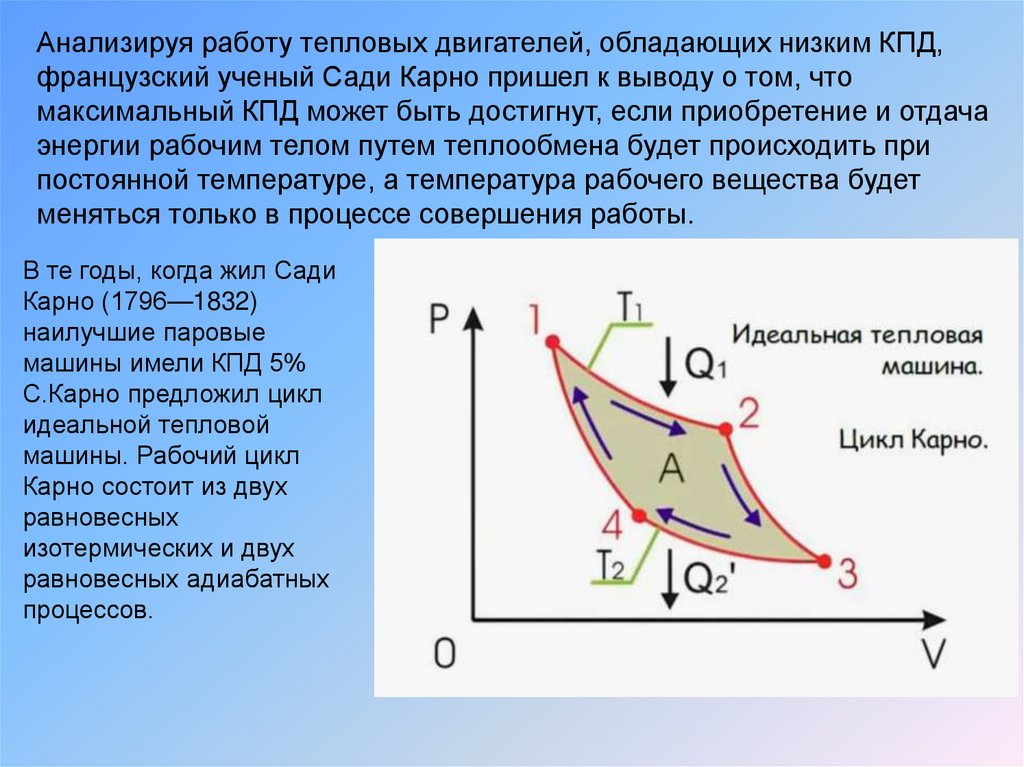
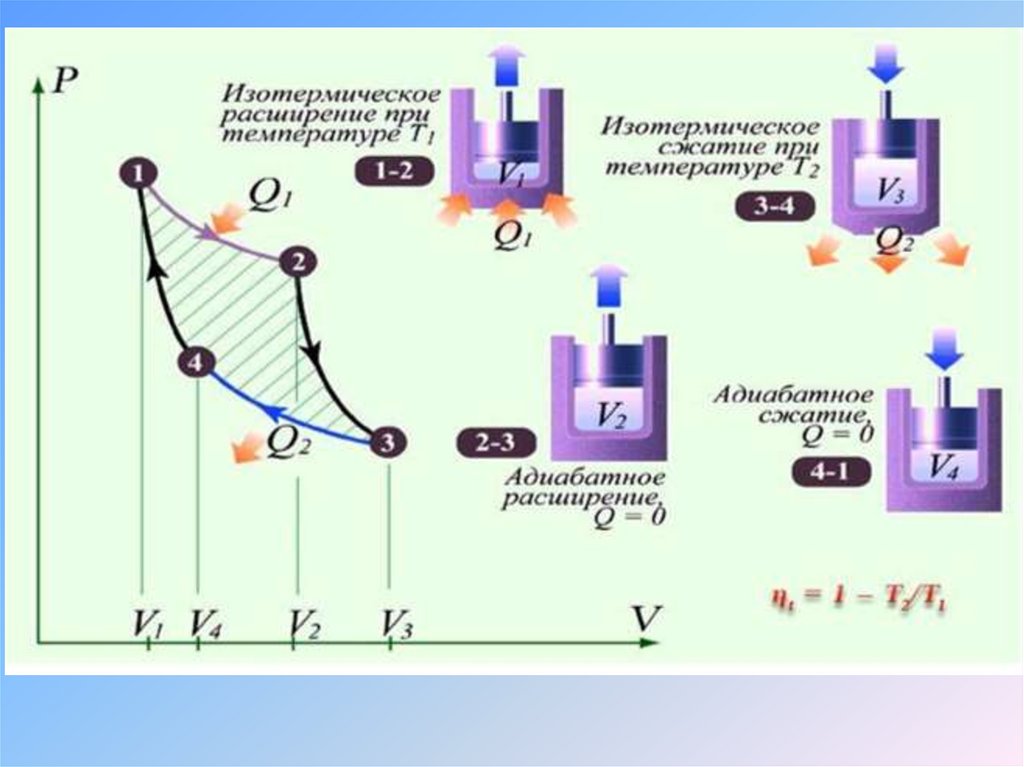
Анализируя работу тепловых двигателей, обладающих низким КПД,французский ученый Сади Карно пришел к выводу о том, что
максимальный КПД может быть достигнут, если приобретение и отдача
энергии рабочим телом путем теплообмена будет происходить при
постоянной температуре, а температура рабочего вещества будет
меняться только в процессе совершения работы.
В те годы, когда жил Сади
Карно (1796—1832)
наилучшие паровые
машины имели КПД 5%
С.Карно предложил цикл
идеальной тепловой
машины. Рабочий цикл
Карно состоит из двух
равновесных
изотермических и двух
равновесных адиабатных
процессов.
66.
67.
Максимальное значение КПДтепловых двигателей (цикл Карно):
T1 T2
max
T1
68.
69.
Отрицательные последствияиспользования тепловых
двигателей:
•Потепление климата
•Загрязнение атмосферы
•Уменьшение кислорода в
атмосфере
Решение проблемы:
•Вместо горючего использовать
сжиженный газ.
•Бензин заменить водородом.
•Электромобили.
•Дизели.
•На тепловых электростанциях
использовать скрубберы, в
которых сера связывается с
известью.
•Сжигание угля в кипящем слое.
КПД тепловых двигателей
Двигатель
КПД, %
Паровая
машина
1
Паровоз
8
20 - 30
Карбюраторный двигатель
Газовая
турбина
36
Паровая
турбина
35 - 46
Ракетный
двигатель на
жидком топливе
47













































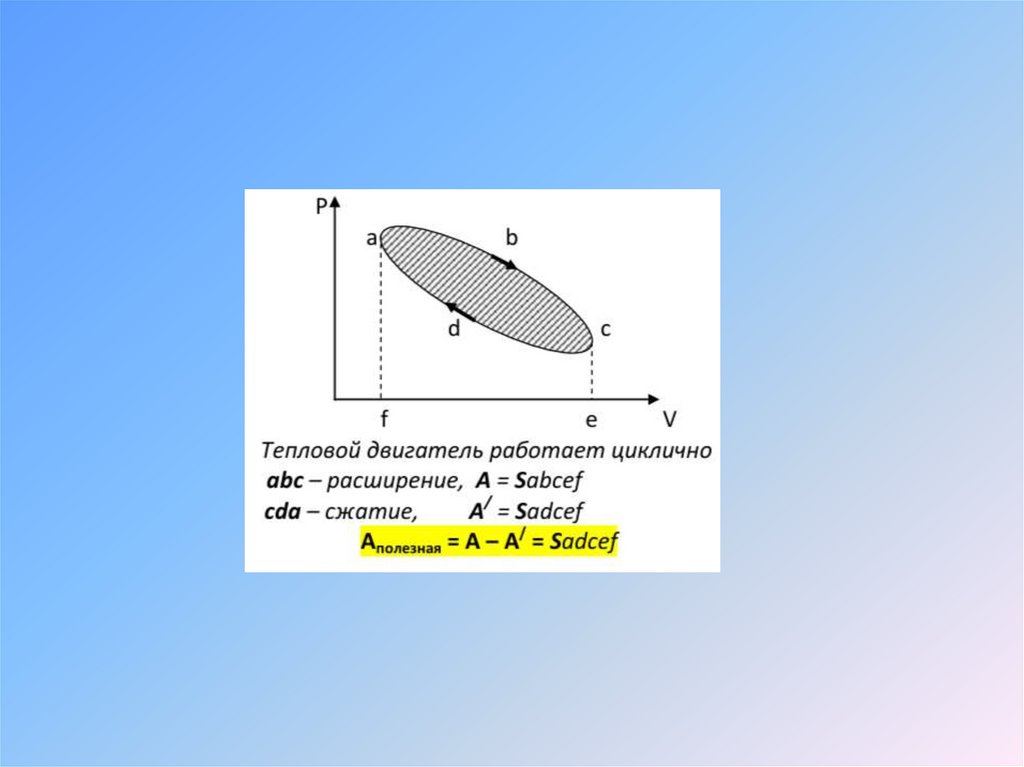



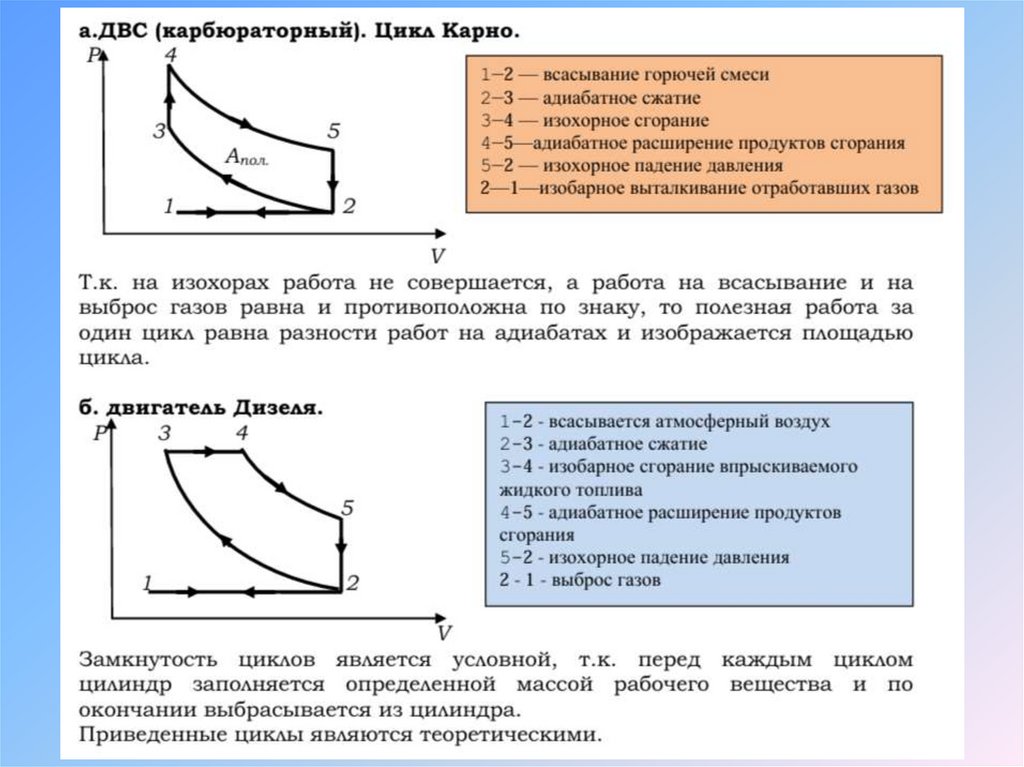

 Физика
Физика








