Похожие презентации:
Элементы физики атомов и молекул
1. Элементы физики атомов и молекул
2. АТОМ ВОДОРОДА В КВАНТОВОЙ МЕХАНИКЕ
Потенциальнаяэнергия
взаимодействия
электрона с ядром
Z- заряд ядра
r – расстояние между
электроном и
ядром
2
Ze
U
4 0 r
3.
Уравнение Шредингера для атомаводорода
2
E U 0
2m
2
2
Ze
0
E
2m
4 0 r
m – масса электрона
Е – полная энергия
4.
Диф. уравнение имеет решениетолько при
2
4
1 Z me
En 2 2 2 ,
n 8h 0
n 1,2,3...
Дискретный набор отрицательных
энергий
5.
n=1 – основнойуровень
n 2
возбужденные уровни
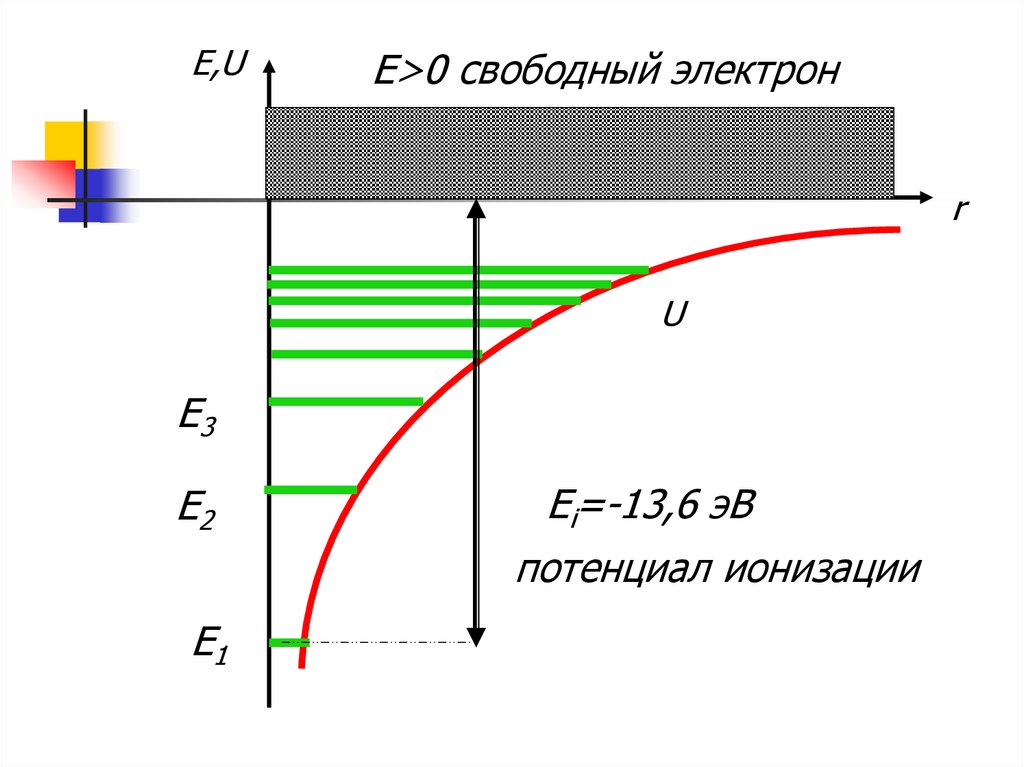
При Е<0 электрон находится в связанном
состоянии внутри гиперболической
потенциальной ямы
При Е>0 электрон становится свободным
При увеличении n уровни располагаются
ближе друг к другу
6.
E,UE>0 свободный электрон
r
U
E3
E2
Ei=-13,6 эВ
потенциал ионизации
E1
7.
Собственныефункции уравнения
Шредингера
содержат 3
целочисленных
параметра n,l,m
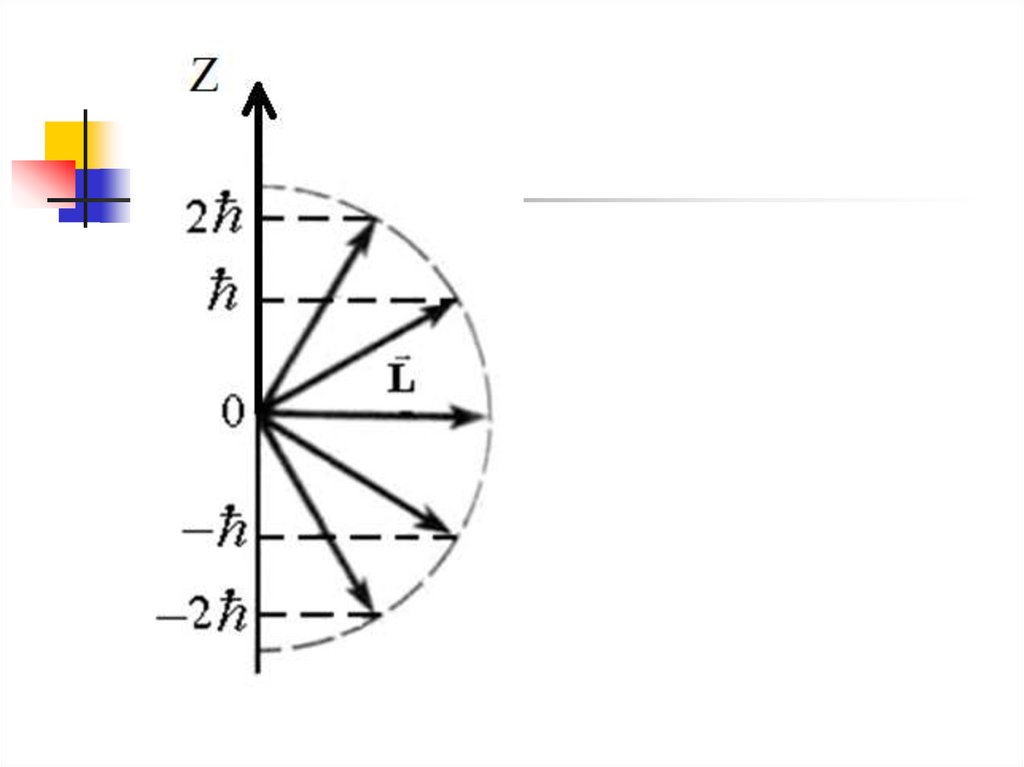
Момент импульса
электрона
квантуется
nlm (r , , )
L ( 1)
Проекция момента
импульса на направление
внешнего магнитного
поля квантуется
L Z m
8.
n – главное квантовое число,определяет номер уровня энергии
– орбитальное квантовое число,
определяет момент импульса
электрона ( форму орбиты)
m – магнитное квантовое число ,
определяет проекцию момента
импульса на направление внешнего
магнитного поля
9.
n 1,2,3.....0,1,2,3..., (n 1)
m 0, 1, 2, 3...,
10.
11.
Каждому значению n соответствуетнесколько волновых функций, которые
отличаются значениями орбитального
и магнитного волновых чисел (l,m).
Состояния с одинаковым n называются
вырожденными
Их количество – кратностью
вырождения
Число различных состояний с
одинаковым n
N n
2
12.
0S - состояние
1
p - состояние
2
d - состояние
3
f - состояние
13.
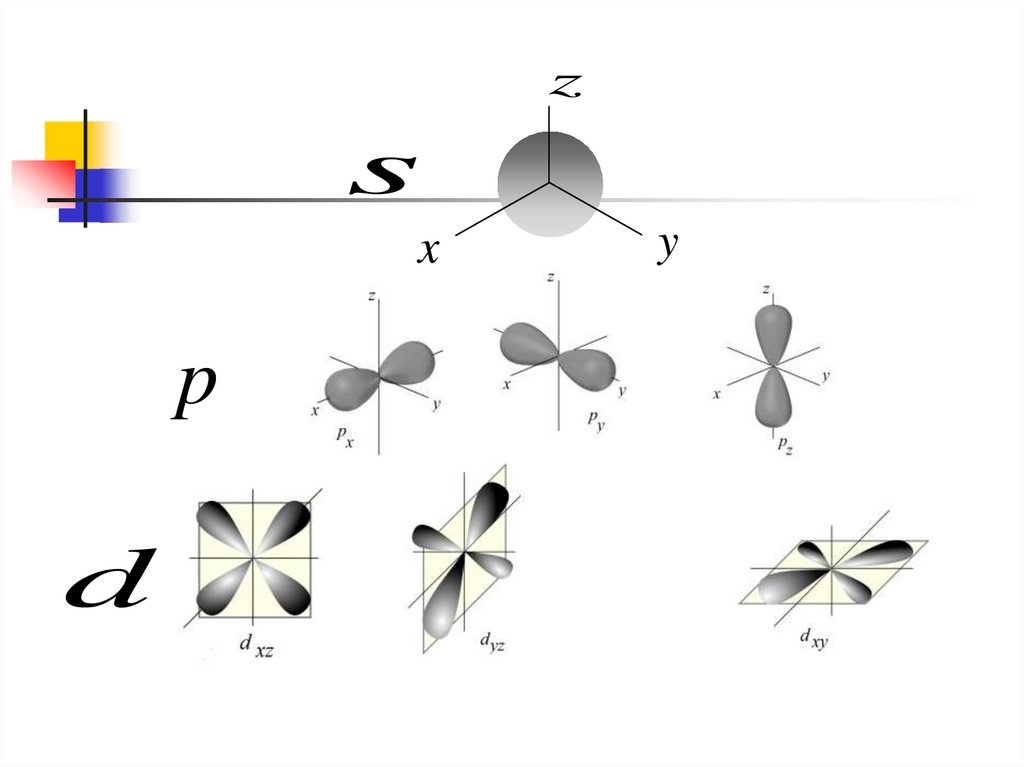
zs
x
p
d
y
14.
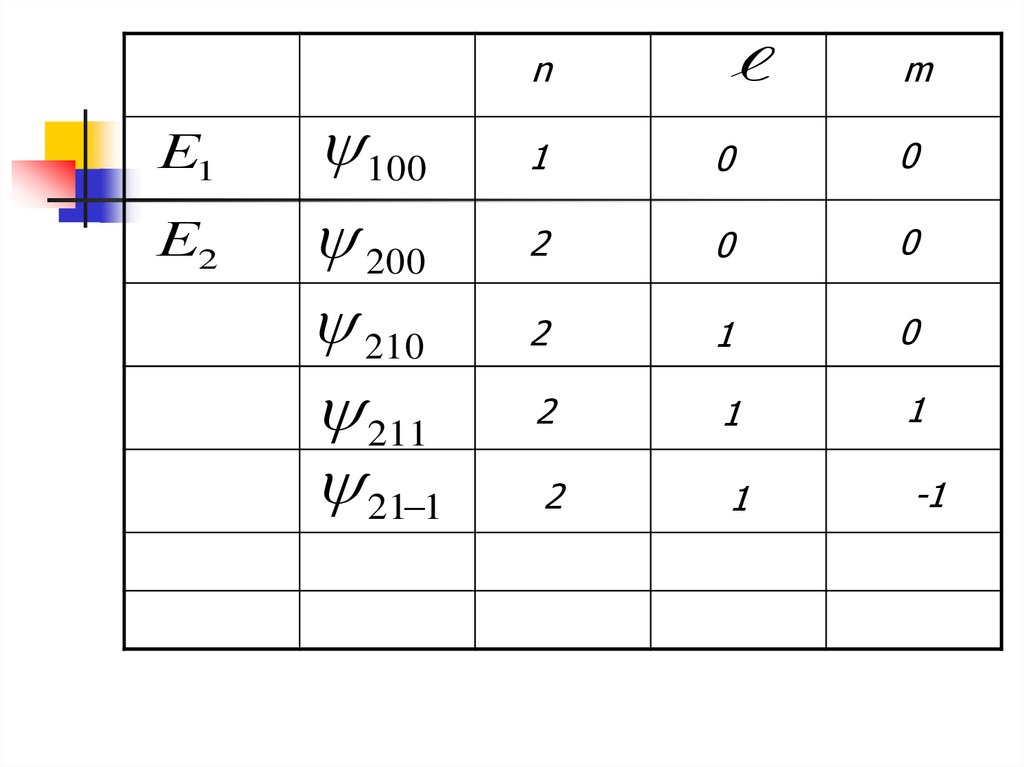
Е1Е2
100
200
210
211
21 1
n
m
1
0
0
2
0
0
2
1
0
2
1
1
2
1
-1
15.
ПРАВИЛА ОТБОРАОграничивают число возможных
переходов в атоме, связанных с
испусканием и поглощением света
1
m 0, 1
16.
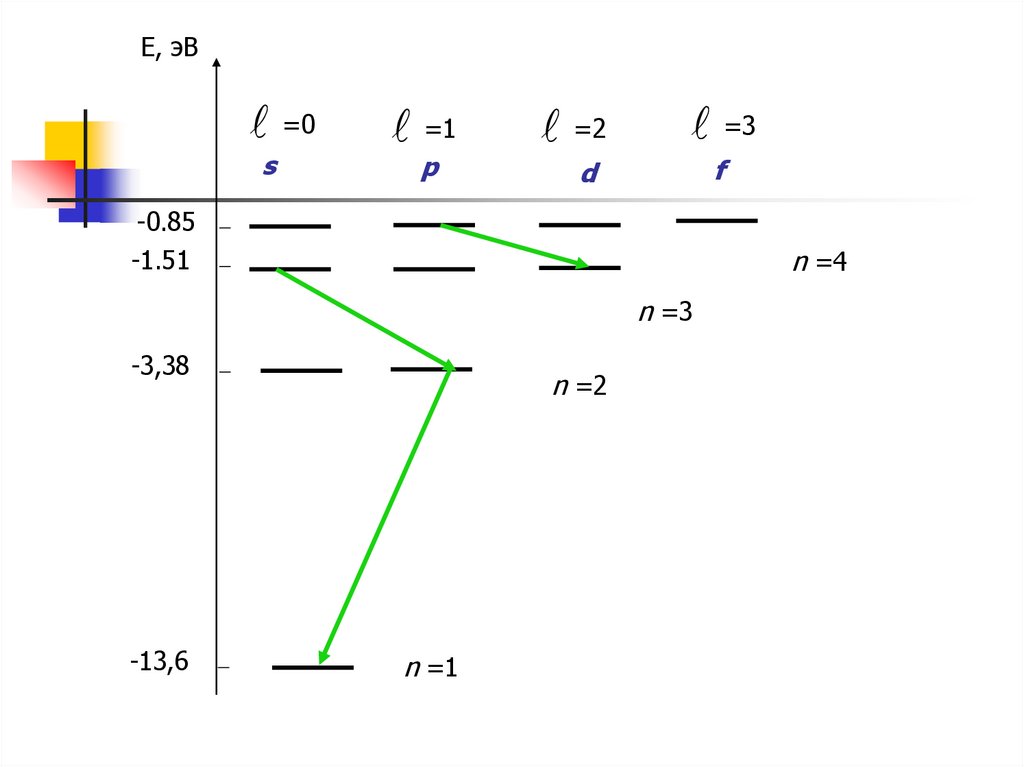
Е, эВ=0
s
=1
p
=2
=3
d
f
-0.85
-1.51
n =4
n =3
-3,38
-13,6
n =2
n =1
17.
При переходе электрона с болеевысоких уровней на более низкие
излучается фотон
Для перехода электрона на более
высокий уровень он должен
поглотить фотон
18. 1s состояние электрона в атоме водорода
100 С er
a
С находится из условия нормировки
С
4 0
a
2
me
1
a
3
Первый боровский
радиус
19.
Вероятность обнаружить электрон в элементе объема dVdW dV 4 r dr
2
2
2
Плотность вероятности
dW
w
dr
4 r
2
1
3e
a
2r
a
2
4 r
2
20.
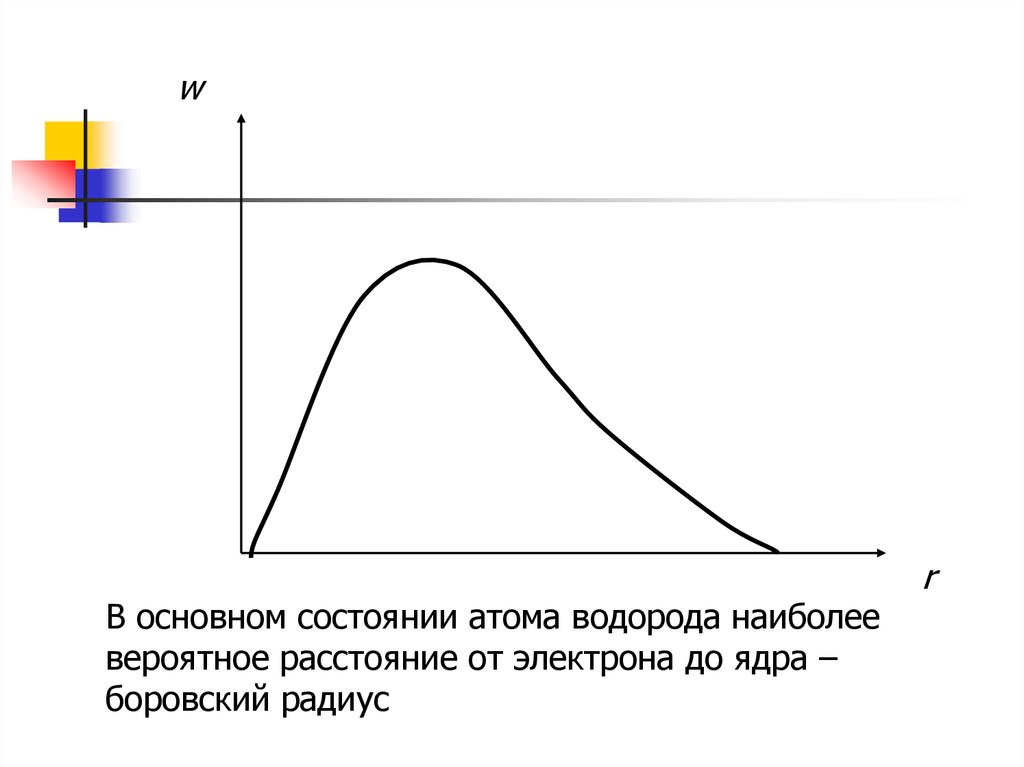
wВ основном состоянии атома водорода наиболее
вероятное расстояние от электрона до ядра –
боровский радиус
r
21. СПИН ЭЛЕКТРОНА
Рассмотрим атомводорода в S состоянии
L ( 1) 0
0
L Z m 0
Магнитное поле не должно влиять
на движение электрона
22.
23.
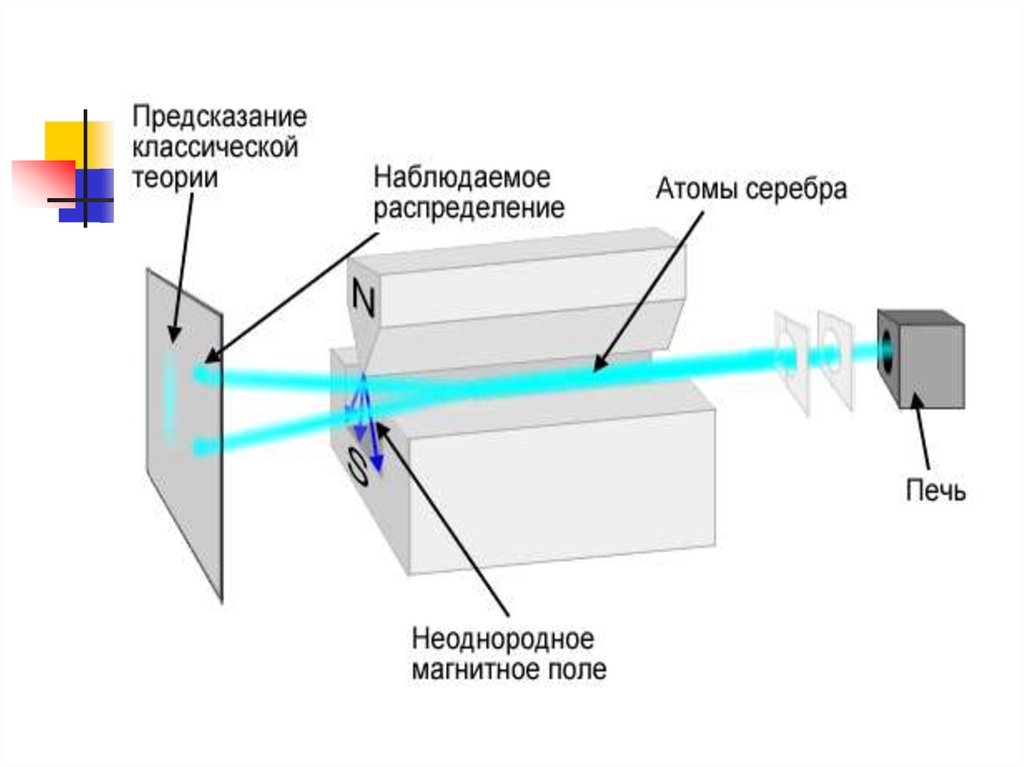
Штерн и Герлах экспериментальнообнаружили, что пучок атомов
водорода в s состоянии расщепляется
в магнитном поле на 2 пучка
24.
BFz pm
cosθ
z
e
pm
LZ 0
2me
Fz 0
25.
Электрон обладает собственнымнеуничтожимым моментом импульса, не
связанным с движением электрона в
пространстве – СПИН .
Ls s(s 1)
s
Для электрона
спиновое квантовое число
s 12
26.
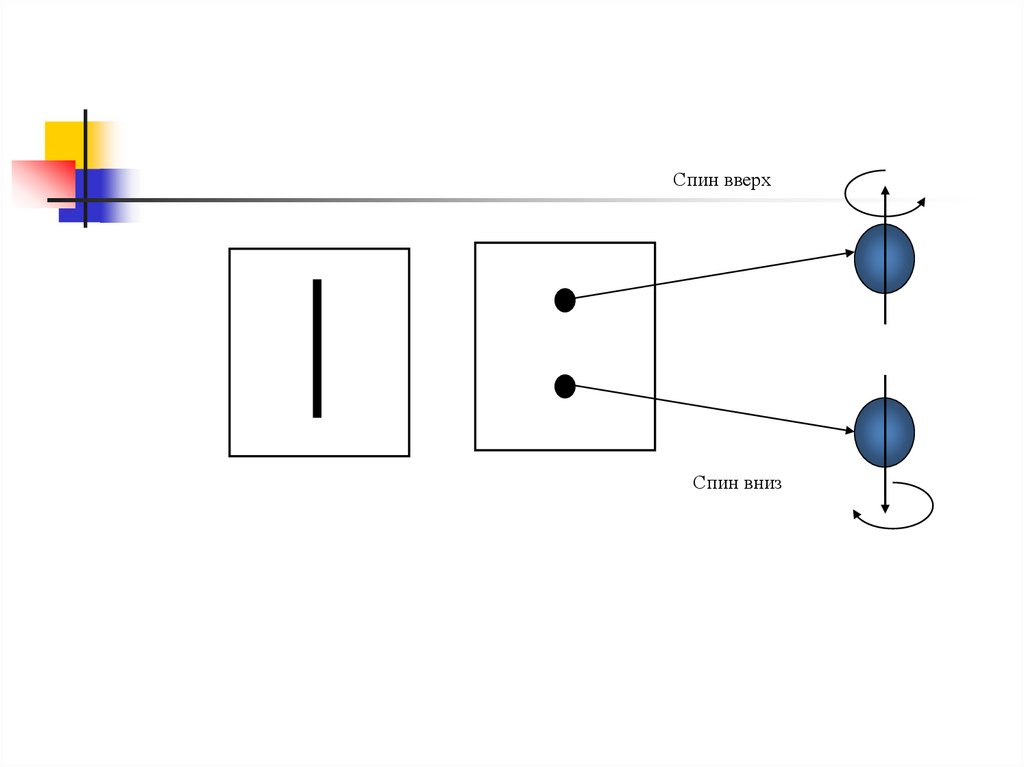
Проекция спина на направлениевнешнего магнитного поля
LsZ ms
ms магнитное спиновое
квантовое число
Для электрона
ms 1 2
27.
Спин вверхСпин вниз
28. ПРИНЦИП ПАУЛИ
Состояние электрона в атоме задается4 квантовыми числами
n 1,2,3,... - главное квантовое число
l 0,1,2,3,..., n 1
- орбитальное квантовое число
m 0, 1, 2,...,
ms 1 2, 1 2
- магнитное квантовое число
- магнитное спиновое квантовое число
29.
В одном и том же атоме не может бытьдвух электронов с одинаковым набором
квантовых чисел
Хотя бы одно из чисел должно
отличаться
Максимальное количество электронов,
находящихся на уровне энергии с
номером n
N 2n
2
30.
Электроны в атоме, имеющиеодинаковое квантовое число n –
называют электронной оболочкой
В каждой оболочке электроны
распределяются по подоболочкам,
соответствующим l
31.
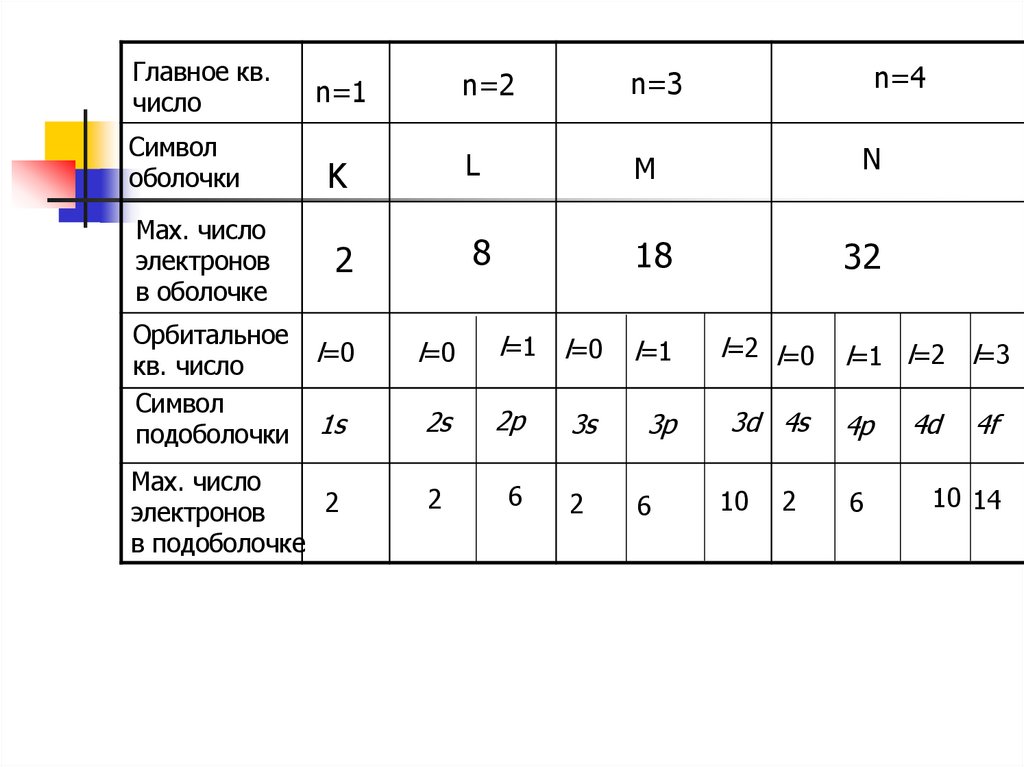
Главное кв.число
n=1
n=2
n=3
n=4
Символ
оболочки
K
L
M
N
Мах. число
электронов
в оболочке
2
8
18
32
Орбитальное
кв. число
Символ
подоболочки
l=0
l=0
l=1 l=0
l=1
l=2 l=0
l=1 l=2 l=3
1s
2s
2p
3s
3p
3d 4s
4p
Мах. число
2
электронов
в подоболочке
2
6
2
6
10
2
6
4d
4f
10 14
32.
На основании принципа Паули можнопостроить таблицу Менделеева









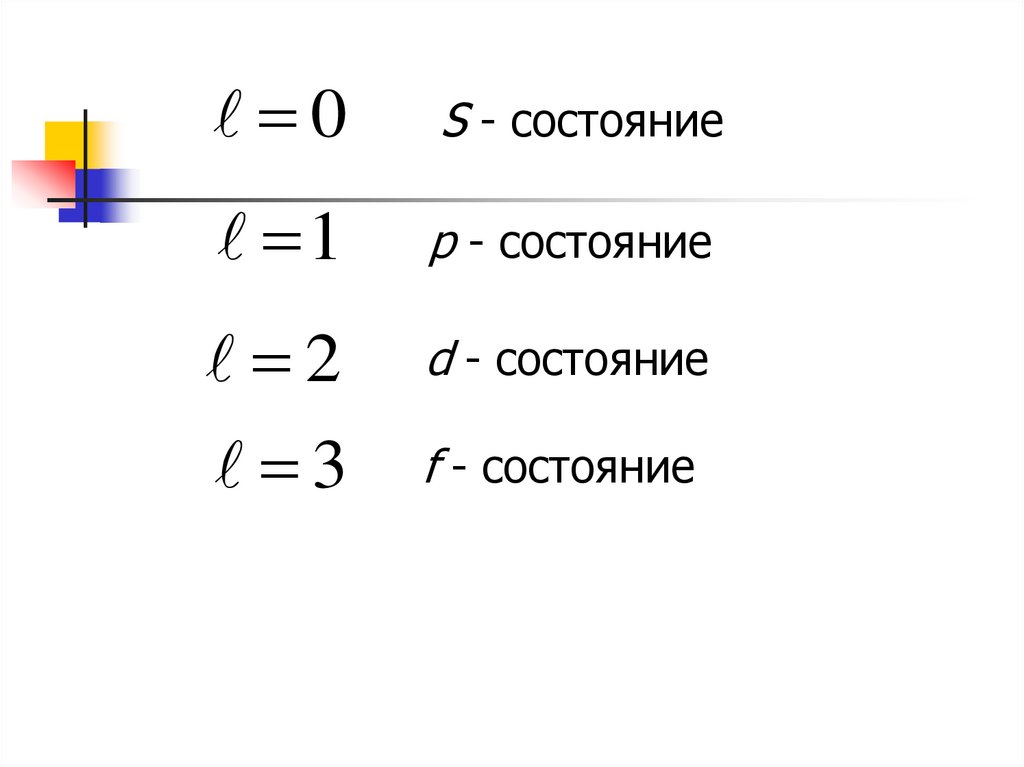













 Физика
Физика








