Похожие презентации:
_Катализ (перед1)
1. КАТАЛИЗ: Основные понятия. Свойства катализаторов. Соотношение Бренстеда-Поляни
В.2. Основные понятия
• Катализом называют явление изменение скоростиреакции в присутствии веществ-катализаторов.
• Катализ является основным средством осуществления
химических превращений в природе и в практической
деятельности человека. Современные процессы
производства аммиака, азотной кислоты и азотных
удобрений, крекинг, риформинг основываются на
использовании каталитических реакций.
3.
• Катализатором называют вещество, изменяющеескорость химической реакции участием в образовании
активированного комплекса одной или нескольких
стадий химического превращения и не входящее в
состав конечных продуктов.
• Другими словами, катализатор - это вещество,
взаимодействующее с молекулами реагирующих
веществ, изменяющее скорость химической реакции и
выделяющееся на последующих стадиях в химически
неизменном виде.
• Большинство химических процессов, задействованных
на предприятиях нефтехимического и
нефтеперерабатывающего комплекса, являются
каталитическими.
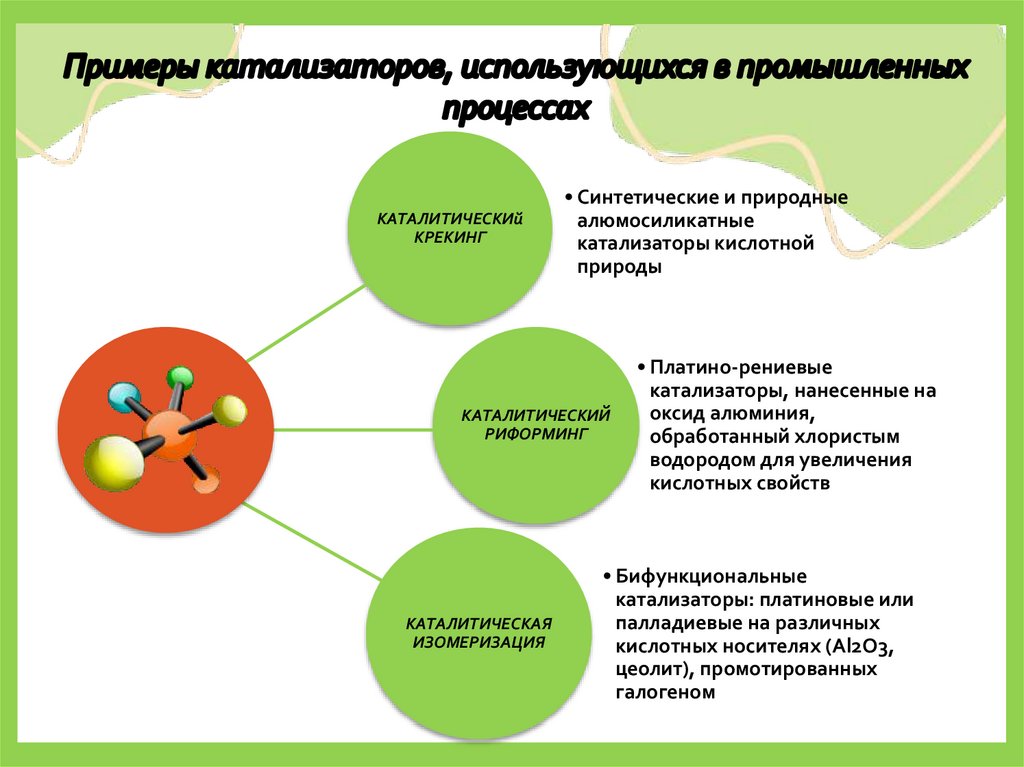
4.
КАТАЛИТИЧЕСКИйКРЕКИНГ
• Синтетические и природные
алюмосиликатные
катализаторы кислотной
природы
КАТАЛИТИЧЕСКИЙ
РИФОРМИНГ
КАТАЛИТИЧЕСКАЯ
ИЗОМЕРИЗАЦИЯ
• Платино-рениевые
катализаторы, нанесенные на
оксид алюминия,
обработанный хлористым
водородом для увеличения
кислотных свойств
• Бифункциональные
катализаторы: платиновые или
палладиевые на различных
кислотных носителях (Al2O3,
цеолит), промотированных
галогеном
5.
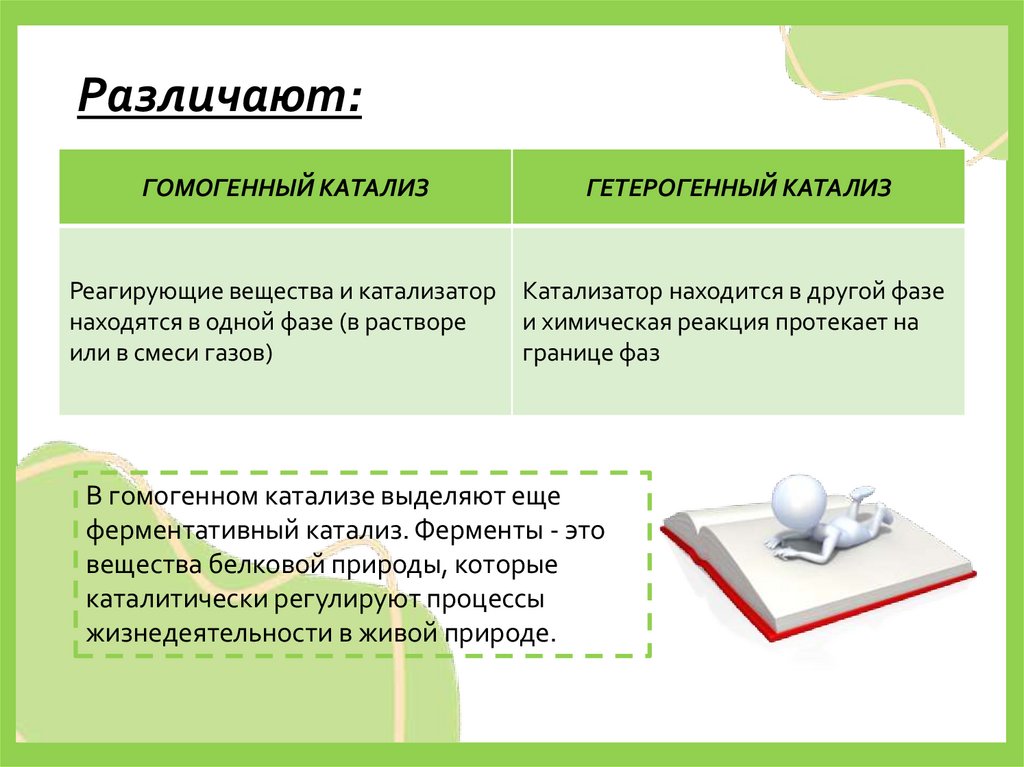
Различают:ГОМОГЕННЫЙ КАТАЛИЗ
ГЕТЕРОГЕННЫЙ КАТАЛИЗ
Реагирующие вещества и катализатор
находятся в одной фазе (в растворе
или в смеси газов)
Катализатор находится в другой фазе
и химическая реакция протекает на
границе фаз
В гомогенном катализе выделяют еще
ферментативный катализ. Ферменты - это
вещества белковой природы, которые
каталитически регулируют процессы
жизнедеятельности в живой природе.
6. Различают:
7.
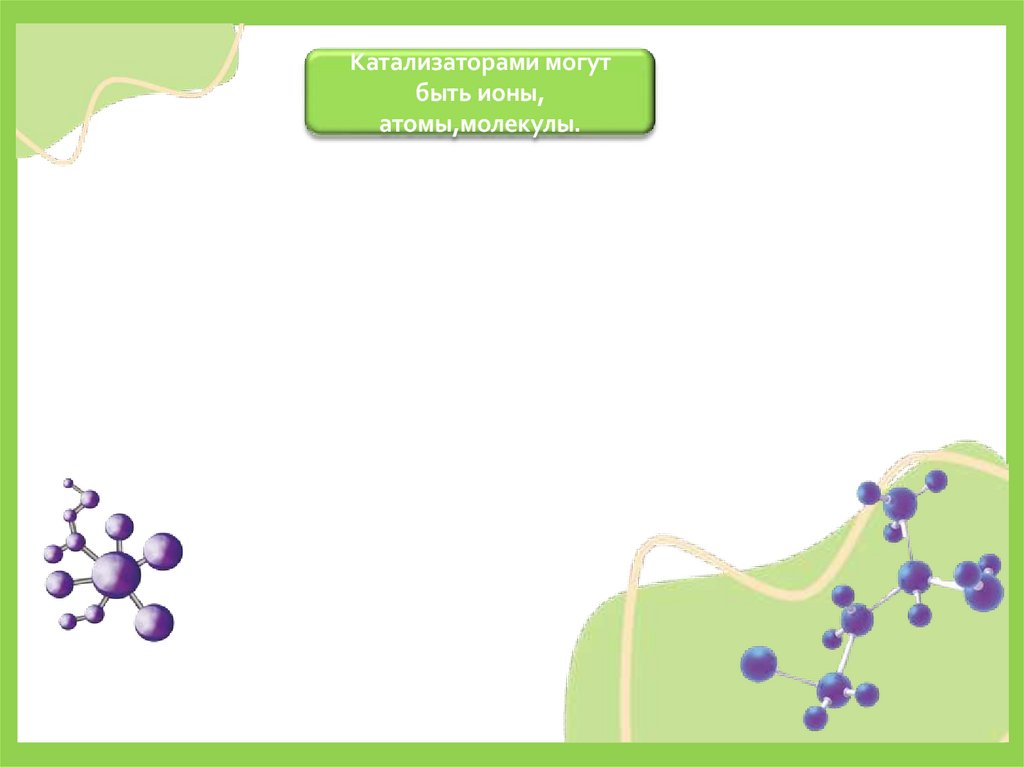
Катализаторами могутбыть ионы,
атомы,молекулы.
8.
• В присутствии катализатора реакции ускоряются, т. е.увеличивается константа скорости реакции:
• Согласно теории абсолютных скоростей реакций
предэкспоненциальный множитель А связан с энтропией
активации ΔS≠ соотношением
• а энергия активации Е практически равна энтальпии
активации ΔН≠ при образовании активированного
комплекса. Таким образом, катализатор ускоряет реакцию
за счет уменьшения энергии активации или увеличения
энтропии активации.
9.
10.
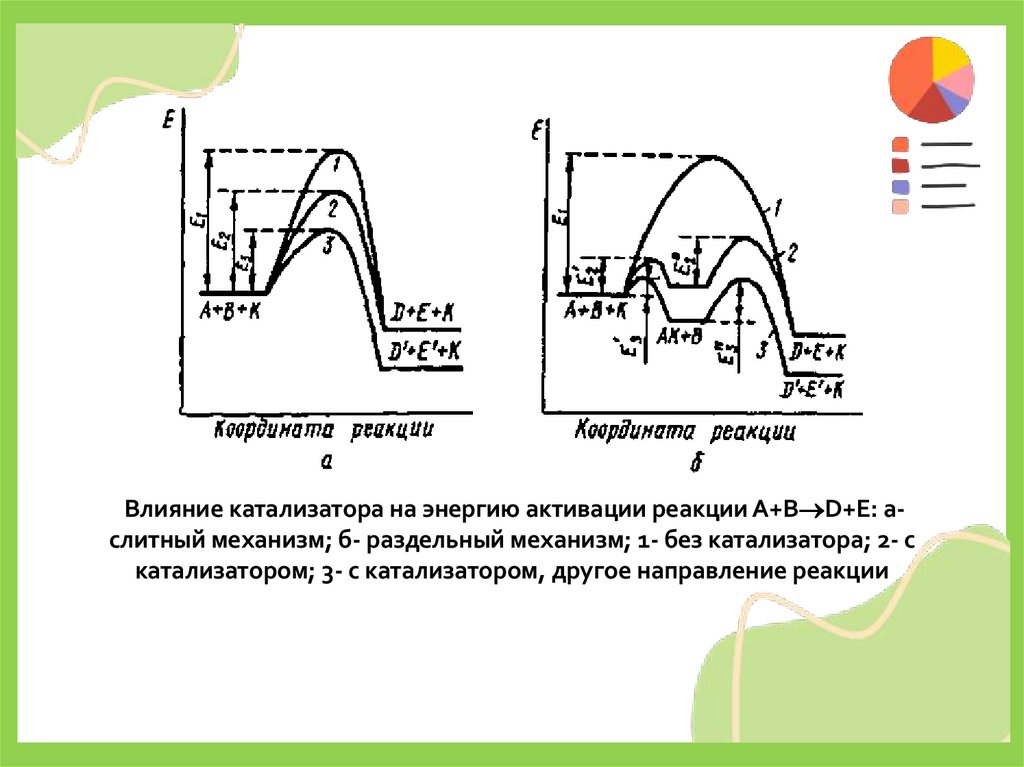
Влияние катализатора на энергию активации реакции А+В D+E: аслитный механизм; б- раздельный механизм; 1- без катализатора; 2- скатализатором; 3- с катализатором, другое направление реакции
11.
• Промежуточное химическое взаимодействие реагентовс катализатором может протекать слитно и раздельно.
При слитном каталитическом процессе в состав
активированного комплекса входят наряду с
катализатором все реагирующие вещества.
• Элементарная реакция A+B→D+E - без катализатора
протекает через активированный комплекс АВ≠
• A+B→ АВ≠→D+E (5)
• а в присутствии катализатора – через активированный
комплекс ABK≠
• A+B+K→ АВK≠→D+E+K (6)
12.
• Увеличение скорости реакции при слитном механизмедостигается в результате уменьшения энергии активации
и соответственно повышения степени компенсации при
химическом взаимодействии реагентов с катализатором.
• В реакциях с участием двух и более реагентов прямое
образование активированного комплекса с участием
катализатора сравнительно мало вероятно, и поэтому в
каталитической реакции по слитному механизму
энтропия активации ΔS≠ уменьшается и соответственно
уменьшаются предэкспоненциальный множитель и
константа скорости реакции.
13.
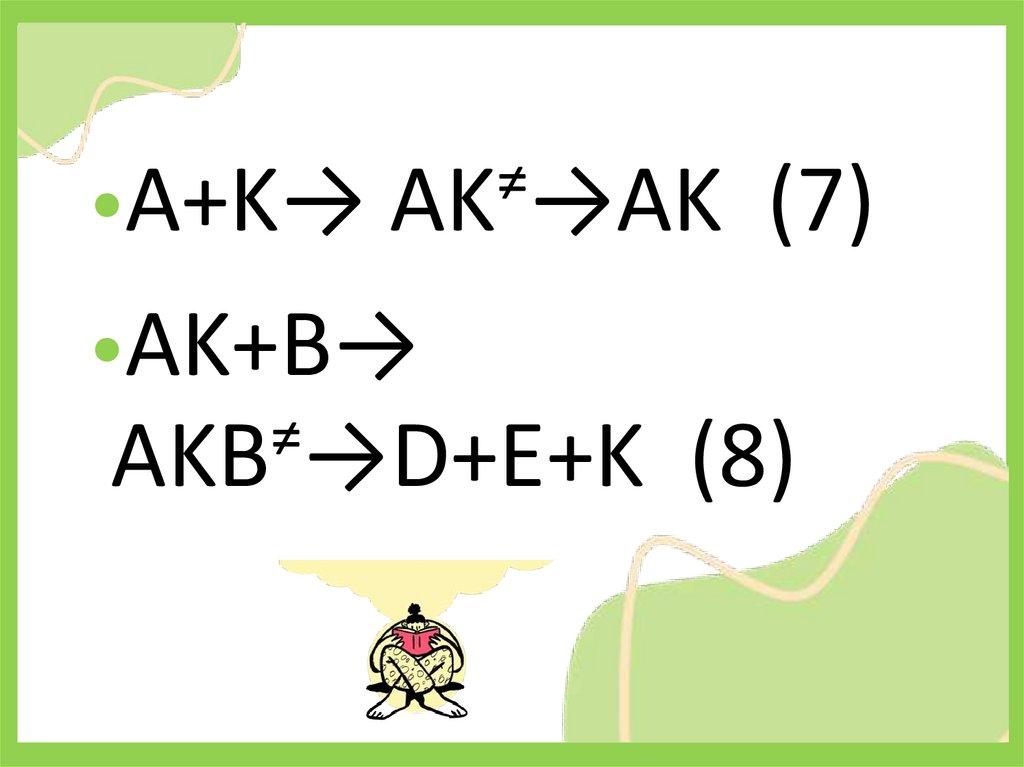
≠•A+K→ АK →AK (7)
•AK+B→
≠
АKB →D+E+K (8)
14.
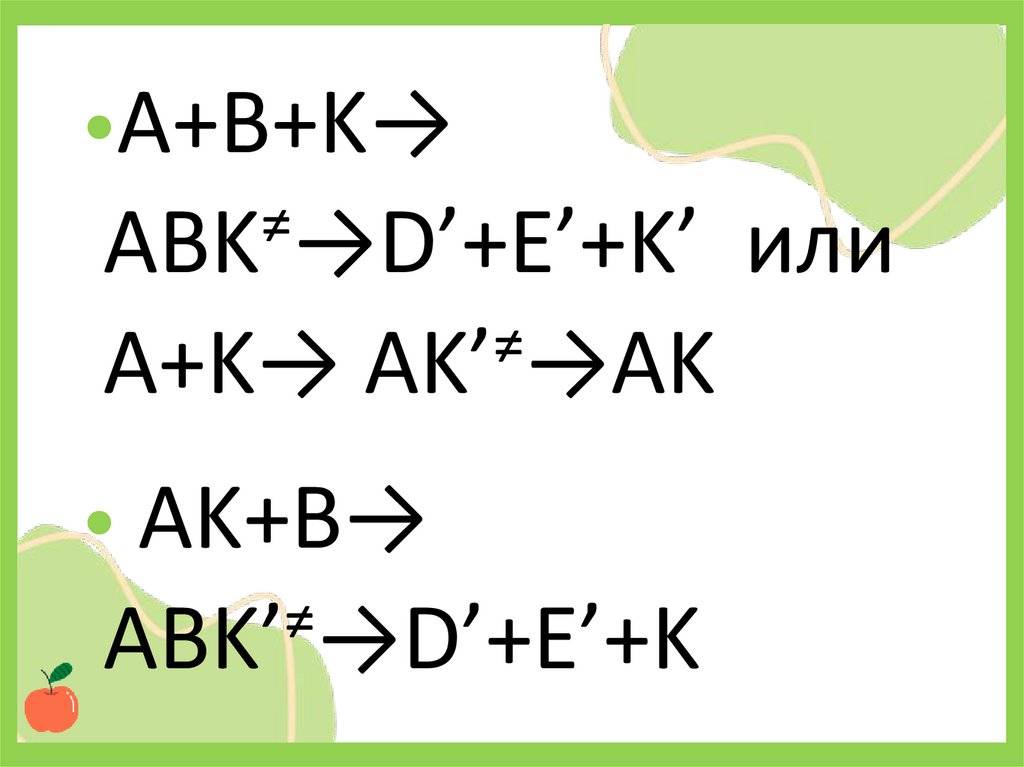
•A+B+K→≠
АBK →D’+E’+K’ или
≠
A+K→ АK’ →AK
• AK+B→
≠
АBK’ →D’+E’+K
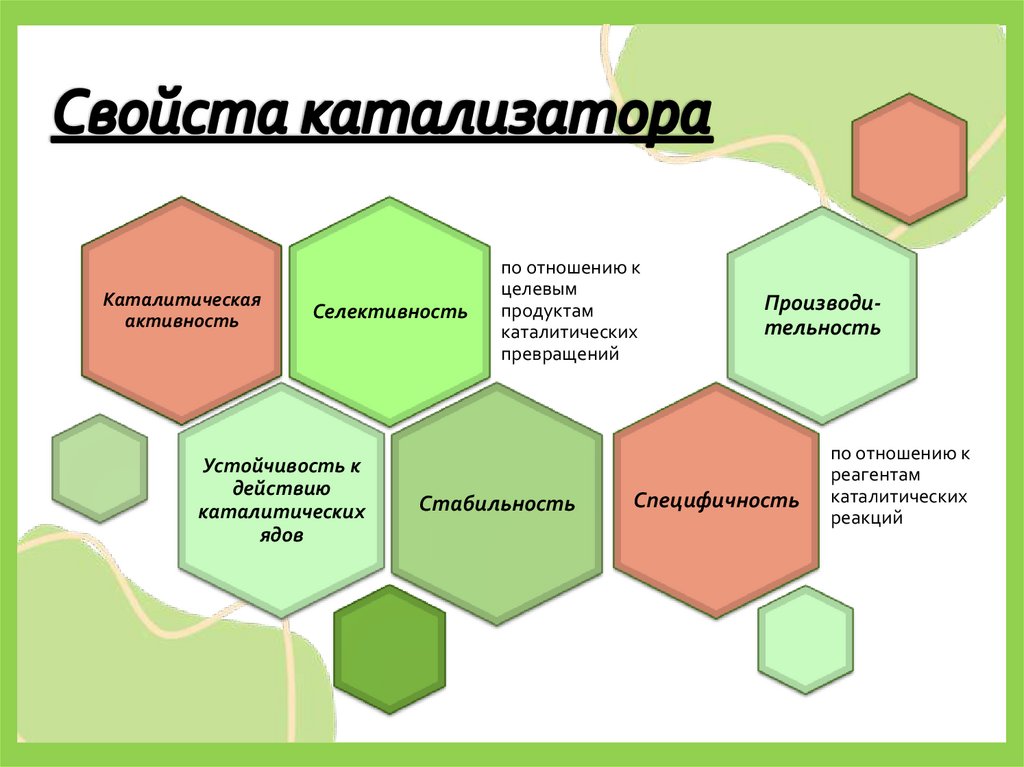
15. Свойста катализатора
Каталитическаяактивность
Селективность
Устойчивость к
действию
каталитических
ядов
по отношению к
целевым
продуктам
каталитических
превращений
Стабильность
Производительность
Специфичность
по отношению к
реагентам
каталитических
реакций
16.
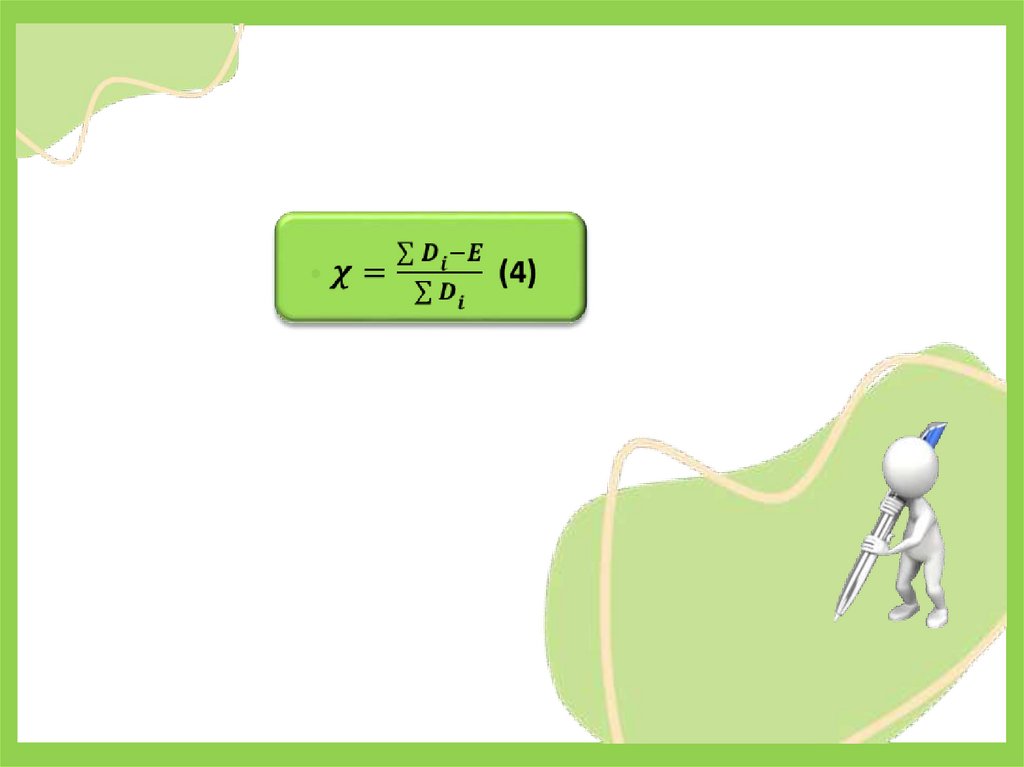
• Мерой каталитической активности А является изменениескорости химической реакции в результате введения в
систему катализатора:
• где wк, и w0 - скорость реакции в присутствии катализатора
и без него соответственно
17.
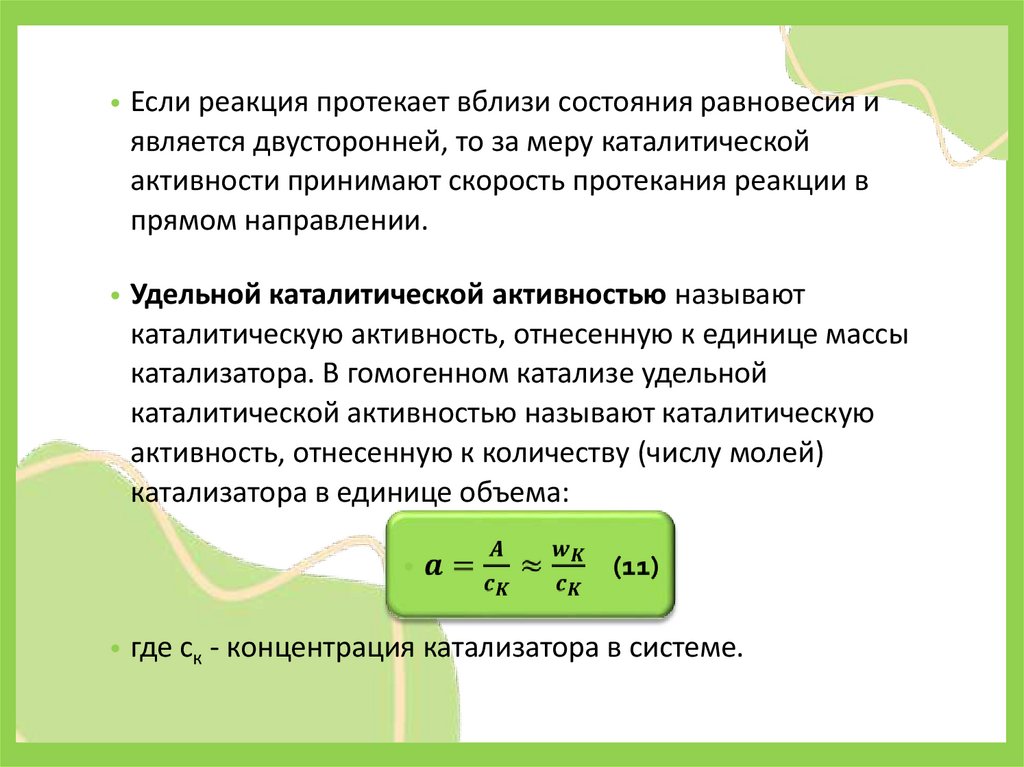
• Если реакция протекает вблизи состояния равновесия иявляется двусторонней, то за меру каталитической
активности принимают скорость протекания реакции в
прямом направлении.
• Удельной каталитической активностью называют
каталитическую активность, отнесенную к единице массы
катализатора. В гомогенном катализе удельной
каталитической активностью называют каталитическую
активность, отнесенную к количеству (числу молей)
катализатора в единице объема:
• где ск - концентрация катализатора в системе.
18.
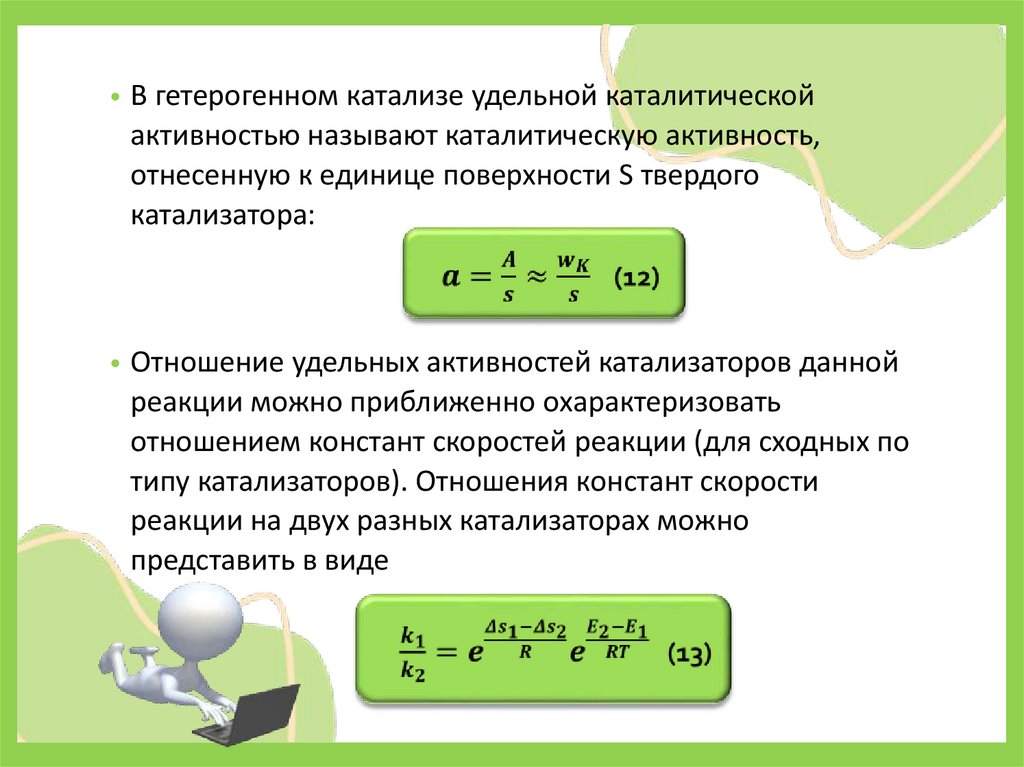
• В гетерогенном катализе удельной каталитическойактивностью называют каталитическую активность,
отнесенную к единице поверхности S твердого
катализатора:
• Отношение удельных активностей катализаторов данной
реакции можно приближенно охарактеризовать
отношением констант скоростей реакции (для сходных по
типу катализаторов). Отношения констант скорости
реакции на двух разных катализаторах можно
представить в виде
19.
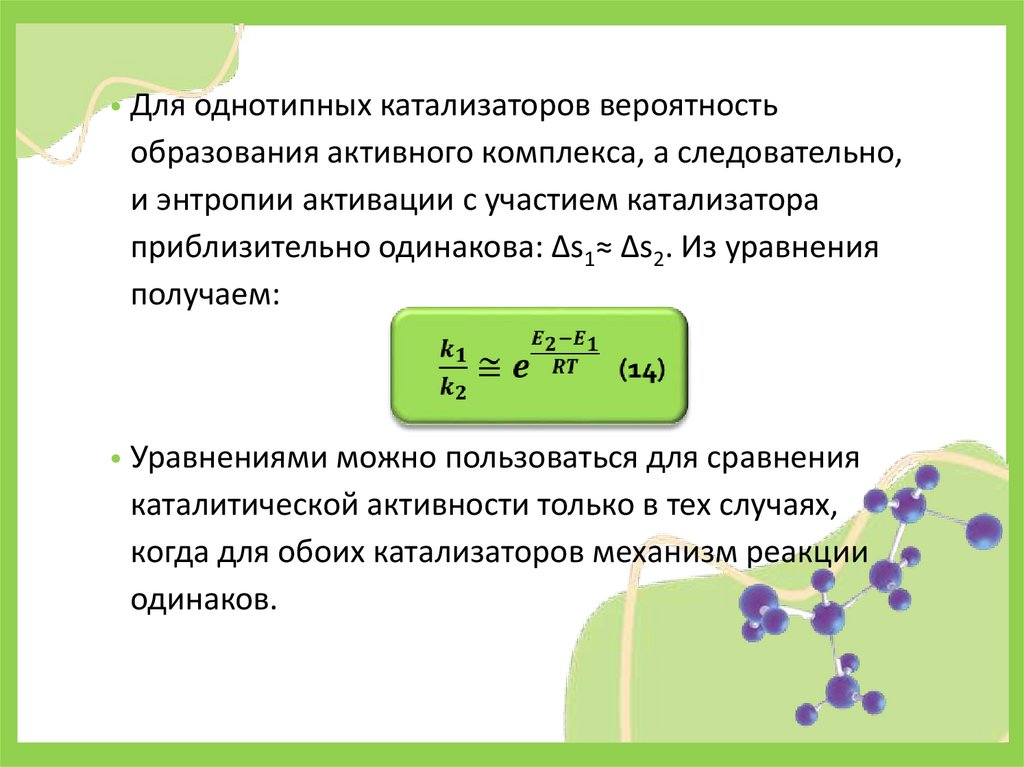
• Для однотипных катализаторов вероятностьобразования активного комплекса, а следовательно,
и энтропии активации с участием катализатора
приблизительно одинакова: Δs1≈ Δs2. Из уравнения
получаем:
• Уравнениями можно пользоваться для сравнения
каталитической активности только в тех случаях,
когда для обоих катализаторов механизм реакции
одинаков.
20.
• Специфичность катализа заключается в том, чтореакции данного типа ускоряются катализаторами лишь
определенного химического состава. Специфичность
свойственна в той или иной мере всем катализаторам и
обусловлена специфичностью химических связей,
возникающих между катализатором и реагентом.
21.
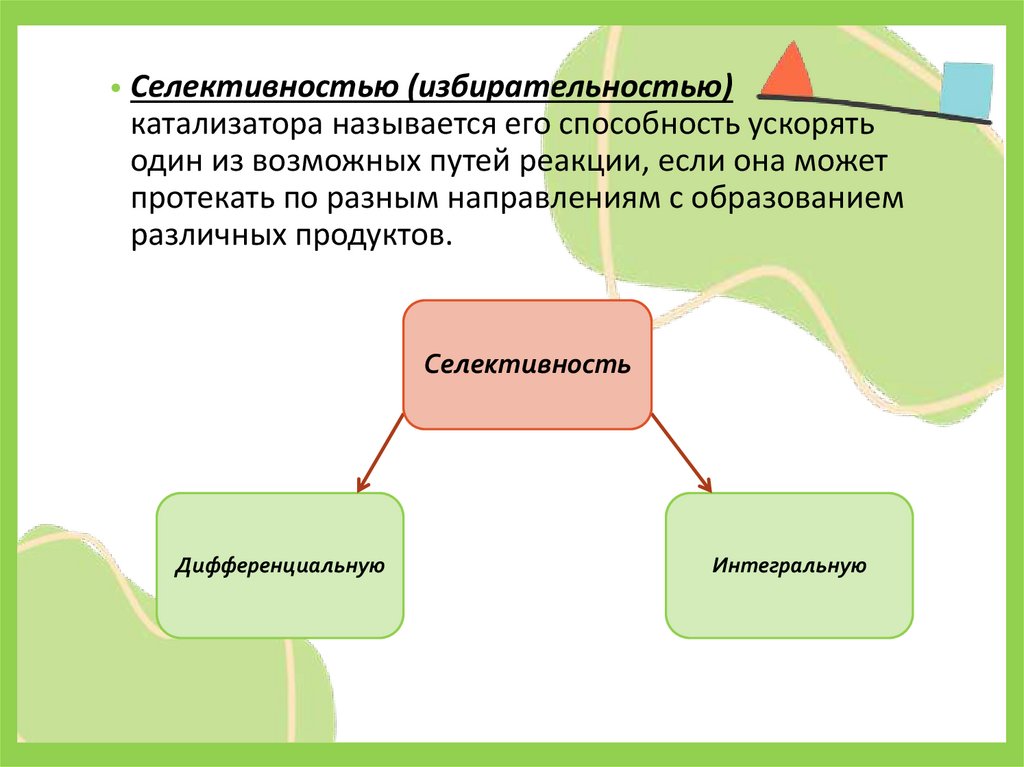
• Селективностью (избирательностью)катализатора называется его способность ускорять
один из возможных путей реакции, если она может
протекать по разным направлениям с образованием
различных продуктов.
Селективность
Дифференциальную
Интегральную
22.
• Дифференциальная селективность катализатора равнаскорости образования соответствующего продукта, деленной
на суммарную скорость превращения реагирующего вещества
по всем направлениям. Например, если исходное вещество А
испытывает превращения по различным параллельным и
последовательным направлениям, причем по одному из этих
направлений образуется требуемый продукт В, то
дифференциальная селективность катализатора в отношении
продукта В равна:
• где nB - количество продукта; nA - количество исходного
вещества; b/a - отношение стехиометрических коэффициентов
при образовании продукта В из исходного вещества А.
23.
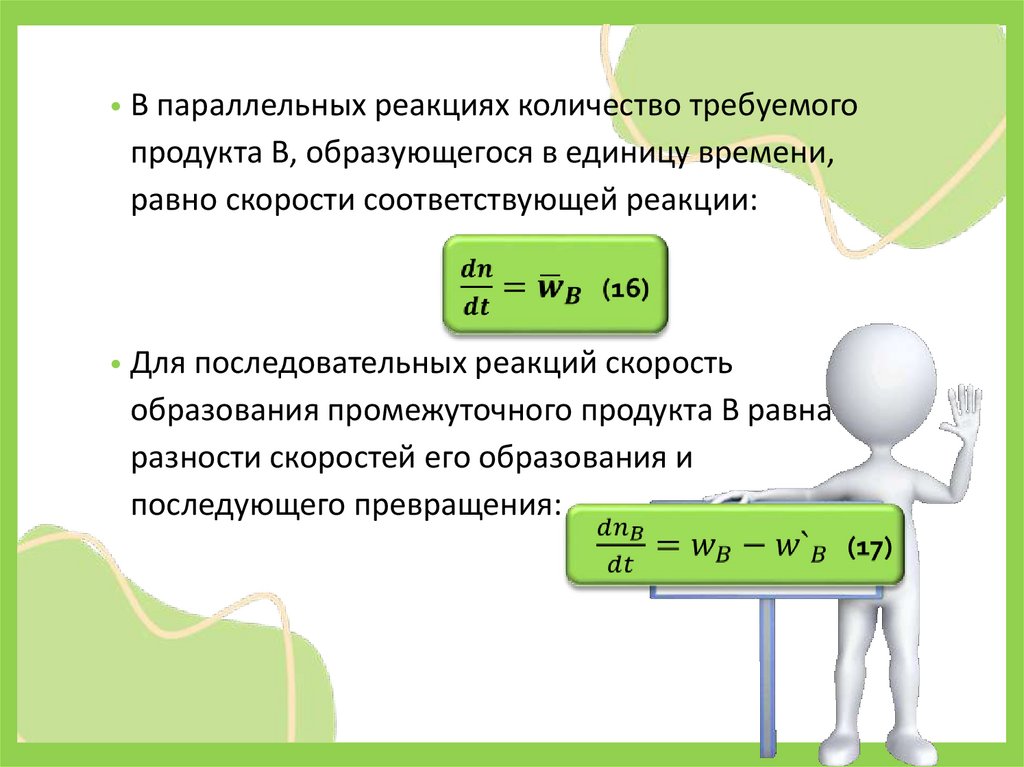
• В параллельных реакциях количество требуемогопродукта В, образующегося в единицу времени,
равно скорости соответствующей реакции:
• Для последовательных реакций скорость
образования промежуточного продукта В равна
разности скоростей его образования и
последующего превращения:
24.
• Интегральной селективностью называется отношениеобщего количества соответствующего продукта,
образовавшегося при конечном изменении степени
превращения исходного вещества, к теоретически
возможному (когда образуется только данный продукт).
• Интегральная селективность полезна для характеристики
всего каталитического процесса. Ее величина зависит от
начального состава реакционной смеси, температуры и
конечной степени превращения. Селективность
катализаторов имеет большое практическое значение, так как
путем подбора подходящего катализатора можно увеличить
выход нужного продукта.
25.
Соотношения Бренстеда-Поляни• Важное значение имеет проблема предвидения
каталитического действия по отношению к данной реакции.
Предсказать активность катализатора можно было бы путем
оценки энтальпии и энтропии образования активированных
комплексов всех стадий каталитического процесса и на
основании сведений о структуре реагирующих веществ и
катализатора. Однако расчет активированного комплекса из
этих данных с использованием методов квантовой химии пока
не позволяет получить нужные количественные результаты
даже в случае простейших каталитических реакций. Поэтому в
настоящее время научные основы предвидения
каталитического действия строят на приближенных оценках
энергии активации, справедливых лишь для ограниченных
групп катализаторов и реакций. Основой для таких
приближенных оценок служит энергия отдельных связей,
разрывающихся или образующихся при превращении
активированного комплекса с участием катализатора.
26. Соотношения Бренстеда-Поляни
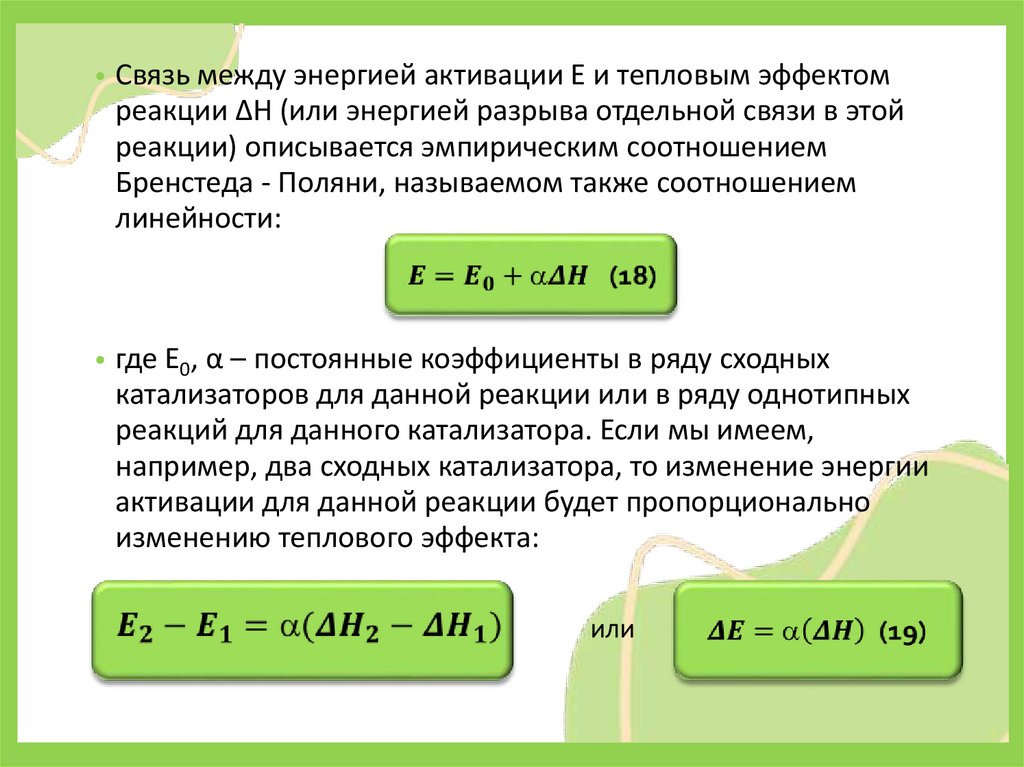
• Связь между энергией активации Е и тепловым эффектомреакции ΔН (или энергией разрыва отдельной связи в этой
реакции) описывается эмпирическим соотношением
Бренстеда - Поляни, называемом также соотношением
линейности:
• где E0, α – постоянные коэффициенты в ряду сходных
катализаторов для данной реакции или в ряду однотипных
реакций для данного катализатора. Если мы имеем,
например, два сходных катализатора, то изменение энергии
активации для данной реакции будет пропорционально
изменению теплового эффекта:
или
27.
• Принципиальное значение соотношений линейности вуравнении (18) состоит в том, что оно устанавливает
связь между кинетическими (E) и термодинамическими
(ΔН) величинами. Строго теоретического обоснования
соотношения линейности до сих пор нет. Однако
широкий экспериментальный материал показывает
справедливость соотношений линейности в пределах
отдельных групп реакций или катализаторов, когда
изменение природы компонента изменяет теплоту
реакции, но не влияет заметно на характер
взаимодействия.
28.
29.
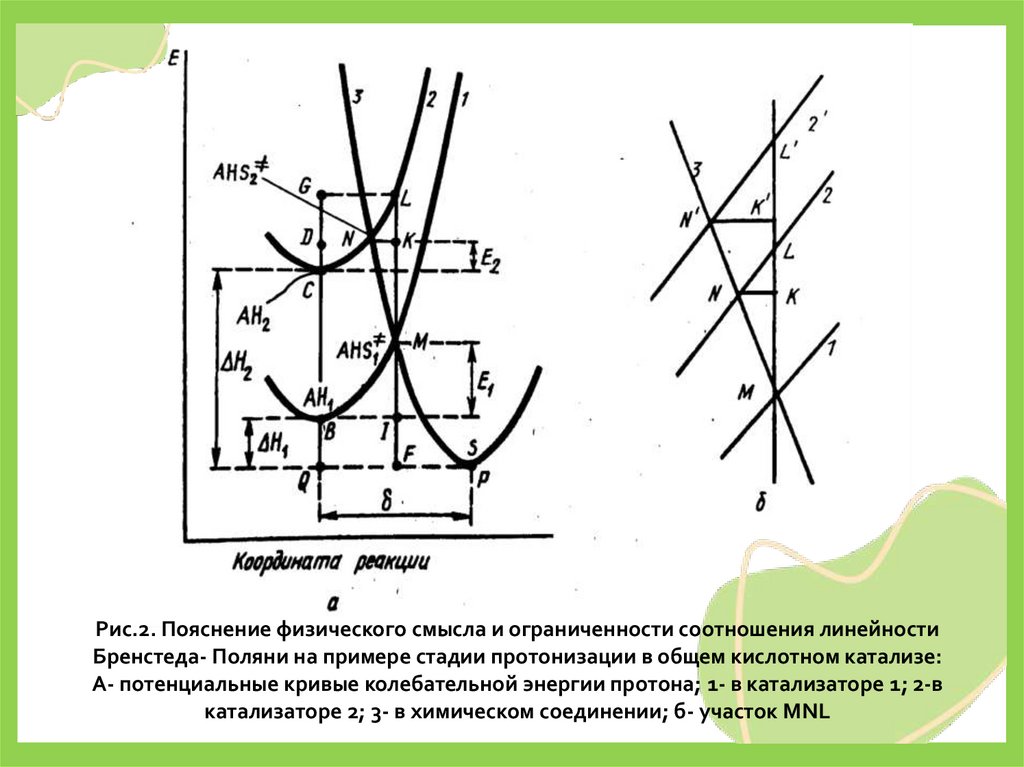
Рис.2. Пояснение физического смысла и ограниченности соотношения линейностиБренстеда- Поляни на примере стадии протонизации в общем кислотном катализе:
А- потенциальные кривые колебательной энергии протона; 1- в катализаторе 1; 2-в
катализаторе 2; 3- в химическом соединении; б- участок MNL
30.
• Если энергия колебаний протона в катализаторе АН1 (кривая1) вдоль линии по направлению к атому реагента, которому
передается протон, достигнет значения энергии, которая
соответствует энергии активированного комплекса AHS≠ (рис.
2, точка М), то он перейдет на реагент S (кривая 3). То же можно
сказать о катализаторе АН2 (кривые 2 и 3, точка их
пересечения N). Поскольку мы рассматриваем два однотипных
катализатора, то кривую 2 можно рассматривать как кривую 1,
перемещенную вверх на графике на величину ВС. При этом,
очевидно, расстояние PQ = δ вдоль оси абсцисс между
минимумами потенциальных кривых 1, 3 и 2, 3 не должно
заметно измениться, а расстояния между двумя любыми
точками по вертикали на кривых 1 и 2 вдоль оси ординат
должны быть одинаковыми. Геометрический смысл энергии
активации Е1 и Е2 и тепловых эффектов реакции ΔН1 и ΔН2
реакций с обоими катализаторами ясен из графика.
31.
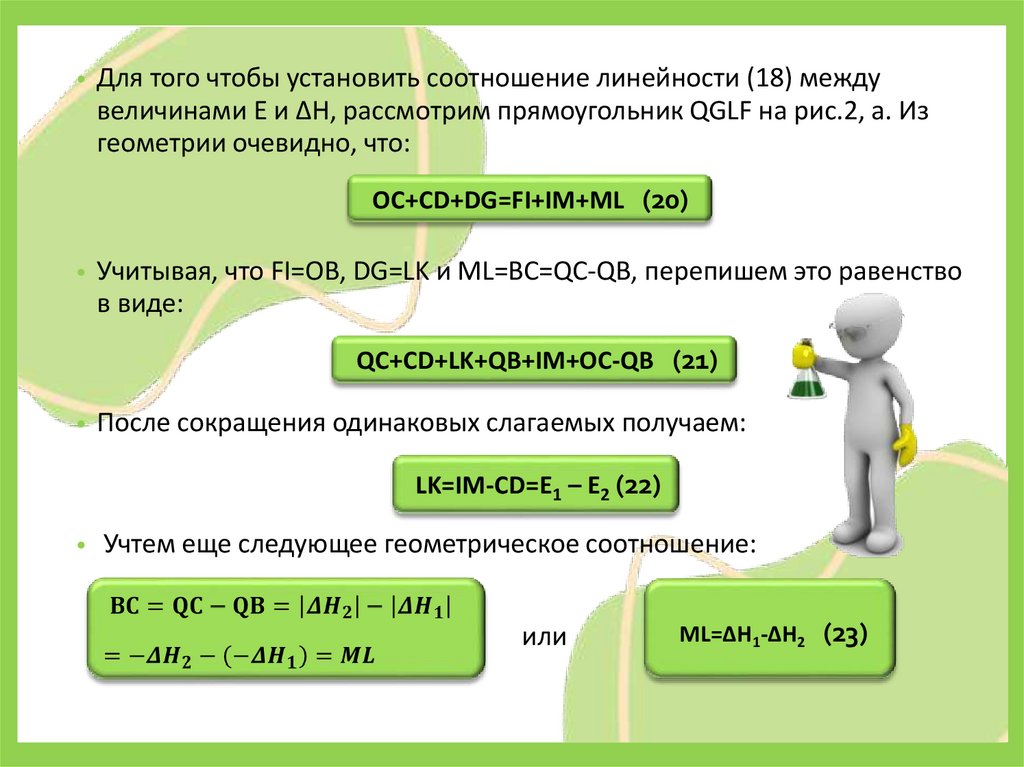
• Для того чтобы установить соотношение линейности (18) междувеличинами Е и ΔН, рассмотрим прямоугольник QGLF на рис.2, а. Из
геометрии очевидно, что:
OC+CD+DG=FI+IM+ML (20)
• Учитывая, что FI=OB, DG=LK и ML=BC=QC-QB, перепишем это равенство
в виде:
QC+CD+LK+QB+IM+OC-QB (21)
• После сокращения одинаковых слагаемых получаем:
LK=IM-CD=E1 – E2 (22)
Учтем еще следующее геометрическое соотношение:
или
ML=ΔH1-ΔH2 (23)
32.
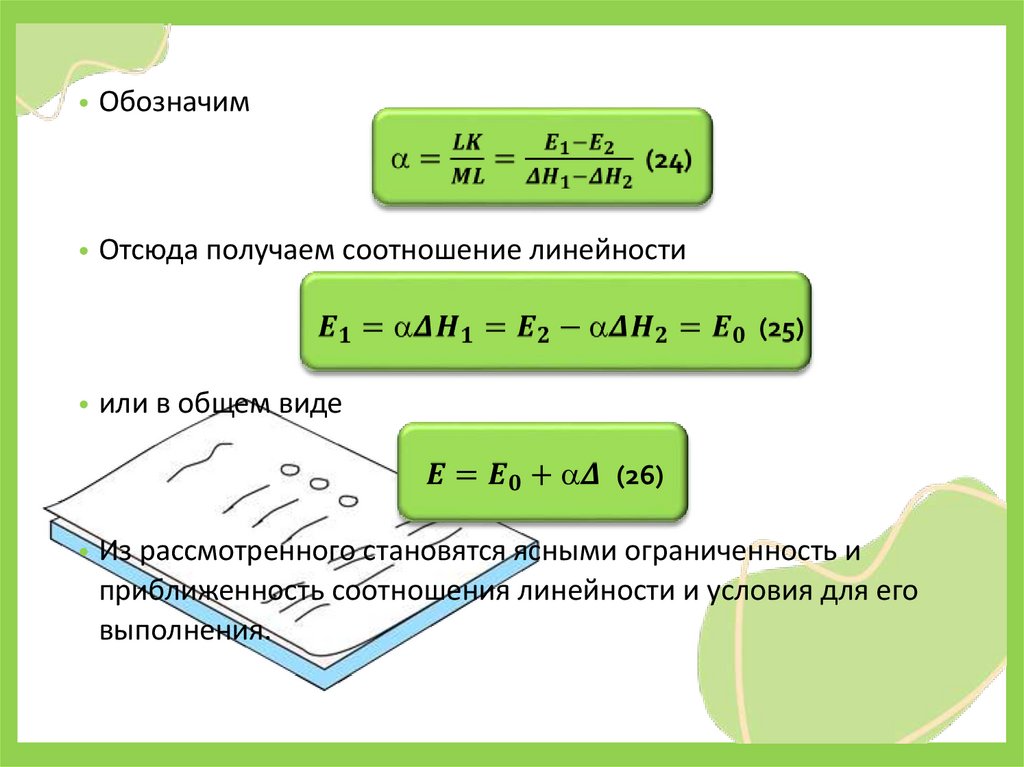
• Обозначим• Отсюда получаем соотношение линейности
• или в общем виде
• Из рассмотренного становятся ясными ограниченность и
приближенность соотношения линейности и условия для его
выполнения.
33.
• Из рассмотренного становится ясной ограниченность и приблтженностьсоотношения линейности и условия его выполнения:
• 1. Оба катализатора должны иметь одинаковый по строению
активированный комплекс, т. е. механизм реакции должен быть
одинаковым.
• 2. Равновесные расстояния между положениями двух атомов, между
которыми происходит передача протона, и форма потенциальных
кривых колебания протона в этих атомах должны быть для обоих
катализаторов одинаковыми.
• 3. В рассматриваемом интервале пересечения потенциальных кривых
(рис.2, б), точки M, N, N', их ветви должны быть приближенно
прямолинейными, чтобы коэффициент α (и, следовательно, Е0)
оставался постоянным. Действительно, из подобия треугольников MNL и
MN'L' следует:
34.
• Очевидно, перечисленные условия будут выполняться тем лучше, чемближе по своим свойствам данные катализаторы и чем ближе ветви
потенциальных кривых на рассматриваемом участке к прямым линиям.
• Несмотря на некоторую ограниченность, соотношение линейности
очень важно и служит пока основным средством предвидения
изменения скорости реакции на однотипных катализаторах. Это
соотношение позволяет найти связь между скоростью каталитической
реакции и энергией промежуточного взаимодействия при катализе. На
основании данных о зависимости энергии промежуточного
взаимодействия от химического состава катализатора можно
предвидеть каталитическое действие.
• Соотношение линейности Бренстеда - Поляни справедливо, если
механизм каталитической реакции и характер связей при
промежуточном взаимодействии реагирующих веществ с катализатором
для рассматриваемой группы катализаторов или реакций одинаков.
35.
Спасибо завнимание!
















 Химия
Химия








