Похожие презентации:
Сера и ее соединения
1.
2.
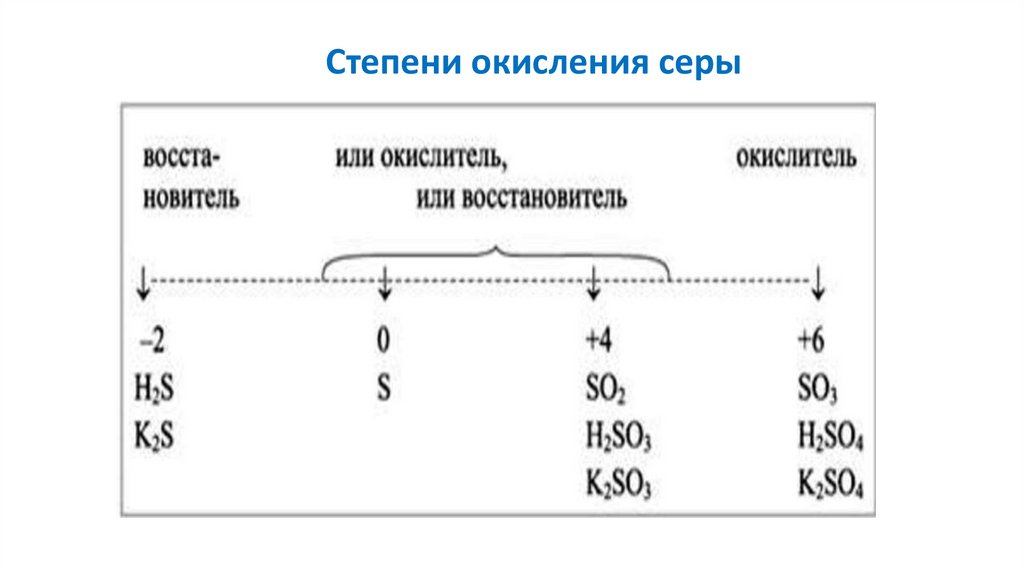
Степени окисления серы3.
4.
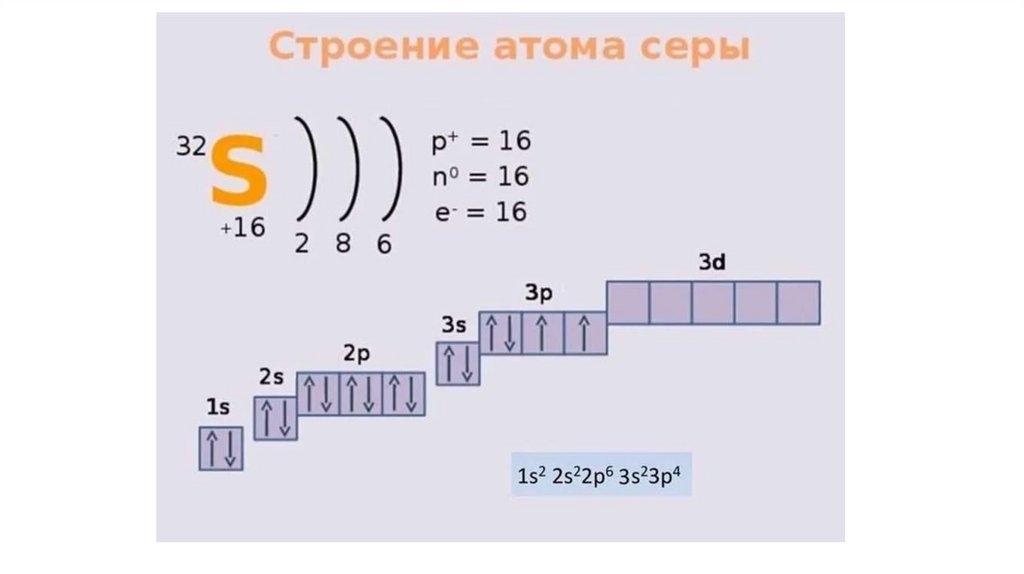
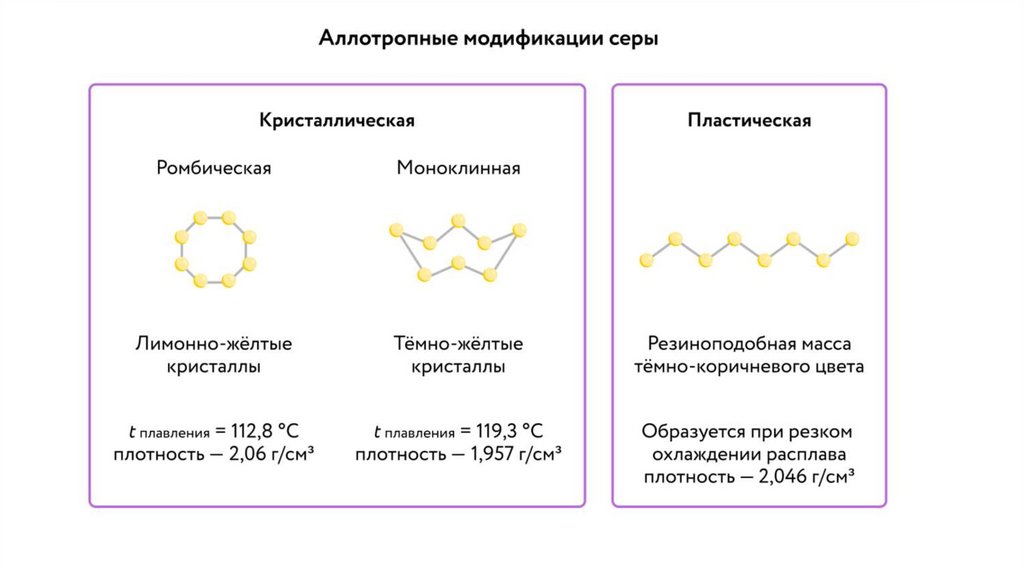
СераСера - элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева.
Относится к группе халькогенов - элементов VIa группы.
Сера - S - простое вещество имеет светло-желтый цвет. Использовалась еще до
нашей эры в составе священных курений при религиозных обрядах.
5.
6.
7.
Природные соединения•FeS2 - пирит, колчедан
•ZnS - цинковая обманка
•PbS - свинцовый блеск (галенит), Sb2S3 - сурьмяный блеск, Bi2S3 - висмутовый
блеск
•HgS - киноварь
•CuFeS2 - халькопирит
•Cu2S - халькозин
•CuS - ковеллин
•BaSO4 - барит, тяжелый шпат
•CaSO4 * 2Н2О - гипс
В местах вулканической активности встречаются залежи самородной серы.
8.
CaSO4 * 2H2OPbS
FeS2
HgS
9.
ПолучениеВ промышленности серу получают из природного газа,
который содержит газообразные соединения серы: H2S,
SO2.
H2S + O2 = S + H2O (недостаток кислорода)
SO2 + C = (t) S + CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS + S
В лабораторных условиях серу можно получить слив
растворы двух кислот: серной и сероводородной.
H2S + H2SO4 = S + H2O (здесь может также выделяться
SO2)
10.
Химические свойства•Реакции с неметаллами
На воздухе сера окисляется, образуя сернистый газ SO2. Реагирует со многими неметаллами, без нагревания
- только со фтором.
S + O2 = (t) SO2
S + 3F2 = SF6
S + Cl2 = (t) SCl2
2S + C = (t) CS2
11.
•Реакции с металламиПри нагревании сера бурно
взаимодействует со многими металлами с
образованием сульфидов.
2K + S = (t) K2S
2Al + 3S = (t) Al2S3
Fe + S = (t) FeS
12.
•Реакции с кислотамиПри взаимодействии с концентрированными
кислотами (при длительном нагревании) сера
окисляется до сернистого газа или серной
кислоты.
S + H2SO4 = (t) SO2 + H2O
S + HNO3 = (t) H2SO4 + NO2 + H2O
(уравняйте методом электронного баланса)
13.
•Реакции с щелочамиСера вступает в реакции диспропорционирования с
щелочами.
3S + 6KOH = (t) 2K2S + K2SO3 + 3H2O
•Реакции с солями
Сера вступает в реакции с солями. Например, в
кипящем водном растворе сера может реагировать
с сульфитами с образованием тиосульфатов.
Na2SO3 + S → (t) Na2S2O3
14.
Применение серы
Практически всю добываемую серу (примерно 90 %)
используют для производства серной кислоты.
Сера применяется также для вулканизации каучуков,
получения органических красителей, лекарственных
препаратов, пороха и других пиротехнических смесей.
Серу в виде мелкого порошка, называемого «серным
цветом», сжигают для получения сернистого газа,
которым садоводы окуривают плодовые растения и
обеззараживают погреба.
Сера входит в состав мазей для лечения кожных
заболеваний.
15.
Блиц-опрос по теме Сера1. Элементы VIa группы по-другому называются
А) Галогены б) Щелочные металлы в) Благородные газы
г)Халькогены
2. Формула цинковой обманки
А) ZnCl2 б) Zn в) ZnS
г) ZnSO
4
4. Выберите формулу бесцветного газ с запахом тухлых яиц
А) NH3
O3
H2S
Г) SO2
5. Выберите продукт реакции KOH + SO (щелочь в избытке)
А) K2SO3
в) KHSO3
Б) K2S
г) KHSO4
Б)
В)
2
16.
Сероводород - H2SСодержится в вулканических
газах, попутных нефтяных
газах, природном газе.
Бесцветный газ с характерным
запахом тухлых яиц.
Огнеопасен. Ядовит.
Используется в химической
промышленности и в лечебных
целях (сероводородные ванны).
17.
ПолучениеВ промышленности: как побочный продукт при
переработке нефти, природного газа, каменного угля.
В лаборатории: сероводород получают в результате
реакции сульфида алюминия с водой, а также
взаимодействия разбавленных кислот с сульфидами.
Al2S3 + 6H2O = (t) 2Al(OH)3↓ + 3H2S↑
FeS + 2HCl = FeCl2 + H2S↑
18.
Химические свойства•Кислотные свойства
Сероводород плохо диссоциирует в воде, является слабой
кислотой. Реагирует с основными оксидами, основаниями с
образованием средних и кислых солей (зависит от соотношения
основания и кислоты).
MgO + H2S = (t) MgS + H2O
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
1 : 1
2KOH + H2S = K2S + 2H2O
2 : 1
Металлы, стоящие в ряду напряжений до водорода, способны
вытеснить водород из кислоты.
Ca + H2S = (t) CaS + H2
19.
•Восстановительные свойстваСероводород - сильный восстановитель (сера в
минимальной степени окисления S2-). Горит в кислороде
синим пламенем, реагирует с кислотами.
H2S + O2 = H2O + S (недостаток кислорода)
H2S + O2 = H2O + SO2 (избыток кислорода)
H2S + HClO3 = H2SO4 + HCl
(уравняйте методом электронного баланса)
20.
Более сильные окислители способны окислять сероводороддо оксида серы(IV) и даже до серной кислоты.
H2S + 3H2SO4(конц.) = 4SO2↑ + 4H2O
H2S + 8HNO3(конц.) = H2SO4 + 8NO2↑ + 4H2O
H₂S + Br₂ → S↓ + 2HBr
21.
CульфидыШироко распространены в природе
FeS2
HgS
Цинковая
обманка.
Сфалерит.
ZnS
Свинцовый блеск.
Галенит
PbS
22.
Сульфидную руду используют в промышленностидля получения металлов
1 стадия – обжиг
2ZnS + 3O2 = 2ZnO + 2SO2↑
2 стадия – восстановление
ZnO + CO = Zn + CO2
23.
•Качественная реакция1) Для определения сульфид-ионов к раствору сульфидов
добавляем Н+ (кислоты)
Na2S + 2HCl = 2NaCl + H2S↑
При добавлении кислот выделяется бесцветный газ с запахом
тухлых яиц.
2) Качественной реакцией на сульфид-ион (сероводород и
сульфиды) является реакция с солями свинца, меди, в ходе
которой образуется осадки черного цвета (сульфид свинца,
сульфид меди (II).
H2S + Pb(NO3)2 = PbS↓ + 2HNO3
H2S + CuCl2 = CuS↓ + 2HCl
24.
С бромной водой•Обесцвечивание бромной воды и появление
серы на поверхности раствора.
•Уравнение реакции: H₂S + Br₂ → S↓ + 2HBr
25.
+4Оксид серы - SO2
Сернистый газ - SO2 - при нормальных условиях бесцветный
газ с характерным резким запахом (запах загорающейся
Получение
спички).
В промышленных условиях сернистый газ получают обжигом пирита.
4FeS2 + 11O2 = (t) 2Fe2O3 + 8SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе
подобных реакций образуется сернистая кислота, распадающаяся на
сернистый газ и воду.
K2SO3 + H2SO4 = (t) K2SO4 + H2O + SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с
серной кислотой.
Cu + 2H2SO4(конц.) = (t) CuSO4 + SO2 + 2H2O
26.
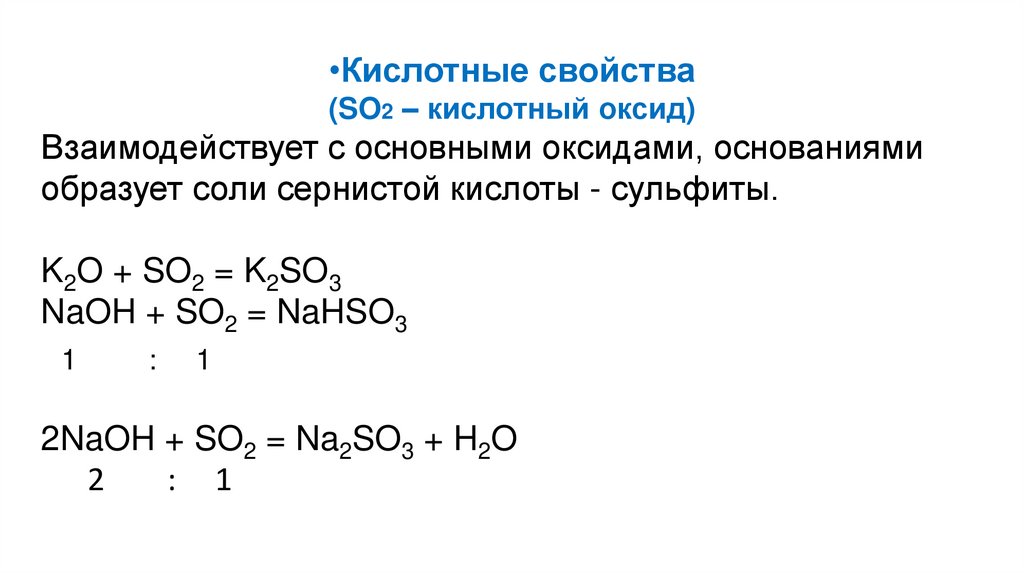
•Кислотные свойства(SO2 – кислотный оксид)
Взаимодействует с основными оксидами, основаниями
образует соли сернистой кислоты - сульфиты.
K2O + SO2 = K2SO3
NaOH + SO2 = NaHSO3
1
:
1
2NaOH + SO2 = Na2SO3 + H2O
2
: 1
27.
•Восстановительные свойстваХимически сернистый газ очень активен. Его
восстановительные свойства продемонстрированы в
реакциях ниже.(сера из степени +4 переходит в +6)
Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 +2H2SO4
2SO2 + O2 = (t, кат. - Pt) 3SO3
SO2 + 2HNO3 = H2SO4 + 2 NO2
SO2 + Cl2 = SO2Cl2
28.
•Как окислительВ присутствии сильных восстановителей SO2 способен
проявлять окислительные свойства (понижать степень
окисления).
CO + SO2 = CO2 + S
H2S + SO2 = S↓ + H2O
29.
Сернистая кислотаСлабая, нестойкая двухосновная кислота. Существует
лишь в разбавленных растворах.
Получение
SO2 + H2O ⇄ H2SO3
Химические свойства
•Диссоциация
Диссоциирует в водном растворе ступенчато.
H2SO3 = H+ + HSO3HSO3- = H+ + SO32-
30.
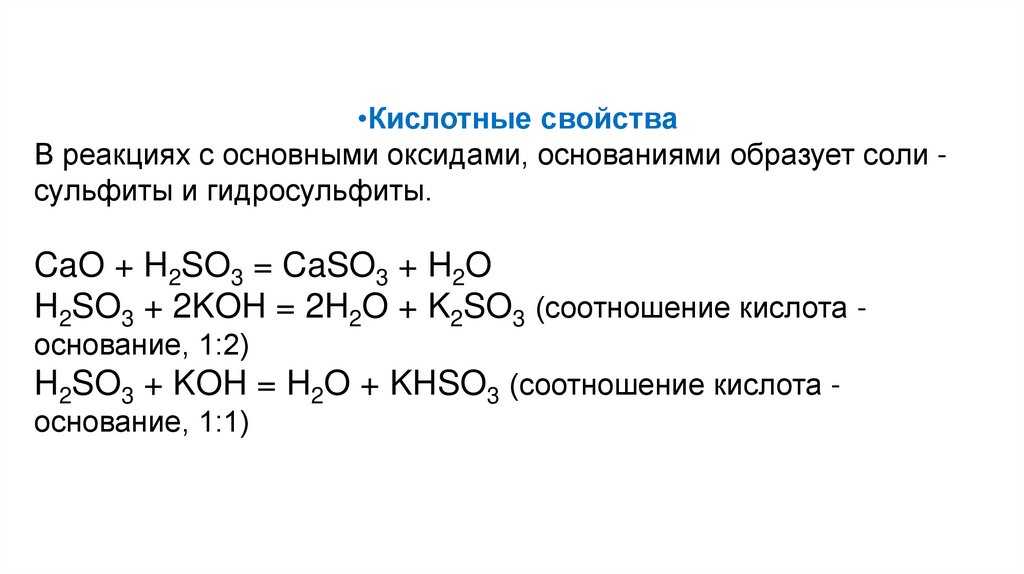
•Кислотные свойстваВ реакциях с основными оксидами, основаниями образует соли сульфиты и гидросульфиты.
CaO + H2SO3 = CaSO3 + H2O
H2SO3 + 2KOH = 2H2O + K2SO3 (соотношение кислота основание, 1:2)
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота основание, 1:1)
31.
Окислительные свойстваС сильными восстановителями сернистая кислота
принимает роль окислителя.
H2SO3 + H2S = S↓ + H 2O
Восстановительные свойства
Как и сернистый газ, сернистая кислота и ее соли
обладают выраженными восстановительными
свойствами.
(повышают СО с +4 до +6)
H2SO3 + Br2 = H2SO4 + HBr
32.
Оксид серы VI - SO3Является высшим оксидом серы. Бесцветная летучая жидкость с
удушающим запахом. Ядовит.
Получение
В промышленности данный оксид получают, окисляя
SO2 кислородом при нагревании и присутствии катализатора (оксид
ванадия - Pr, V2O5).
2SO2 + O2 = (кат) 2SO3
В лабораторных условиях разложением солей серной
кислоты - сульфатов.
Fe2(SO4)3 = (t) SO3 + Fe2O3
33.
Кислотные свойстваЯвляется кислотным оксидом, соответствует серной кислоте. При
реакции с основными оксидами и основаниями образует ее соли сульфаты и гидросульфаты. Реагирует с водой с образованием
серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке - средняя
соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке кислая соль)
SO3 + Ca(OH)2 = CaSO4 + H2O
SO3 + Li2O = Li2SO4
SO3 + H2O = H2SO4
34.
Окислительные свойстваSO3 - сильный окислитель. Чаще всего
восстанавливается до SO2.
SO3 + P = SO2 + P2O5 ( уравнять методом электр. баланса)
SO3 + H2S = SO2 + H2O
SO3 + KI = SO2 + I2 + K2SO4( уравнять методом электр. баланса)
35.
Серная кислота H2SO4 – это сильнаякислота, двухосновная, прочная и
нелетучая. При обычных условиях серная
кислота – тяжелая маслянистая жидкость,
хорошо растворимая в воде.
Химические свойства
1. Серная кислота реагирует с основными оксидами,
основаниями, амфотерными оксидами и амфотерными
гидроксидами.
H2SO4 + MgO → MgSO4 + H2O
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
36.
При взаимодействии серной кислоты с гидроксидомкалия образуются сульфаты или гидросульфаты:
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
2. Серная кислота вытесняет более слабые кислоты из солей
в растворе (карбонаты, сульфиды и др.). Также серная
кислота вытесняет летучие кислоты из их солей (кроме
солей HBr и HI).
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
37.
3. Концентрированная серная кислота реагирует ствердым нитратом натрия. При этом менее летучая
серная кислота вытесняет азотную кислоту:
NaNO3 (тв.) + H2SO4 → NaHSO4 + HNO3
Аналогично – концентрированная серная кислота
вытесняет хлороводород из твердых
хлоридов, например, хлорида натрия:
NaCl(тв.) + H2SO4 → NaHSO4 + HCl
38.
4. Также серная кислота вступает в обменные реакции с солями.Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 + BaCl2 → BaSO4 + 2HCl
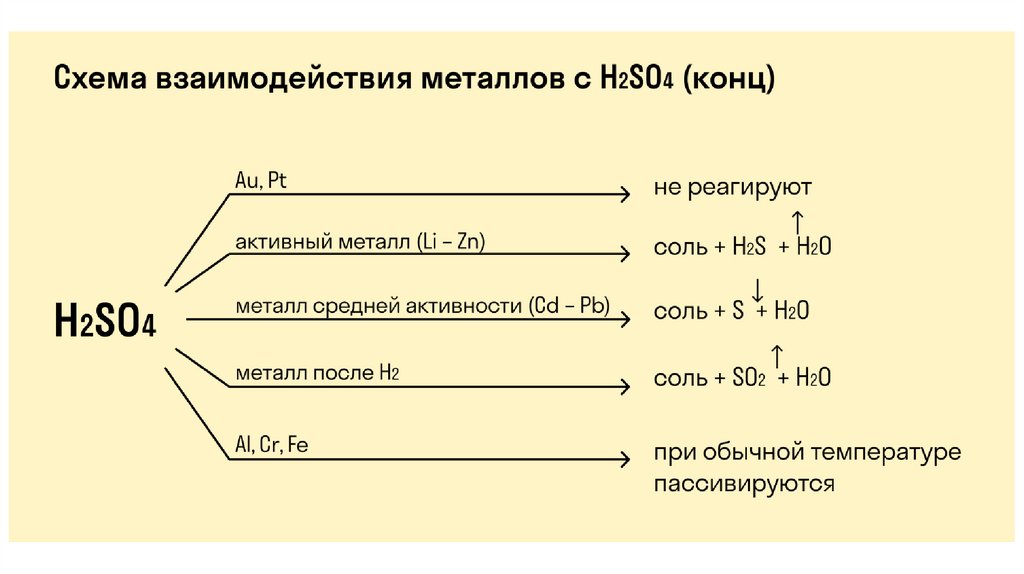
5.
Разбавленная
серная
кислота
взаимодействует
с металлами, которые расположены в ряду активности металлов до
водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется
сульфат железа (II):
H2SO4(разб.) + Fe → FeSO4 + H2
Серная кислота взаимодействует с аммиаком с образованием солей
аммония:
H2SO4 + NH3 → NH4HSO4
39.
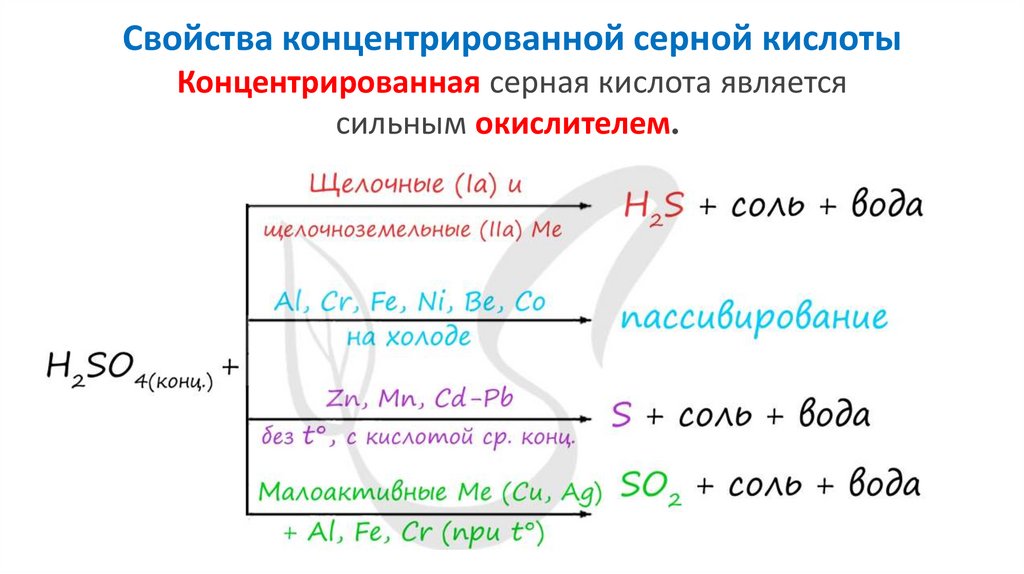
Свойства концентрированной серной кислотыКонцентрированная серная кислота является
сильным окислителем.
40.
41.
42.
Привзаимодействии
с
щелочными
металлами
и
цинком
концентрированная серная кислота восстанавливается
до сероводорода:
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
При взаимодействии с щелочноземельными металлами и
магнием концентрированная серная кислота восстанавливается
до серы:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
43.
При взаимодействии с неактивнымиметаллами концентрированная серная кислота
восстанавливается до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
44.
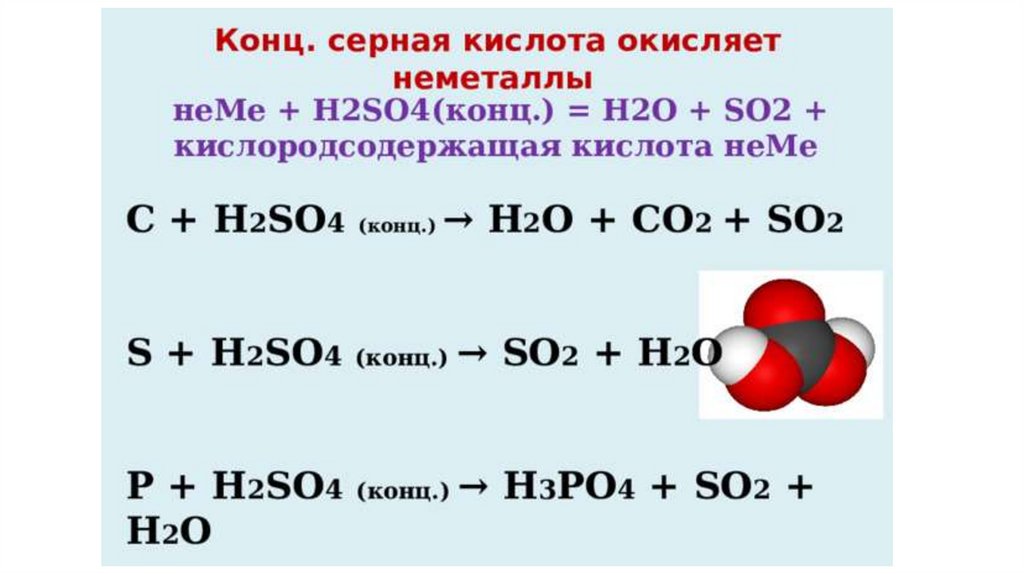
Концентрированная серная кислота окисляет неметаллы фосфор, углерод, серу. При этом серная кислотавосстанавливается до оксида серы (IV):
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
45.
Уже при комнатной температуре концентрированная сернаякислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O
46.
Качественнаяреакция
на
сульфат-ионы
–
взаимодействие с растворимыми солями бария. При этом
образуется белый кристаллический осадок сульфата
бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl






































 Химия
Химия








