Похожие презентации:
сера
1.
СЕРАСера
S
2.
ИЗ ИСТОРИИ ОТКРЫТИЯСера встречается в природе в свободном (самородном)
состоянии, поэтому она была известна человеку уже в глубокой
древности. Считалось, что горящая сера отгоняет нечистую силу.
В Библии говорится об использовании серы для очищения
грешников. У человека средневековья запах «серы»
ассоциировался с преисподней. Применение горящей серы для
дезинфекции упоминается Гомером. В Древнем Риме с помощью
сернистого газа отбеливали ткани.
3.
ИЗ ИСТОРИИ ОТКРЫТИЯИздавна использовалась сера в
медицине — ее пламенем
окуривали больных, ее включали
в состав различных мазей для
лечения кожных заболеваний. В
11 в. Авиценна (Ибн Сина), а
затем и европейские алхимики
полагали, что металлы, в том
числе золото и серебро, состоят
из находящихся в различных
соотношениях серы и ртути.
Поэтому сера играла важную роль
в попытках алхимиков найти
«философский камень» и
превратить недрагоценные
металлы в драгоценные.
4.
ИЗ ИСТОРИИ ОТКРЫТИЯПрактическое значение серы резко возросло после того, как
изобрели черный порох (в состав которого обязательно
входит сера). Византийцы в 673 г., защищая
Константинополь, сожгли флот неприятеля с помощью так
называемого греческого огня — смеси селитры, серы,
смолы и других веществ — пламя которого не гасилось
водой. В средние века в Европе применялся черный порох,
по составу близкий к смеси греческого огня. С тех пор
началось широкое использование серы для военных целей.
5.
СЕРА КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТПоложение в
периодической системе
3 период, VIА группа,
порядковый номер 16
Строение атома
Ar=32, заряд ядра=+16
(16 р+, 16 n0) 16ē
S )2 )8 )6
Степени окисления
Высший оксид и
высший гидроксид
Летучее водородное
соединение
-2, 0, +2, +4, +6
SO3 и H2SO4
H2S
6.
СЕРА В ПРИРОДЕСера встречается в природе в свободном
виде и в составе соединений (сульфиды,
сульфаты)
7.
СЕРА В ПРИРОДЕСамородная сера
Пирит FeS2 Цинковая обманка ZnS
8.
СЕРА В ПРИРОДЕГлауберова соль
Na2SO4 ∙ 10H2O
Гипс CaSO4 ∙ 2H2O
9.
ФИЗИЧЕСКИЕ СВОЙСТВАТвердое вещество желтого цвета без
запаха. Нерастворима в воде. Водой не
смачивается (плавает на поверхности).
10.
АЛЛОТРОПИЯ СЕРЫАллотропия – явление, при котором один
химический элемент образует несколько
простых веществ
11.
АЛЛОТРОПИЯ СЕРЫ1) Кристаллическая
2) Пластическая
ЛимонноТемно-желтые
желтые
кристаллы
кристаллы
Наиболее
Образуется при
устойчивая
кристаллизации
модификация расплава
Резиноподобная
масса темнокоричневого цвета
Образуется при резком
охлаждении расплава
12.
ХИМИЧЕСКИЕ СВОЙСТВА1) С металлами. Не взаимодействует с
золотом и платиной.
+1 -2
2Na + S → Na2S сульфид натрия
+2 -2
Hg + S → HgS сульфид ртути
t +3 -2
2Al + 3S → Al2S3 сульфид алюминия
13.
ХИМИЧЕСКИЕ СВОЙСТВА2) С неметаллами. Не взаимодействует с
азотом, йодом и благородными газами.
+6 -1
S + 3F2 → SF6 фторид серы (VI)
t +4 –2
S + O2 → SO2 оксид серы (IV),
сернистый газ
t +1 -2
H2 + S → Н2S сероводород
14.
ХИМИЧЕСКИЕ СВОЙСТВА3) С щелочами
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
15.
ХИМИЧЕСКИЕ СВОЙСТВА4) С кислотами –окислителями
S + 2H2SO4(конц.) = 3SO2↑ + 2H2O
S + 6HNO3(конц.) = H2SO4 + 6NO2 + 2H2O
16.
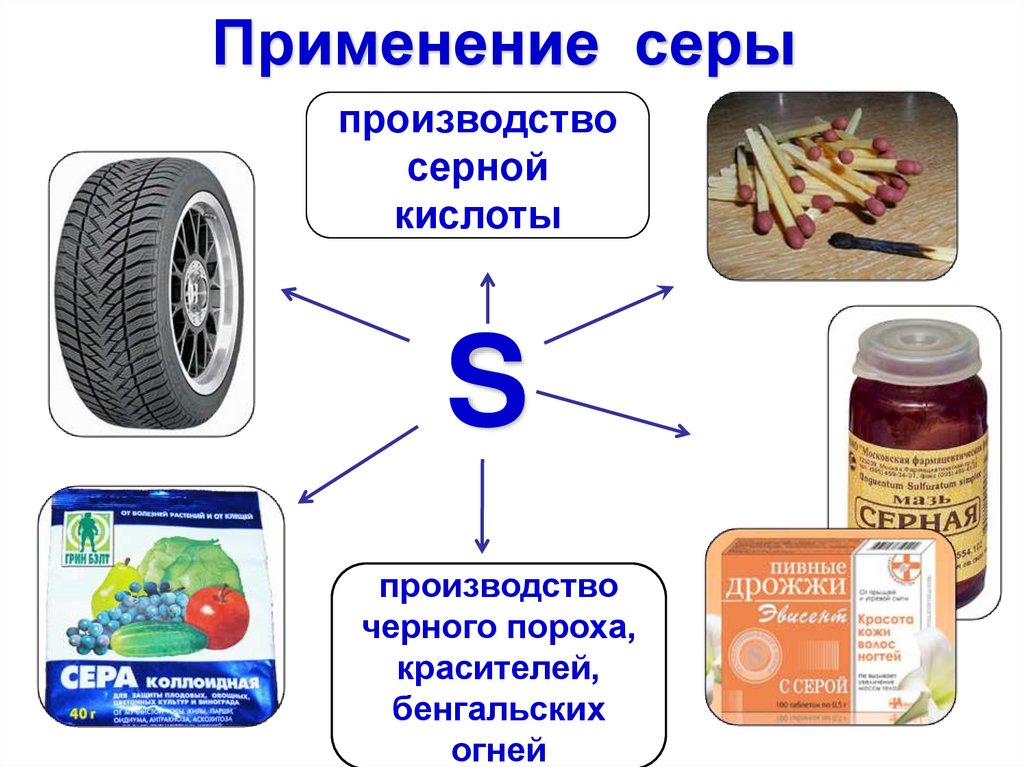
Применение серыпроизводство
серной
кислоты
S
для борьбы с
вредителями
растений
производство
черного пороха,
красителей,
бенгальских
огней
производство
спичек
17.
Соединения серы (§ 14, 15)Н2S
1. Названия (все
возможные)
2. Физические
свойства
- агрегатное состояние
- цвет
- запах
- растворимость в
воде
- токсичность
3. Применение
SO2
SO3
H2SO3
















 Химия
Химия








