Похожие презентации:
1бСТР Лекция 8
1.
Лекция по теме«Получение и свойства цемента»
Новоселова Елена Викторовна
2.
Учебные вопросы1. Производство цемента
2. Гидратационное твердение цемента
3. Добавки в цемент и бетон
4. Коррозия цементного камня, бетона и железобетона
Литература:
1. Коровин, Н.В. Общая химия / Н.В. Коровин. − М.: Академия,
2013. – Гл. 12.
2. Химия: поверхностные явления, коллоидные системы,
минеральные вяжущие вещества: учебное пособие / В.В. Грушина
и др.; МАДИ. – М.: МАДИ, 2017. – с. 56-64 (№ 331, маркер 17Е436)
3.
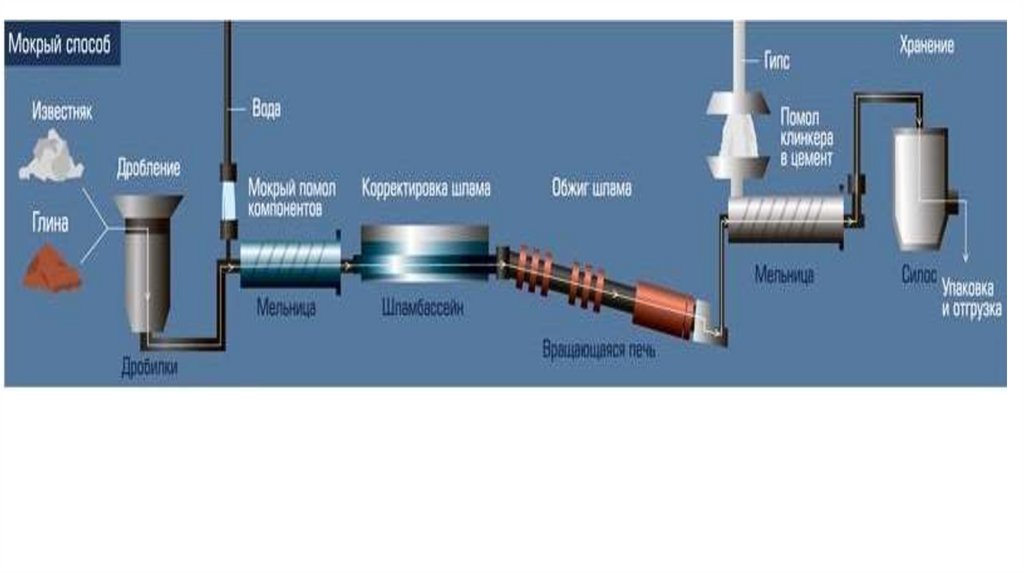
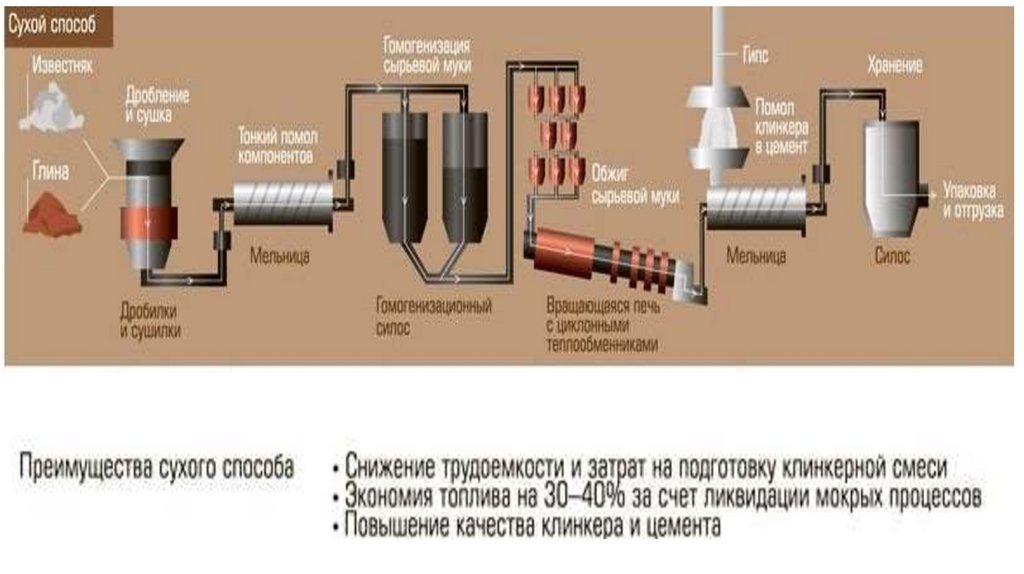
1. Производство цемента4.
Сырьё для производства портландцемента –смеси, состоящие из 75…78 % известняка (мела,
ракушечника, известнякового туфа, мрамора)
и 22…25 % глин (глинистых сланцев, суглинков),
либо известняковые мергели.
Для получения требуемого химического
состава сырья используют корректирующие
добавки:
пиритные огарки, колошниковую пыль,
бокситы, пески, опоки, трепелы.
5.
Распространённыепортландцемента
–
методы
«сухой»
производства
и
«мокрый»,
в
зависимости от способа получения сырья – в виде
водных суспензий или в виде сухих смесей.
Обжиг сырьевой смеси проводится при температуре 1 4700C в
течение 2…4 часов в длинных вращающихся печах
(3,6х127 м, 4×150 м и 4,5х170 м)
с внутренними теплообменными устройствами
для синтеза необходимых минералов цементного
клинкера.
6.
7.
8.
9.
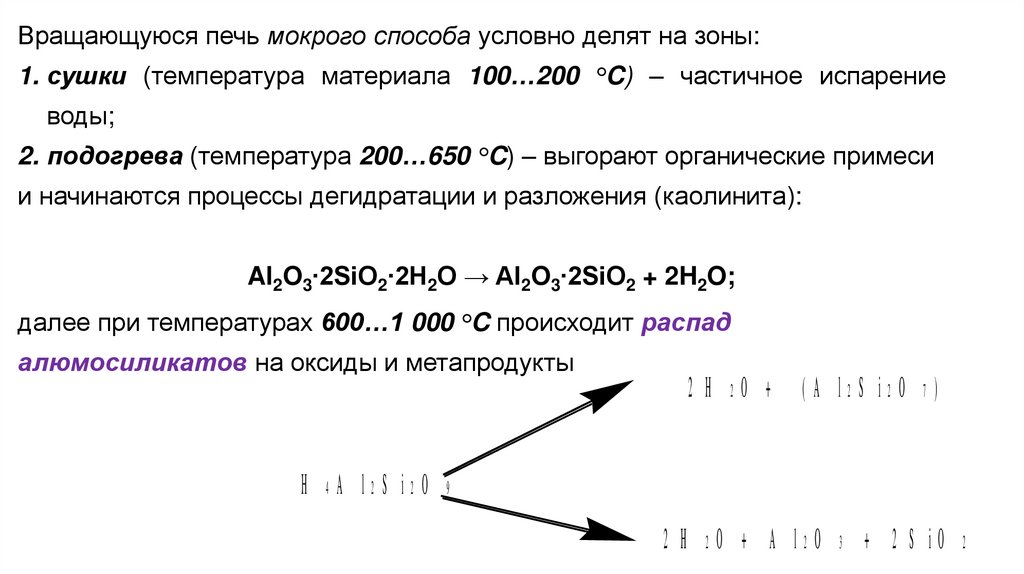
Вращающуюся печь мокрого способа условно делят на зоны:1. сушки (температура материала 100…200 °C) – частичное испарение
воды;
2. подогрева (температура 200…650 °C) – выгорают органические примеси
и начинаются процессы дегидратации и разложения (каолинита):
Al2O3∙2SiO2∙2H2O → Al2O3∙2SiO2 + 2H2O;
далее при температурах 600…1 000 °C происходит распад
алюмосиликатов на оксиды и метапродукты
2 H 2O +
(A l2S i2O 7)
H 4A l2S i2O 9
2 H 2O + A l2O 3 + 2 S iO 2
10.
3.декарбонизации
(температура
900…1200
°C)
–
разложение
известнякового компонента:
СаСО3 → CаO + СО2,
одновременно продолжается распад глинистых минералов на оксиды.
Происходит синтез новых соединений:
CаO + Al2O3 = Ca(AlO2)2,
CаO + Fe2O3 = Ca(FeO2)2,
2CaO + SiO2 = Ca2SiO4.
11.
Однокальциевыйтрёхкальциевый:
алюминат
Ca(AlO2)2
постепенно
переходит
в
Ca(AlO2)2+ 2СаО = Са3(АlО3)2.
Реакции, протекающие во 2 и 3 зонах, сопровождаются образованием
разрыхленного материала с сильно развитой поверхностью и высокой
реакционной способностью.
4. экзотермических реакций (температура 1200…1350°C) – завершается
процесс образования Са3(АlО3)2, Ca2SiO4 и идёт синтез Ca4(AlO3)2(FeO2)2 :
Ca(AlO2)2+ 2СаО + Ca(FeO2)2 = Са4(АlО3)2 (FeO2)2
– формируются 3 из 4 основных минералов клинкера.
Часть СаО остается ещё свободной.
12.
5. спекания (температура 1300→1470→1300°C) – частичное плавлениематериала.
Завершаются реакции образования силикатов и алюминатов кальция.
Происходит частичный переход двухкальциевого силиката в
трёхкальциевый (алит):
Са2SiO4 + CаO = Ca3SiO5.
Свободного CаO остается не более 1,0 %
Материал спекается и образует зернистую массу, называемую
цементным клинкером.
Размеры зерен клинкера 7-20 мм.
13.
6. охлаждения (температура 1300…1000°C) – медленно понижаетсятемпература.
При выходе из печи клинкер охлаждается, его размалывают
(до размера 85% частиц не более 80 мкм),
смешивают с гипсом (3-5% к общей массе)
и используют как гидравлическое вяжущее вещество – портландцемент.
Химический состав цементного клинкера
выражают условно-процентным содержанием оксидов:
СаО (С) – 60-77% (масс.)
SiO2 (S) – 19-34% (масс.)
Al2O3 (A) – 4-7% (масс.)
Fe2O3 (F) – 2-6% (масс.)
14.
Химико-минералогический состав цементного клинкераНазвание минерала
цементного клинкера
Химическая формула
Условное
обозначение
Примерное
содержание в
клинкере, %
Трёхкальциевый силикат
(алит)
Ca3SiO5
(3CaO·SiO2)
C 3S
40…60
Двухкальциевый силикат
(белит)
β-Ca2SiO4
(β-2CaO·SiO2)
C 2S
15…40
Трёхкальциевый алюминат
Ca3(AlO3)2
(3CaO·Al2O3)
C 3A
5…15
Четырёхкальциевый
алюмоферрит (целит)
Ca4(AlO3)2 (FeO2)2
(4CaO·Al2O3·Fe2O3)
C4AF
10… 20
15.
16.
2. Гидратационное твердение цементаВзаимодействие минералов цементного клинкера с водой
Трёхкальциевый силикат (алит) Са3SiO5 активно взаимодействует с
водой (∆Н° гидр. = - 502,7 Дж/г),
за 3 суток он гидратируется на 70-80%.
Продукт гидратации (гидролиза) твердеет с образованием материала,
имеющего высокую прочность.
Са3SiO5 + (n+1)Н2О = Са2SiO4 · nН2О + Са(ОН)2.
Двухкальциевый
гидросиликат
17.
Двухкальциевый силикат (белит) β-Са2SiO4 менее активен (∆Н0гидр= -259,78Дж/г).
За 3 суток гидратируется 10% белита, для завершения гидратации
требуется несколько месяцев.
β-Са2SiO4 + nН2О = Са2SiO4· nН2О.
Двухкальциевый
гидросиликат
В результате гидролиза алита и белита образуется
гидросиликат кальция состава Са2SiO4·nН2О, где n = 1,17.
Это смесь гидросиликатов различного состава:
в основном кислые соли ортокремневой кислоты Н4SiO4.
18.
Трёхкальциевыйалюминат
Са3(АlO3)2
–
самый
активный
минерал
цементного клинкера (∆Н0гидр= -850,57 Дж/г).
Схватывание происходит за несколько минут,
но прочность получаемого продукта низкая:
Са3(АlO3)2 + 6Н2О ↔ Са3(АlO3)2·6Н2О.
Гидроалюминат кальция
Чтобы замедлить эту реакцию, цементный клинкер при измельчении
смешивают с гипсом
(в соотношении 3-5% к массе цемента в зависимости от содержания С3А):
Са3(АlO3)2 + З(СаSО4·2Н2О) + 25Н2О ↔ Саз(АlO3)2·ЗСаSО4·31Н2О.
Игольчатые кристаллы
малорастворимой двойной соли –
гидросульфоалюмината кальция
19.
Четырёхкальциевыйалюмоферрит
(целит)
Са4(АlO3)2(FеО2)2
– медленно гидратирующееся вещество.
∆Н°гидр. = - 419 Дж/г.
Са4(АlO3)2(FеО2)2
+
(n+6)H2O
=
Са3(АlO3)2·6Н2О
Гидроалюминат
кальция
+
Са(FеО2)2·nН2О
Гидроферрит
кальция
Продукт гидратации обладает высокой прочностью.
В состав цементного камня входят:
• гидросиликаты кальция Са2SiO4·nН2О,
• гидроалюминаты кальция Са3(АlO3)2·6Н2О,
• гидросульфоалюминаты кальция Са3(АlO3)2·ЗСаSO4·31Н2О,
• гидроферриты кальция Са(FеО2)2·nН2О,
• гидроксид кальция Сa(OH)2
• и другие разновидности гидросиликатов и гидроалюминатов.
20.
21.
22.
23.
24.
3. Добавки в цемент и бетонИх вводят в цемент при помоле цементного клинкера
или с "водой затворения" при получении цементного теста,
бетонной смеси.
В зависимости от влияния на свойства цемента и бетона
различают добавки:
• воздухововлекающие и газообразующие;
• пластифицирующие и суперпластифицирующие;
• ускорители твердения;
• противоморозные;
• для специальных целей.
25.
Воздухововлекающие и газообразующие добавки (ПАВ)Воздухововлекающие добавки вводят в цемент (0,05-0,1%) на стадии
помола цементного клинкера.
Для производства воздухововлекающих добавок используют
анионные и амфотерные, неионогенные поверхностно-активные
вещества (ПАВ). Это соли лаурилсульфатов, CH3(CH2)11OSO3Na,
лаурилэфирсульфатов CH3(CH2)11(OCH2CH2)nOSO3Na,
алкилбензолсульфонатов
Наиболее часто используется
абиетат (резинат) натрия С19Н29 –СООNа.
Равномерное распределение пор с воздухом по всему объёму бетона
повышает его морозостойкость, улучшает его удобоукладываемость .
26.
Газообразующие добавки - кремнийорганические соединения ГКЖ(гидрофобизирующие кремнийорганические жидкости)
Полиэтилгидросилоксан (ГКЖ-94) взаимодействует с Са(ОН)2:
Пузырьки H2, равномерно распределённые в цементном тесте, обусловливают
дополнительную гидрофобизацию пор и капилляров в цементном камне.
Его структура становится более однородной и насыщенной замкнутыми
микропорами, что повышает морозостойкость бетона.
27.
Пластифицирующие и суперпластифицирующие добавки (ПАВ)вводятся в количестве 0,1- 0,З% (пластифицирующие) и
1-1,5 % (суперпластифицирующие) к массе цемента.
Они уменьшают коэффициент внутреннего трения между частицами,
понижают водопотребность цемента.
Пластификаторы и суперпластификаторы предотвращают слипание
отдельных частиц, замедляют коагуляцию новообразований, при этом
высвобождается некоторое количество воды.
Добавки пластификаторов разжижают бетонные смеси, и требуемая
пластичность смеси достигается
при меньшем расходе воды и цемента.
28.
В качестве пластифицирующих добавок используют:• ССБ (сульфитно-спиртовую барду), в основе которой —
кальциевые соли лигносульфоновых кислот;
• жирные кислоты с числом углеродных атомов более 18,
• соли жирных кислот и др.
ЛСТ - лигносульфонат технический
29.
В качестве суперпластификаторов используются:меламиноформальдегидные
и нафталиноформальдегидные сульфированные
водорастворимые смолы.
СНФ - сульфонафталинформальдегид (С-3)
30.
Ускорители твердения бетонавводят в количестве от 1 до 3% (чаще 1,2%) к массе цемента
вместе с "водой затворения":
NаСl, СаСl2, Nа2SО4, К2СО3 и Са(NO3)2.
В зависимости от механизма действия эти добавки делят на 3 класса:
1. Добавки, повышающие растворимость вяжущих веществ
(НСl,
NаСl)
или
понижающие
растворимость
гидратных
новообразований (соли Са) за счёт введения одноимённого иона.
2. Добавки, реагирующие с вяжущими веществами с
образованием труднорастворимых или малодиссоциирующих
соединений.
3. Добавки – готовые центры кристаллизации.
Эти добавки являются электролитами, при их растворении в воде образуются
сольваты.
В результате химические и физические свойства воды меняются.
31.
Противоморозные добавкивводят в количестве до 10% к массе цемента в зависимости от температуры воздуха,
они в соответствии с законом Рауля понижают температуру замерзания воды.
Это СаСl2, NaCl, К2CO3, СаСl2 + СO(NH2)2 (мочевина),
Са(NO2)2 + Са(NO3)2 + СаСl2 (нитрит-нитрат-хлорид кальция – ННХК) и др.
Рассчитывают концентрацию добавки по уравнению Рауля:
∆t = i· Kк · Сm,
где i – изотонический коэффициент, связанный со степенью диссоциации электролита
(α) формулой:
(i 1)
α
(n 1)
n – число ионов, образующихся при диссоциации молекулы растворённого вещества;
Кк – криоскопическая константа (для воды К = 1,86);
Сm – моляльная концентрация добавки.
32.
Добавки для специальных целейантикоррозионные добавки, предохраняющие стальную арматуру
железобетонных конструкций от коррозии
(ингибиторы коррозии – NаNО2, К2СгО4 и др.),
• суперускорители для торкретирования (послойного нанесения
бетонной смеси на поверхность конструкции под давлением)
• комплексные добавки
33.
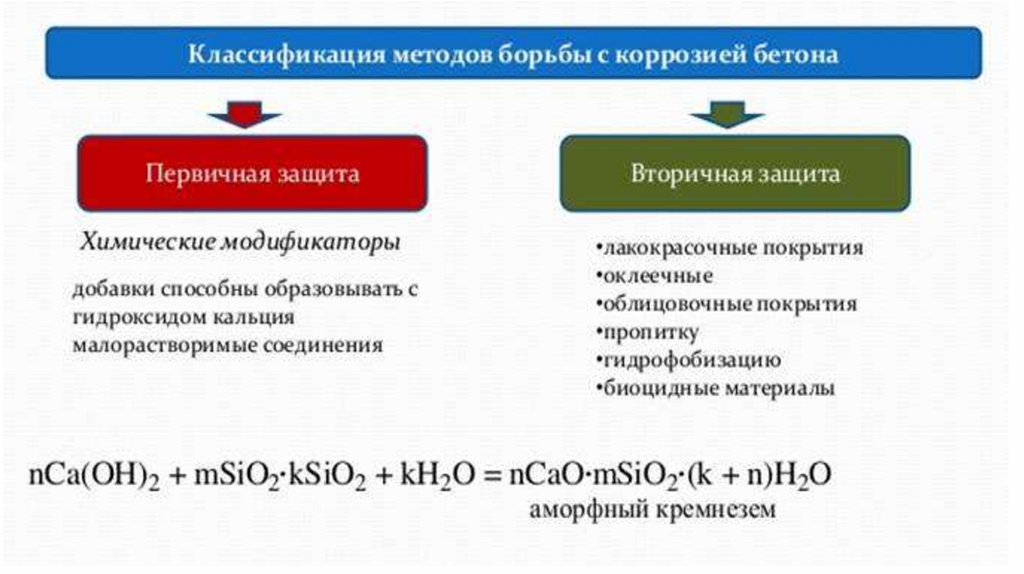
4. Коррозия цементного камня, бетона и железобетона34.
К первому виду – физической коррозии относятся процессы, которыевозникают в бетоне при действии воды и водных растворов, способных
растворять компоненты цементного камня.
Ко второму виду коррозии (химической) можно отнести процессы, при которых происходят химические реакции взаимодействия
между компонентами цементного камня и агрессивной средой.
Третий вид коррозии (химической) включает процессы, при развитии
которых в теле бетона происходят накопление и кристаллизация малорастворимых продуктов реакции, имеющих бóльший объем,
чем исходные вещества.
35.
Ко второму виду коррозии бетона относятся:1) коррозия под действием растворов с низким значением рН (кислот, солей),
2) углекислотная,
3) магнезиальная и др.
а) углекислотная коррозия
Ca(OH)2 + CO2 = CaCO3 + H2O,
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Гидрокарбонат кальция хорошо растворим
и вымывается из бетона,
что приводит к разрушению цементного камня.
36.
б) магнезиальная коррозия.Са(ОН)2 + MgSO4 + 2H2O = CaSO4 · 2H2O + Mg(OH)2
или
Ca3(AlO3)2 + 3MgSO4 + 12H2O = 3CaSO4 · 2H2O + 3Mg(OH)2 + 2Al(OH)3.
Гидроксиды магния – рыхлые продукты,
которые вымываются из бетона.
37.
Наиболее опасной коррозией третьего вида является коррозия поддействием растворов, содержащих сульфаты.
В реакцию с ними вступает гидроалюминат кальция:
Са3(АlO3)2· 6Н2O + ЗСаSO4 + 25Н2О ↔ Са3(АlO3)2·ЗСаSO4·31Н2О
Образующийся в затвердевшем бетоне гидросульфоалюминат кальция
называют "цементной бациллой".
Он имеет значительно больший объём, чем исходные вещества, повышает
внутреннее давление в бетоне, что приводит к разрушению конструкций.








































 Строительство
Строительство