Похожие презентации:
необоротні та оборотні хім
1. Оборотні та необоротні реакції
Хімія 9 клас2.
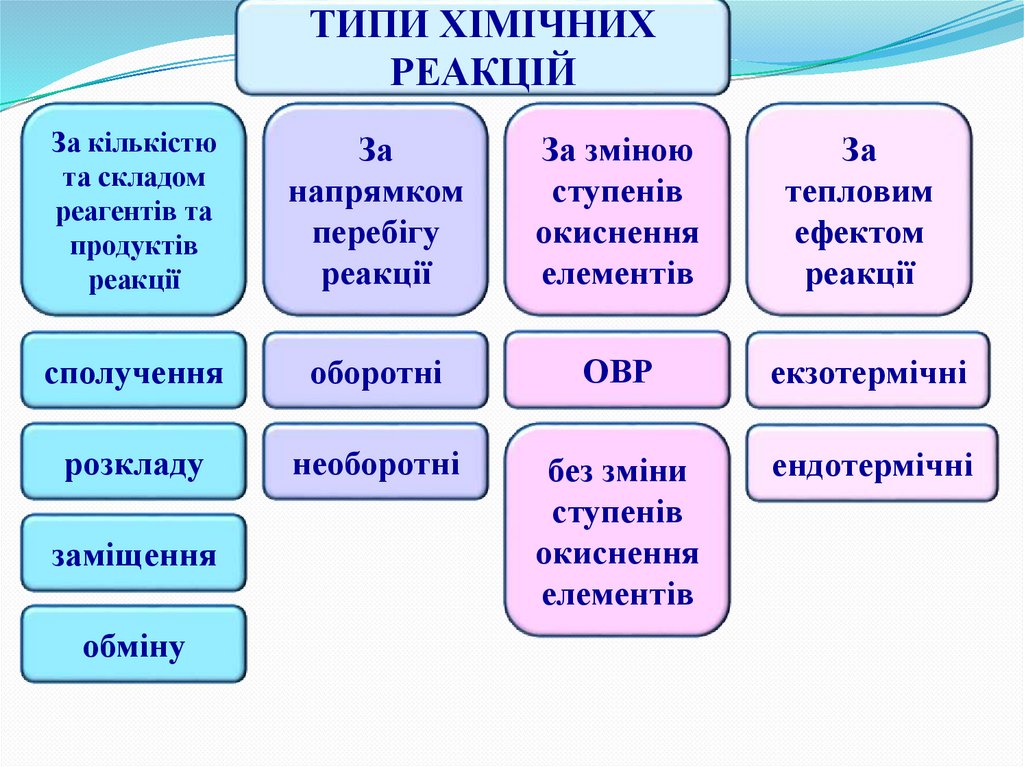
ТИПИ ХІМІЧНИХРЕАКЦІЙ
За кількістю
та складом
реагентів та
продуктів
реакції
За
напрямком
перебігу
реакції
За зміною
ступенів
окиснення
елементів
За
тепловим
ефектом
реакції
сполучення
оборотні
ОВР
екзотермічні
розкладу
необоротні
без зміни
ступенів
окиснення
елементів
ендотермічні
заміщення
обміну
3. Оборотні й необоротні реакції
За напрямом перебігу реакції поділяютьна оборотні й необоротні.
Під час вивчення електролітичної дисоціації
ви ознайомилися з реакціями електролітів у
розчинах, які завершуються повним
перетворенням реагентів на продукти.
4.
РеакціїНеоборотні
Оборотні
Хімічні реакції, що
відбуваються в одному
напрямку до повного
перетворення вихідних
речовин у продукти
реакції
Хімічні реакції, що за
однакових умов
відбуваються у двох
протилежних напрямках:
прямому і зворотному
HCl + KOH = KCl + HOH
У рівняннях оборотних
реакцій замість «=»
ставиться «↔»
N2 + 3H2 2NH3
5. НЕОБОРОТНІ РЕАКЦІЇ
Розглядаючи взаємодію речовин, ми наголошувалина односторонньому перебігу хімічних процесів.
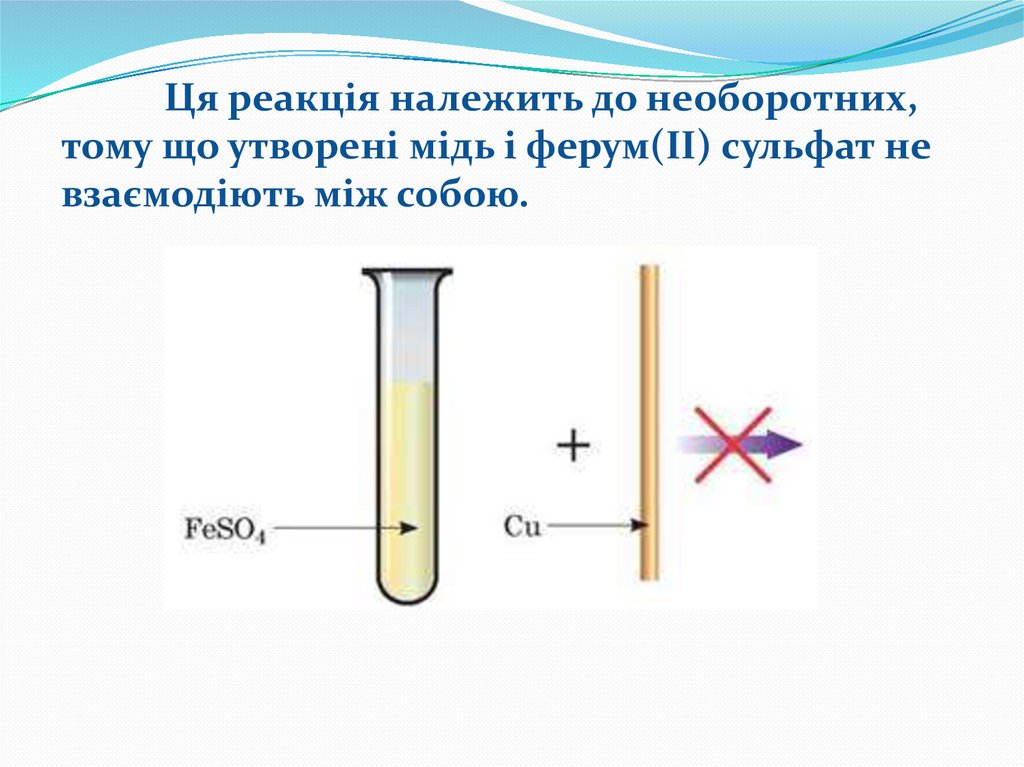
Наприклад, між купрум(ІІ) сульфатом і залізом
відбувається реакція заміщення (мал.) й утворюються
ферум(ІІ) сульфат і мідь:
Fe + CuSO4 = FeSO4+ Cu
6.
Ця реакція належить до необоротних,тому що утворені мідь і ферум(ІІ) сульфат не
взаємодіють між собою.
7. Необоротні реакції
- реакції, щовідбуваються в одному напрямку і закінчуються
повним перетворенням реагентів на продукти
реакції.
Необоротні реакції
відбуваються доти, доки
повністю не витратиться один з
реагентів.
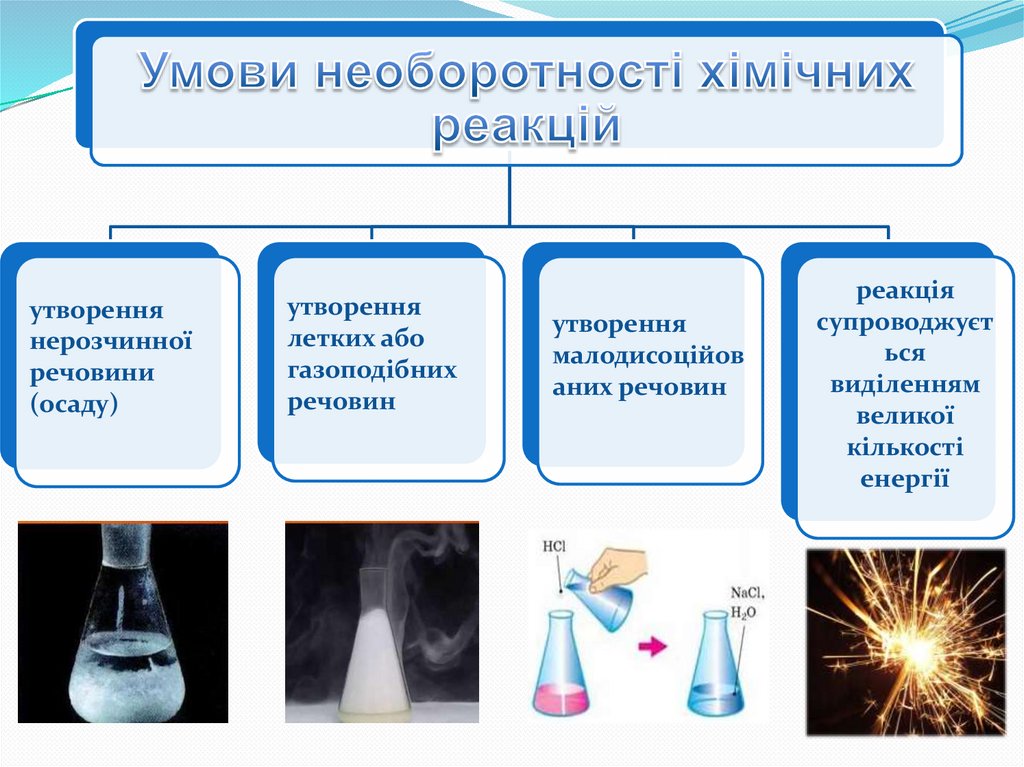
8.
утвореннянерозчинної
речовини
(осаду)
утворення
летких або
газоподібних
речовин
утворення
малодисоційов
аних речовин
реакція
супроводжуєт
ься
виділенням
великої
кількості
енергії
9. ОБОРОТНІ РЕАКЦІЇ
Більшість хімічних реакцій відбуваються недо кінця. Продукти, які утворилися в результаті
реакції можуть взаємодіяти між собою. Такі реакції
називаються оборотними.
Оборотні реакції — це реакції, що за одних і
тих самих умов відбуваються одночасно у
протилежних напрямках, тому реагенти однієї
реакції є продуктами другої i навпаки.
10.
Оборотними називають хімічні реакції,які одночасно відбуваються у двох
протилежних напрямках.
Наприклад:
Зверни увагу!
У рівняннях оборотних реакцій замість знаку «=»
ставлять знак оборотності — «⇄».
11.
Летка сполука Нітрогену з Гідрогеном амоніакNH3 утворюється з простих речовин азоту і водню за
рівнянням реакції сполучення:
N2 + 3H2 → 2NH3.
Одночасно з цією реакцією відбувається реакція
розкладу утвореного амоніаку на дві прості речовини —
азот і водень:
2NH3 → N2 + 3H2
Оборотність реакції позначають двома стрілками у
протилежних напрямках:
12.
Взаємодію взятих для оборотної реакціїреагентів називають прямою реакцією, а
взаємодію утворюваних продуктів реакції —
зворотною реакцією.
На самому початку оборотної реакції, коли
концентрація реагентів висока, швидкість прямої
реакції більша, ніж зворотної
13.
З часом реагенти витрачаються, їхконцентрація зменшується. Натомість збільшується
маса і концентрація продуктів реакції. У певний
момент хімічної взаємодії швидкості прямої й
зворотної реакцій зрівнюються й надалі обидві
реакції відбуваються з однаковою швидкістю.
Такий стан оборотних реакцій називають
станом хімічної рівноваги. У цьому стані реакція
може перебувати тривалий час, якщо не вдаватись
ні до якого впливу на неї.
14.
Стан системи, коли швидкість прямої ізворотної реакцій є однаковими, називають
хімічною рівновагою.
А+В ↔ С+Д
Vпрямої р-ції = Vзворотної р-ції
Зверни увагу!
Стан рівноваги можна змістити, змінюючи
концентрацію реагентів або утворених продуктів, тиск,
температуру. Зміщення рівноваги буде відбуватися у бік
зменшення цього впливу.
15.
Хімічна рівновага — це стан системи, за якогошвидкість прямої реакції (1) дорівнює швидкості
зворотної реакції (2). За хімічної рівноваги концентрації
речовин залишаються незмінними. Хімічна рівновага
має динамічний характер: пряма і зворотна реакції за
умови рівноваги не припиняються.
Динамічний характер
рівноваги
16.
(Стан хімічної рівноваги кількісно характеризуєтьсяконстантою рівноваги, що є відношенням констант
прямої (К1) та зворотної (К2) реакцій.
Для реакції mA + nB pC + dD константа рівноваги
дорівнює:
Константа рівноваги залежить від температури та
природи реагентів. Чим більше значення константи
рівноваги, тим більше рівновага зсунута в бік утворення
продуктів прямої реакції.)
17. Принцип Ле Шательє
Принцип Ле Шательє. Якщо насистему, що перебуває в стані
рівноваги, чиниться зовнішній вплив
(змінюються концентрація,
температура, тиск), то це сприяє
протіканню тієї із двох протилежних
реакцій, що ослабляє цей вплив:
Французький учений
Анрі-Луї Ле Шательє
(08.10.1850-17.09.1936)
у 1884 р. сформулював
загальний
принцип зміщення
хімічної рівноваги:
18.
Вплив зміни тиску на стан хімічної рівноваги1. Тиск. Збільшення тиску (для газів) зміщає рівновагу
в бік реакції, що веде до зменшення об’єму (тобто до
утворення меншого числа молекул газоподібних речовин).
N2(г) + 3H2(г) ↔ 2NH3(г)
4
Р ↑→
2
Р ↓←
Збільшення P приводить до 1 > 2.
19.
2. Температура. Підвищення температури зміщає рівновагу вбік ендотермічної реакції (тобто в бік реакції, що протікає з
поглинанням теплоти).
2NO2 ⇄ N2O4 +58 кДж/моль
Збільшення t° приводить до 2 > 1.
N2 + O2 ⇄ 2NO – Q
Збільшення t° приводить до 1 > 2.
(∆H > 0)
20.
Вплив зміни концентрації речовинна стан хімічної рівноваги
3. Збільшення концентрації вихідних
речовин і вилучення продуктів зі сфери реакції
зміщає рівновагу в бік прямої реакції.
N2 + 3H2 ↔ 2NH3
С(N2) ↑→
С(Н2) ↑→
С (NH3) ↑←
С(N2) ↓←
С(Н2) ↓←
С (NH3) ↓→
21.
Каталізатор4. Каталізатори не впливають на
стан рівноваги, тому що однаково
прискорює і пряму, і зворотну
реакцію. За наявності каталізатора
швидше встановлюється стан хімічної
рівноваги.
22. Підсумки
За напрямом перебігу реакції поділяють на оборотні йнеоборотні.
Необоротні реакції - реакції, що відбуваються в одному
.
напрямку
і закінчуються повним перетворенням реагентів на
продукти реакції.
Оборотні реакції — це реакції, що за одних і тих самих
умов відбуваються одночасно у протилежних напрямках,
тому реагенти однієї реакції є продуктами другої i навпаки.
Стан системи, коли швидкість прямої і зворотної реакцій
є однаковими, називають хімічною рівновагою.
На стан рівноваги впливають: тиск(для газів),
температура, концентрація реагентів та продуктів реакції.
23.
Домашнє завдання1. Перетворіть схеми наведених оборотних реакцій на
хімічні рівняння. Проаналізуйте зміщення хімічної
рівноваги в цих реакціях під упливом різних чинників:
а) СО(г) + Н2О(г) ⇄ СО2(г) + Н2(г), ΔΗ < 0
б) СО(г) + О2(г) ⇄ СО2(г), ΔΗ < 0
в) Ν2Ο4(г) ⇄ ΝΟ2 (г), ΔΗ > 0
г) С(т) + Н2О(г) ⇄ СО(г) + Н2(г), ΔΗ > 0
д) РСl5(г) ⇄ РСl3(г) + Сl2(г); ΔΗ > 0
2. Дізнайтеся, де ще, окрім хімії, працює принцип Ле
Шательє, і підготуйте стисле повідомлення за
результатами дослідження.




















 Химия
Химия








