Похожие презентации:
вода слайды
1.
Рассмотрите слайды,определите тему
урока
2.
3.
4.
5.
6.
7. Самое удивительное вещество на Земле.
8. Вода
Общее содержание воды на Земле составляетпримерно 1500 млн. куб. км. Всё живое и
неживое содержит воду. В организме
человека 65-70% воды от массы тела.
За 60 лет человек перекачивает через себя
более 50 т воды.
9. Нет предела человеческому разуму, нет предела его возможностям; и то, что мы теперь так много знаем о природе и свойствах
поистине самогоудивительного в мире вещества –
о воде, открывает еще большие,
неограниченные возможности.
И.В. Петряков-Соколов
10. Вода в природе
11.
Вода занимает ¾ поверхности ЗемлиГидросфера -71% земной поверхности
Моря и океаны- 1.4 млрд. куб.км
Ледники – 30 млн. куб. км
Реки и озера – 2 млн. куб. км
Атмосфера – 14 т. куб. км
В человеке – 65%
12.
13.
14.
15.
16.
•ГЖТ• Без ВЗЦ
• Молярная масса – 18 г/моль
• Ткип. – 100, Тплав. – 0.
• Плотность – 1г/мл, плотность-0,92г/мл
• Высокая теплоемкость – 4,2 кДЖ
• Универсальный растворитель
17. ПРОВЕРЯЕМ
Н2О, Н-О-НМ(Н2О)=18г/моль
связь ковалентная полярная
молекула воды - диполь
+
-жидкость, газ или твёрдое вещество,
без цвета, вкуса и запаха, хороший
растворитель
Na2O + Н2О→2NaOH
SO2+ Н2О→H2SO3
18. Какие особенности имеет вода?
Лёд плавает на поверхностиводы
Объём замёрзшей воды больше,
чем жидкой
Вода долго нагревается и
медленно остывает
19.
АНОМАЛЬНЫЕ ФИЗИЧЕСКИЕСВОЙСТВА ВОДЫ:
1.Вода- вещество, у которого плотность в
твёрдом состоянии ниже, чем в жидком.
2.Вода- после плавления сначала сжимается в
объёме, а с ростом температуры, начинает
расширяться.
3. Аномально высокой является теплоёмкость
воды.
4. Вода обладает намного более высокими
температурами кипения и плавления, чем
следовало бы ожидать, зная состав молекулы.
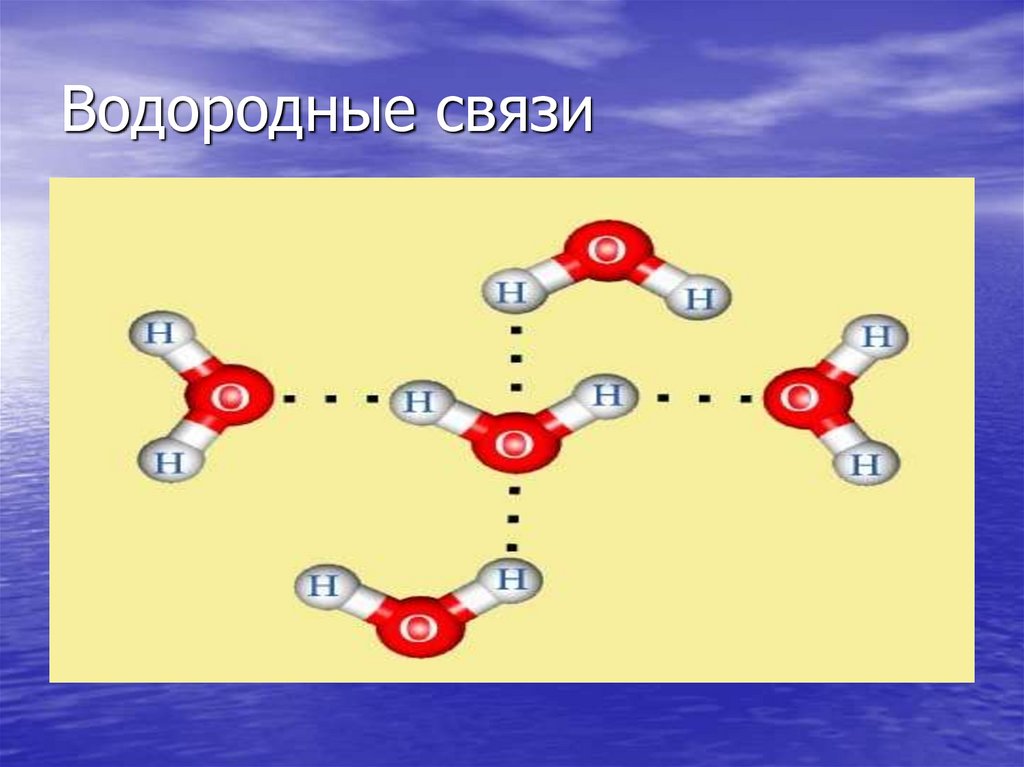
20. Строение молекулы воды
• Связь-ковалентная полярная.• Угловое строение, угол 104,5 градусов.
• Молекула – диполь.
• Ассоциация молекул.
• Водородная связь.
21. Водородные связи
22.
23.
Роль воды:1. Неорганическое вещество клеток
2. Среда обитания живых существ
3. Среда протекания биохимических
реакций
4. Участник фотосинтеза
6СО2+6Н2О→С6Н12О6 +6О2
5. Важнейший преобразователь неживой
природы (камни,скалы →почва)
6. Участник практически всех химических
реакций на Земле
7. Мощный источник энергии (ГЭС)
8. Важнейший регулятор климата Земли
24. Содержание воды в организме человека (%)
• Головной мозг:Серое вещество 83
Белое вещество 70
• Спинной мозг 74
• Почки
82
• Сердце
79
• Легкие
79
• Мышцы
75
Кожа
72
Печень
70
Желудочный сок 99,5
Плазма крови 92
Слюна
99,4
Зубная эмаль 0,2
25. Самое удивительное вещество на Земле.
26.
• Вода! Вода, у тебя нет ни вкуса, ницвета, ни запаха, тебя невозможно
описать, тобой наслаждаются , не
ведая, что ты такое!
• Нельзя сказать, что ты необходима для
жизни: ты - сама жизнь!
Антуан де Сент-Экзюпери
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45. Очистка воды Стадии очистки воды
• Отстаивание• Фильтрование
• Хлорирование
46. Загрязнение воды
47. Химические свойства воды.
Вода - окислитель1)Взаимодействует с активными Ме I и II групп
( кроме Be и Mg) при обычных условиях.
Ме + Н2О→Ме(ОН)n + Н2↑
2) С Ме, стоящими в ряду напряжения от Мg до
водорода при нагревании
Ме + Н2О→МеО + Н2↑
48.
Вода-восстановитель1) Реагирует с сильным окислителем F2
2 F2 +2Н2О→ 4НF +O2↑
2)Электролиз воды:
2Н2О→2 Н2↑+O2↑
49.
Реакции соединения:1)С оксидами активных Ме I и II групп
(кроме Be и Mg):
Li2O + Н2О→2LiOH
2)С кислотными оксидами:
Р2О5 + 3 Н2О→ 2Н3РО4
3)С некоторыми солями образует
кристаллогидраты:
СuSO4 + 5 Н2О→ СuSO4∙5 Н2О
50. Круговорот воды в природе.
• Испарение.• Конденсация.
• Осадки.
51. Тяжелая вода.
• Протий заменен дейтерием.• Ткип. – 101,4; Тзам. – 3,8
• Жизнь невозможна.
• Используют при получении
атомной энергии, замедляет
нейтроны.
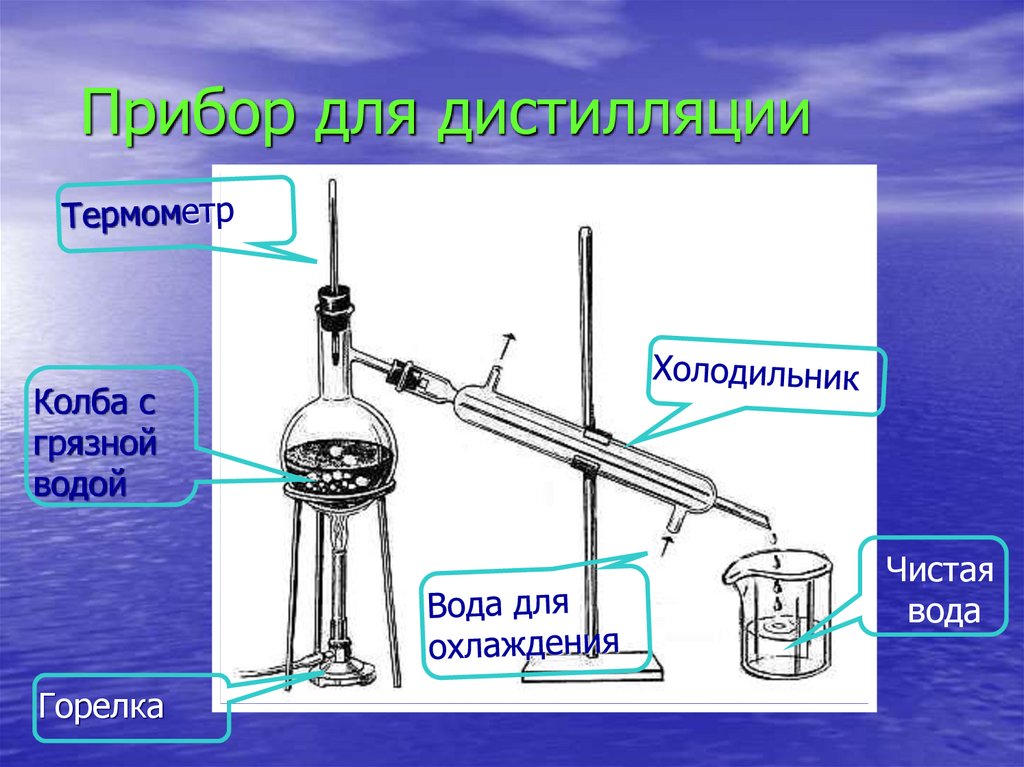
52. Прибор для дистилляции
Колба сгрязной
водой
Чистая
вода
Горелка
53.
Домашнее задание1.Объясните, почему оксиды натрия и
калия не могут существовать в
природе?
2.Закончите уравнения реакций:
1) … + Н2О→ КОН + …
2) ВаО + …→ Ва(ОН)2
3) N2О5 + Н2О→