Похожие презентации:
20. Вода
1.
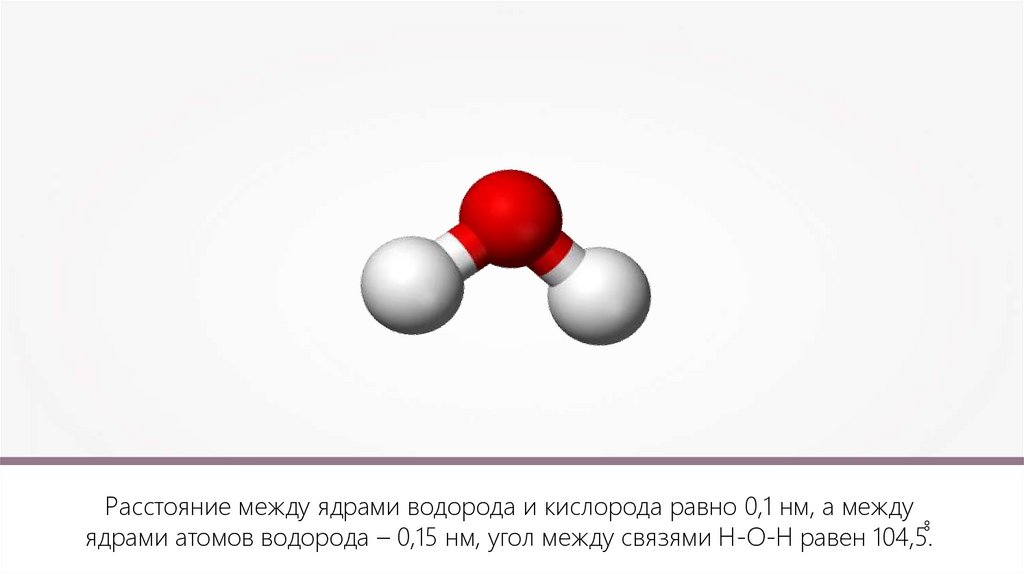
Расстояние между ядрами водорода и кислорода равно 0,1 нм, а междуядрами атомов водорода – 0,15 нм, угол между связями Н-О-Н равен 104,5̊̊.
2.
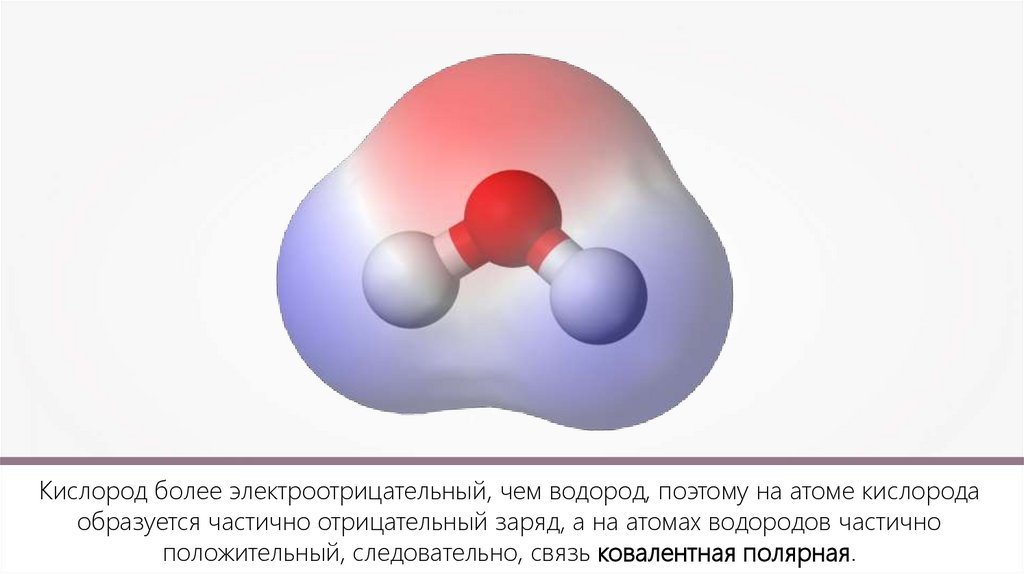
Кислород более электроотрицательный, чем водород, поэтому на атоме кислородаобразуется частично отрицательный заряд, а на атомах водородов частично
положительный, следовательно, связь ковалентная полярная.
3.
Относительная молекулярная масса водыравна 18. При обычных условиях при такой
маленькой относительной молекулярной
массе вода всё равно является жидкостью.
H2 O
4.
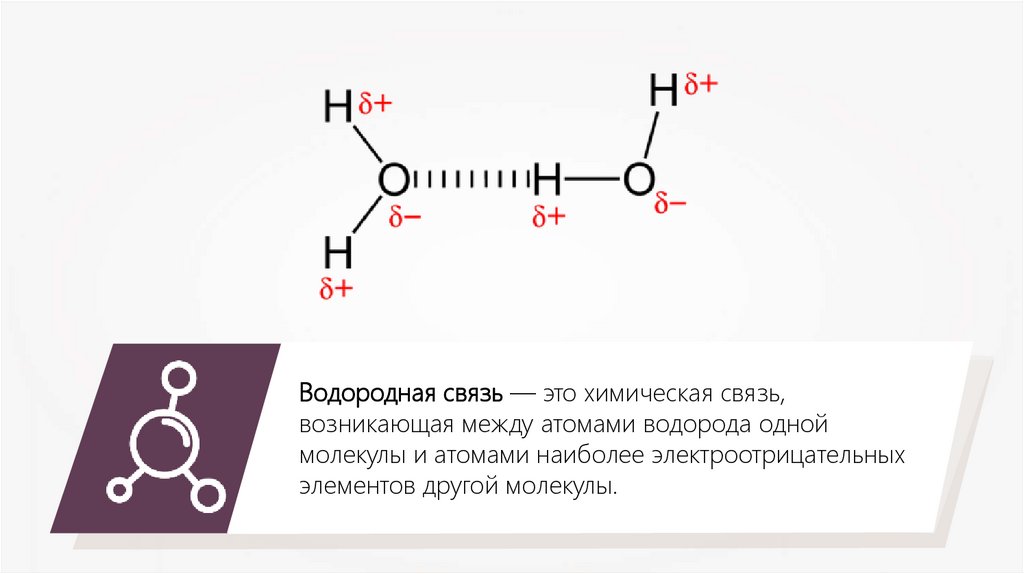
Водородная связь — это химическая связь,возникающая между атомами водорода одной
молекулы и атомами наиболее электроотрицательных
элементов другой молекулы.
5.
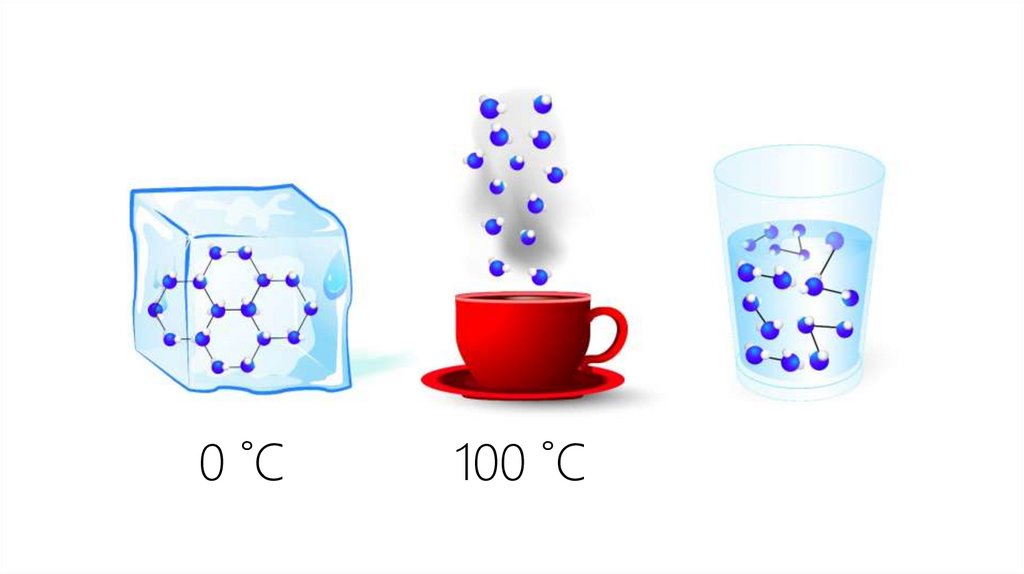
0 ˚С100 ˚С
6.
Значения теплоты плавления и теплоты парообразования воды очень высокие, ониопределяют многие физико-химические и биологические процессы на нашей планете.
7.
8.
9.
Обычно при повышении температуры теплоемкость веществ возрастает, но в случаеводы в пределах от 0 до 37 ˚С теплоёмкость падает, а от 37 до 100 ˚С возрастает.
10.
11.
Вязкость воды с увеличением давления при температурениже 30˚С существенно уменьшается.
12.
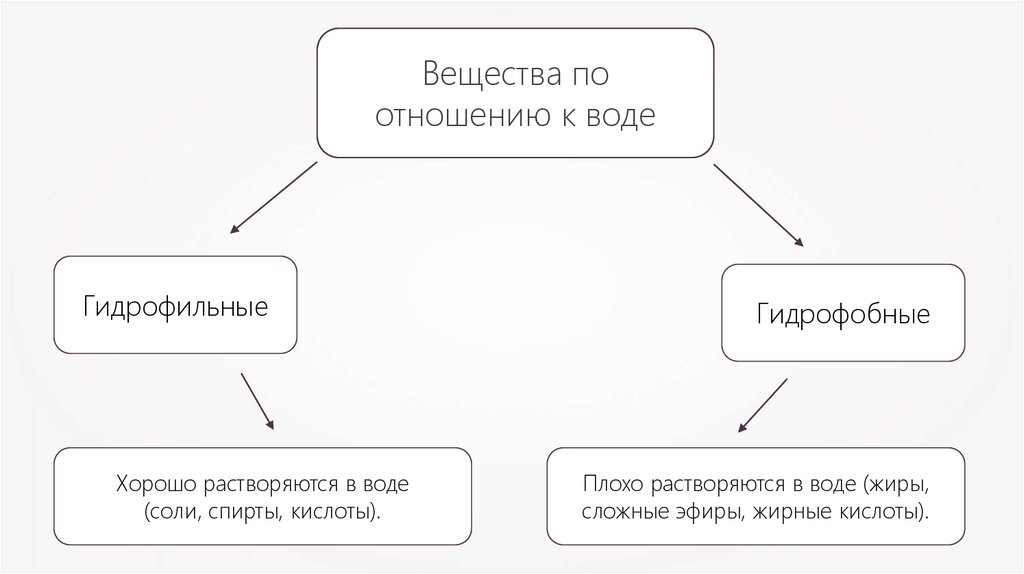
Вещества поотношению к воде
Гидрофильные
Хорошо растворяются в воде
(соли, спирты, кислоты).
Гидрофобные
Плохо растворяются в воде (жиры,
сложные эфиры, жирные кислоты).
13.
14.
Химические свойства воды1. Реагирует со щелочными и щелочноземельными
металлами:
2H2O + 2K = 2KOH + H2↑
2H2O + Mg = Mg(OH)2 + H2↑
2. Взаимодействует с основными и кислотными оксидами:
H2O + CaO = Ca(OH)2
H2O + CO2 = H2CO3
15.
Химические свойства воды3. Под действием света, электрического тока или высокой
температуры вода разлагается:
2H2O = 2H2↑ + O2↑
4. Некоторые неорганические и органические вещества
подвергаются гидролизу:
Na2CO3 + H2O = NaHCO3 + NaOH
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
16.
Химические свойства воды5̊̊. Вода способна образовывать с некоторыми веществами
кристаллогидраты:
CuSO4 · 5̊̊H2O
Na2CO3 · 10H2O
6. Вода взаимодействует с некоторыми неметаллами:
2H2O + 2F2 = 4HF + O2↑
H2O + C = CO↑ + H2↑











 Химия
Химия








