Похожие презентации:
свойства водорода
1.
Водород, егосвойства и
получение
2.
Открытие водородаВодород открыт в 1766 г. английским физикохимиком Г. Кавендишем. При взаимодействии
цинка с кислотами он наблюдал выделение
газа, сгорающего на воздухе с образованием
воды.
Генри Кавендиш
1731–1810 гг.
Кавендиш первым изучил свойства водорода.
Он обнаружил, что это необычайно легкий газ –
он в 14 раз легче воздуха. Это свойство
водорода позже использовали для наполнения
воздушных шаров и дирижаблей.
3.
Водород в природеВодород – самый распространенный элемент в космосе, в состав
космической материи входит 63 % H, 36 % He и 1 % всех остальных
элементов.
4.
Водород в природеНа Земле водород – третий по
химической распространенности
элемент (после O и Si), основа
гидросферы.
Встречается
в
химически связанном виде (вода,
живые
организмы,
нефть,
природный
газ,
минералы),
содержится в верхних слоях
атмосферы.
В атмосфере водорода мало –
около 1∙10–5 %, зато в воде –
более 10 %.
5.
Изотопы водородаВ природном водороде присутствуют три изотопа: протий (99,984 %),
дейтерий (0,016 %) и тритий, в незначительном количестве образующийся в
верхних слоях атмосферы (на Земле всего 2 кг трития).
6.
Физические свойства– бесцветный газ,
-без запаха и вкуса,
- не растворяется в воде,
- в 14,5 раз легче воздуха,
- имеет низкие температуры плавления и кипения:
259,2 °С и 253°С, соответственно,
- Обладает хорошей теплопроводностью (в 7 раз
больше, чем воздух)
7.
Получение водорода в лаборатории2HCl + Zn = ZnCl2 + H2↑
Для получения используют аппарат
Киппа
2Na + 2H2O = 2NaOH + H2↑,
CaH2 + 2H2O = Ca(OH)2↓ + 2H2↑
8.
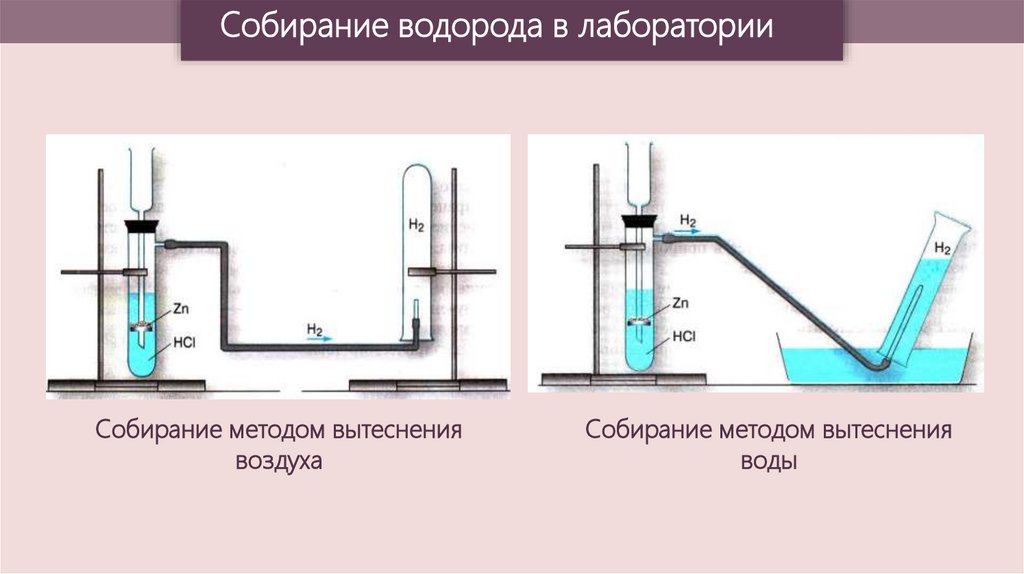
Собирание водорода в лабораторииСобирание методом вытеснения
воздуха
Собирание методом вытеснения
воды
9.
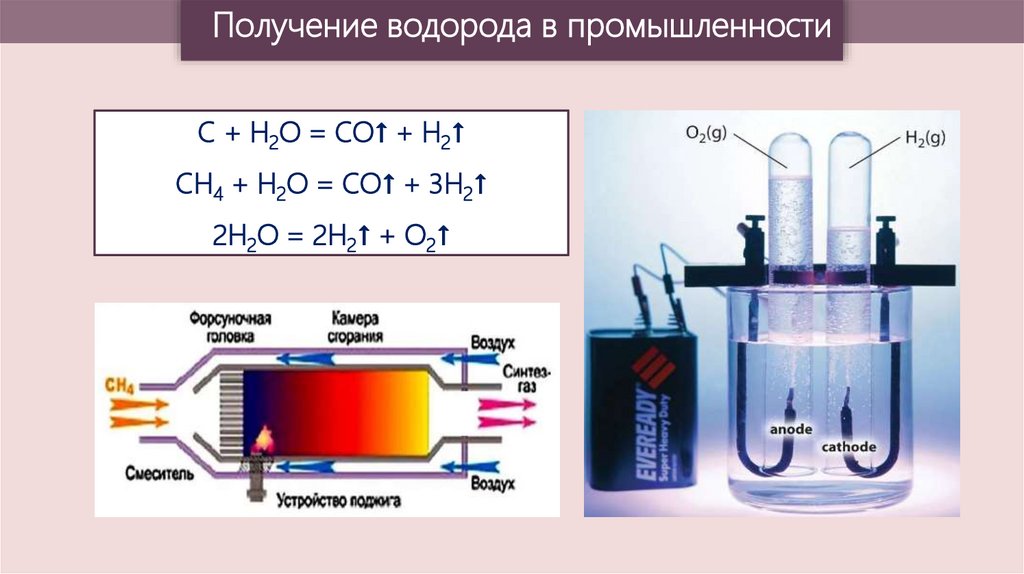
Получение водорода в промышленностиC + H2O = CO↑ + H2↑
CH4 + H2O = CO↑ + 3H2↑
2H2O = 2H2↑ + O2↑
10.
Химические свойстваПри обычных условиях водород малоактивен, но при нагревании
вступает в реакции со многими веществами:
1. С активными металлами, образуя белые кристаллические
вещества - гидриды:
Н2 + 2Li = 2LiH
Они легко разлагаются водой с образованием основания и
водорода:
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
11.
Химические свойства2. С кислородом:
2Н2 + О2 = 2Н2О + Q
(смесь 2 объемов Н2 и 1 объема
О2 называется гремучим газом).
3. С галогенами:
Н2 + Cl2 = 2НСl
(с фтором взрывается даже в темноте и при - 252°С), с
хлором и бромом реагирует лишь при освещении или
нагревании, а с йодом только при нагревании.
12.
Химические свойства4. С азотом:
ЗН2 + N2 = 2NН3
лишь на катализаторе и при повышенных
температуpax и давлениях.
5. С серой:
Н2 + S = H2S,
6. С углеродом без катализатора только
при высоких температуpax:
2Н2 + С = СН4
13.
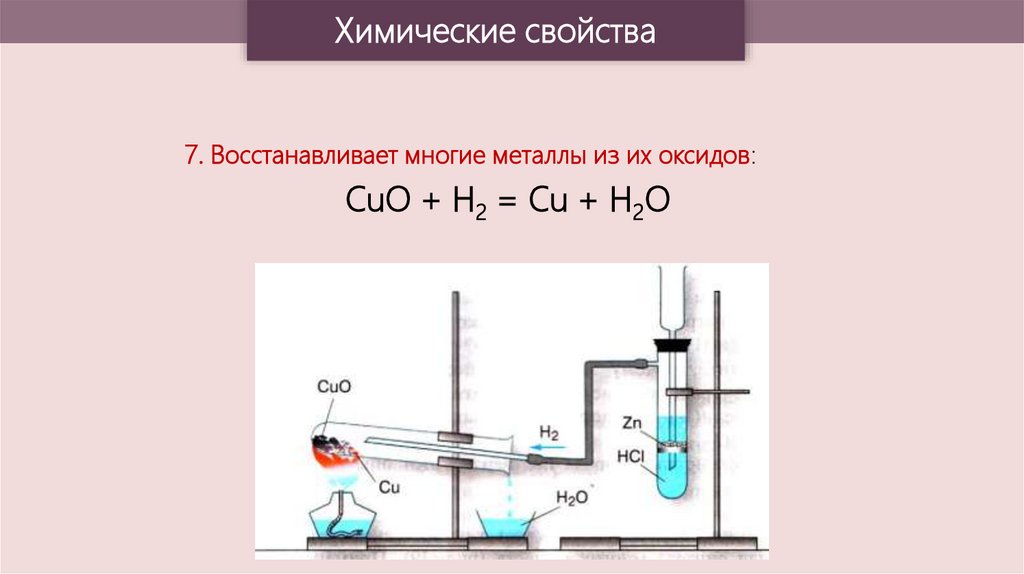
Химические свойства7. Восстанавливает многие металлы из их оксидов:
CuO + H2 = Cu + H2O
14.
Применение водорода– резка и сварка металлов;
– в качестве ракетного топлива;
– производство минеральных удобрений;
– получение соляной кислоты;
– получение тугоплавких металлов;
– получении твёрдых жиров (маргарина);
– синтез метилового спирта и других
органических продуктов.











 Химия
Химия








