Похожие презентации:
Оксиды_углерода,_их_физические_и_химически
1. Оксиды углерода, их физические и химические свойства. Экологические проблемы, связанные с оксидом углерода (IV).
9 класс.2.
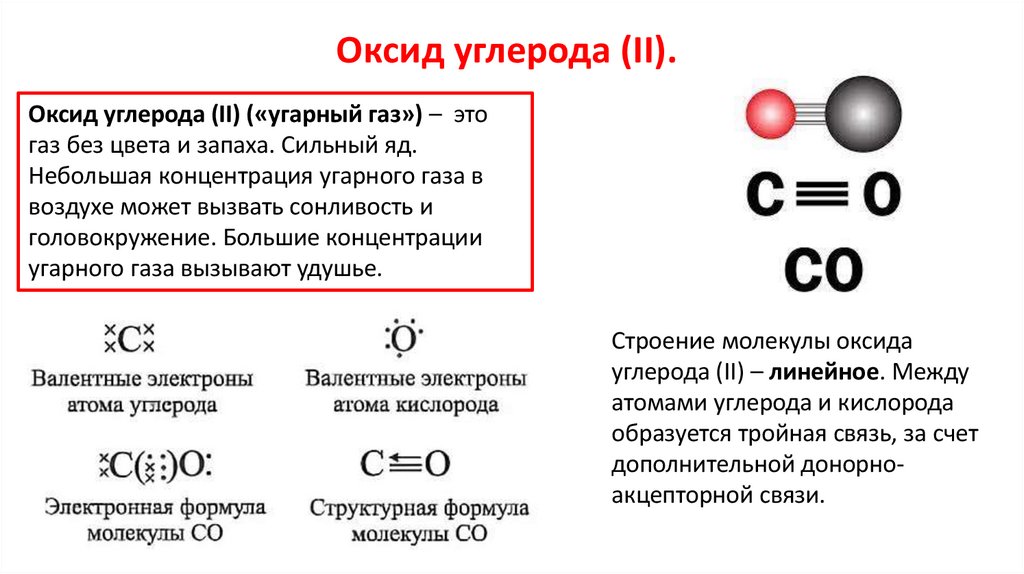
Оксид углерода (II).Оксид углерода (II) («угарный газ») – это
газ без цвета и запаха. Сильный яд.
Небольшая концентрация угарного газа в
воздухе может вызвать сонливость и
головокружение. Большие концентрации
угарного газа вызывают удушье.
Строение молекулы оксида
углерода (II) – линейное. Между
атомами углерода и кислорода
образуется тройная связь, за счет
дополнительной донорноакцепторной связи.
3.
Способы получения.В промышленности угарный газ получают в газогенераторах при пропускании воздуха
через раскаленный уголь.
C + O2 → CO2
CO2 + C → 2CO
Химические свойства.
Оксид углерода (II) – несолеобразующий оксид.
1. Угарный газ горит в атмосфере кислорода.
2СO + O2 → 2CO2
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием
света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl2 → COCl2
3. Оксид углерода (II) восстанавливает металлы из оксидов.
3CO + Fe2O3 → 2Fe + 3CO2
4.
Оксид углерода(II) СО называют также угарным газом. Откуда такое название? Ядовитый воздух, содержащий оксид углерода(II), на Руси называлиугаром, отсюда и глагол «угореть». Угарный газ чрезвычайно токсичен. Его молекулы,
подобно молекулам кислорода, способны соединяться с гемоглобином крови, причём
образующееся соединение (карбоксигемоглобин) прочнее, чем комплекс кислорода с
гемоглобином (оксигемоглобин). Карбоксигемоглобин препятствует нормальному
насыщению крови кислородом, возникает кислородное голодание организма, что
приводит к смерти.
5.
Угарный газ содержится в выхлопных газахавтомобилей. По техническим
нормам его объёмная доля в продуктах
сгорания топлива не должна превышать
0,5 %. Но даже правильно
отрегулированный двигатель, работающий в
закрытом помещении (например, гараже),
представляет собой источник смертельной
опасности. Угарный газ очень коварен.
Первое время человек не ощущает никаких
признаков отравления, затем внезапно
слабеет, теряет сознание. Если при этом
отравление продолжается, то оно приводит
к летальному исходу.
6.
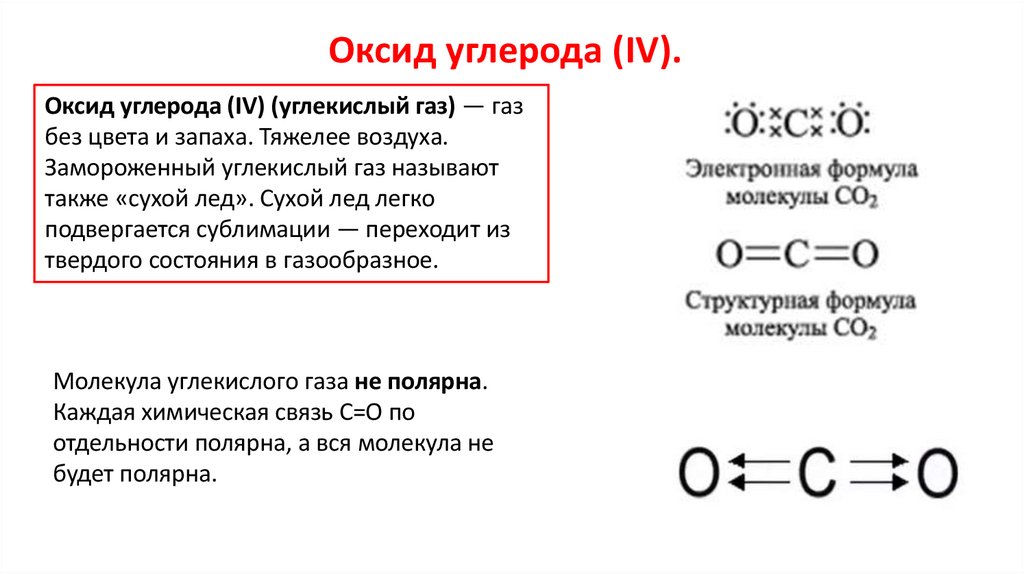
Оксид углерода (IV).Оксид углерода (IV) (углекислый газ) — газ
без цвета и запаха. Тяжелее воздуха.
Замороженный углекислый газ называют
также «сухой лед». Сухой лед легко
подвергается сублимации — переходит из
твердого состояния в газообразное.
Молекула углекислого газа не полярна.
Каждая химическая связь С=О по
отдельности полярна, а вся молекула не
будет полярна.
7.
Способы получения.Углекислый газ образуется при действии сильных кислот на карбонаты и гидрокарбонаты
металлов
CaCO3 + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HBr → NaBr +H2O +CO2
Углекислый газ также образуется при термическом разложении нерастворимых
карбонатов и при разложении растворимых гидрокарбонатов.
CaCO3 → CaO + CO2
Углекислый газ — типичный кислотный оксид.
8.
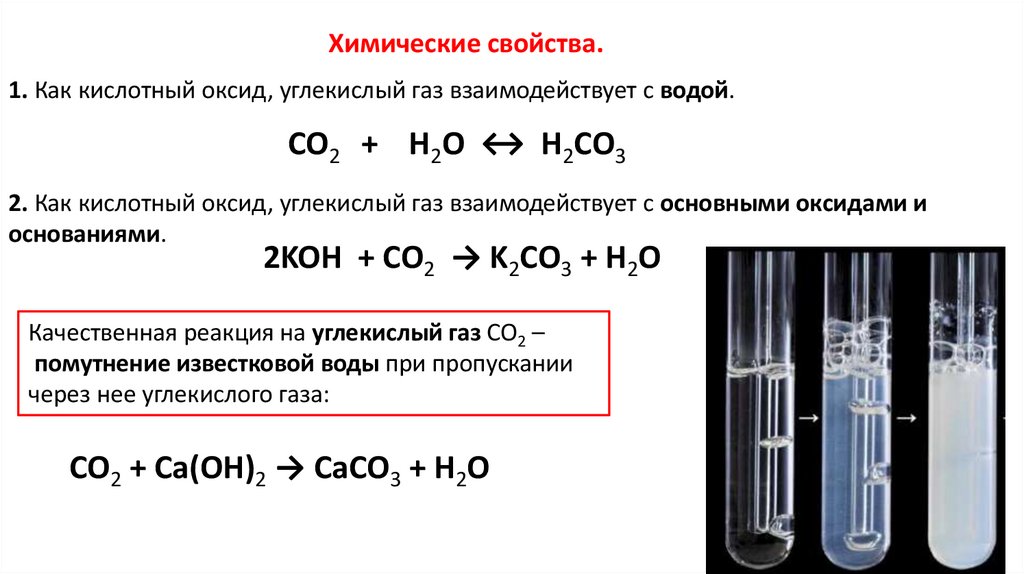
Химические свойства.1. Как кислотный оксид, углекислый газ взаимодействует с водой.
CO2 + H2O ↔ H2CO3
2. Как кислотный оксид, углекислый газ взаимодействует с основными оксидами и
основаниями.
2KOH + CO2 → K2CO3 + H2O
Качественная реакция на углекислый газ CO2 –
помутнение известковой воды при пропускании
через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3 + H2O
9.
Экологические проблемы, связанные с оксидом углерода (IV).Основные экологические проблемы, связанные с оксидом углерода (IV) включают
усиление парникового эффекта, что приводит к глобальному потеплению, изменению
климата и таянию ледников.
Усиление парникового эффекта:
CO2 является основным парниковым газом, который удерживает тепло в атмосфере.
Увеличение его концентрации усиливает этот эффект, приводя к глобальному потеплению.
Изменение климата: Повышение средней температуры на планете вызывает целый ряд
климатических изменений, включая изменение режима осадков.
Таяние ледников и повышение уровня моря: Рост температуры приводит к таянию
ледниковых шапок, что способствует повышению уровня мирового океана.





 Химия
Химия








