Похожие презентации:
Лекция 2
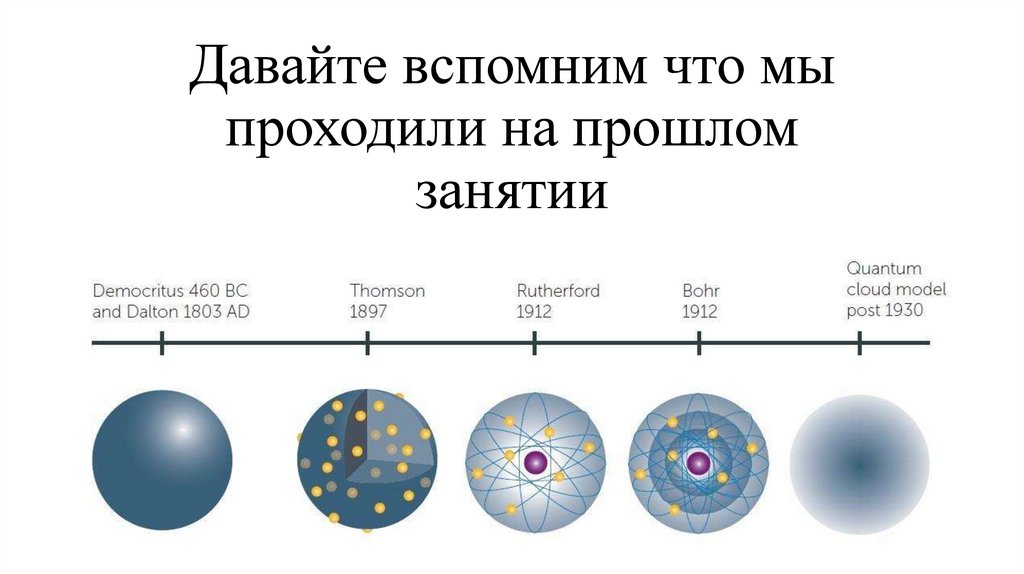
1. Давайте вспомним что мы проходили на прошлом занятии
2. Домашнее задание
Подготовка мини-проекта в формате презентации, и защита наследующей паре. Регламент 5-7 минут.
Защита мини проектов
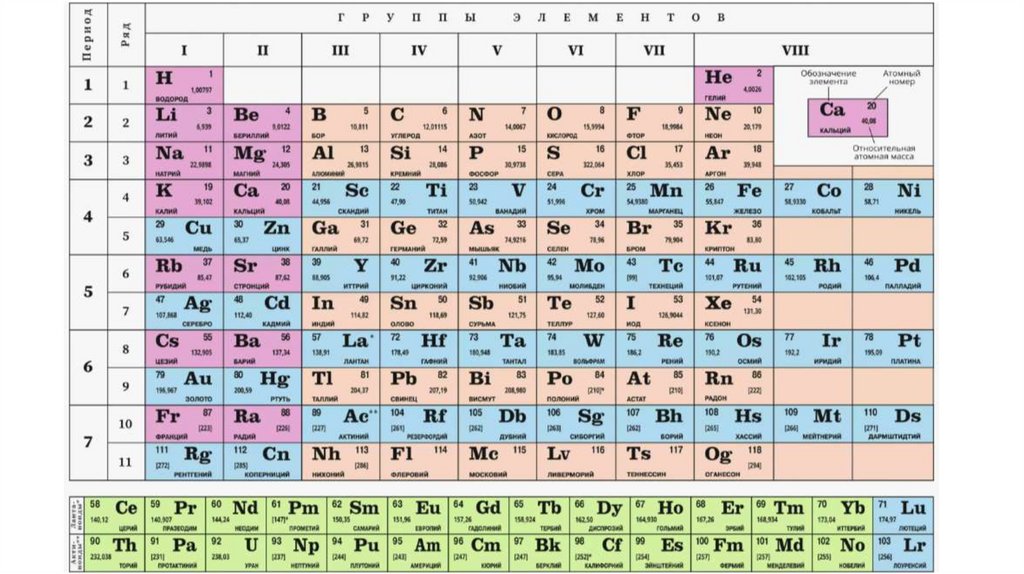
3. Периодическая система химических элементов Д.И. Менделеева. Физический смысл Периодического закона Д.И. Менделеева.
Закономерности изменения свойств химическихэлементов. Мировоззренческое и научное значение
Периодического закона Д.И. Менделеева. Прогнозы Д.И.
Менделеева. Открытие новых химических элементов.
4.
Периодическийзакон
Д. И. Менделеева
— один из фундаментальных законов природы, который
устанавливает
периодическую
зависимость
свойств
химических элементов и образованных ими веществ от
заряда атомного ядра.
Периодическая система химических элементов
(таблица Менделеева) — графическое выражение этого
закона.
5.
6. Физический смысл периодического закона
Физический смысл закона заключается в периодическом повторении строениявалентных электронных оболочек атомов при увеличении значения главного
квантового
числа
(номера
периода).
Это
повторение
приводит
к
периодическому изменению химических свойств элементов.
После открытия строения атома стало ясно, что главной характеристикой
атома является положительный заряд ядра, который численно равен атомному
номеру элемента. Заряд ядра определяет число электронов в атоме, его
электронное строение и, следовательно, свойства.
7.
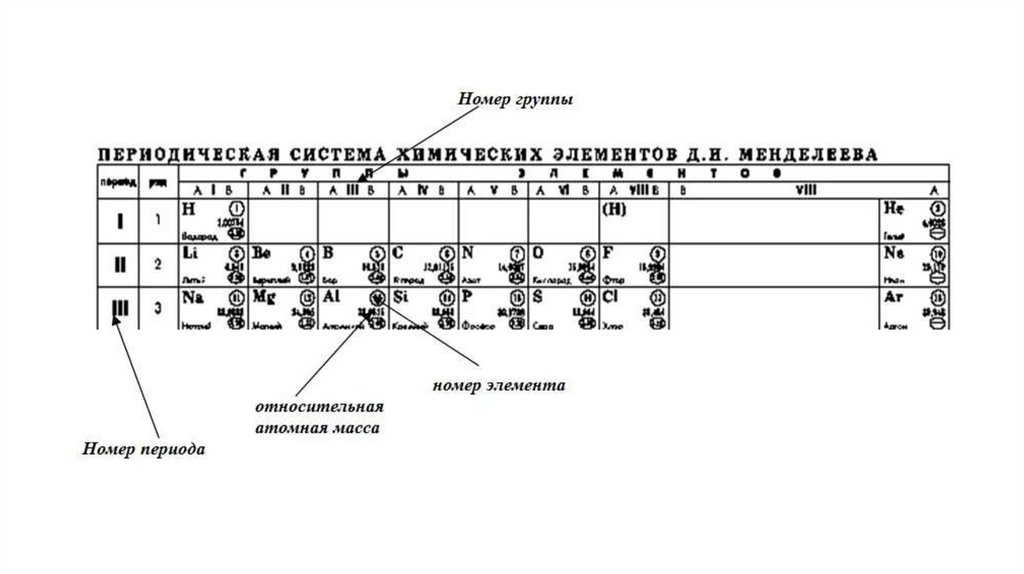
Номер периода в Периодической системе соответствует числуэнергетических уровней в атоме. В периоде слева направо увеличивается
заряд ядра, число электронов на внешнем уровне, а радиус атома
уменьшается из-за более сильного притяжения электронов к ядру.
Номер группы (для главных подгрупп) равен числу валентных
электронов на внешнем энергетическом уровне. Элементы одной группы
имеют
сходное
строение
внешней
электронной
обуславливает подобие их химических свойств.
оболочки,
что
8.
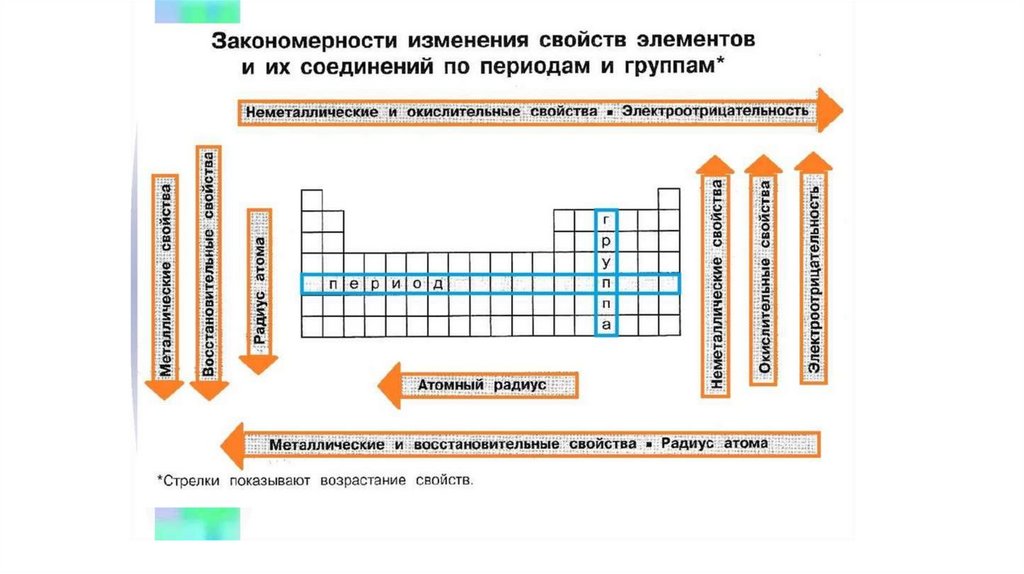
9. Закономерности изменения свойств элементов и их соединений
В периодах (слева направо):• увеличиваются
электроотрицательность,
окислительные
свойства,
энергия
неметаллические
ионизации,
и
способность
образовывать кислотные соединения;
• уменьшаются металлические и восстановительные свойства, радиус
атома;
• степень окисления элементов в высших оксидах возрастает, а в летучих
водородных соединениях — уменьшается.
10. В главных подгруппах (сверху вниз):
•увеличиваются радиус атома, металлические и восстановительныесвойства, основность оксидов и гидроксидов;
•уменьшаются
неметаллические
и
окислительные
свойства,
электроотрицательность, энергия ионизации;
•для элементов VI–VII групп возрастает сила бескислородных
кислот.
11. Примеры других закономерностей:
В периодах слева направо усиливается кислотность высшихоксидов и гидроксидов, а в группах сверху вниз — основность.
В периодах слева направо уменьшается способность элементов
образовывать основные соединения, а в группах сверху вниз —
усиливается.
12.
13. Мировоззренческое и научное значение Периодического закона
Обоснование единства природы. Закон показал, что свойстваэлементов не случайны, а подчинены строгой закономерности, что
отражает упорядоченность мироустройства.
Развитие науки. Закон стал основой для развития теории строения
атома и химической связи. Он позволил уточнить атомные массы и
другие
характеристики
элементов,
а
также
существование новых элементов и их свойства.
предсказывать
14.
Систематизация знаний. Периодическая система объединиларазрозненные факты о химических элементах в единую стройную
систему, что облегчило изучение и прогнозирование химических
реакций.
Переход химии от описательной науки к объясняющей. Закон
позволил не только систематизировать известные элементы, но и
предсказывать новые, что изменило подход к химическим
исследованиям.
15. Прогнозы Д. И. Менделеева
Прогнозы Д. И. МенделееваМенделеев оставил в своей таблице пустые клетки для ещё не
открытых
элементов
закономерности
и
предсказал
Периодического
их
свойства,
закона.
Для
используя
обозначения
гипотетических элементов он использовал приставки «эка» (один),
«дви» (два), «три» (три) от санскритских числительных, добавляя
их к названию ближайшего известного элемента.
16. Примеры успешных прогнозов:
Экаалюминий (галлий). Открыт в 1875 году ПолемЛекоком де Буабодраном. Свойства галия совпали с
предсказаниями Менделеева.
Экабор
(скандий).
Открыт
в
1879
году
Ларсом
Фредериком Нильсоном.
Экасилиций (германий). Открыт в 1886 году Клеменсом
Александром Винклером. Это открытие стало особенно
значимым, так как германий по свойствам значительно
отличался от соседних элементов.
17. Другие предсказанные элементы:
• двителлур (полоний, открыт в 1898 году);• экацезий (франций, открыт в 1939 году);
• экаиод (астат, открыт в 1942–1943 годах);
• экамарганец (технеций, открыт в 1937 году).
18.
Некоторые прогнозы Менделеева не подтвердились, что связано снедостатками знаний о строении атома в его время, в частности, с
непониманием роли лантаноидов. Однако в целом предсказания сыграли
ключевую роль в признании Периодического закона и развитии химии.
Менделеев рассматривал Периодический закон как всеобщий закон
природы, который будет развиваться и дополняться. Его пророческие
слова о том, что закону «будущее не грозит разрушением, а только
надстройки и развитие обещает», полностью оправдались.
19. Мини - проект
Влияние на смежные науки. Периодический закон нашёлприменение
в
геохимии,
космохимии,
физической
химии,
биохимии и других областях.
1. Поделится на мини-группы
2. Разработать
проект
на
тему
профессиональной деятельности.
3. Выполнить презентацию и доклад.
4. Защитить проект.
роль
химии
в
моей















 Химия
Химия








