Похожие презентации:
c1439bf2ea444407c63ea823bdbaafbb (1)
1.
Альдегиды и кетоны(КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ)
2.
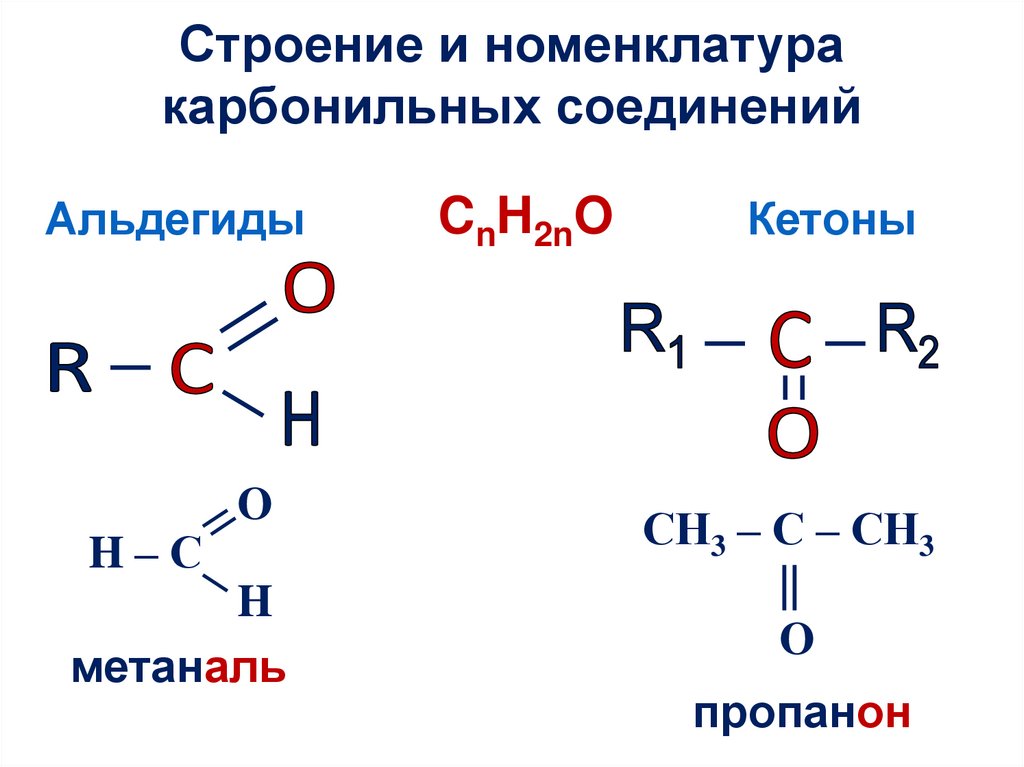
Строение и номенклатуракарбонильных соединений
Альдегиды
H–С
O
H
метаналь
CnH2nO
Кетоны
СН3 – С – СН3
||
O
пропанон
3.
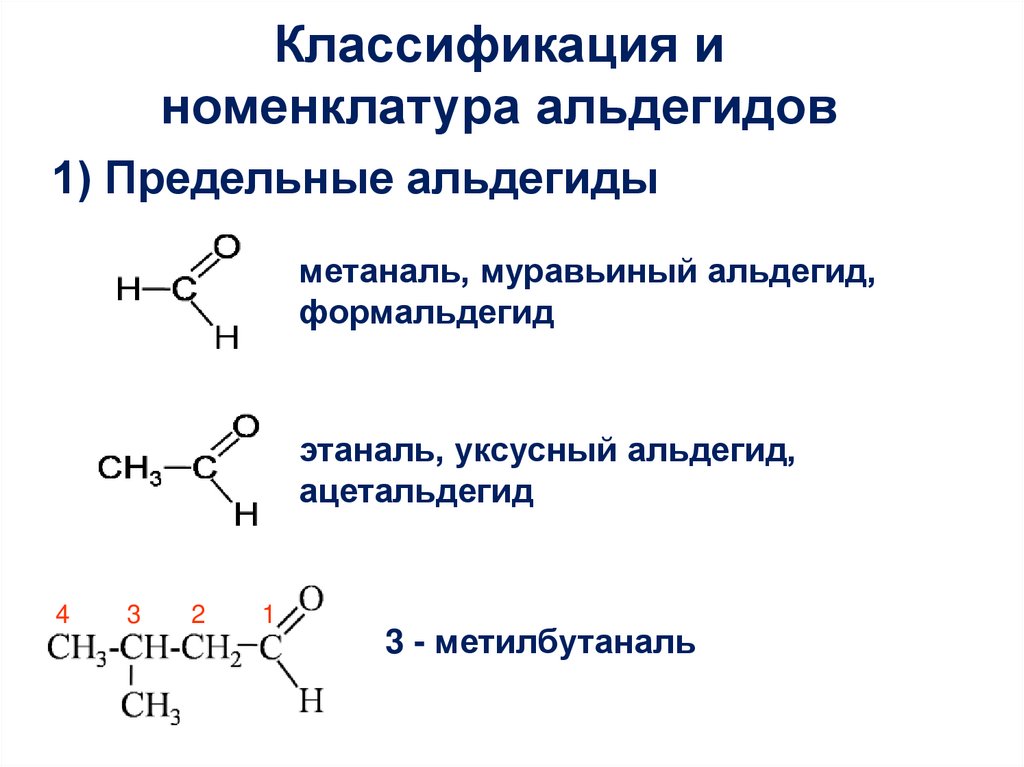
Классификация иноменклатура альдегидов
1) Предельные альдегиды
метаналь, муравьиный альдегид,
формальдегид
этаналь, уксусный альдегид,
ацетальдегид
4
3
2
1
3 - метилбутаналь
4.
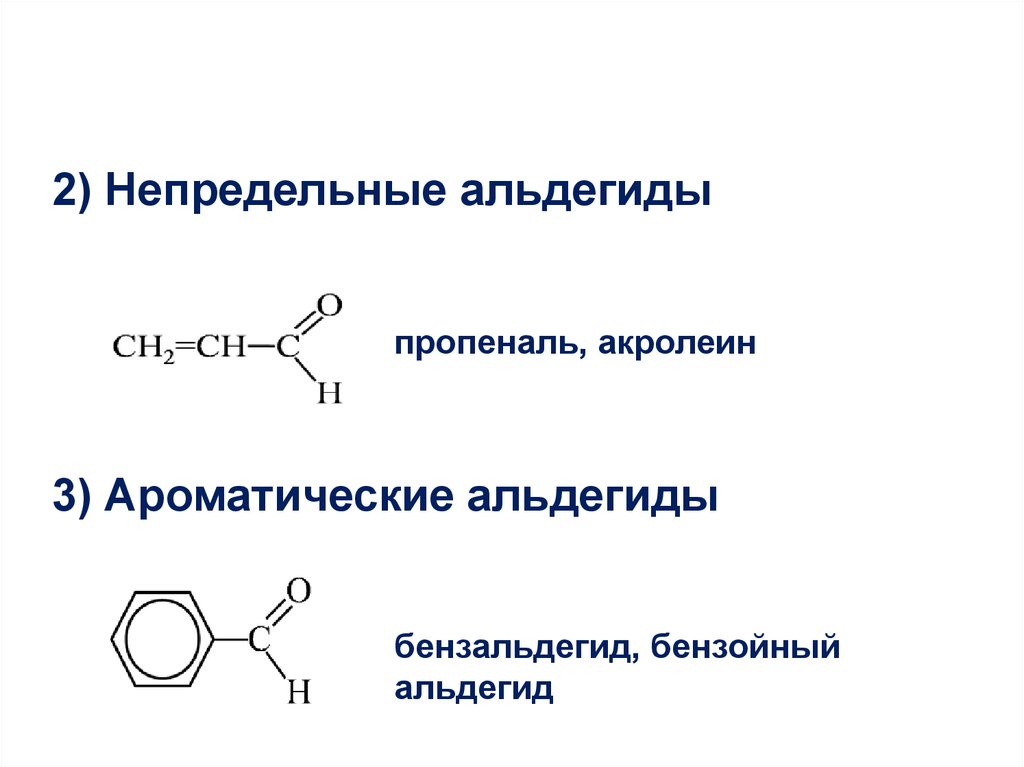
2) Непредельные альдегидыпропеналь, акролеин
3) Ароматические альдегиды
бензальдегид, бензойный
альдегид
5.
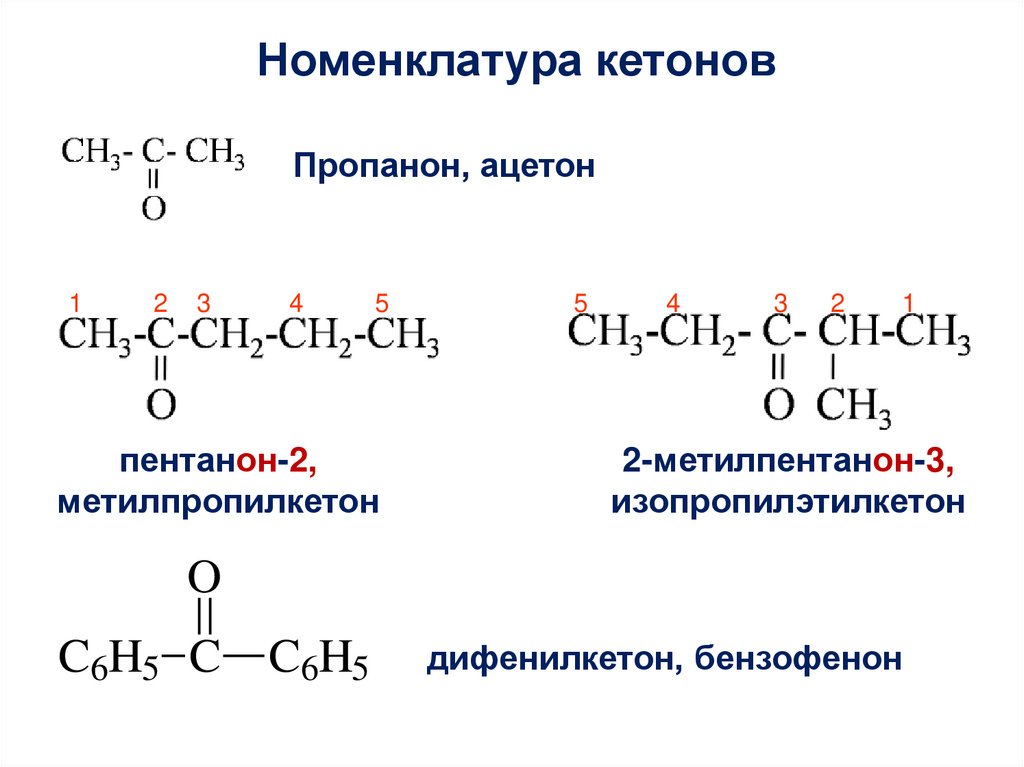
Номенклатура кетоновПропанон, ацетон
1
2
3
4
5
пентанон-2,
метилпропилкетон
5
4
3
2
1
2-метилпентанон-3,
изопропилэтилкетон
O
C6H5 C C6H5
дифенилкетон, бензофенон
6.
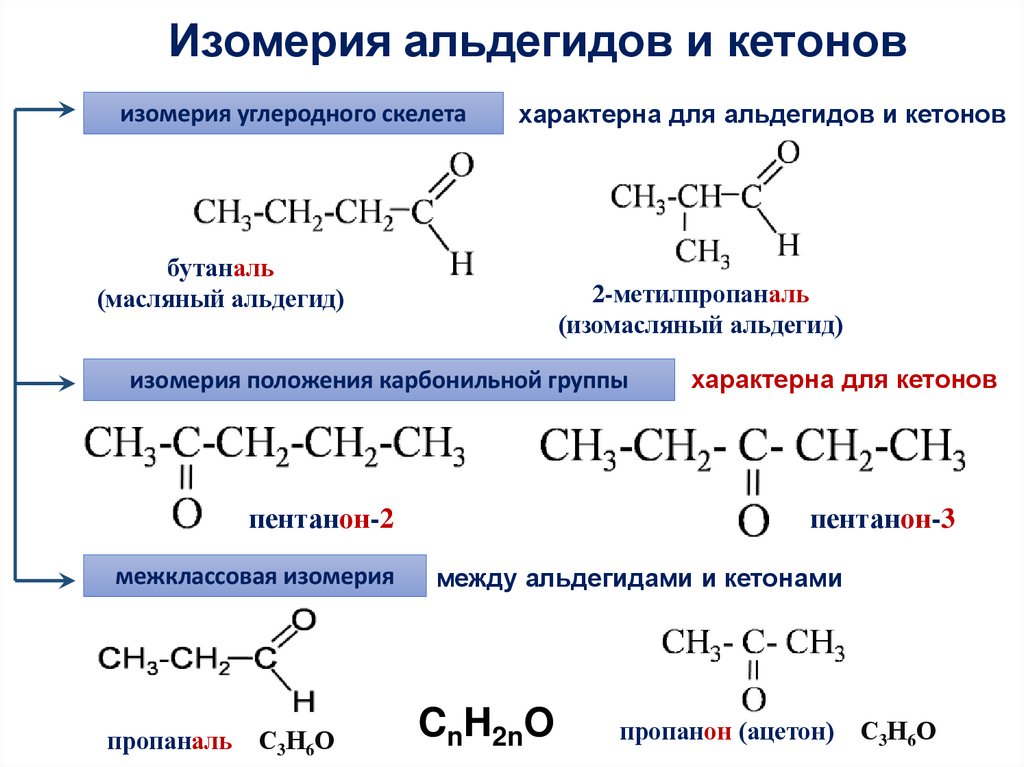
Изомерия альдегидов и кетоновизомерия углеродного скелета
характерна для альдегидов и кетонов
бутаналь
(масляный альдегид)
2-метилпропаналь
(изомасляный альдегид)
изомерия положения карбонильной группы
пентанон-2
характерна для кетонов
пентанон-3
межклассовая изомерия
между альдегидами и кетонами
пропаналь
CnH2nO
С3Н6О
пропанон (ацетон)
С3Н6О
7.
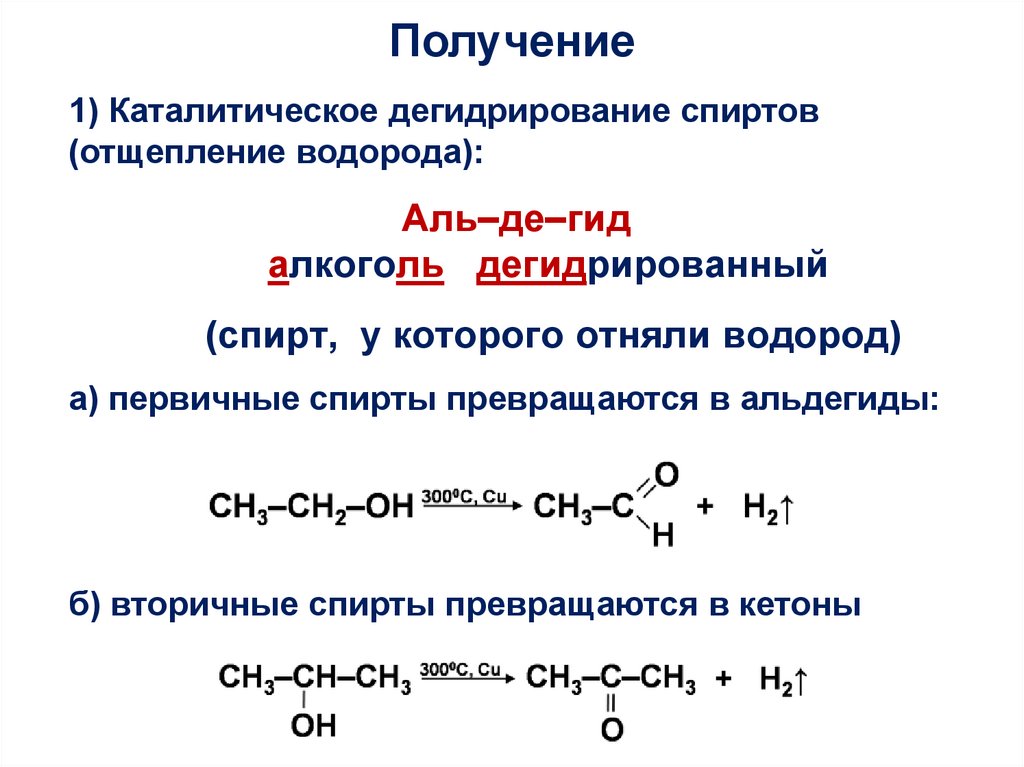
Получение1) Каталитическое дегидрирование спиртов
(отщепление водорода):
Аль–де–гид
алкоголь дегидрированный
(спирт, у которого отняли водород)
а) первичные спирты превращаются в альдегиды:
б) вторичные спирты превращаются в кетоны
8.
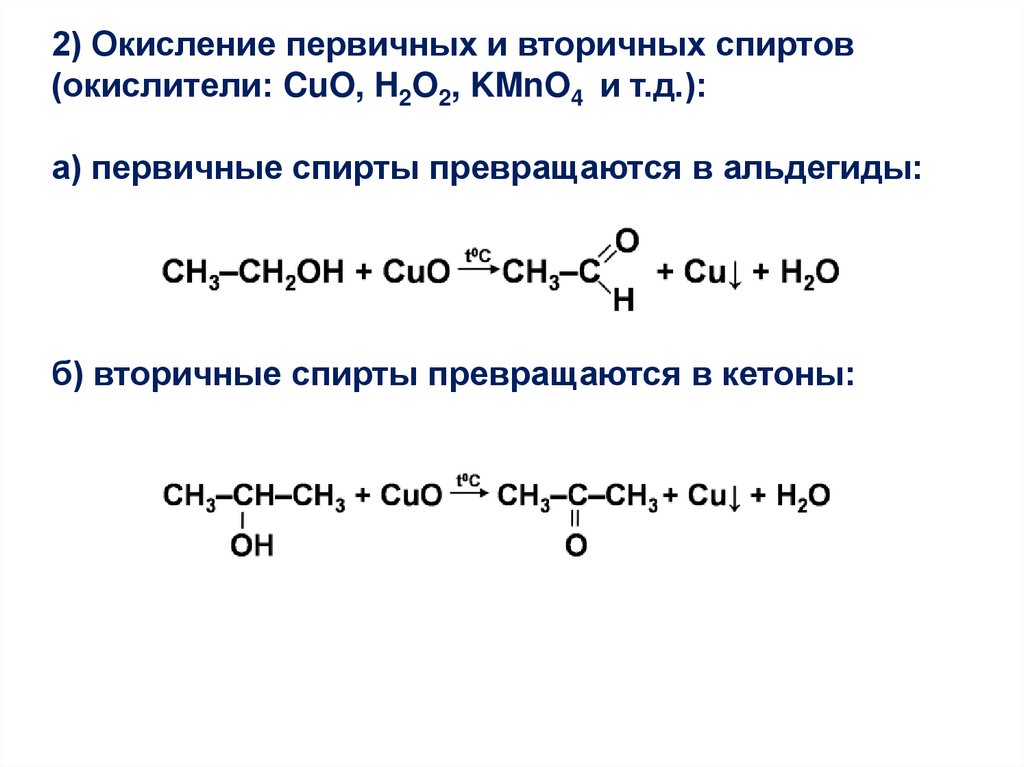
2) Окисление первичных и вторичных спиртов(окислители: CuO, H2O2, KMnO4 и т.д.):
а) первичные спирты превращаются в альдегиды:
б) вторичные спирты превращаются в кетоны:
9.
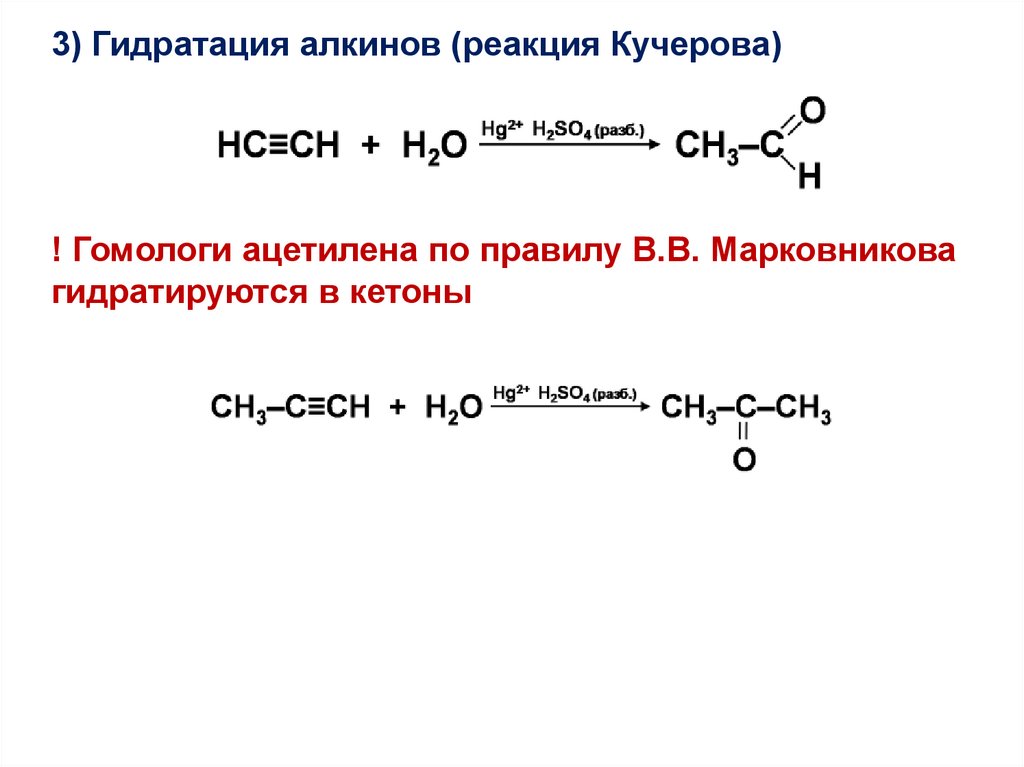
3) Гидратация алкинов (реакция Кучерова)! Гомологи ацетилена по правилу В.В. Марковникова
гидратируются в кетоны
10.
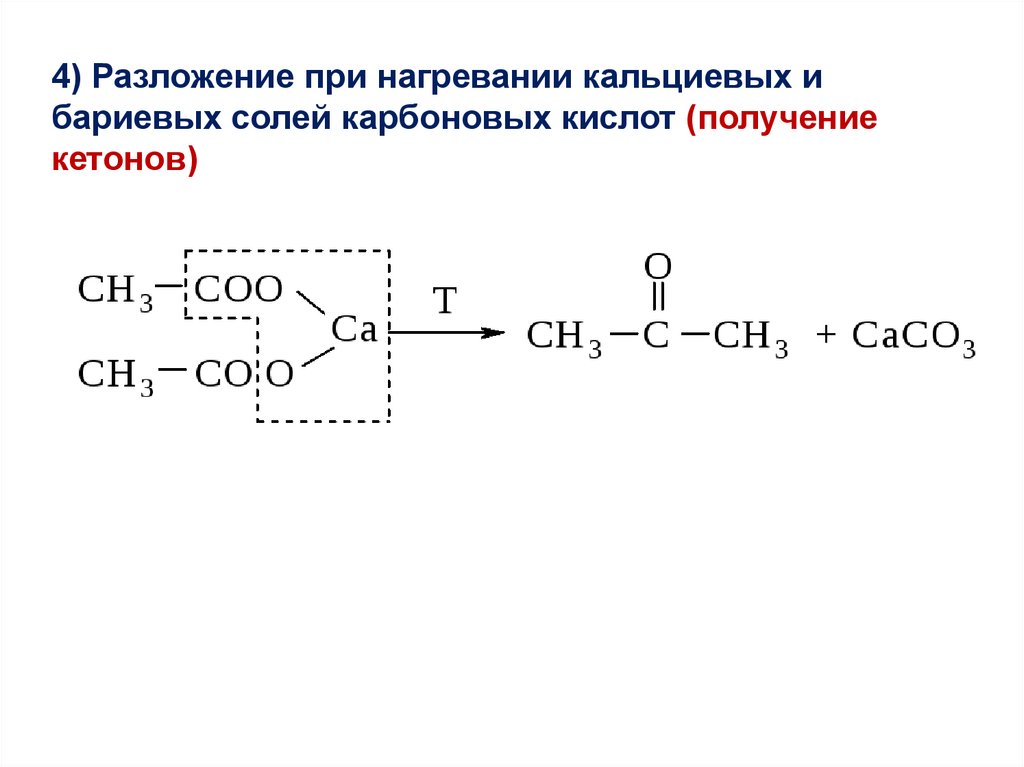
4) Разложение при нагревании кальциевых ибариевых солей карбоновых кислот (получение
кетонов)
11.
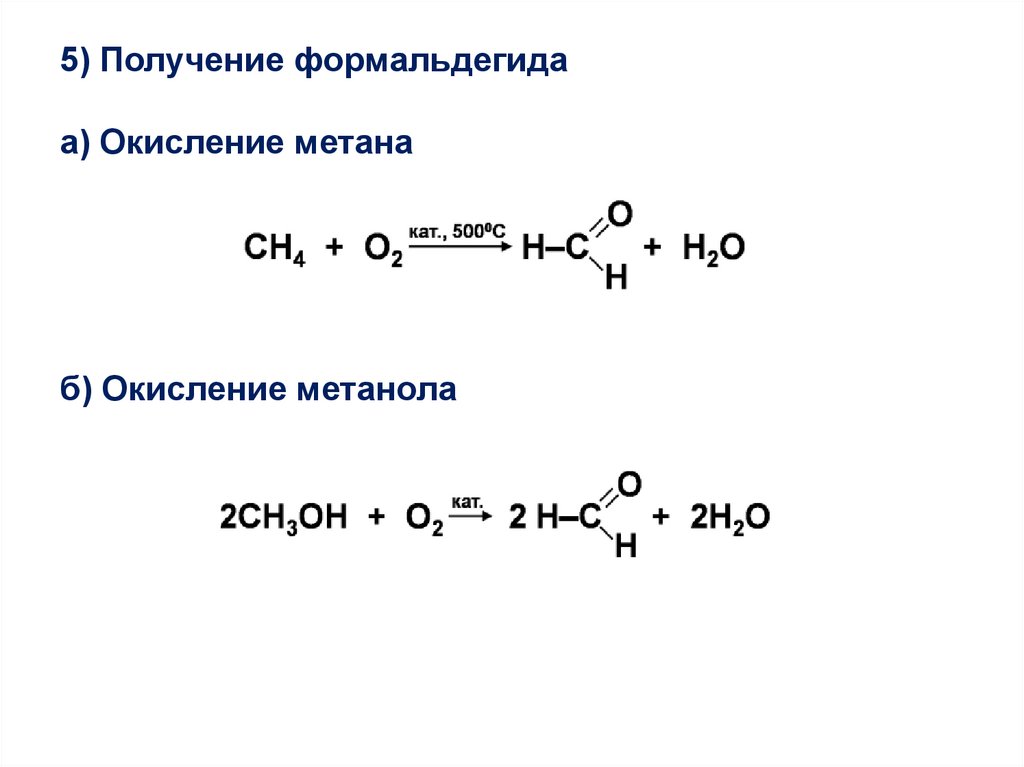
5) Получение формальдегидаа) Окисление метана
б) Окисление метанола
12.
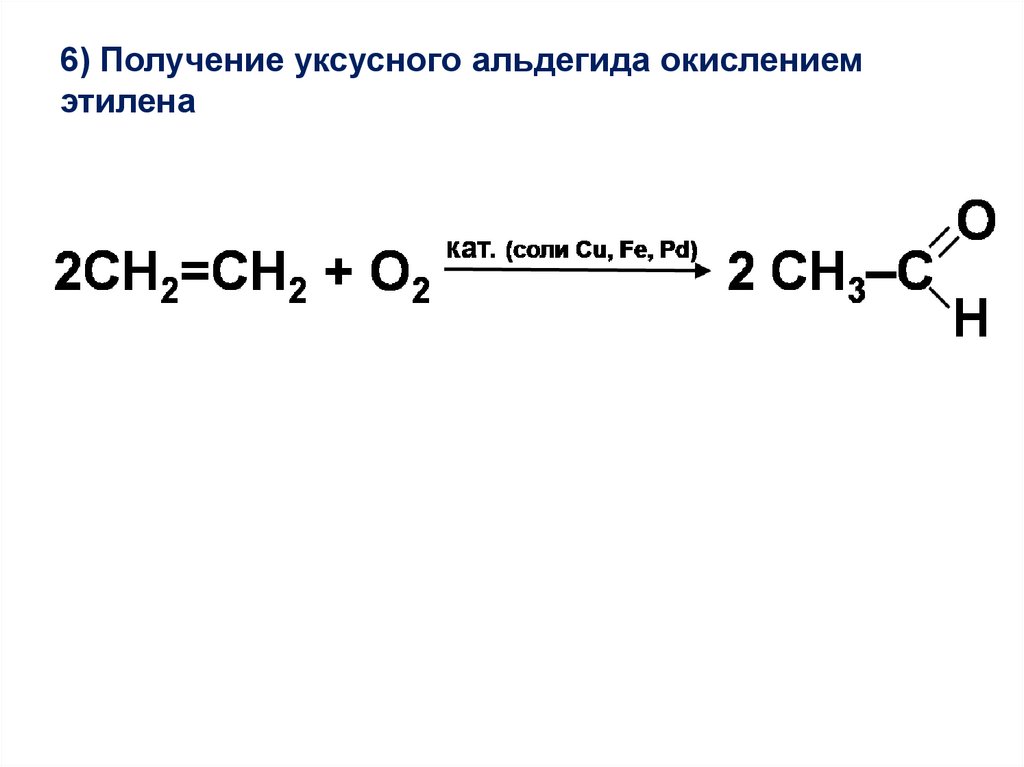
6) Получение уксусного альдегида окислениемэтилена
13.
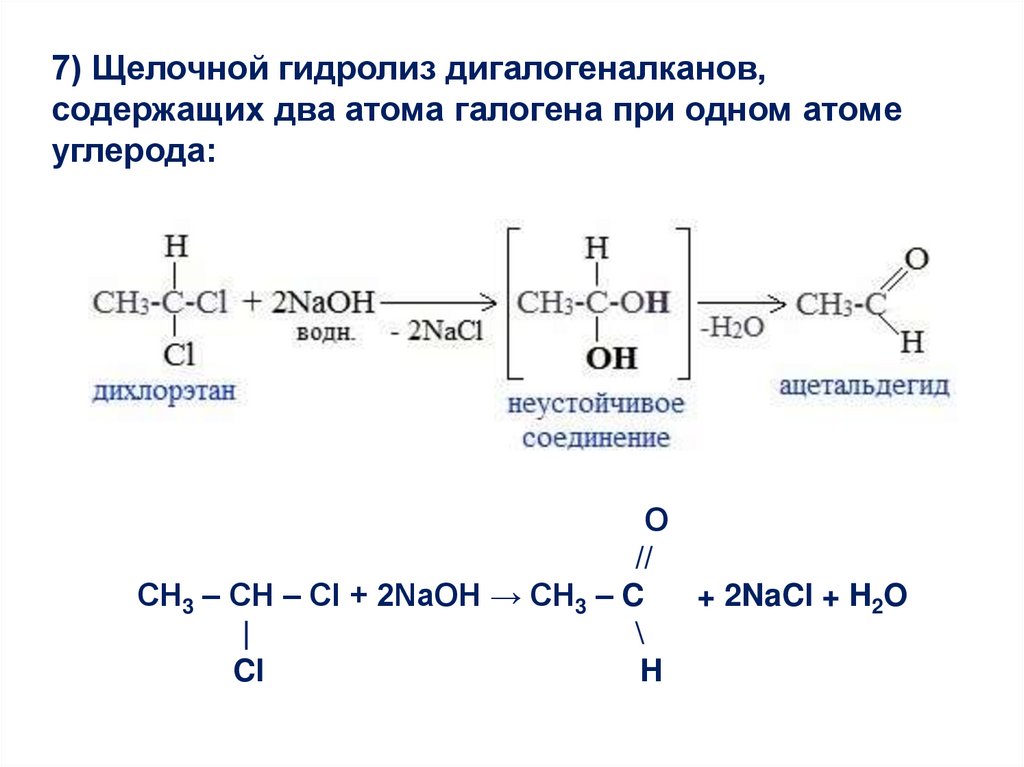
7) Щелочной гидролиз дигалогеналканов,содержащих два атома галогена при одном атоме
углерода:
О
//
СН3 – СН – Cl + 2NaOH → CH3 – C
+ 2NaCl + H2O
|
\
Cl
H
14.
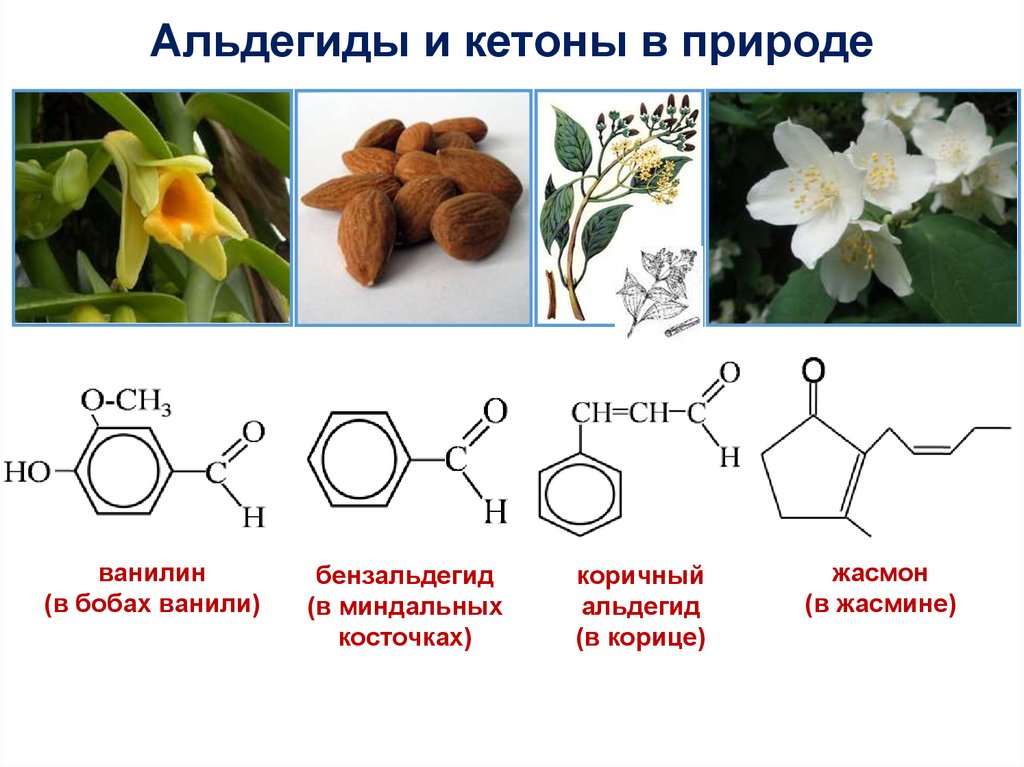
Альдегиды и кетоны в природеванилин
(в бобах ванили)
бензальдегид
(в миндальных
косточках)
коричный
альдегид
(в корице)
жасмон
(в жасмине)
15.
Физические свойства альдегидовБесцветный газ с резким
запахом, хорошо растворим в
воде, очень ядовит.
Применяется в производстве
фенолформальдегидных
пластмасс, лекарств (например,
уротропина).
формальдегид
40% - ный водный раствор
формальдегида называется
формалином (используется для
хранения биопрепаратов,
протравливания семян перед
посевом, дубления кож)
16.
Физические свойства альдегидовБесцветная жидкость с
характерным запахом, хорошо
растворим в воде, ядовит.
Применяется в производстве
уксусной кислоты, пластмасс,
ацетатного волокна.
Уксусный
альдегид
17.
Физические свойства кетоновАцетон
Бесцветная легкоподвижная
летучая жидкость с
характерным запахом, хорошо
растворимая в воде. Ацетон
хорошо растворяет многие
органические вещества
(ацетилцеллюлозу и
нитроцеллюлозу, жиры, воск,
резину и др.), а также ряд солей
(хлорид кальция, иодид калия).
Является одним из
метаболитов, производимых
человеческим организмом.
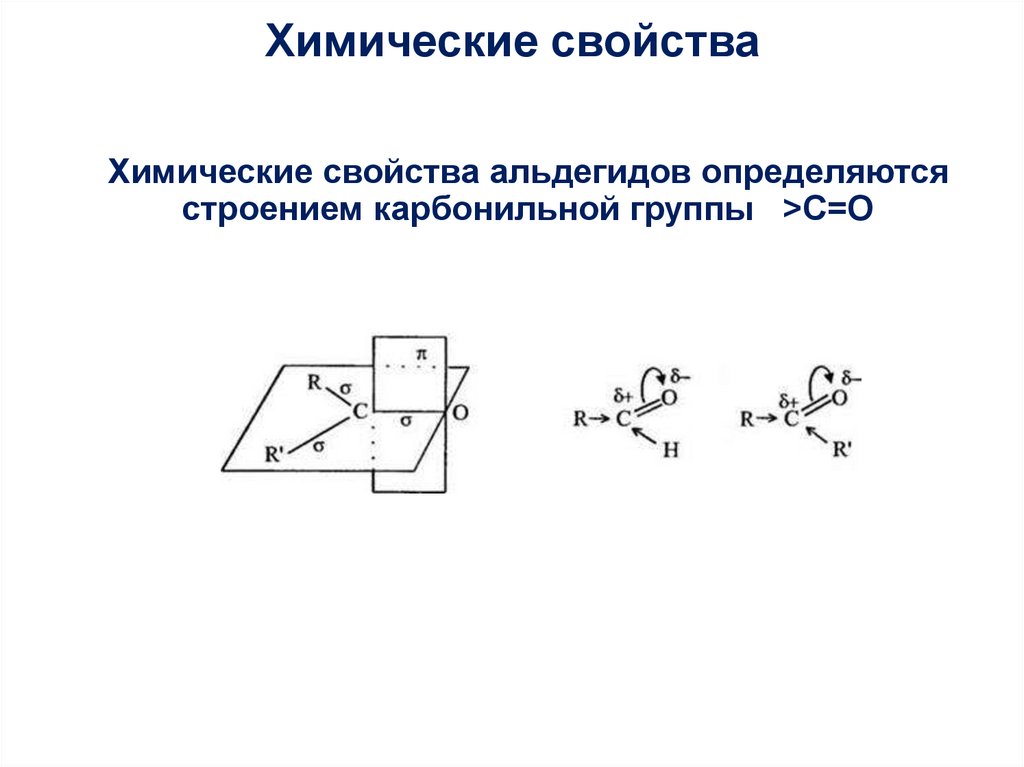
18. Химические свойства альдегидов определяются строением карбонильной группы >C=O
Химические свойстваХимические свойства альдегидов определяются
строением карбонильной группы >C=O
19.
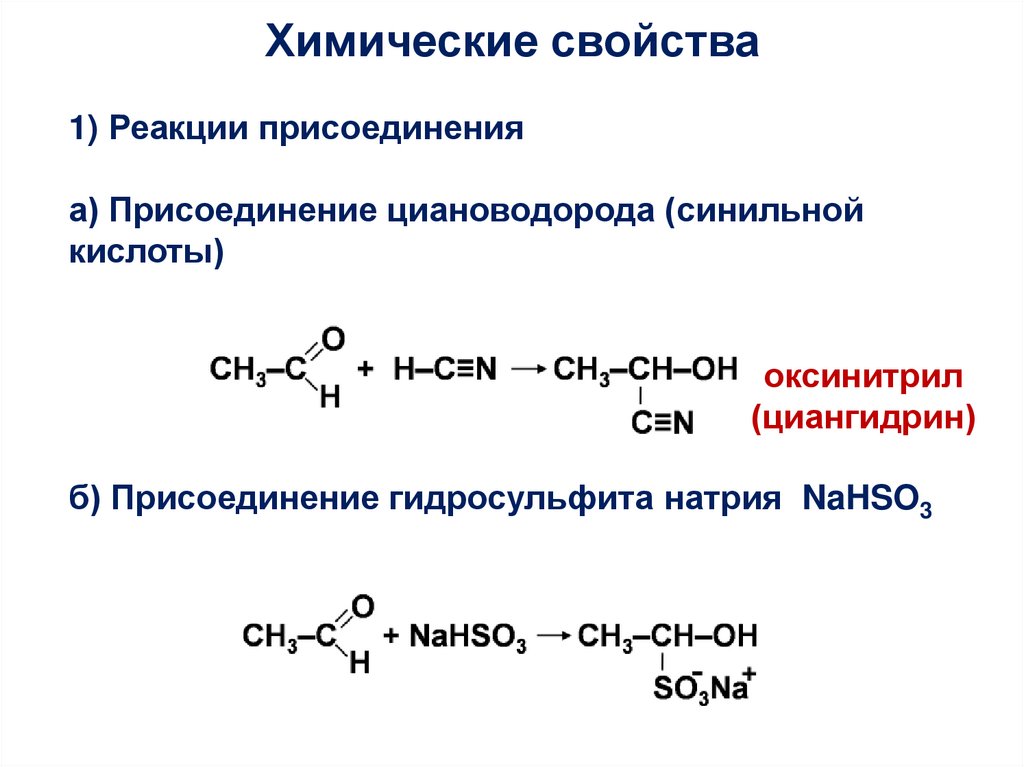
Химические свойства1) Реакции присоединения
а) Присоединение циановодорода (синильной
кислоты)
оксинитрил
(циангидрин)
б) Присоединение гидросульфита натрия NaHSO3
20.
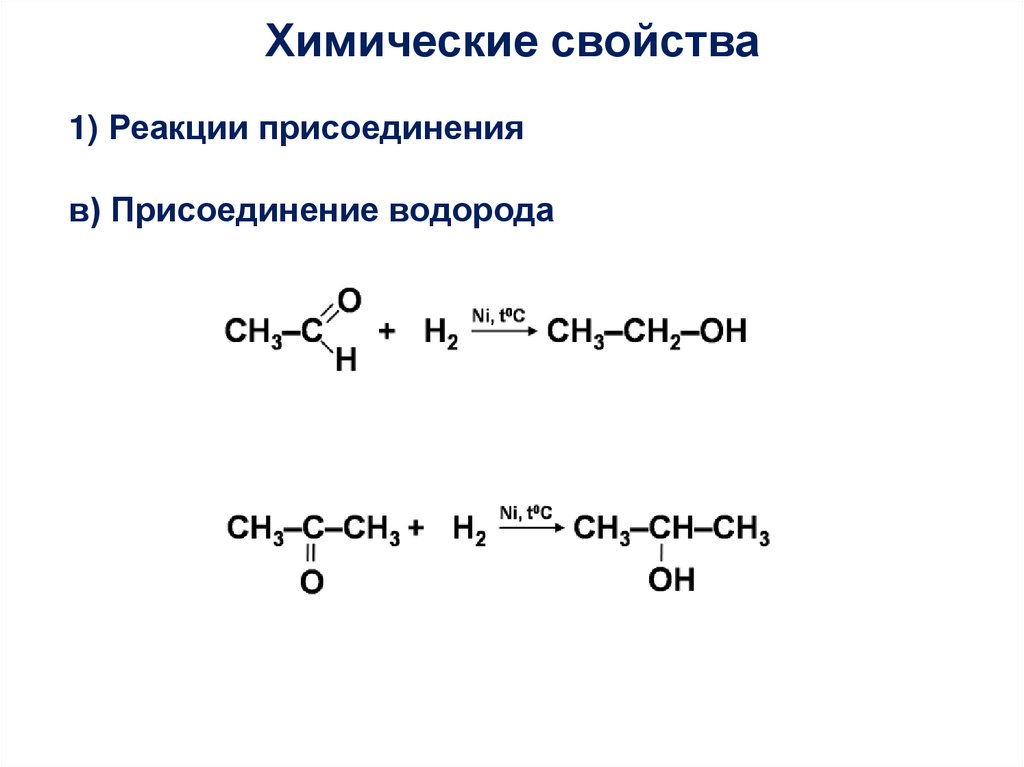
Химические свойства1) Реакции присоединения
в) Присоединение водорода
21.
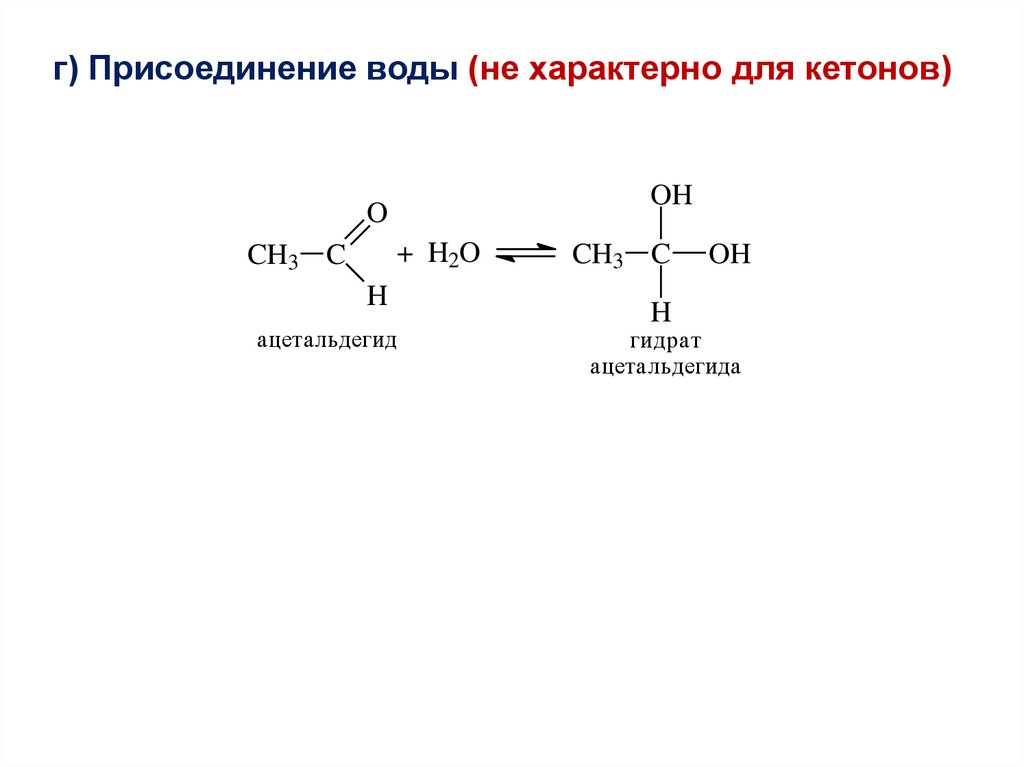
г) Присоединение воды (не характерно для кетонов)OH
O
+ H2O
CH3 C
H
ацетальдегид
CH3 C
H
OH
гидрат
ацетальдегида
22.
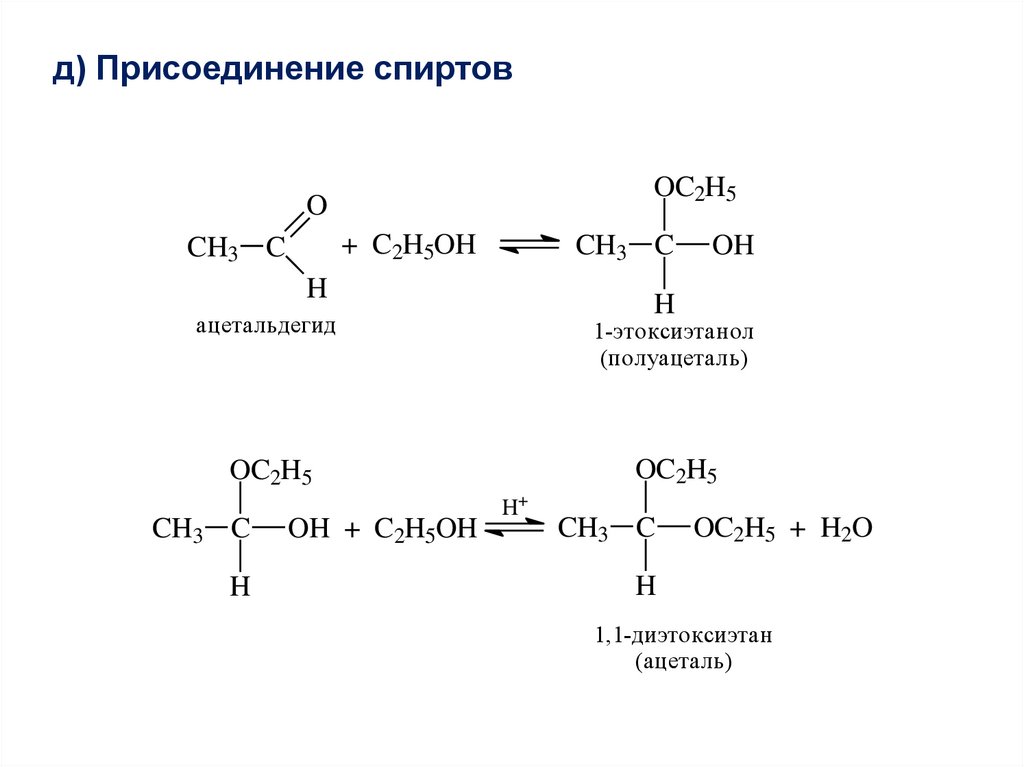
д) Присоединение спиртовOC2H5
O
+ C2H5OH
CH3 C
CH3 C
H
OH
H
ацетальдегид
1-этоксиэтанол
(полуацеталь)
OC2H5
OC2H5
CH3 C
H
OH + C2H5OH
H+
CH3 C
OC2H5 + H2O
H
1,1-диэтоксиэтан
(ацеталь)
23.
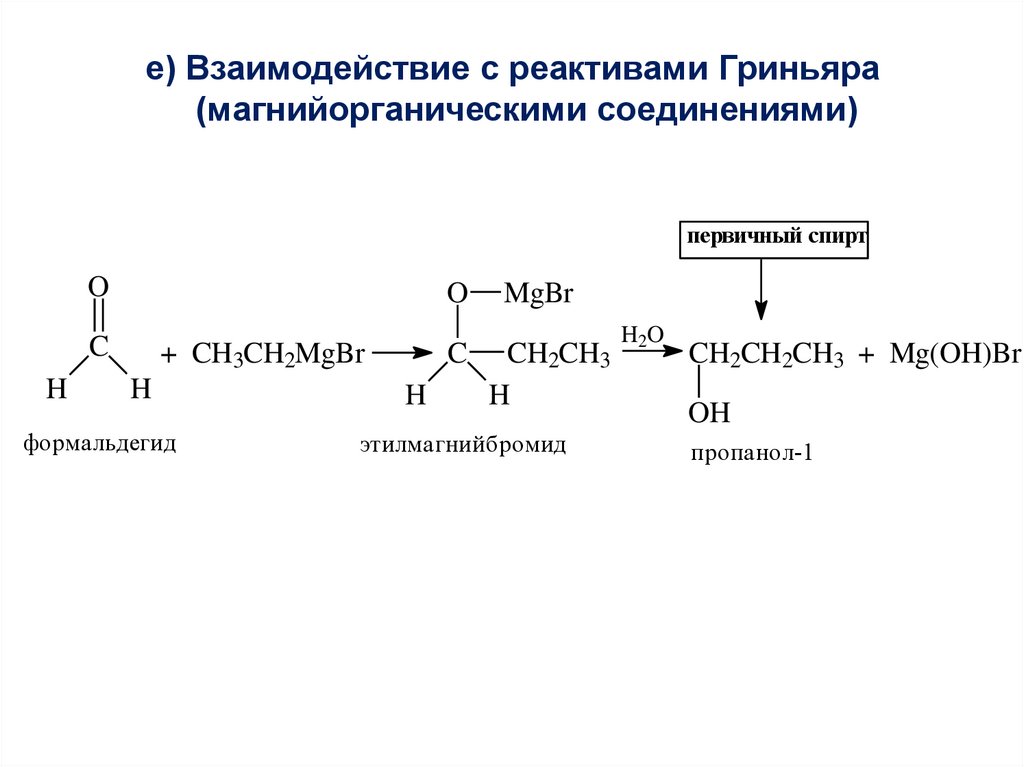
е) Взаимодействие с реактивами Гриньяра(магнийорганическими соединениями)
первичный спирт
O
C
H
+ CH3CH2MgBr
H
формальдегид
H
O
MgBr
C
CH2CH3
H
этилмагнийбромид
H2O
CH2CH2CH3 + Mg(OH)Br
OH
пропанол-1
24.
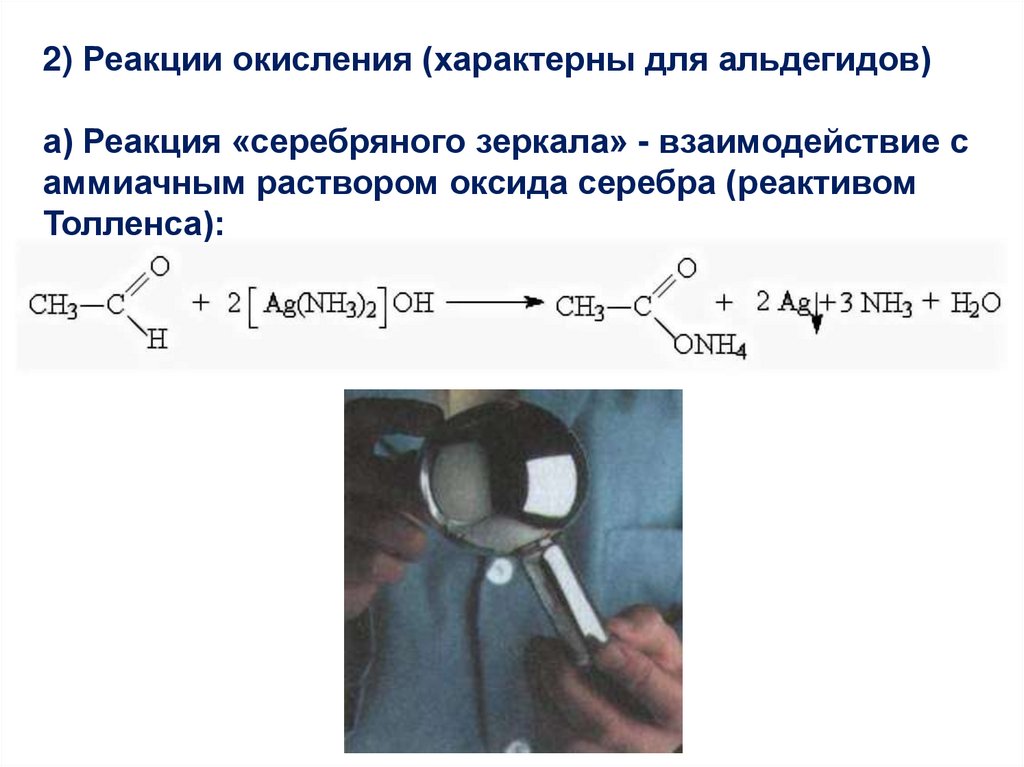
2) Реакции окисления (характерны для альдегидов)а) Реакция «серебряного зеркала» - взаимодействие с
аммиачным раствором оксида серебра (реактивом
Толленса):
25.
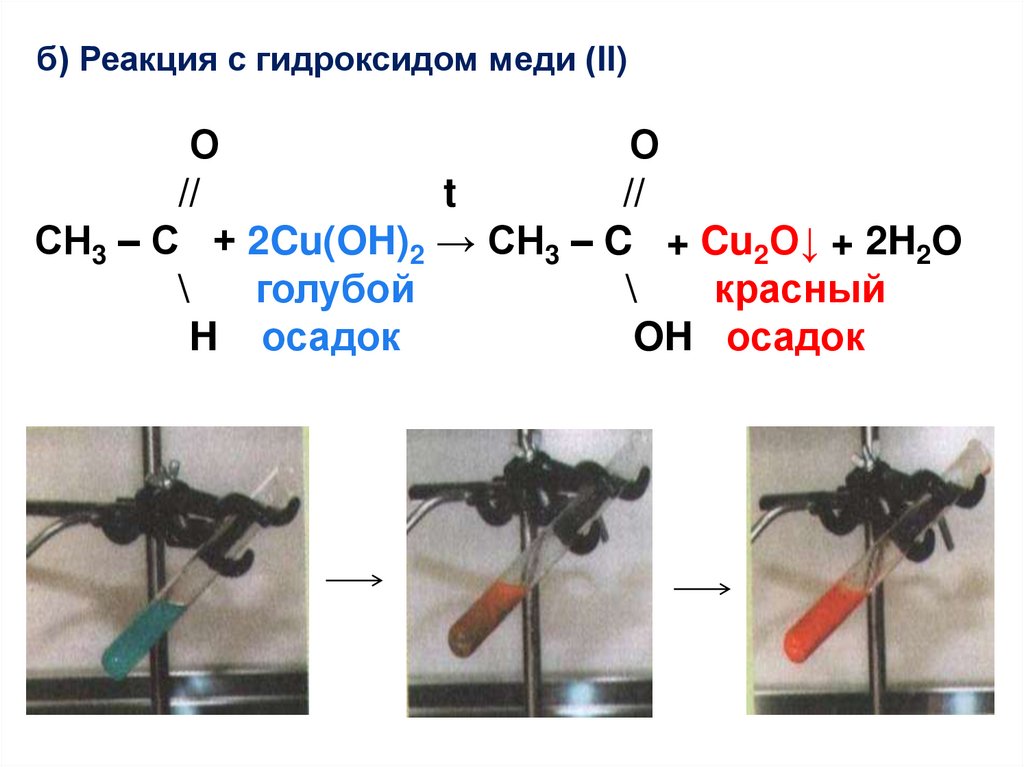
б) Реакция с гидроксидом меди (II)О
О
//
t
//
СН3 – С + 2Cu(OH)2 → CH3 – C + Cu2O↓ + 2H2O
\
голубой
\
красный
H осадок
OH осадок
26.
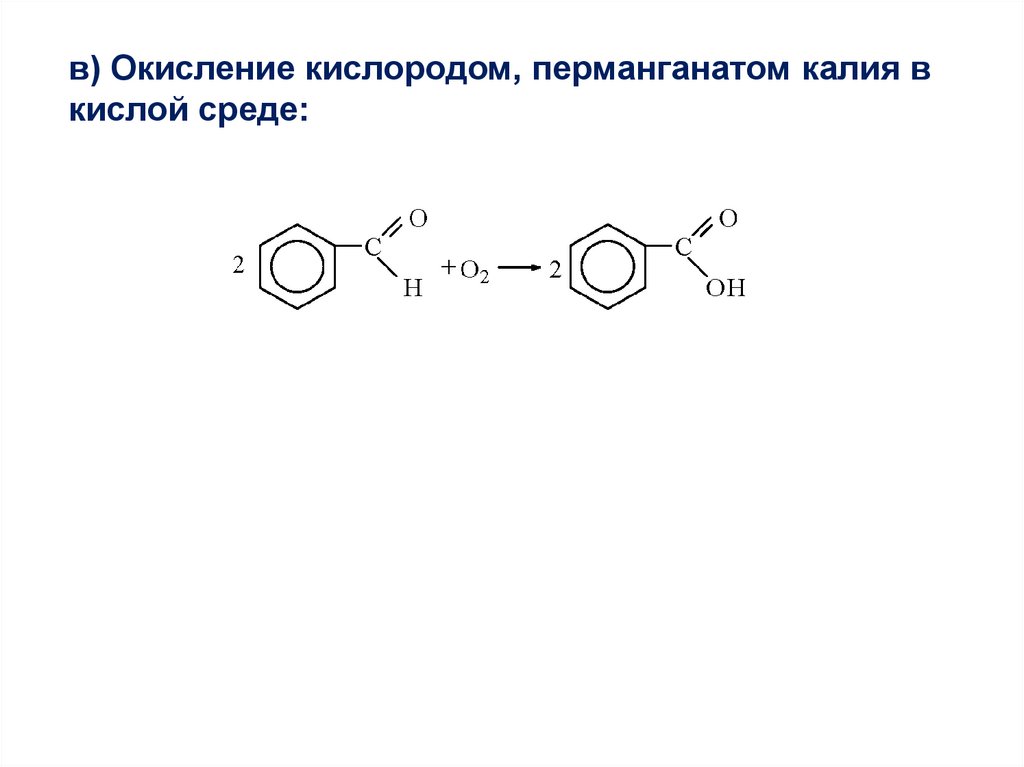
в) Окисление кислородом, перманганатом калия вкислой среде:
27.
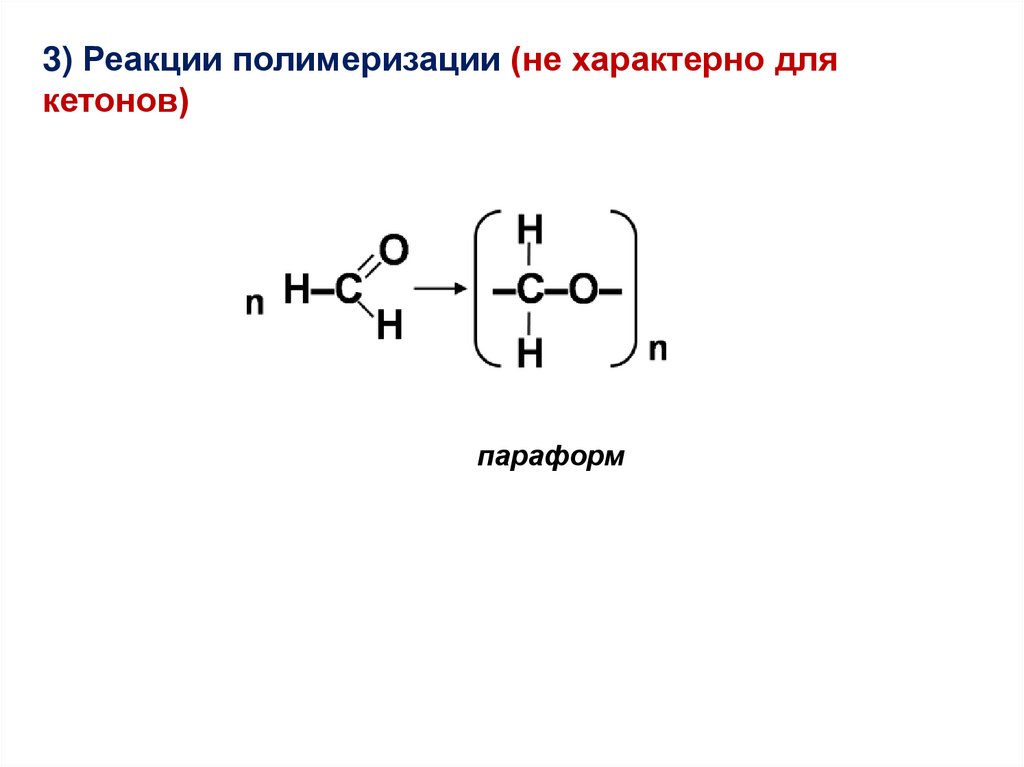
3) Реакции полимеризации (не характерно длякетонов)
параформ
28.
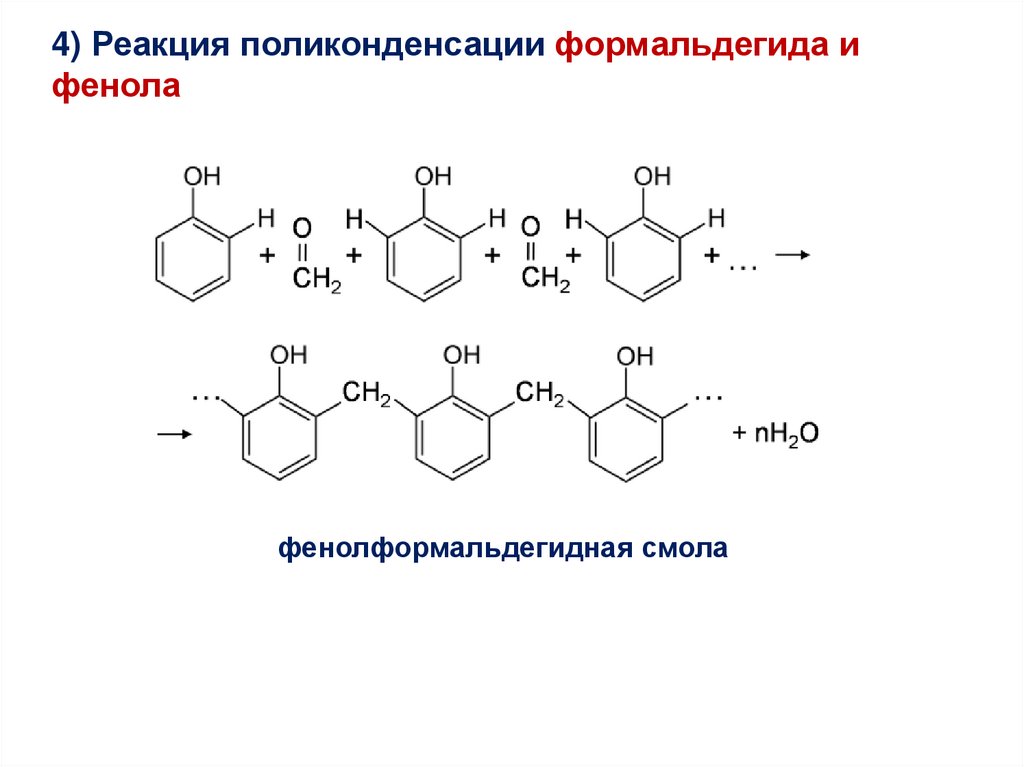
4) Реакция поликонденсации формальдегида ифенола
фенолформальдегидная смола
29.
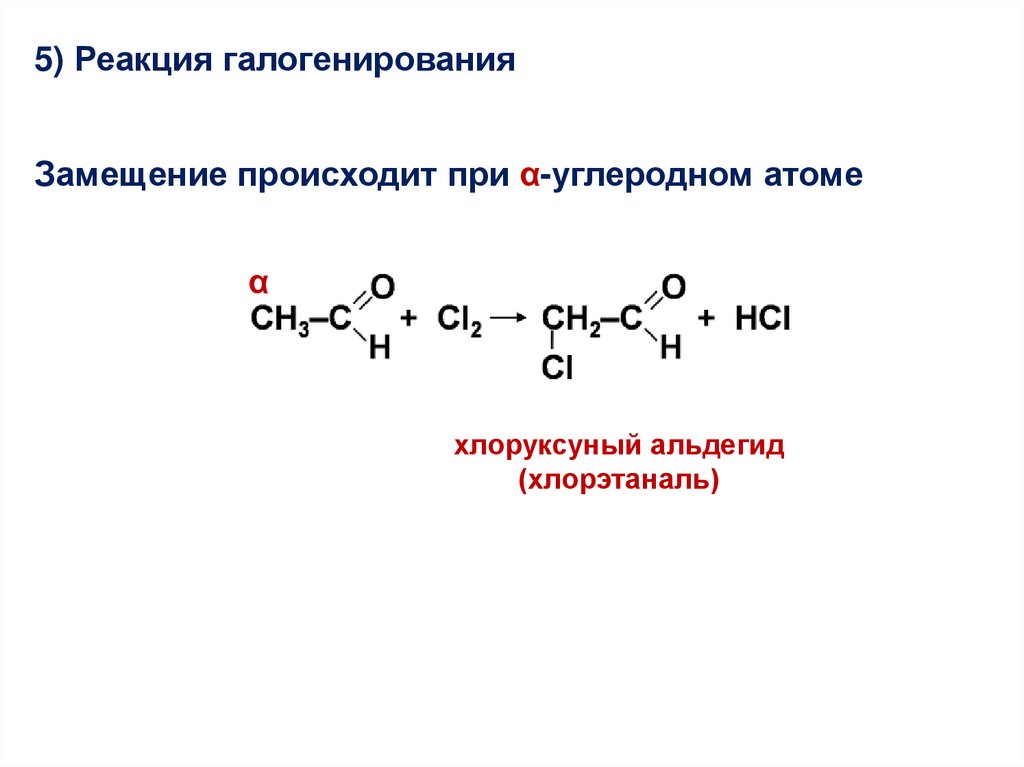
5) Реакция галогенированияЗамещение происходит при α-углеродном атоме
α
хлоруксуный альдегид
(хлорэтаналь)




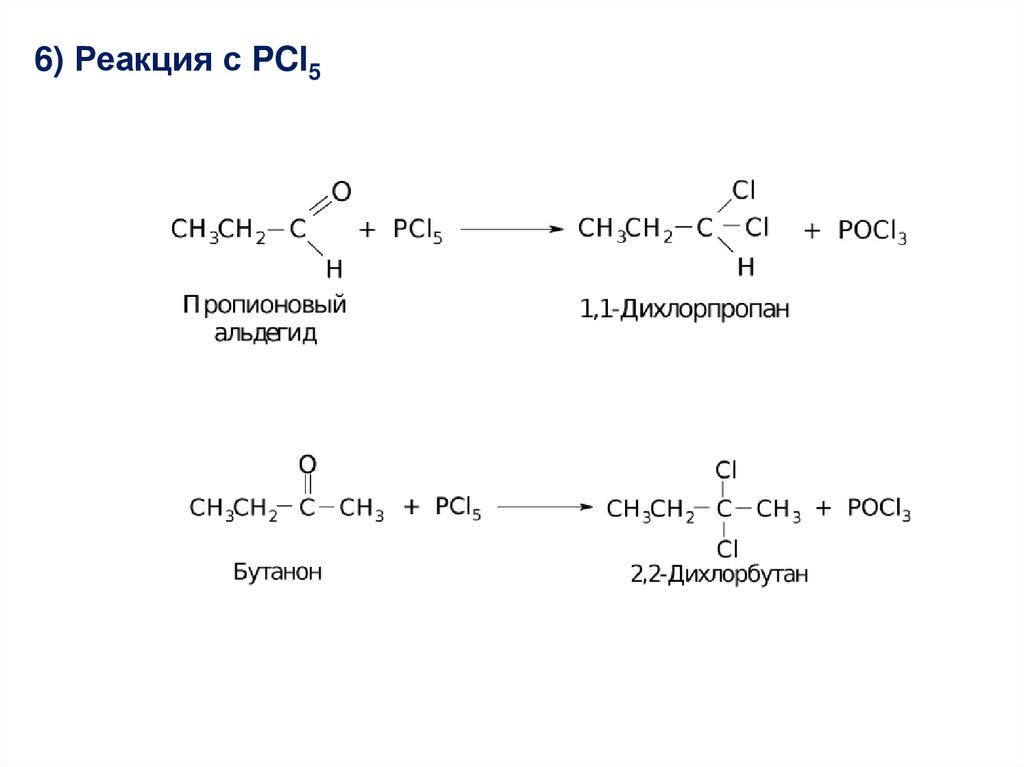
 Химия
Химия