Похожие презентации:
Классификация неорг (1)
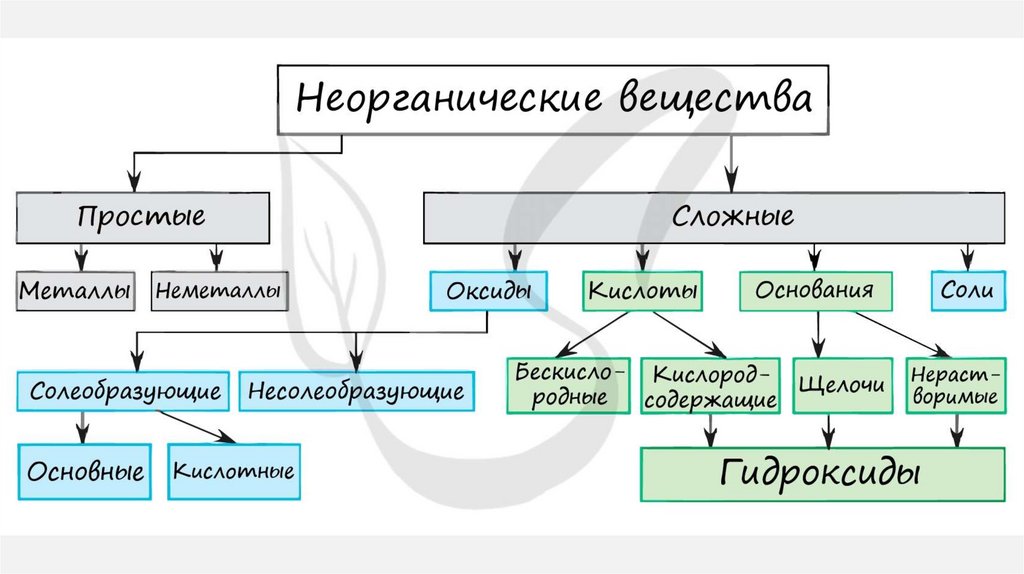
1. КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
2.
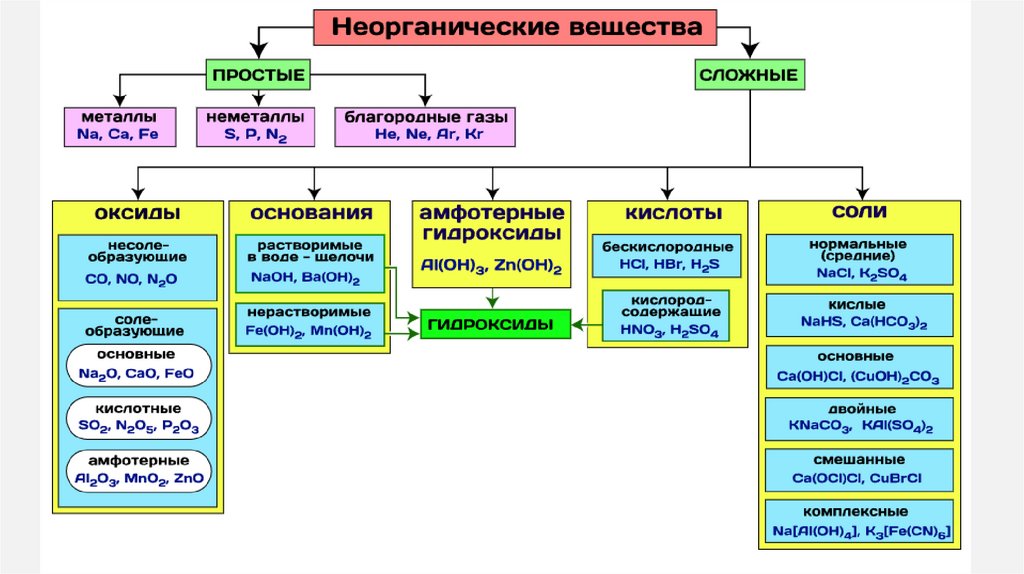
• По элементному составу: бинарные имногоатомные соединения
• По агрегатному состоянию: газообразные,
твердые и жидкие
• По растворимости в воде: нерастворимые,
слаборастворимые и растворимые
3.
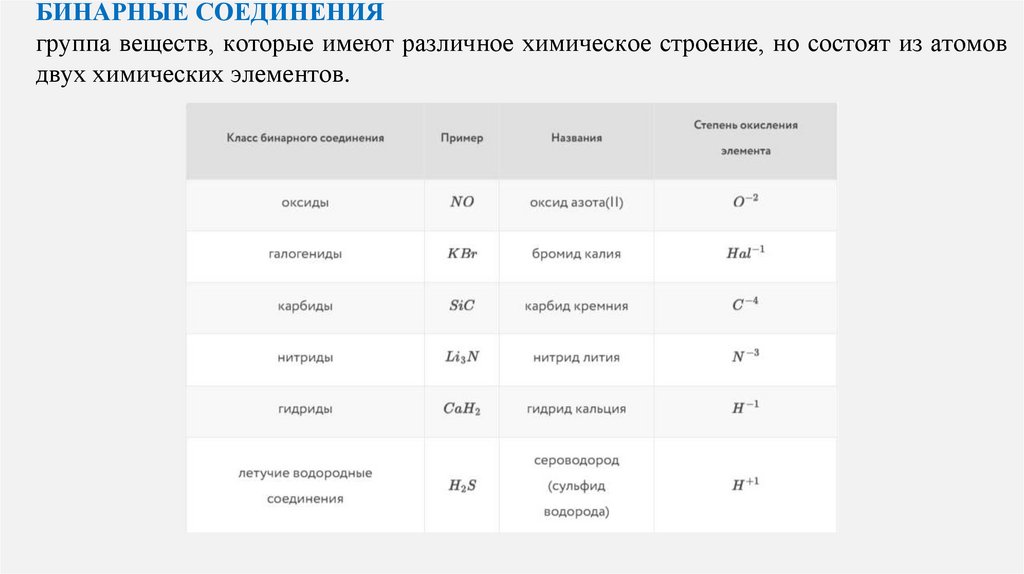
БИНАРНЫЕ СОЕДИНЕНИЯгруппа веществ, которые имеют различное химическое строение, но состоят из атомов
двух химических элементов.
4.
МНОГОЭЛЕМЕНТНЫЕСОЕДИНЕНИЯ
можно разделить на две группы:
• Гидроксиды — это продукты прямого или
косвенного соединения оксидов с водой.
Представлены тремя большими классами:
основания,
амфотерные
гидроксиды
и
кислородосодержащие кислоты.
• Соли можно разделить на четыре группы:
средние соли; кислые соли; основные соли;
комплексные соли.
5.
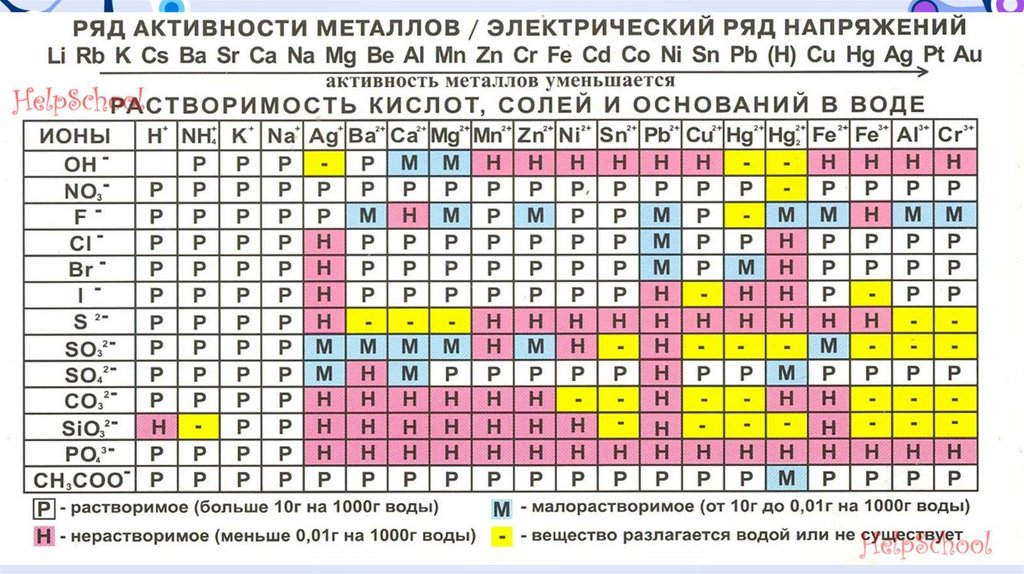
ВСЕВЕЩЕСТВА
ПО
РАСТВОРИМОСТИ
УСЛОВНО ДЕЛЯТСЯ НА ТРИ ГРУППЫ:
• растворимые — при комнатной температуре растворяется больше 1 г
вещества в 100 г воды;
• малорастворимые — растворяется от 0,01 г до 1 г в 100 г воды;
• практически нерастворимые — растворяется меньше 0,01 г в 100 г
воды.
Растворимость кислот, оснований и солей можно узнать в таблице
растворимости.
6.
7.
8.
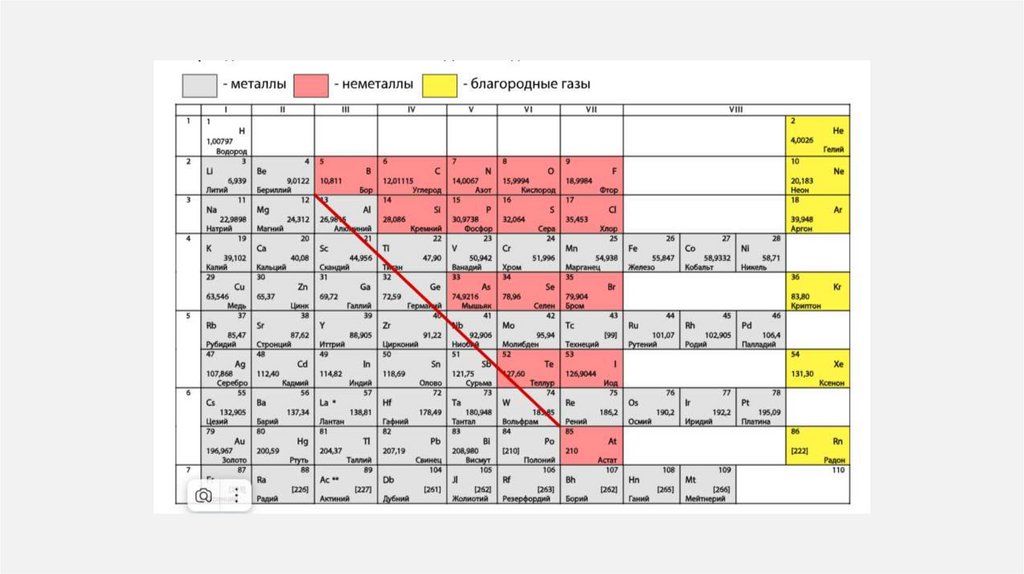
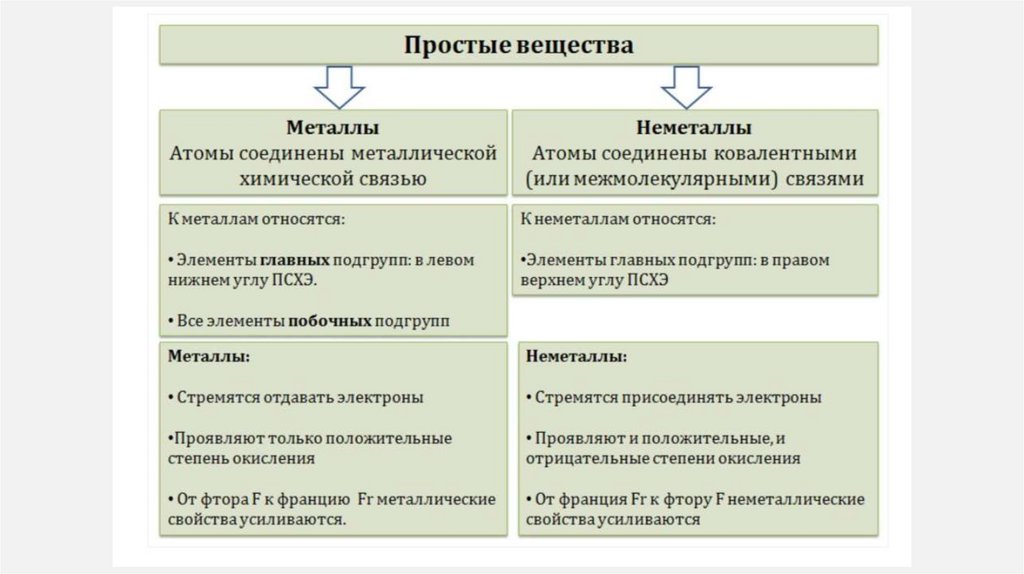
9. МЕТАЛЛЫ И НЕМЕТАЛЛЫ
• МЕТАЛЛЫ – химические элементы, атомыкоторых в процессе реакции стремятся
отдавать электроны.
• На внешне энергетическом уровне: от 1 до 3
электронов
• известно более 87 металлов
• характеризуются
металлическими
свойствами:
металлический
блеск;
пластичность;
теплопроводность;
электропроводность
• НЕМЕТАЛЛЫ
–
химические
элементы, атомы которых стремятся
принять
чужие
электроны
(неметаллические свойства).
• не характерны общие физические
свойства
• существует 22 неметалла.
10.
11. Заполните таблицу, используя элементы: Cu, Au, Mg, Cl, Br, O2, Fe, H2, N2
ЗАПОЛНИТЕ ТАБЛИЦУ, ИСПОЛЬЗУЯЭЛЕМЕНТЫ:
CU, AU, MG, CL, BR, O2, FE, H2, N2
Металлы
Неметаллы
12.
МеталлыCu, Au, Mg, Fe
Неметаллы
Cl, Br, O2, H2, N2
13.
14. Оксиды
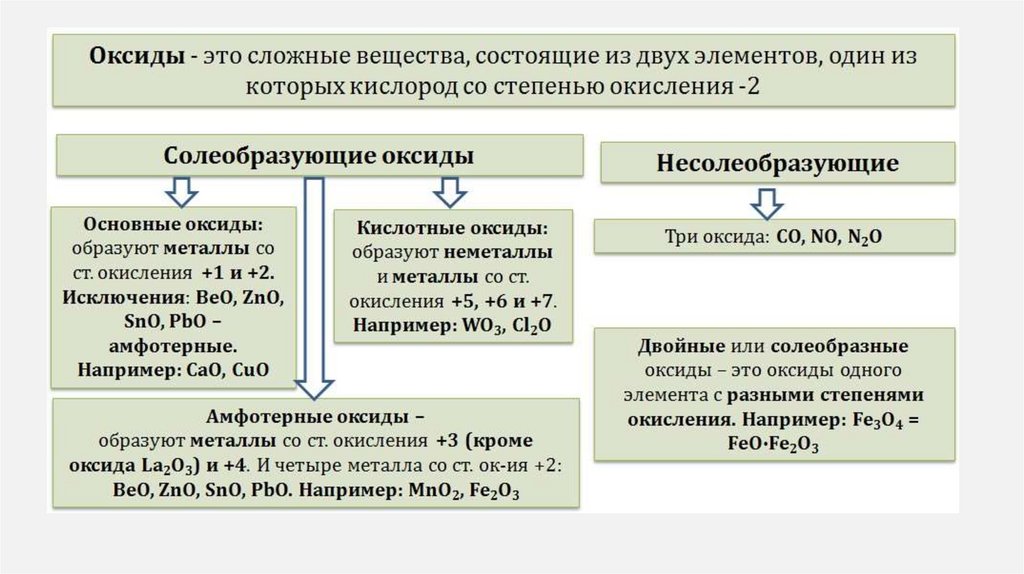
ОКСИДЫОксиды – сложные вещества, которые
состоят из атомов кислорода и атомов
какого–либо
химического
элемента
(Ме/неМе).
15.
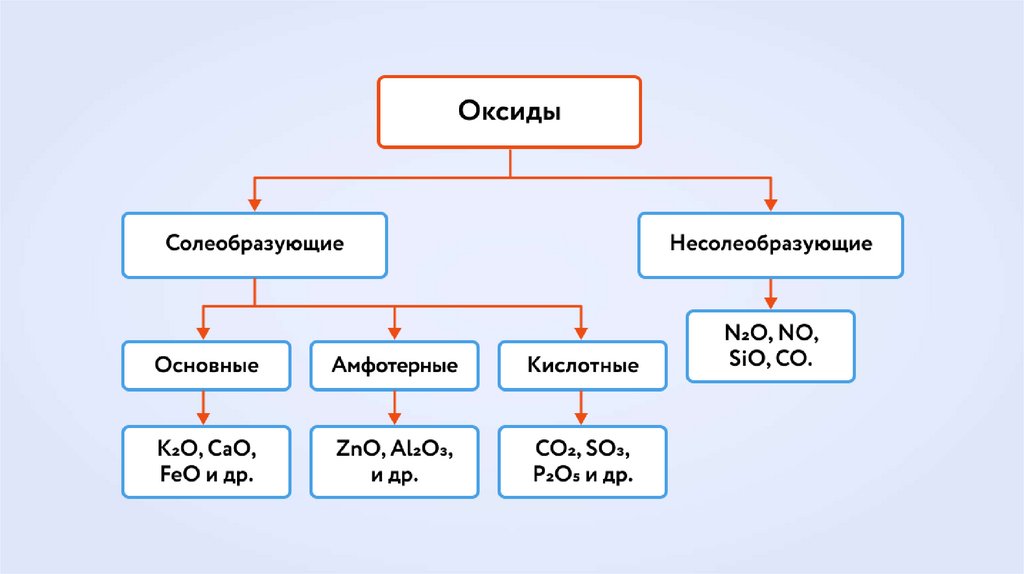
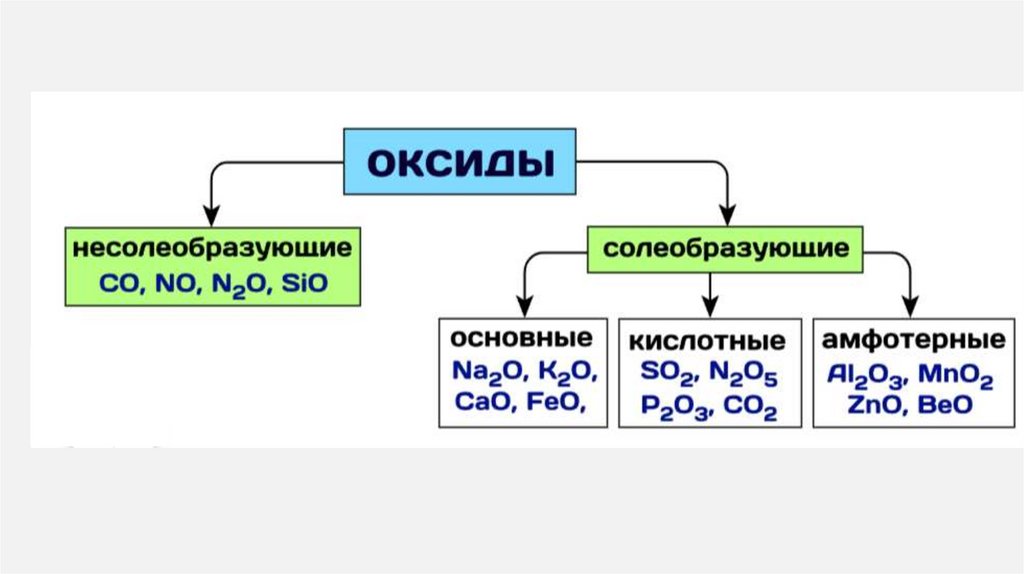
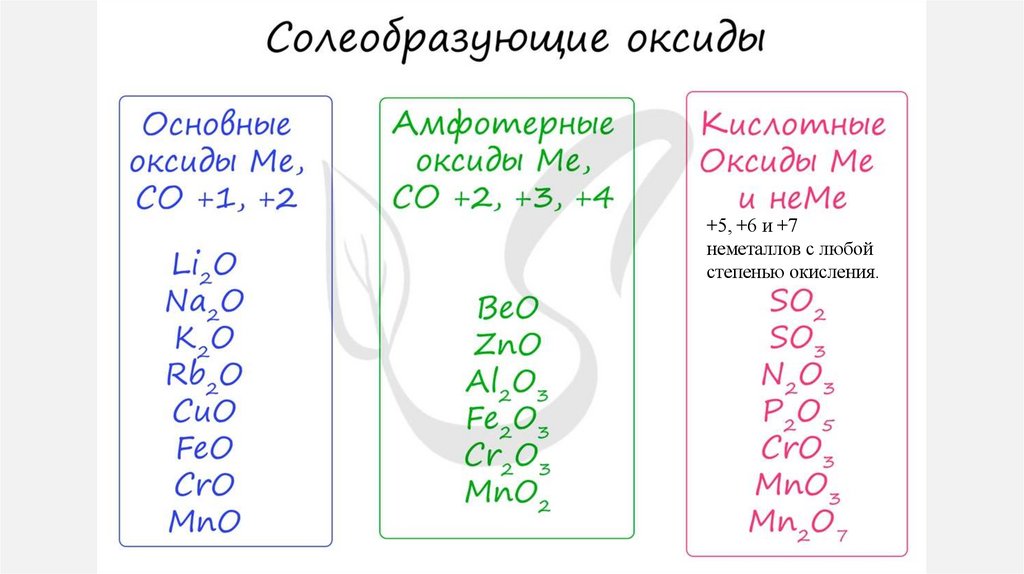
16. ОКСИДЫ
СОЛЕОБРАЗУЮЩИЕ• Имеют
соответствующие
основания и кислоты
им
• Вступают в реакции солеобразования .
• CuO - соответствует основанию Cu(OH)2
• P2O5 - соответствует кислоты H3PO4
НЕСОЛЕОБРАЗУЮЩИЕ
• Образованы неметаллами
степени окисление +1 и +2
• CO SiO N 2 O NO
в
17.
18.
+5, +6 и +7неметаллов с любой
степенью окисления.
19.
20. Основания
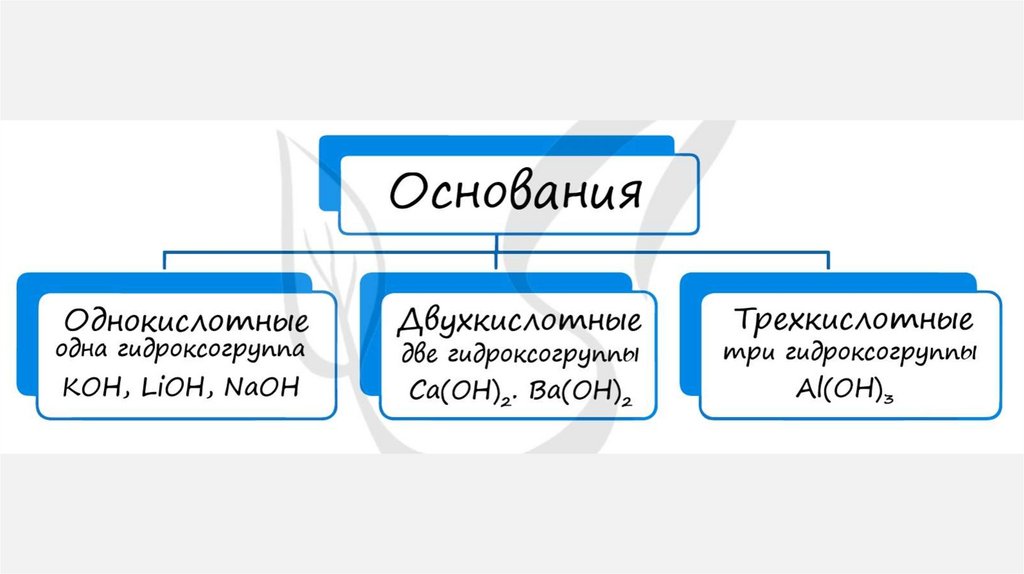
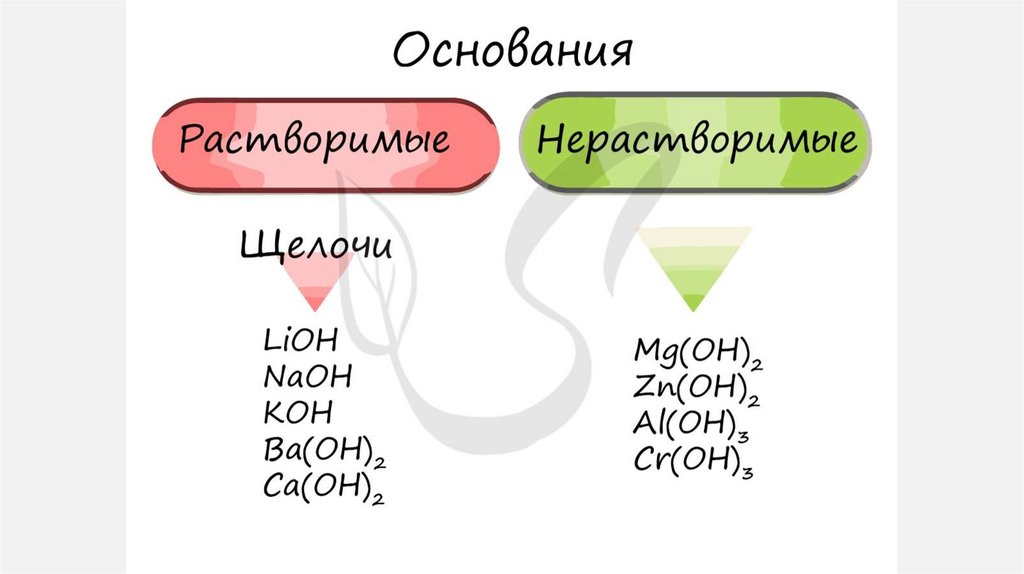
ОСНОВАНИЯОснования – сложные вещества, которые
состоят из атомов металла и одной или
несколько –OH групп (гидроксогрупп) =
Me(OH)x
21.
АМФОТЕРНЫЕ ГИДРОКСИДЫ – это гидроксидыметаллов, проявляющие двойственную природу, т.е.
способные проявлять как свойства кислот, так и свойства
оснований.
Амфотерными являются гидроксиды металлов в степенях
окисления +3 и +4 (как и оксиды).
Несмотря на степень окисления +2 к амфотерным оксидам
относятся соединения Be(OH)2, Zn(OH)2, Sn(OH)2,
Pb(OH)2.
22.
23.
24. Выпишите формулы, которые являются основаниями, дайте названия
ВЫПИШИТЕ ФОРМУЛЫ ,КОТОРЫЕ ЯВЛЯЮТСЯ
ОСНОВАНИЯМИ,
ДАЙТЕ НАЗВАНИЯ
CaCO3, NaOH, HCl, P2O5, NO2, S, Au, Al2O3,
H3PO4, CuCl2, Fe(OH)3, H2CO3, Al, KNO3,
H2SO4, H2, C, AgCl, Cu(OH)2, Mg(OH)2, FeO
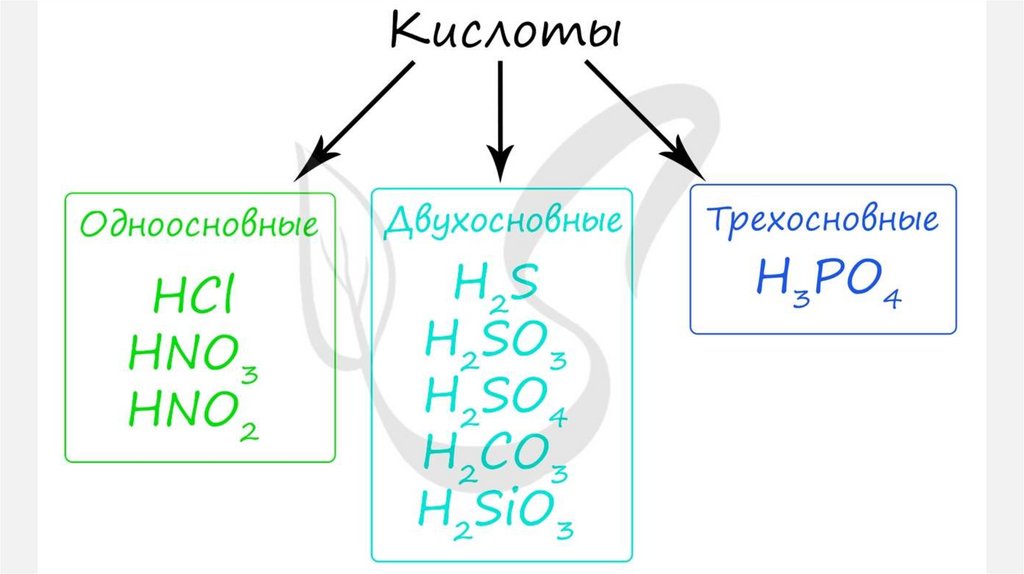
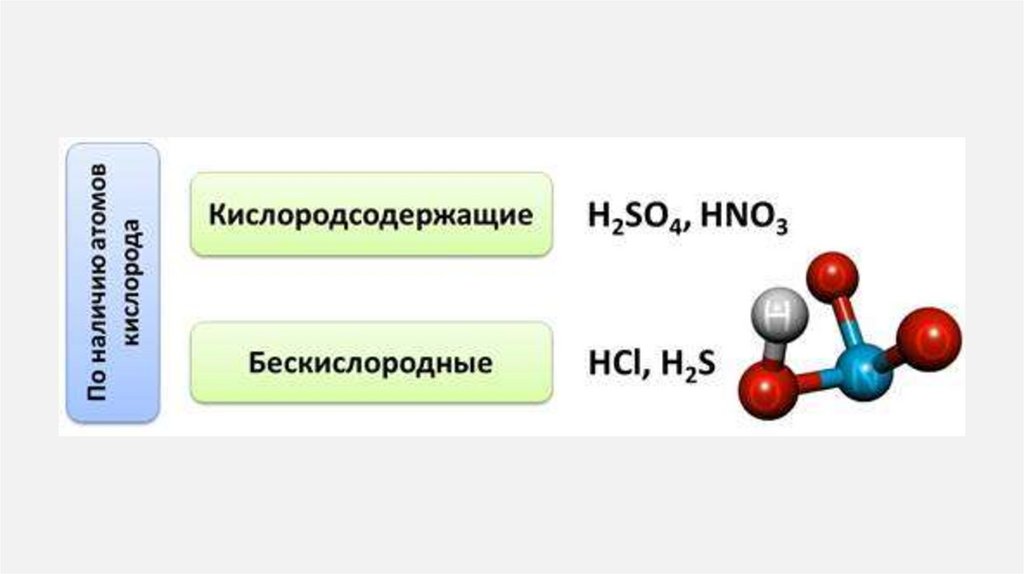
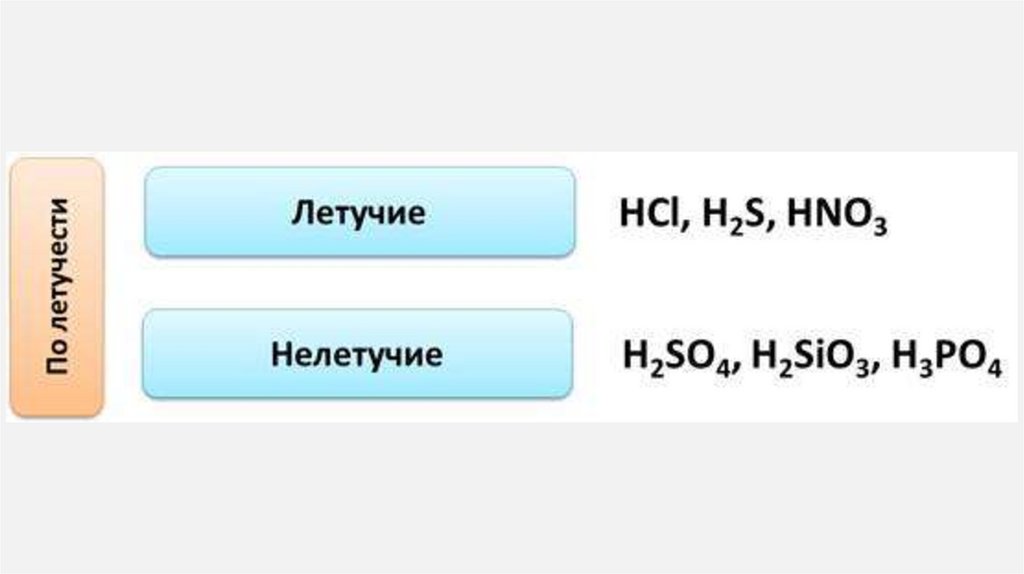
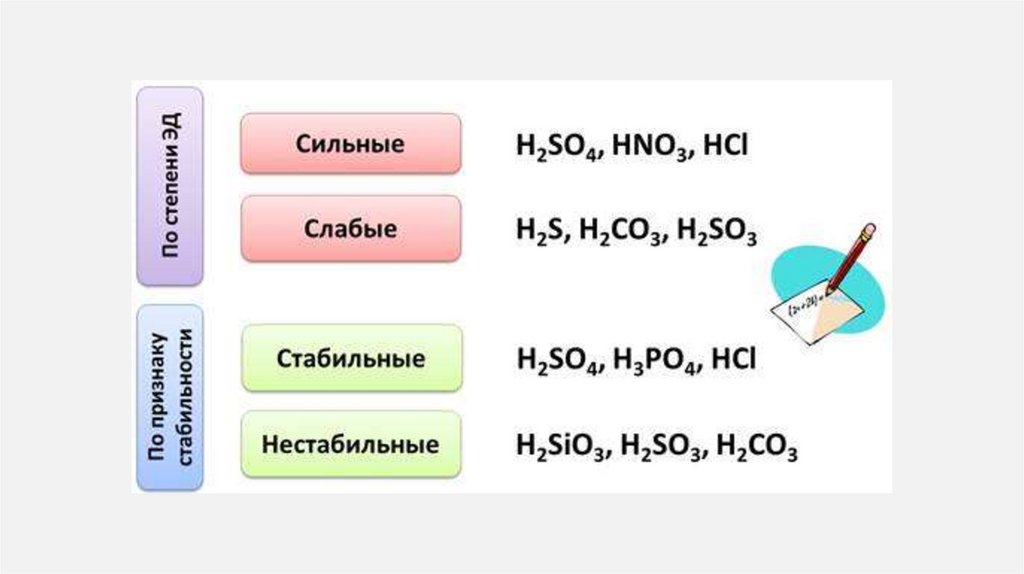
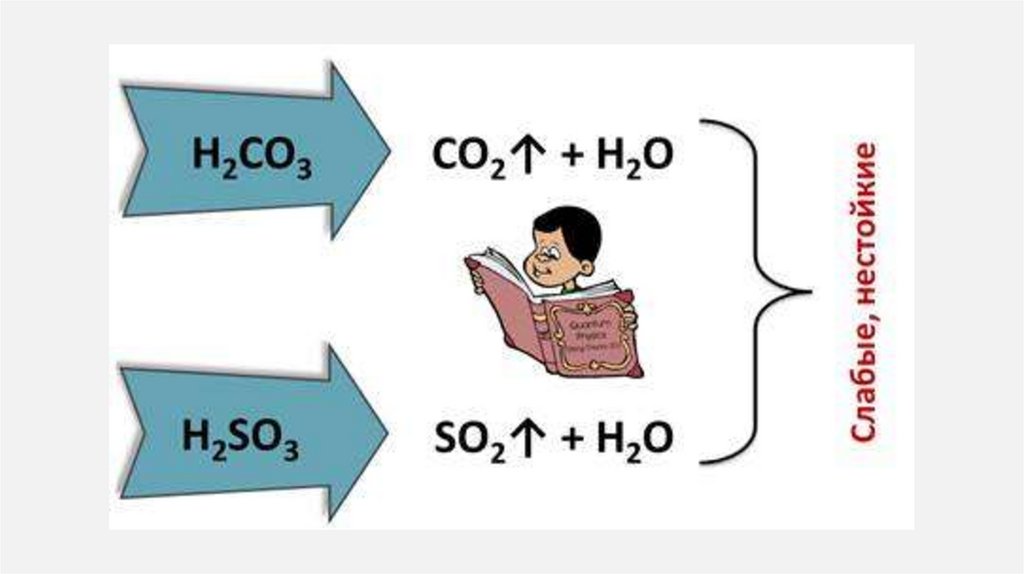
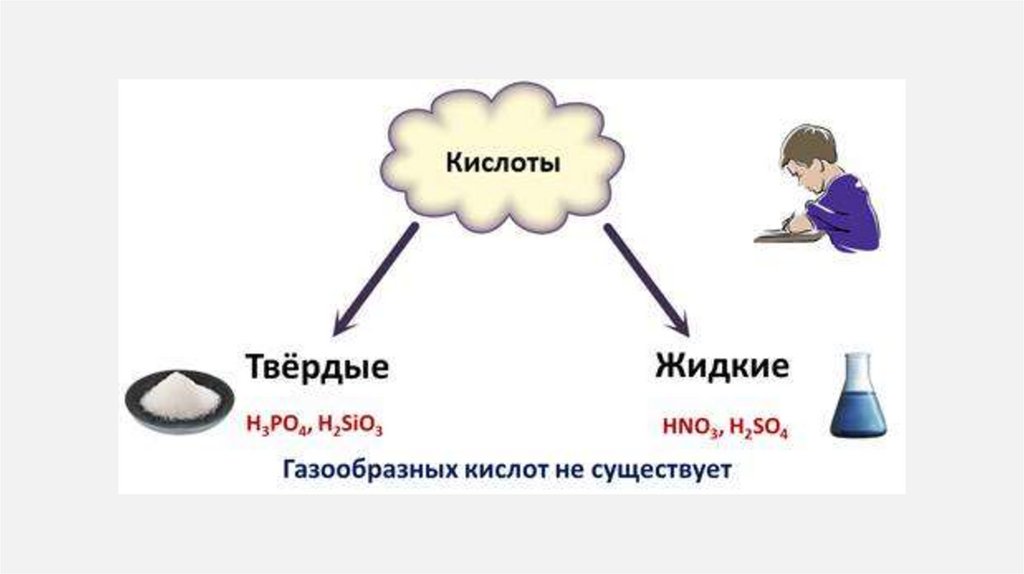
25. Кислоты
КИСЛОТЫ1.
Кислоты— класс сложных химических веществ,
состоящих из атомов водорода и кислотных
остатков.
В первую очередь кислоты делятся на:
органические или карбоновые
неорганические или минеральные
2.
26.
27.
28.
29.
30.
31.
32.
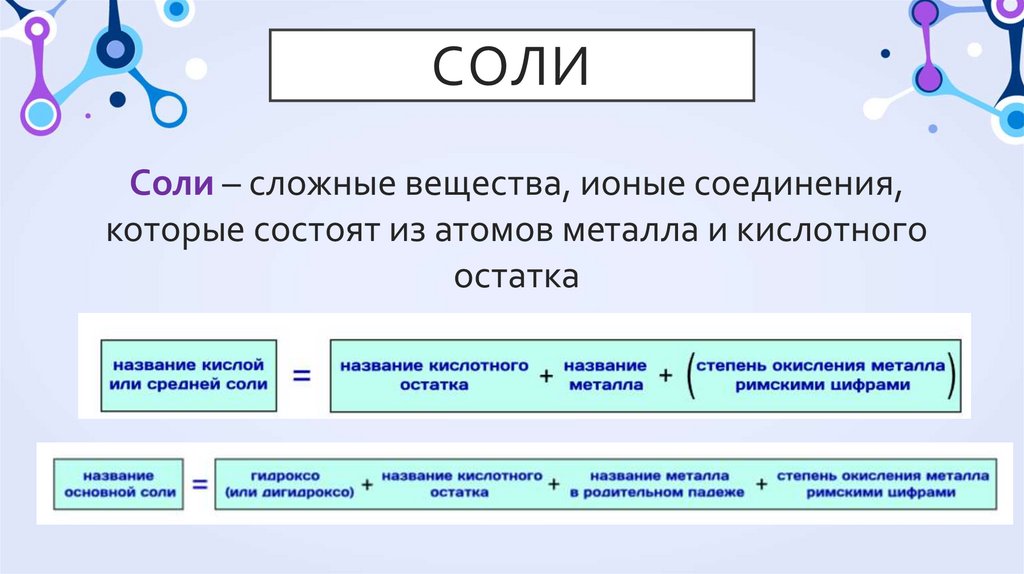
33. Соли
СОЛИСоли – сложные вещества, ионые соединения,
которые состоят из атомов металла и кислотного
остатка
34.
ПО КЛАССИФИКАЦИИ СОЛИ БЫВАЮТ:Средние - продукт полного замещения атомов водорода в кислоте на
металл: KNO3, NaCl, BaSO4, Li3PO4
Кислые - продукт неполного замещения атомов водорода: LiHSO4,
NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и
гидрофосфат натрия)
Основные - продукт неполного замещения гидроксогрупп на
кислотный остаток: CrOHCl (хлорид гидроксохрома II)
Двойные - содержат два разных металла и один кислотный остаток
(NaCr(SO4)2
Смешанные - содержат один металл и два кислотных остатка MgClBr
(хлорид-бромид магния
Комплексные - содержат комплексный катион или анион - атом
металла, связанный с несколькими лигандами: Na[Cr(OH)4]
(тетрагидроксохромат натрия)
35. Напишите формулы следующих кислотных остатков
НАПИШИТЕ ФОРМУЛЫСЛЕДУЮЩИХ КИСЛОТНЫХ
ОСТАТКОВ
Карбонат
Хлорид
Нитрат
Сульфат
Ортофосфат
36. Составьте формулы следующих солей
СОСТАВЬТЕФОРМУЛЫ
СЛЕДУЮЩИХ
СОЛЕЙ
карбонат кальция
хлорид натрия
фосфат калия
сульфат железа (III)
нитрат цинка
силикат калия


















 Химия
Химия








