Похожие презентации:
1. Многоликий углерод
1. ТЕМА 4. Углерод и кремний 9 часов.
Урок №1 Многоликий углерод20.01.2026
А.Г.Волкова
1
2. План урока
1. углерод в природе2. углерод – химический элемент
3. углерод – простое вещество:
А) аллотропия
Б) адсорбция
4. химические свойства углерода
5. применение
20.01.2026
А.Г.Волкова
2
3. 1. Углерод в природе
Л. 0,48% по массеГ. Около 3% по массе
А. 0,046% CO2 по массе
Б. 18% по массе
К. В атмосфере Солнца, планет, в каменных и
железных метеоритах.
20.01.2026
А.Г.Волкова
3
4. 2. Углерод – химический элемент
Дайте характеристику Х.Э.Зарисуйте схему строения атома
Запишите электронную конфигурацию
Энергетическую диаграмму
Определите валентности
и возможные степени окисления
20.01.2026
А.Г.Волкова
4
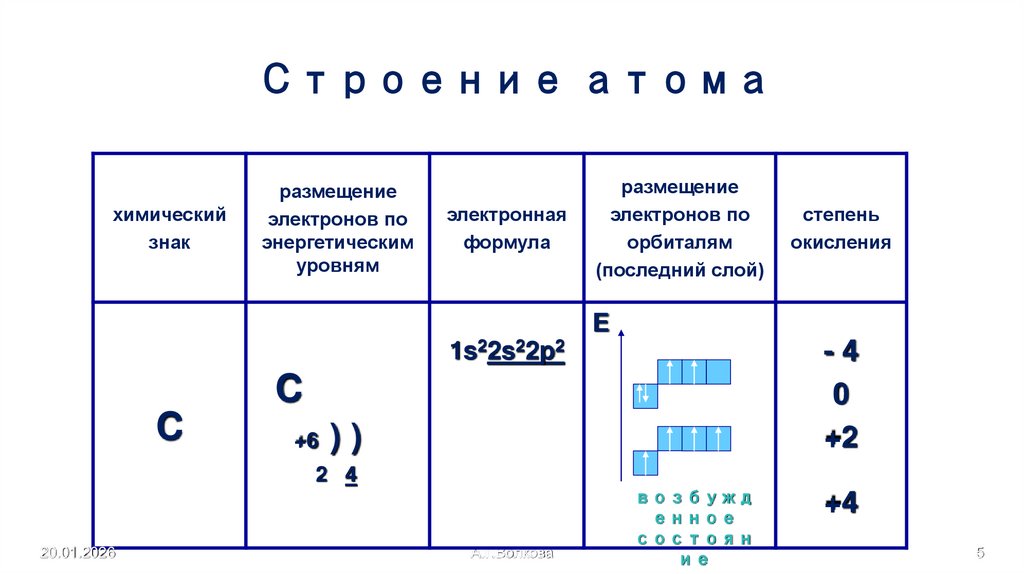
5. Строение атома
химическийзнак
размещение
электронов по
энергетическим
уровням
электронная
формула
размещение
электронов по
орбиталям
(последний слой)
степень
окисления
E
-4
0
+2
1s22s22p2
C
C
+6 ) )
2 4
20.01.2026
А.Г.Волкова
возбужд
енное
состоян
ие
+4
5
6. 3. Простое вещество а. Аллотропия углерода
Аллотропия- явление существования химическогоэлемента в виде нескольких простых веществ –
аллотропных модификаций
Углерод образует несколько простых веществ, из которых
важнейшими считаются алмаз и графит. Есть еще карбин,
фуллерен, нанотрубки и «аморфный углерод».
Вывод: причина аллотропии углерода – различное
строение кристаллической решетки
20.01.2026
А.Г.Волкова
6
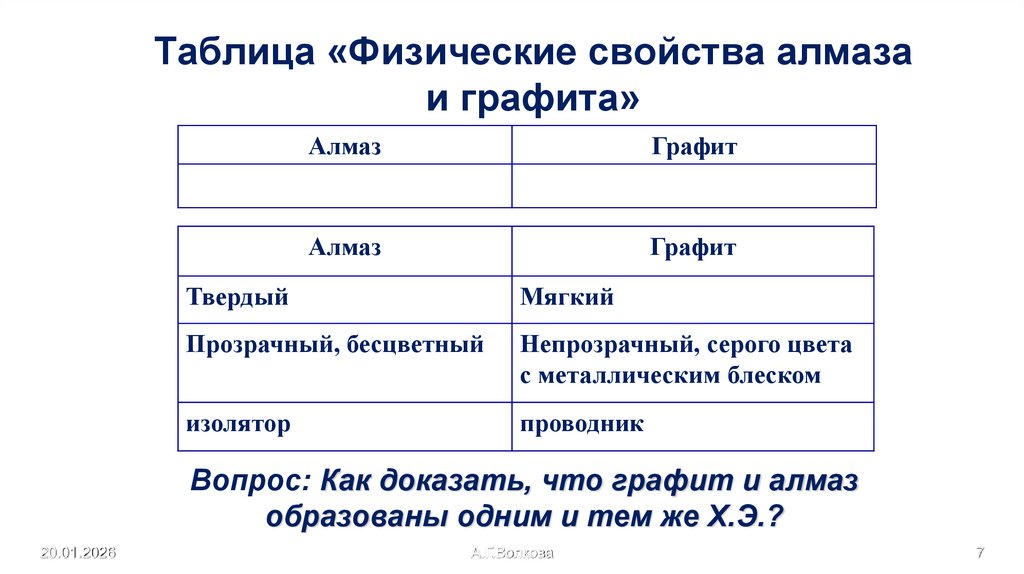
7. Таблица «Физические свойства алмаза и графита»
АлмазГрафит
Алмаз
Графит
Твердый
Мягкий
Прозрачный, бесцветный
Непрозрачный, серого цвета
с металлическим блеском
изолятор
проводник
Вопрос: Как доказать, что графит и алмаз
образованы одним и тем же Х.Э.?
20.01.2026
А.Г.Волкова
7
8. 3б. Адсорбция
Адсорбция – поглощение газообразных илирастворенных веществ поверхностью твердого
вещества
Обусловлена пористостью угля
Обратный процесс – десорбция
Используется для очистки газов и жидкостей от
примесей.
Применяется в быту, медицине, в промышленности,
для защиты дыхательных путей (противогаз)
20.01.2026
А.Г.Волкова
8
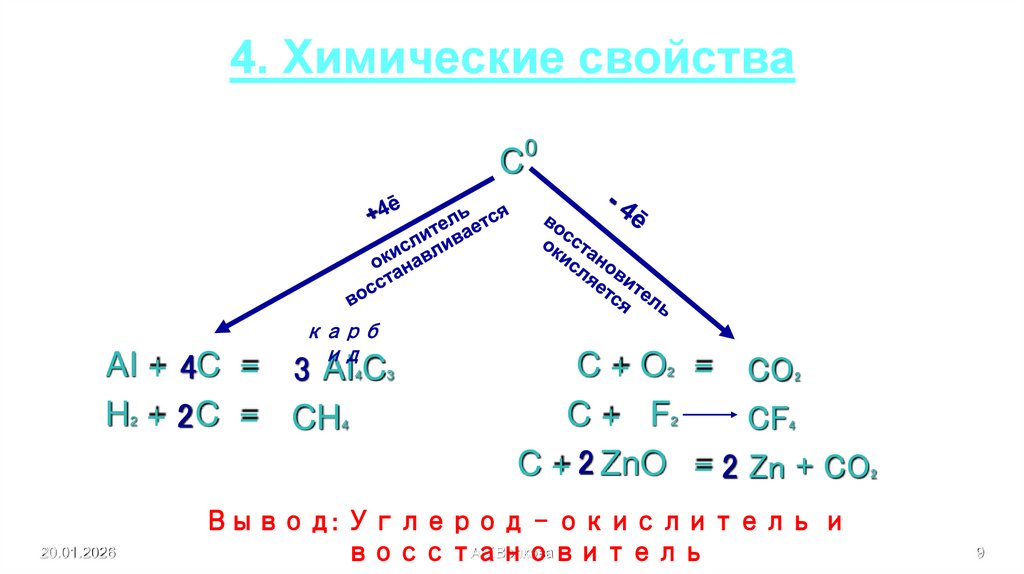
9. 4. Химические свойства
Cкарб
ид
AI + 4C = 3 AI C
H + 2 C = CH
4
2
20.01.2026
4
3
0
C + O = CO
C+ F
CF
C + 2 ZnO = 2 Zn + CO
2
2
2
4
Вывод: Углерод – окислитель и
А.Г.Волкова
восстановитель
2
9
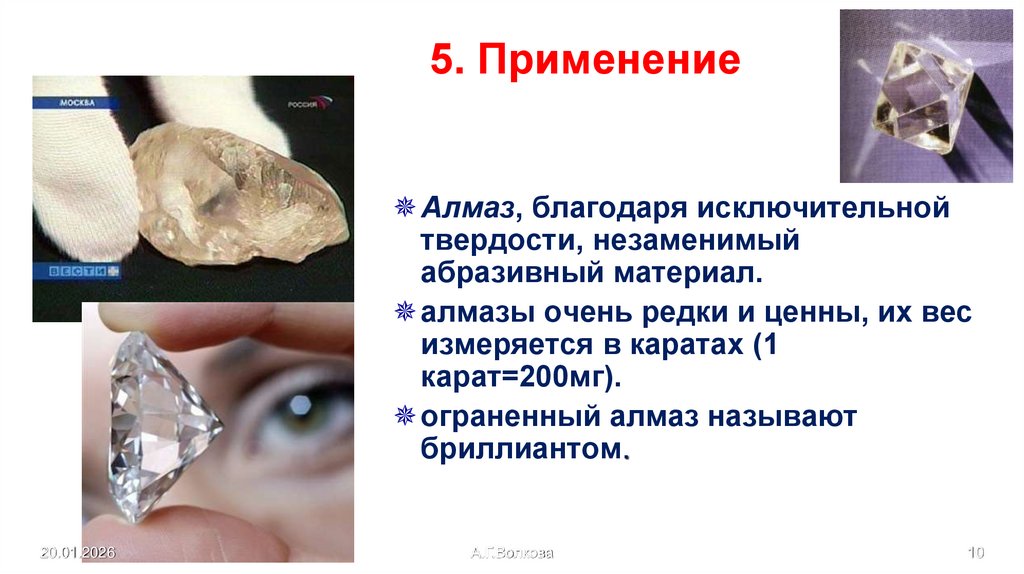
10. 5. Применение
Алмаз, благодаря исключительнойтвердости, незаменимый
абразивный материал.
алмазы очень редки и ценны, их вес
измеряется в каратах (1
карат=200мг).
ограненный алмаз называют
бриллиантом.
20.01.2026
А.Г.Волкова
10
11.
Звезда Св.Андрея
Первозванн
ого
Цветной
алмаз
Орлов
Большая
император
ская
корона
20.01.2026
А.Г.Волкова
11
12.
Графит используется вкарандашной
промышленности.
в качестве смазки при особо
высоких или низких
температурах.
в медицине в виде мазей для
лечения кожных заболеваний
20.01.2026
А.Г.Волкова
12
13. Аморфный углерод
Сажа – используется для изготовления типографской краски,картриджей, резины, косметической туши и т. д.
Кокс –при выплавке чугуна.
Древесный уголь – в качестве топлива, при выплавке цветных
металлов, очистки от примесей.
Карболен (активированный уголь) применяется в фармакологии и
медицине для абсорбции и выведения из организма различных
токсинов.
радиоактивные изотопы углерода — для научных исследований
(радиоуглеродный анализ) в геологии и археологии.
Карбин— в фотоэлементах.
20.01.2026
А.Г.Волкова
13
14. МЕТАН СН4
Углерод в виде ископаемоготоплива: угля и углеводородов
(нефть, природный газ) — один из
важнейших источников энергии
для человечества.
20.01.2026
А.Г.Волкова
14
15. Домашнее задание
п. 20Упр. 8 стр. 109
Где находятся крупнейшие месторождения алмазов
в России и мире?
20.01.2026
А.Г.Волкова
15











 Химия
Химия








