Похожие презентации:
МОЙ_ПР_получ угл газа
1.
Практическая работа«Получение углекислого газа
и изучение его свойств» с.115
2.
В две пробирки налейте по 20 капель дистиллированнойводы и добавьте по 3—4 капли раствора фиолетового
лакмуса. В третью пробирку внесите примерно 20 капель
раствора известковой воды. Установите пробирки в штатив.
Туда же поместите и три пустые пробирки.
3.
HClЧерез
некоторое
время
CaCO3
Лакмус
красный
Лакмус
фиолетовый
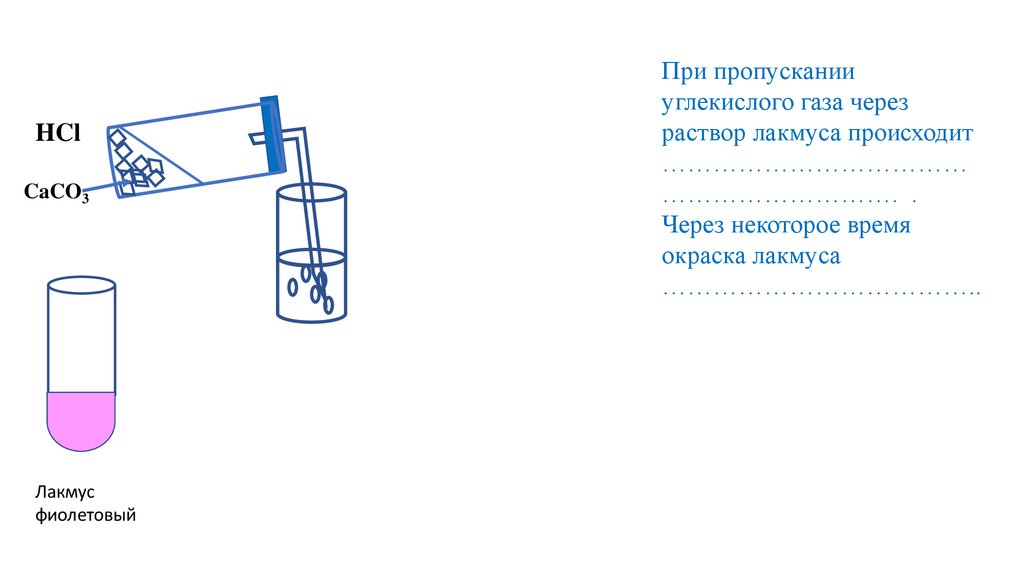
При пропускании
углекислого газа через
раствор лакмуса происходит
………………………………
………………………. .
Через некоторое время
окраска лакмуса
………………………………..
Лакмус
фиолетовый
4.
HClЧерез
некоторое
время
CaCO3
Лакмус
красный
Лакмус
фиолетовый
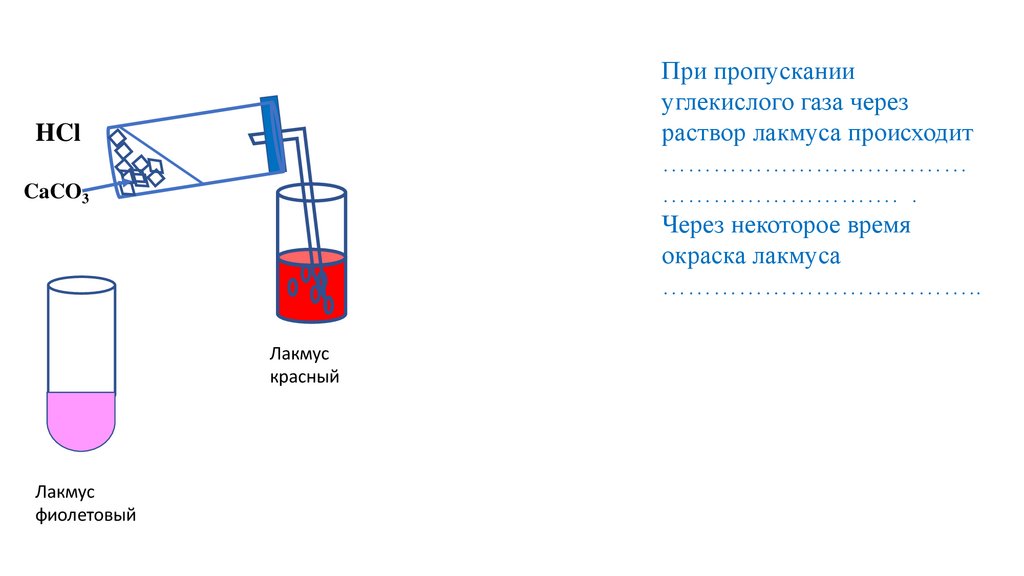
При пропускании
углекислого газа через
раствор лакмуса происходит
………………………………
………………………. .
Через некоторое время
окраска лакмуса
………………………………..
Лакмус
фиолетовый
5.
HClЧерез
некоторое
время
CaCO3
Лакмус
красный
Лакмус
фиолетовый
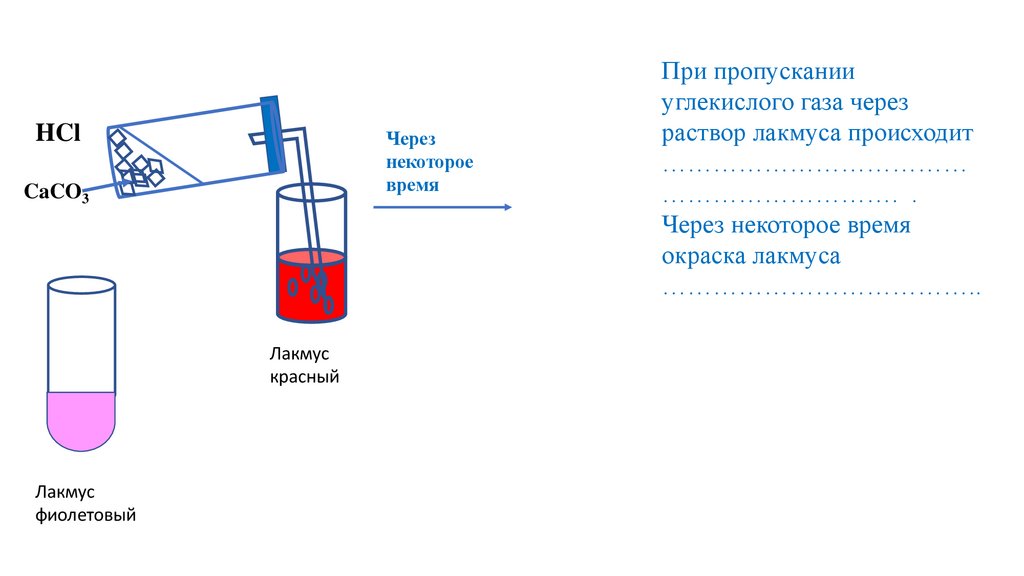
При пропускании
углекислого газа через
раствор лакмуса происходит
………………………………
………………………. .
Через некоторое время
окраска лакмуса
………………………………..
Лакмус
фиолетовый
6.
HClЧерез
некоторое
время
CaCO3
Лакмус
красный
Лакмус
фиолетовый
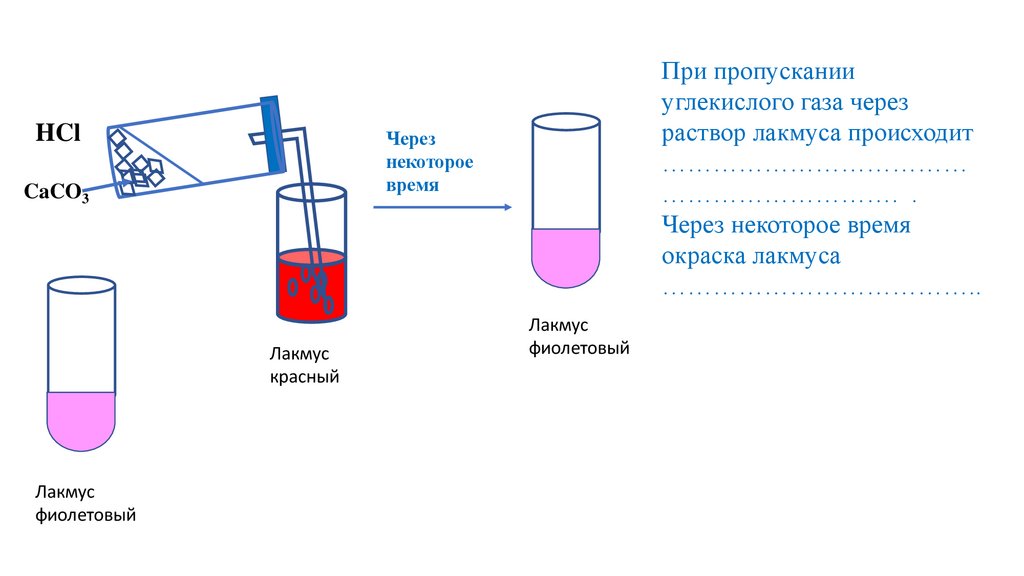
При пропускании
углекислого газа через
раствор лакмуса происходит
………………………………
………………………. .
Через некоторое время
окраска лакмуса
………………………………..
Лакмус
фиолетовый
7.
Промойте конец газоотводной трубки в стакане с водой.После этого конец газоотводной трубки перенесите в
пробирку с известковой водой и пропускайте газ до
помутнения раствора
Продолжайте пропускать газ через помутневший раствор.
Что наблюдаете? Запишите уравнения реакции в
молекулярной и ионной формах.
HCl
CaCO3
8.
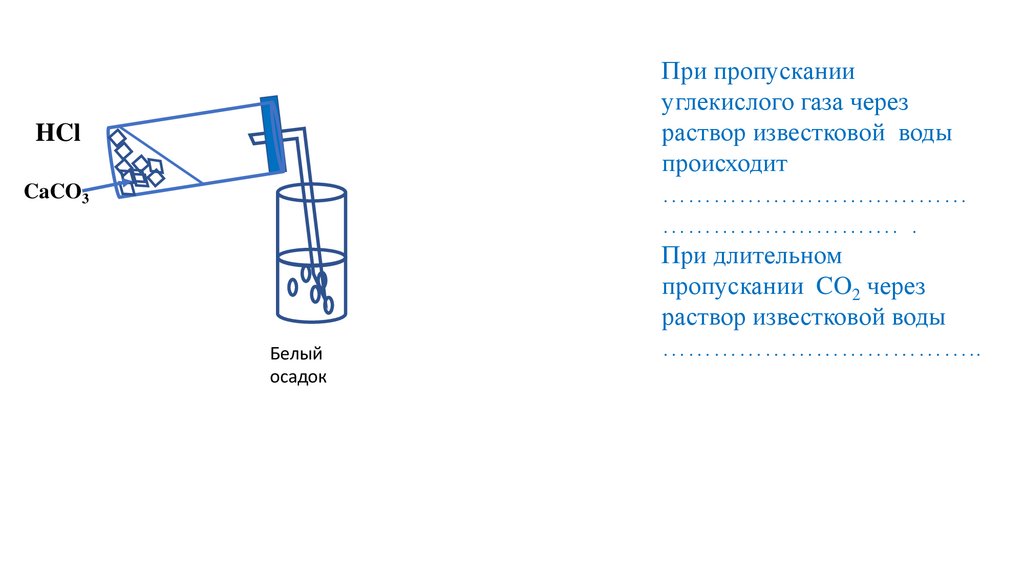
HClCaCO3
Белый
осадок
При пропускании
углекислого газа через
раствор известковой воды
происходит
………………………………
………………………. .
При длительном
пропускании CO2 через
раствор известковой воды
………………………………..
9.
Промойте конец газоотводной трубки в стакане с водой.Перенесите газо-отводную трубку в четвёртую пробирку,
опустив её до дна пробирки. Соберите газ методом вытеснения
воздуха (почему именно этим методом?).
7. Зажгите лучинку и внесите её в пробирку. Что наблюдаете?
Объясните наблюдаемое
HCl
CaCO3
10.
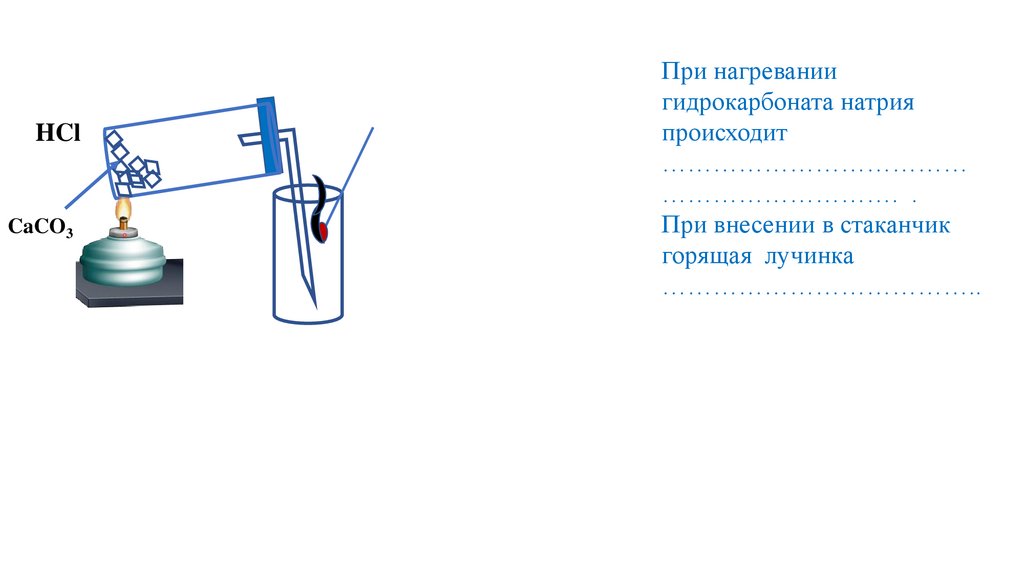
HClCaCO3
При нагревании
гидрокарбоната натрия
происходит
………………………………
………………………. .
При внесении в стаканчик
горящая лучинка
………………………………..
11.
Составление уравненийреакций
12.
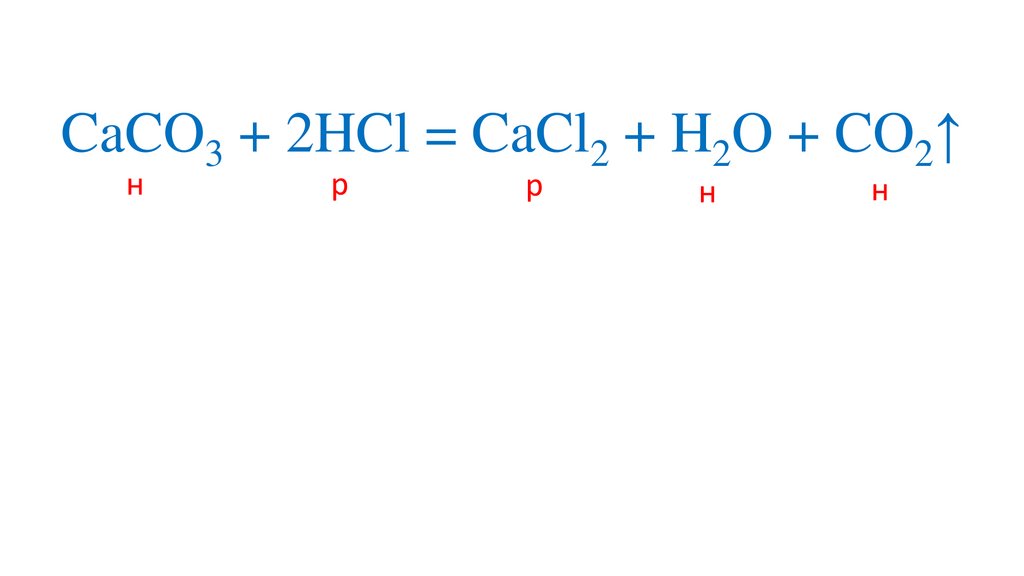
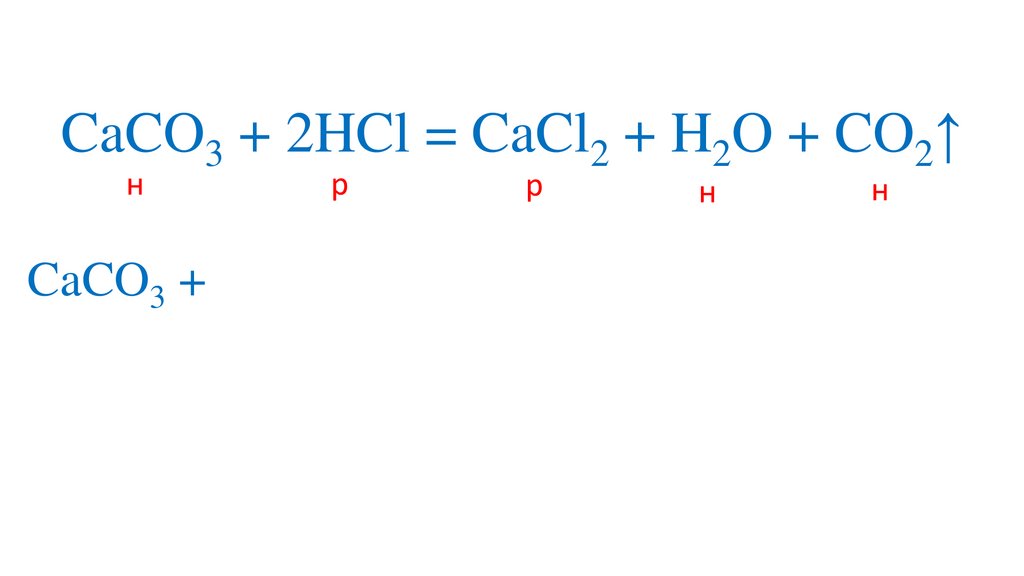
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑13.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑14.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑н
р
р
н
н
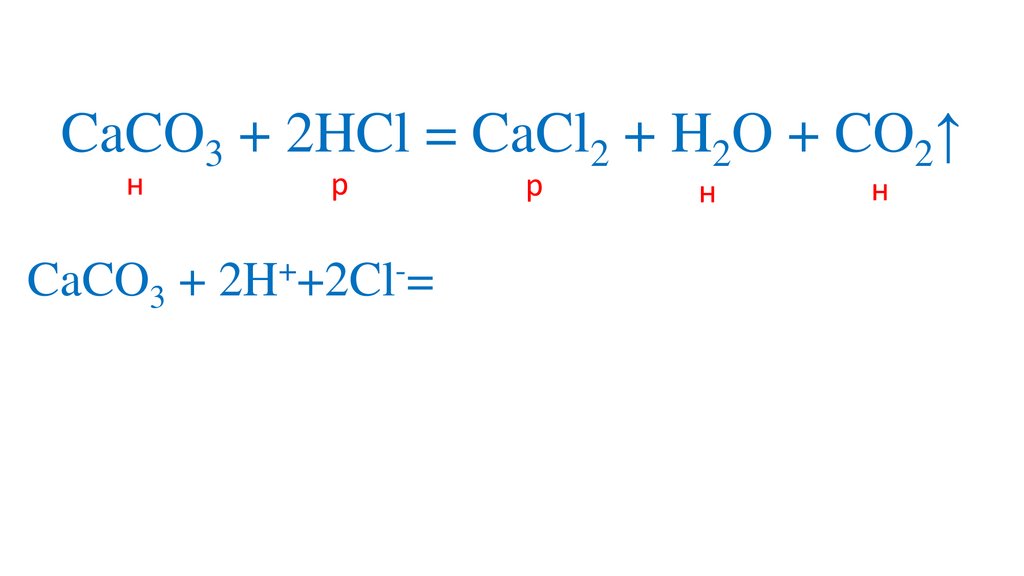
+
2+
CaCO3 + 2H +Cl = Ca +2Cl + H2O + CO2↑
15.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑н
р
р
н
н
+
2+
CaCO3 + 2H +Cl = Ca +2Cl + H2O + CO2↑
16.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑н
р
р
н
н
+
2+
CaCO3 + 2H +2Cl = Ca +2Cl + H2O + CO2↑
17.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑н
р
р
н
н
+
2+
CaCO3 + 2H +2Cl = Ca +2Cl + H2O + CO2↑
18.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑н
р
р
н
н
+
2+
CaCO3 + 2H +2Cl = Ca +2Cl + H2O + CO2↑
19.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑н
р
р
н
н
+
2+
CaCO3 + 2H +2Cl = Ca +2Cl + H2O + CO2↑
20.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑н
р
р
н
н
+
2+
CaCO3 + 2H +2Cl = Ca +2Cl + H2O + CO2↑
+
2+
CaCO3 + 2H = Ca + H2O + CO2↑
21.
CO2 + H2O=H2CO3+
2H2CO3 =2H +CO3 -кислая среда, pH<7
22.
CO2 + H2O=H2CO3+
2H2CO3 =2H +CO3 -кислая среда, pH<7
23.
CO2 + H2O=H2CO3+
2H2CO3 =2H +CO3 -кислая среда, pH<7
24.
CO2 + H2O=H2CO3+
2H2CO3 =2H +CO3 -кислая среда, pH<7
25.
CO2 + H2O=H2CO3+
2H2CO3 =2H +CO3 -кислая среда, pH<7
26.
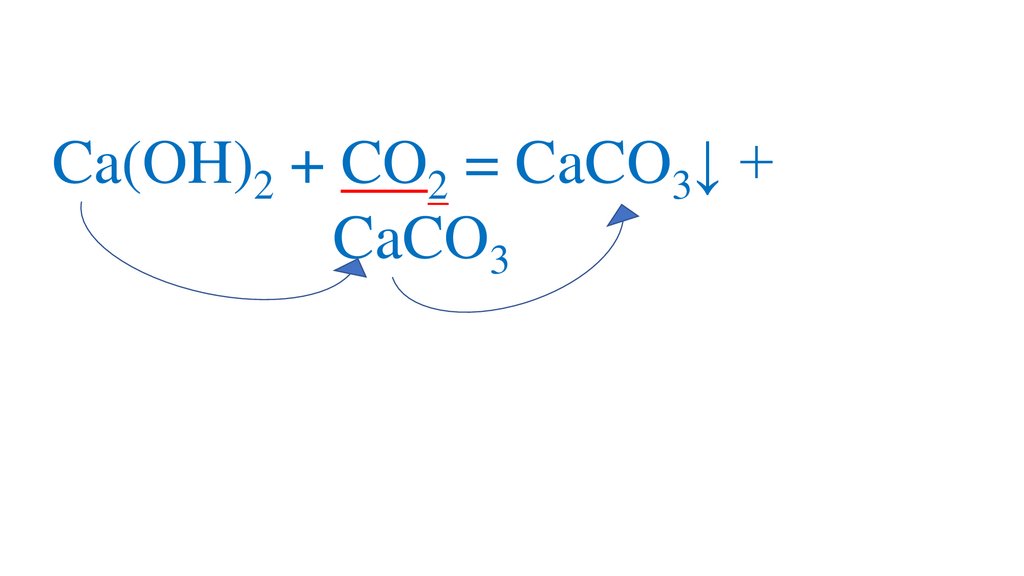
Ca(OH)2 + CO2 = CaCO3↓ + H2OH2CO3
CaCO3↓ + CO2 = Ca(HCO3)2
27.
Ca(OH)2 + CO2 = CaCO3↓ + H2OH2CO3
CaCO3↓ + CO2 = Ca(HCO3)2
28.
Ca(OH)2 + CO2 = CaCO3↓ + H2OH2CO3
CaCO3↓ + CO2 = Ca(HCO3)2
29.
Ca(OH)2 + CO2 = CaCO3↓ + H2OH2CO3
CaCO3↓ + CO2 = Ca(HCO3)2
30.
Ca(OH)2 + CO2 = CaCO3↓ + H2OCaCO3
CaCO3↓ + CO2 = Ca(HCO3)2
31.
Ca(OH)2 + CO2 = CaCO3↓ + H2OH2CO3
CaCO3↓ + CO2 = Ca(HCO3)2
32.
Ca(OH)2 + CO2 = CaCO3↓ + H2OH2CO3
CaCO3↓ + CO2 = Ca(HCO3)2
33.
Ca(OH)2 + CO2 = CaCO3↓ + 2H2OH2CO3
CaCO3↓ + CO2 = Ca(HCO3)2
34.
Ca(OH)2 + CO2 = CaCO3↓ + 2H2OH2CO3
CaCO3↓ + CO2 = Ca(HCO3)2
35.
При длительном пропускании углекислогогаза через известковую воду осадок исчезает
36.
CaCO3↓ + CO2+H2O = Ca(HCO3)2Именно наличием гидрокарбонатов кальция и
магния в природной воде и объясняется её
временная жёсткость.





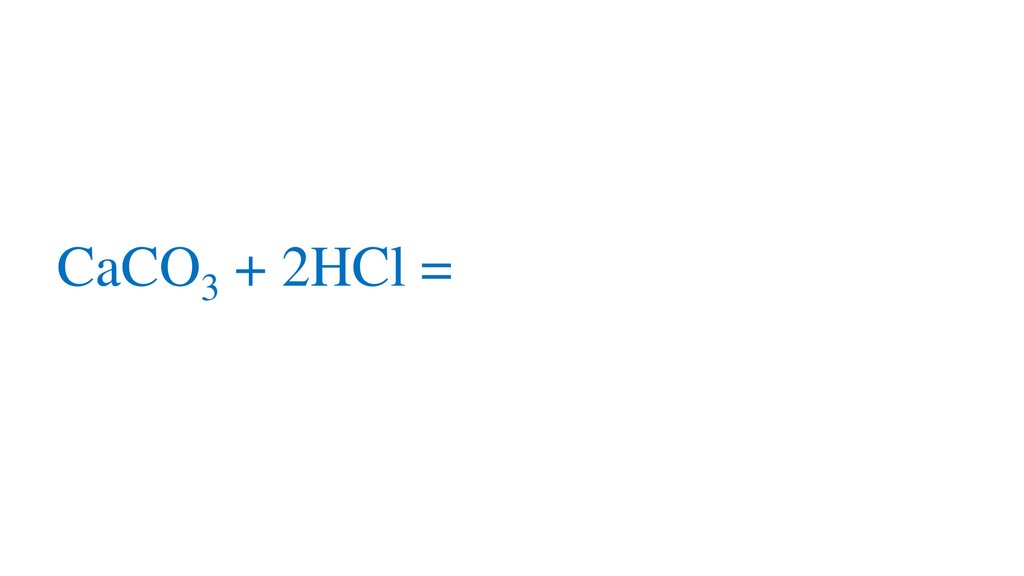
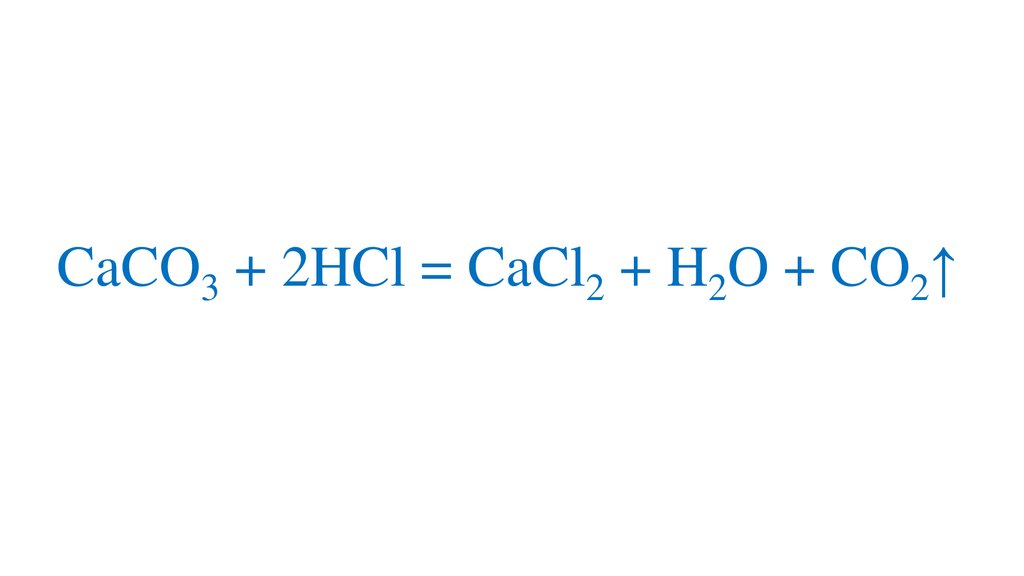
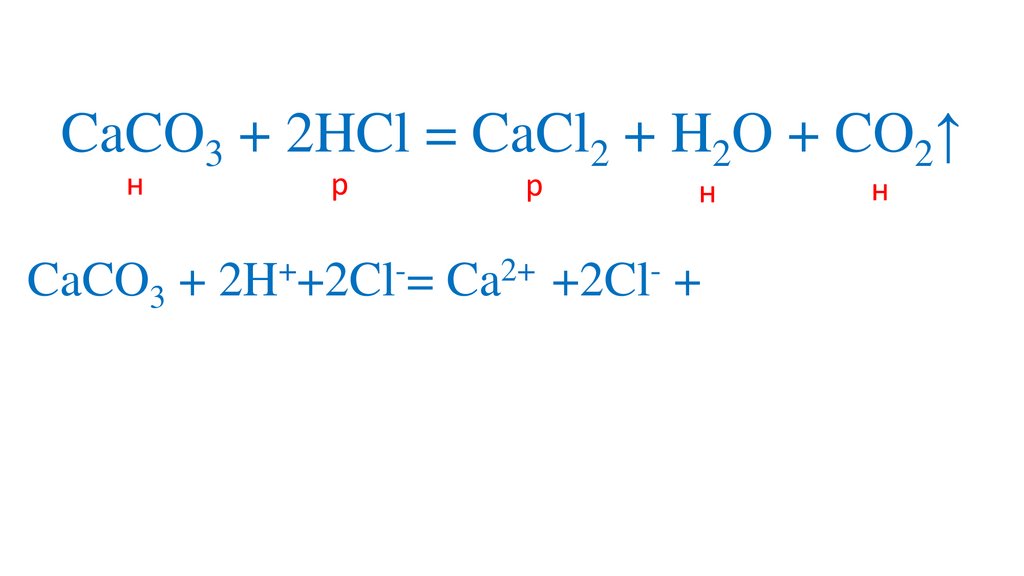
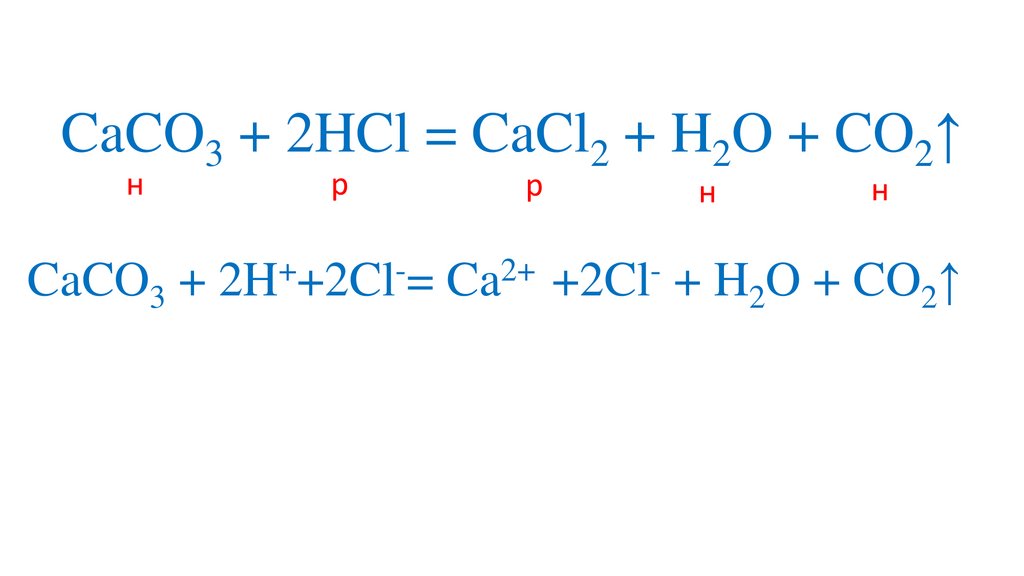
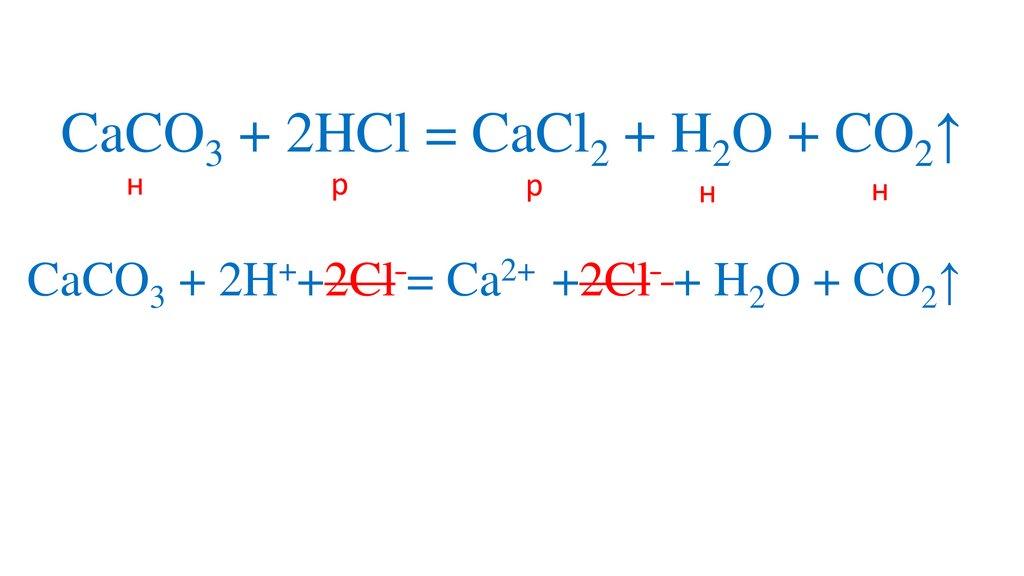
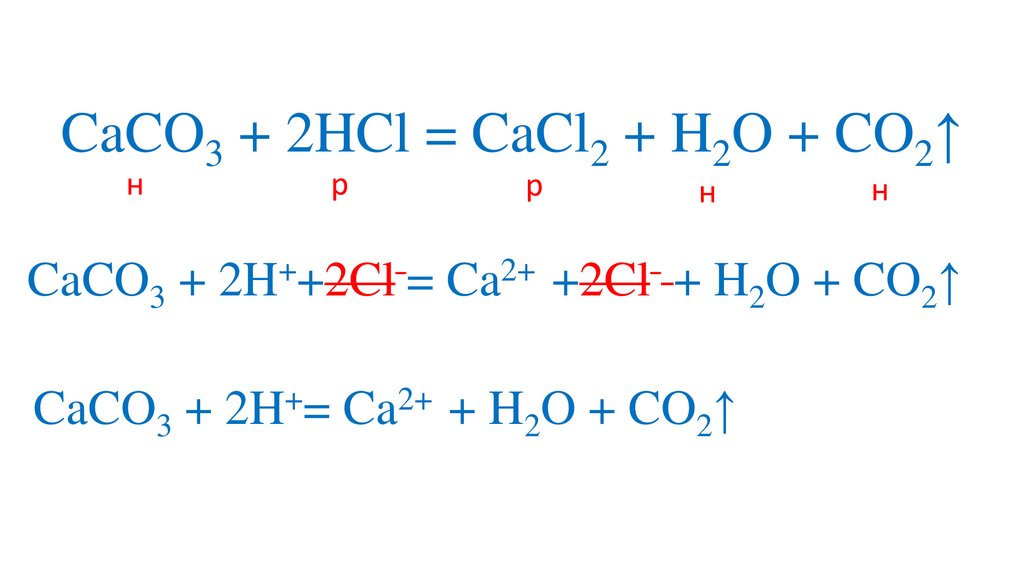
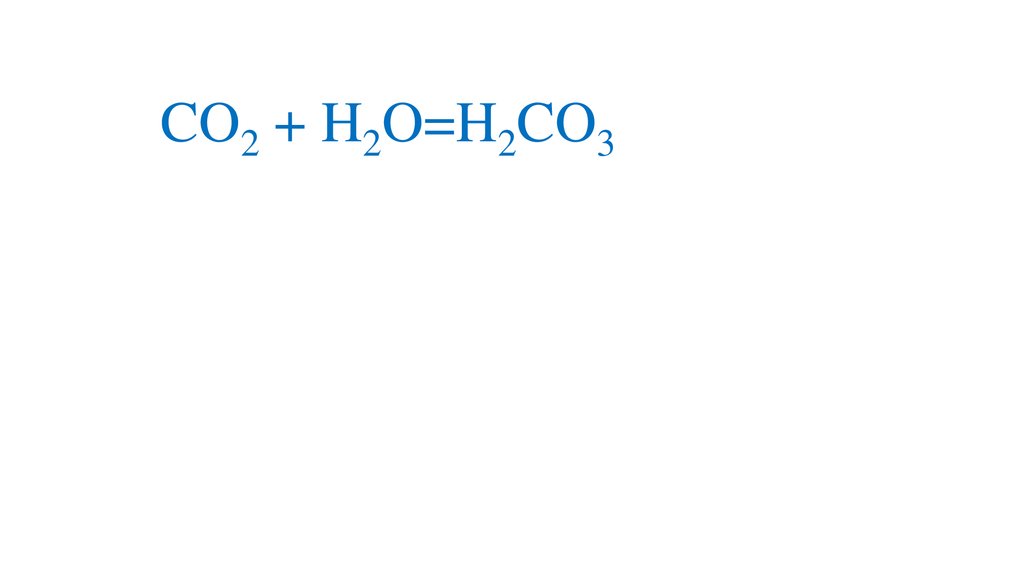
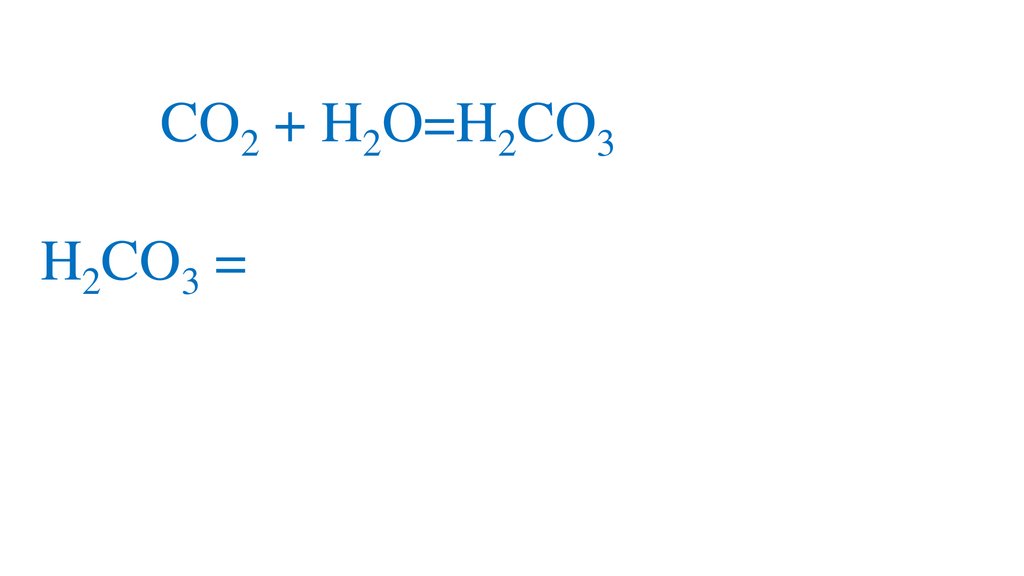
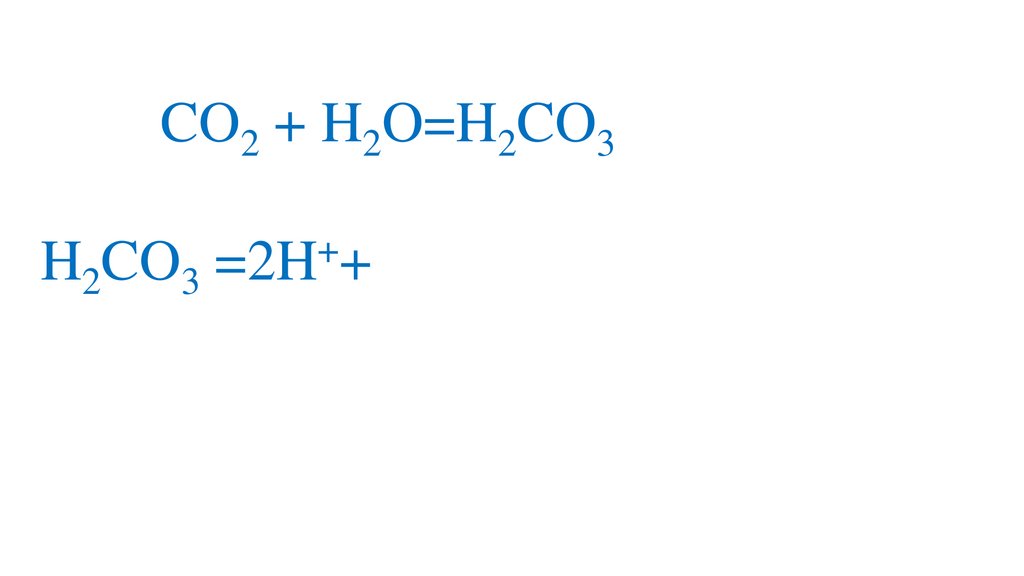
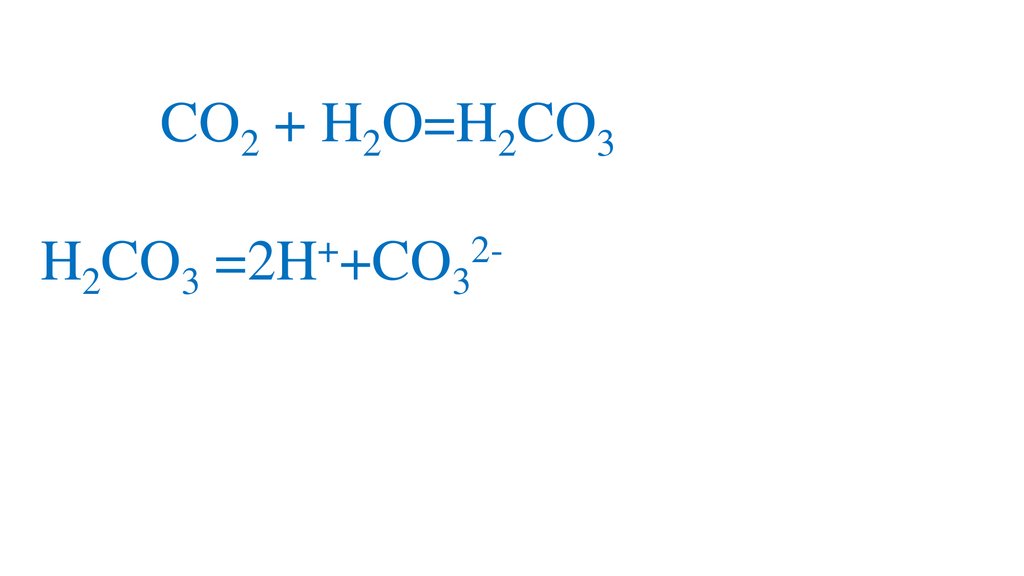
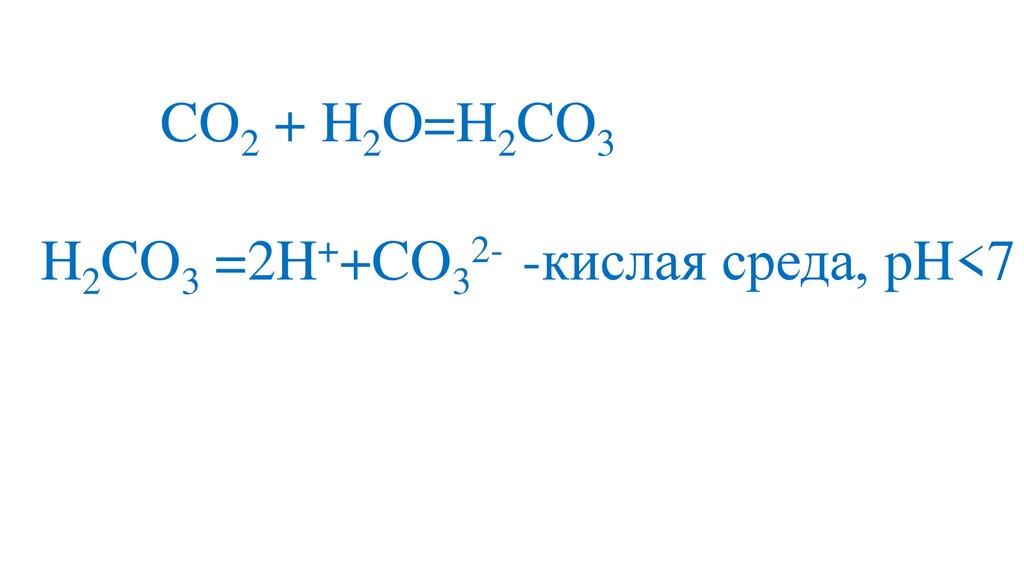
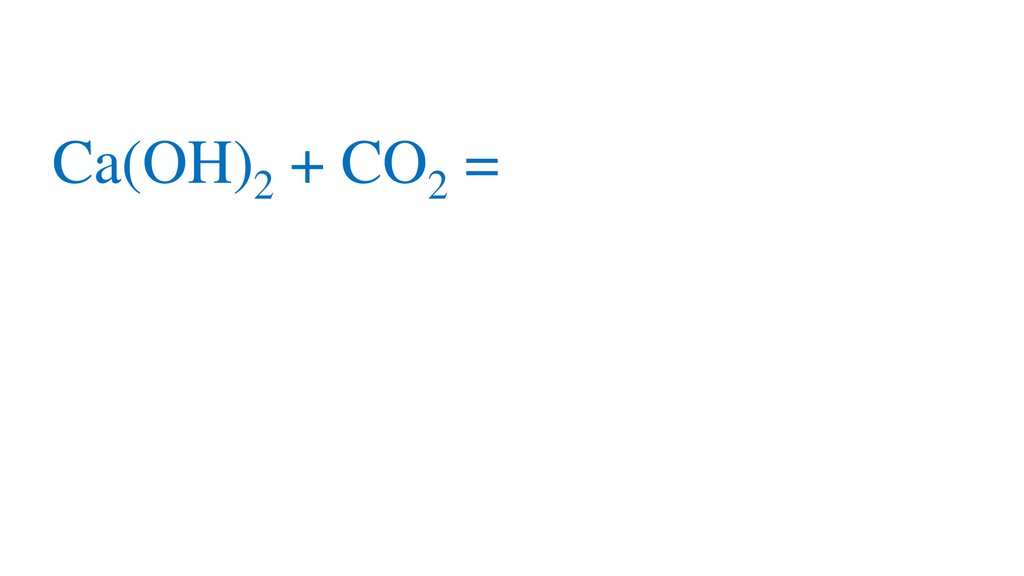
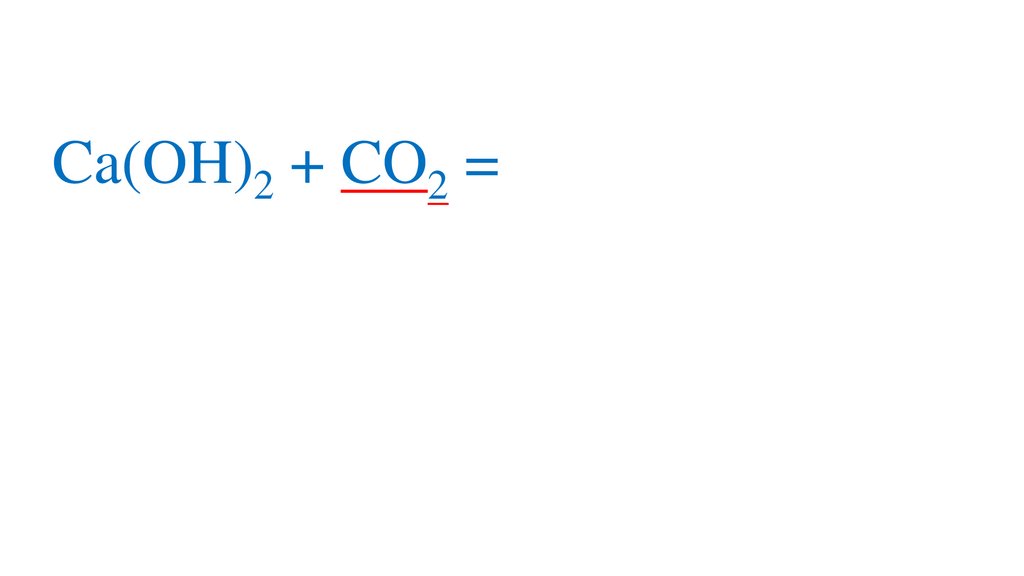
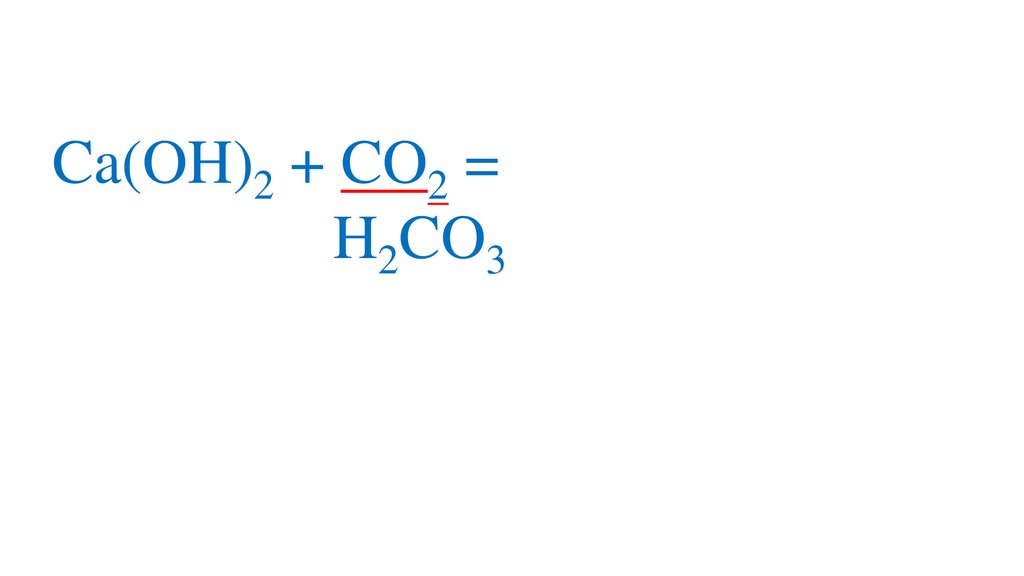
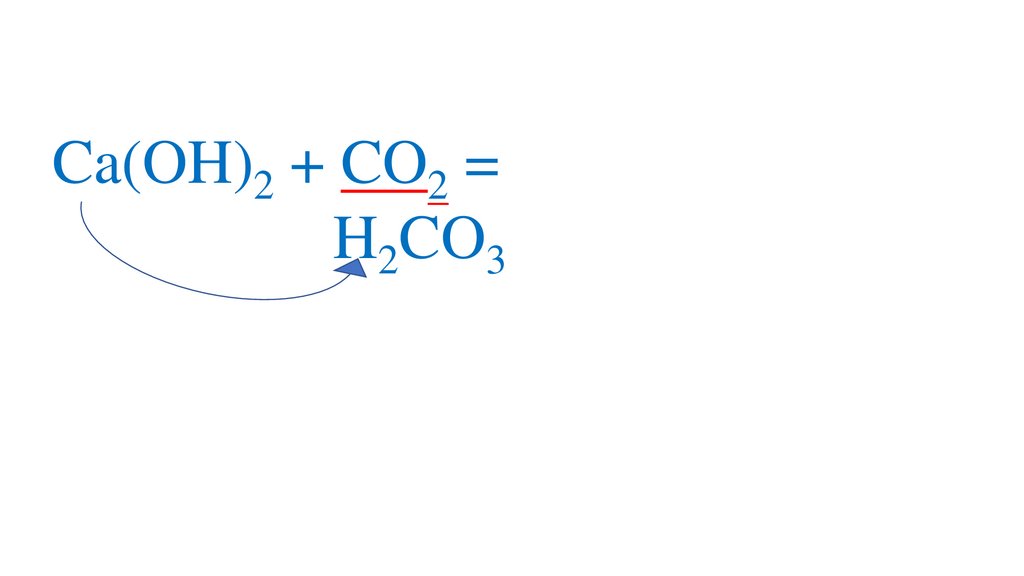
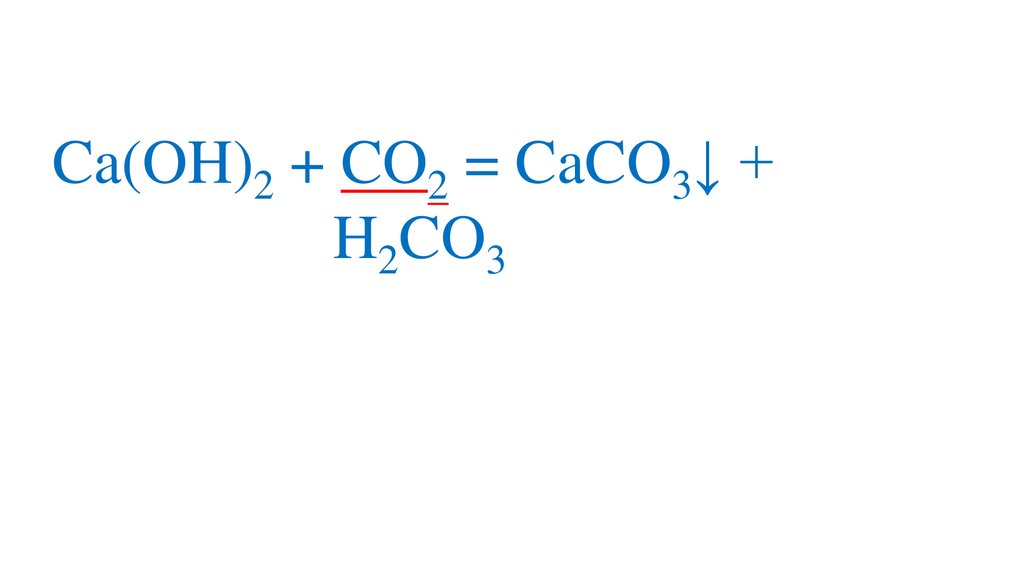
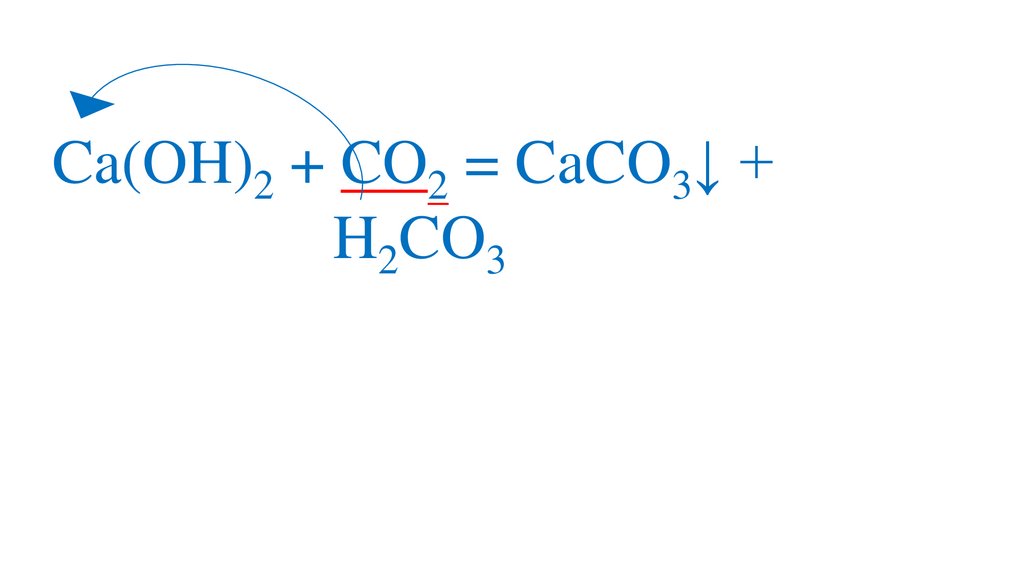
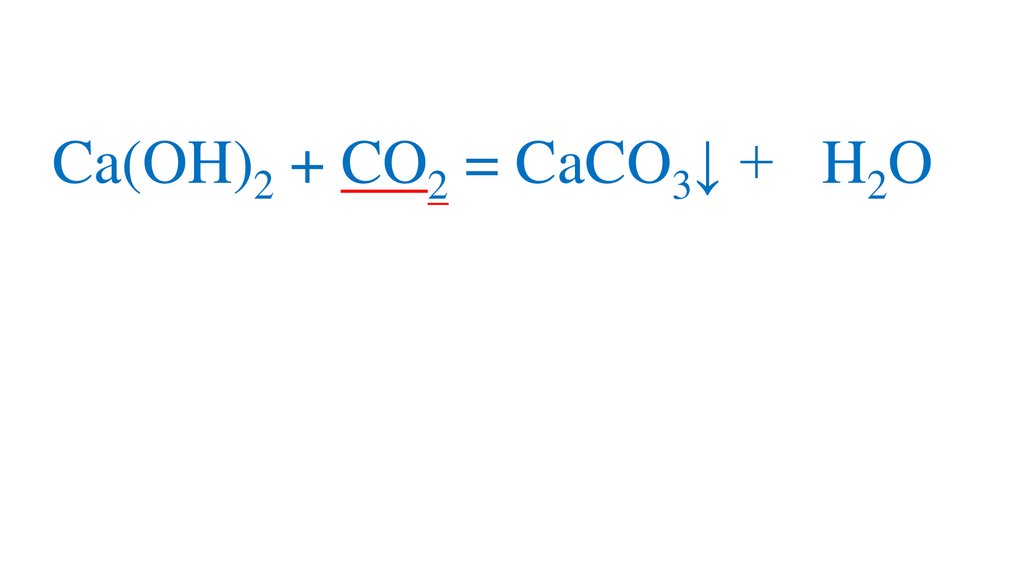
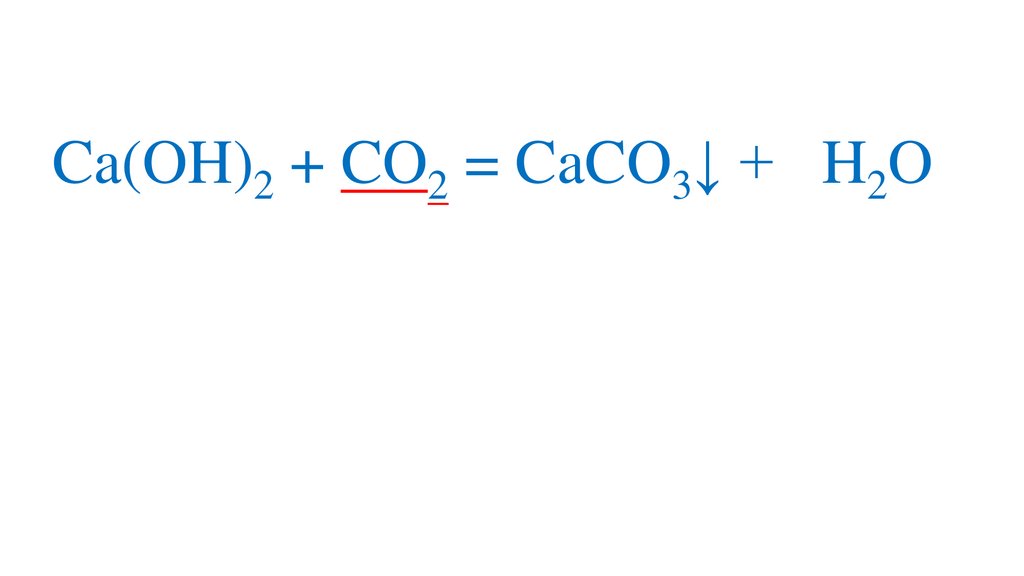

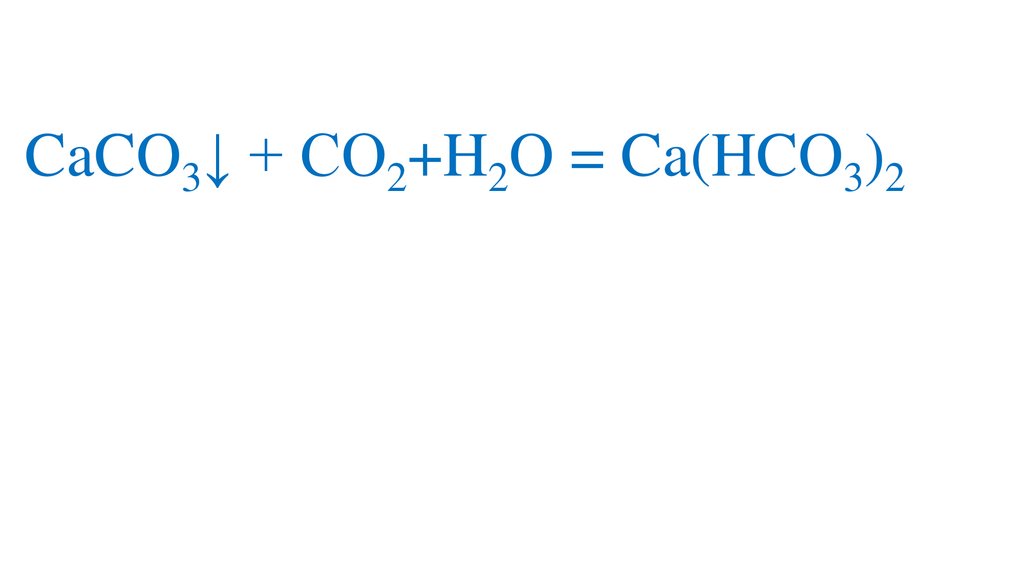
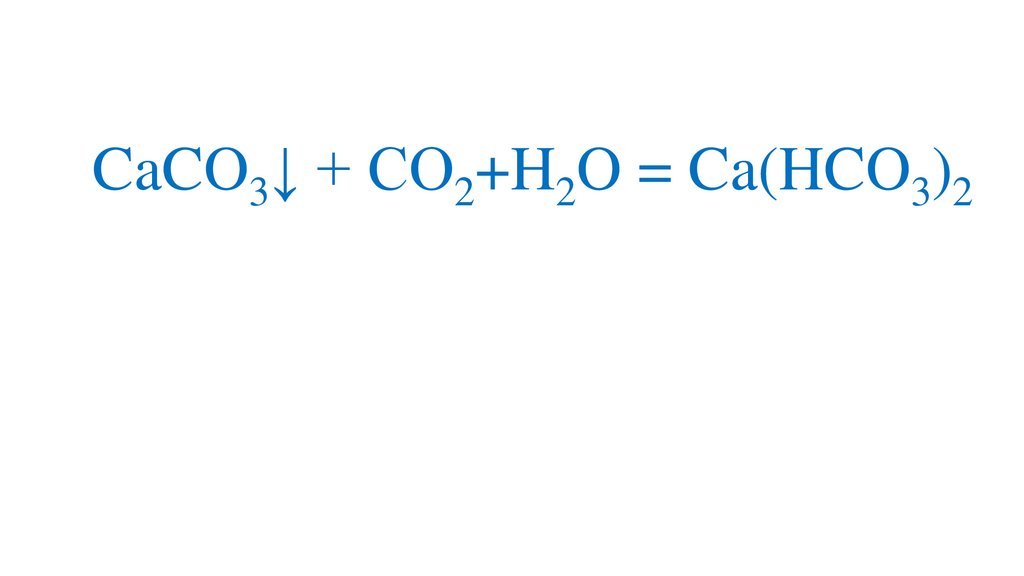
 Химия
Химия








