Похожие презентации:
96df28f14e6243368d74e8c1435125c4
1. Угадай-ка
-Сложное вещество при диссоциациикоторого образуются атомы водорода
и кислотный остаток.
-Это вещество известно алхимикам с 10
века, как «купоросное или серное
масло»
-Это тяжелая маслянистая жидкость.
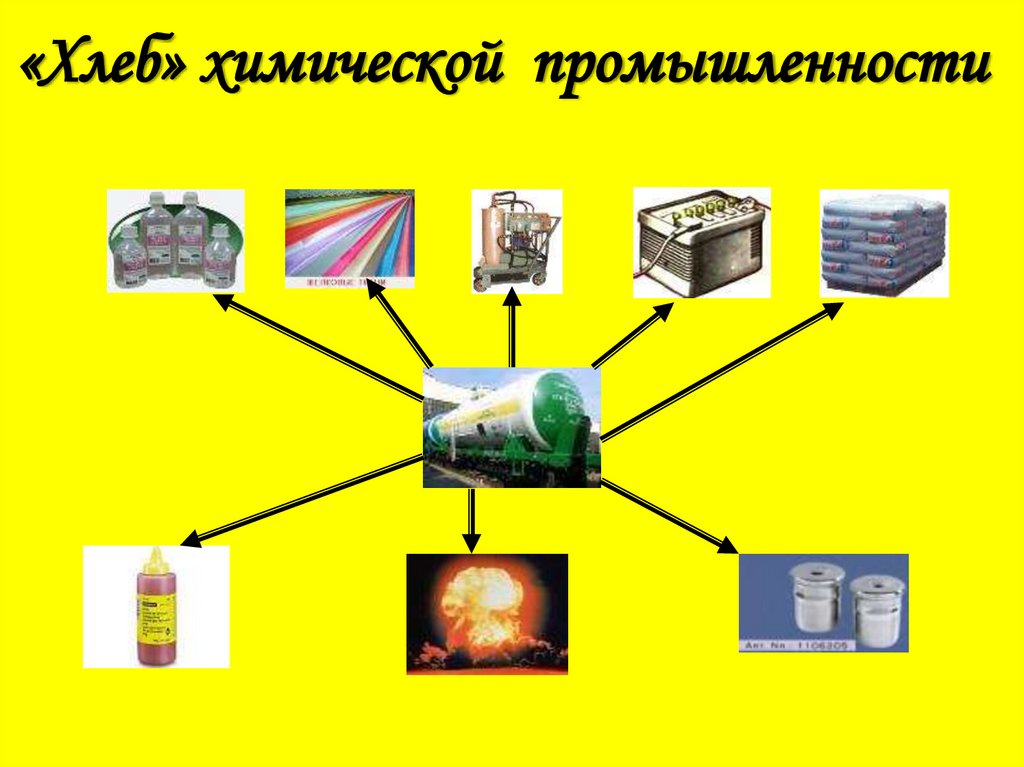
-Является «хлебом» химической
промышленности.
-Это кислородосодержащее
соединение элемента с порядковым
номером 16.
2. Группа хранения
Vll группаФизиологически
активное
вещество. Яд
3.
4. «Хлеб» химической промышленности
5. «Химическое королевство».
В одном химическомкоролевстве жила
волшебница и
звали ее Серной
кислотой.
6. «Физические свойства»
С виду былаона уж и не
так плоха:
бесцветная
жидкость
вязкая как
масло, без
запаха.
7. Физические свойства серной кислоты.
*безводная серная кислотаэто бесцветная маслянистая жидкость без запаха.
*смешивается с водой в
любых отношениях.
*t пл. =10,30 С,t кип= 2960С,
ρ=1, 84 г/см3.
*гигроскопична-обладает
сильным водоотнимающим действием.
8.
«Растворение кислоты»Серная кислота хотела
быть заметной и поэтому
решила отправиться в
путешествие.
Она шла уже пять
часов, ей очень захотелось
пить.
9. «Растворение кислоты»
И вдруг она увиделаколодец. «Вода!» воскликнула
Кислота и,
подбежав к
колодцу,
прикоснулась к
воде.
Вода страшно
зашипела
10.
…. С криком испуганнаяКислота бросилась прочь.
Конечно же, что при
смешивании серной кислоты с
водой выделяется большое
количество теплоты она не
знала.
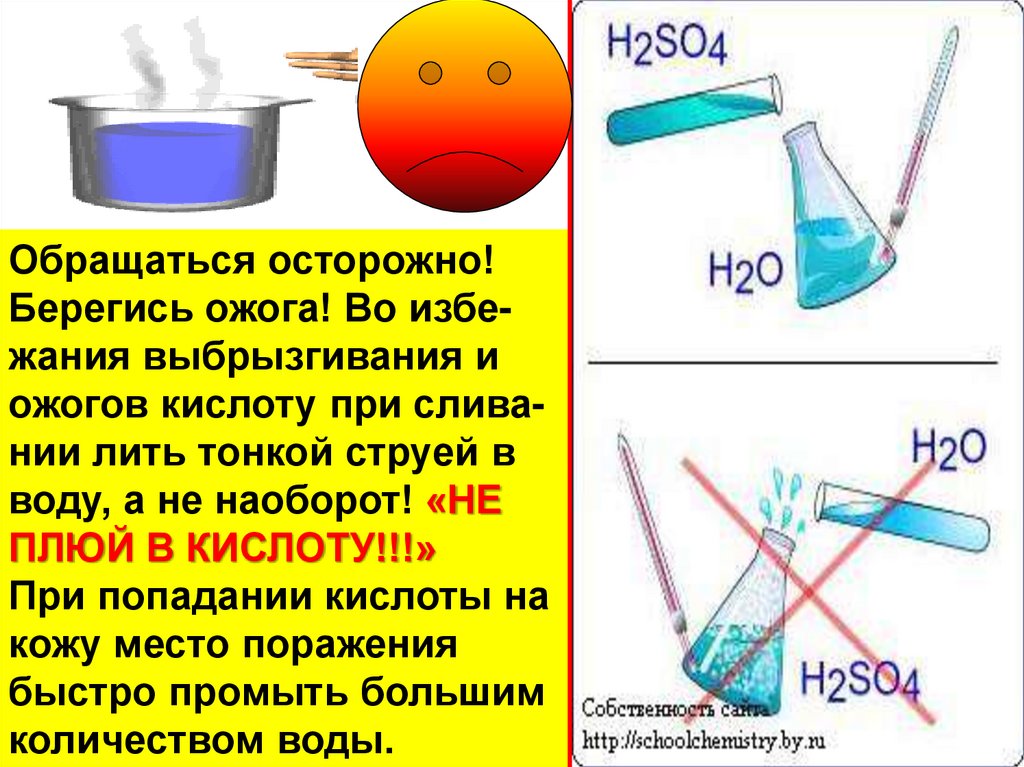
11. Техника безопасности при работе с серной кислотой
• H2SO4очень едкое вещество –при попадании на кожу вызывает сильнейшие ожоги.
• ПРИ СМЕШИВАНИИ H2SO4 С
ВОДОЙ ВЫДЕЛЯЕТСЯ БОЛЬШОЕ
КОЛИЧЕСТВО ТЕПЛОТЫ.
• ПРИ РАСТВОРЕНИИ H2SO4
НУЖНО ВЛИТЬ ЕЕ ТОНКОЙ
СТРУЁЙ В ВОДУ И ПЕРЕМЕШИВАТЬ.
• ЕСЛИ ВОДУ ВЛИТЬ В СЕРНУЮ
КИСЛОТУ, ТО ВОДА, НЕ УСПЕВ
СМЕШАТЬСЯ С КИСЛОТОЙ ,
МОЖЕТ ЗАКИПЕТЬ И ВЫБРОСИТЬ
БРЫЗГИ НА ЛИЦО И РУКИ.
11
12.
Обращаться осторожно!Берегись ожога! Во избежания выбрызгивания и
ожогов кислоту при сливании лить тонкой струей в
воду, а не наоборот! «НЕ
ПЛЮЙ В КИСЛОТУ!!!»
При попадании кислоты на
кожу место поражения
быстро промыть большим
количеством воды.
12
13.
«Если вода соприкасается ссерной кислотой, то вода, не
успев смешаться с ней, может
закипеть и выбросить брызги
серной кислоты» Эта запись
появилась в дневнике молодой
путешественницы, а затем вошла
в учебники.
Не плюй в
кислоту!!!
14.
Так Кислота неутолила свою
жажду, она
увидела
раскидистое
дерево, решила
прилечь и
отдохнуть в тени.
15.
Но и это у нее неполучилось. Как
только серная
Кислота
дотронулась до
дерева, оно стало
обугливаться. Не
зная причины этого,
испуганная Кислота
убежала прочь.
16. «Ювелирный магазин»
Вскоре она пришла вгород и решила
зайти в магазин. Им
оказался
ювелирный.
Кислота увидела
множество
прекрасных колец.
17.
Попросив у продавцазолотое кольцо, она
надела его на свой
длинный, красивый
палец. Кислоте
понравилось кольцо, и
она его купила.
18. «Последние слова»
Выйдя из города, «Последние слова»Кислота отправилась домой. В
пути её не оставляли мысли: почему же вода и дерево вели себя так
странно при соприкосновении с
ней, а с этой золотой вещицей ничего не произошло?
19.
«Да всё потому, что золото всерной кислоте не окисляется.
Золото- благородный металл».
Это были последние слова,
записанные Кислотой в своём
дневнике.
20.
Способы полученияа)в лаборатории
SO3 + H2O = H2SO4
б)в промышленности
контактным способом по
схеме:FeS2 1стадия SO2 2стадия SO3
3стадия
H2SO4 ×SO3 (олеум)
21.
обжиг серногоколчедана FeS2 +O2 = Fe2O3
+SO2 (ОВР) (5клеток) (
)
каталитическое
окисление сернистого газа
SO2 + O2
V2O5
(ОВР) (5клеток) (
SO3 + Q
)
22.
Растворение SO3 вразбавленной H2SO4
H2SO4 + SO3 = H2SO4
образуется безводная серная
кислота, в которой растворяется
SO3 и образуется смесь,
которая называется
= H2SO4 ×SO3
23.
24. Раствор H2SO4 взаимодействует с Ме , стоящими в ряду активности до водорода.
1)Ag + H2SO4 # т.к. серебростоит в ряду активности
после водорода
2)2Al0 +3H+12S+6O-24 =
Al+32(S+6O-24)3 +3H02
0
3+
Al - 3ē = Al
ок-ие, в-ль.
2H+1 +2ē =H20
в-ие, ок-ль.
0
+
3+
0
Al + H = Al + H2
24
25.
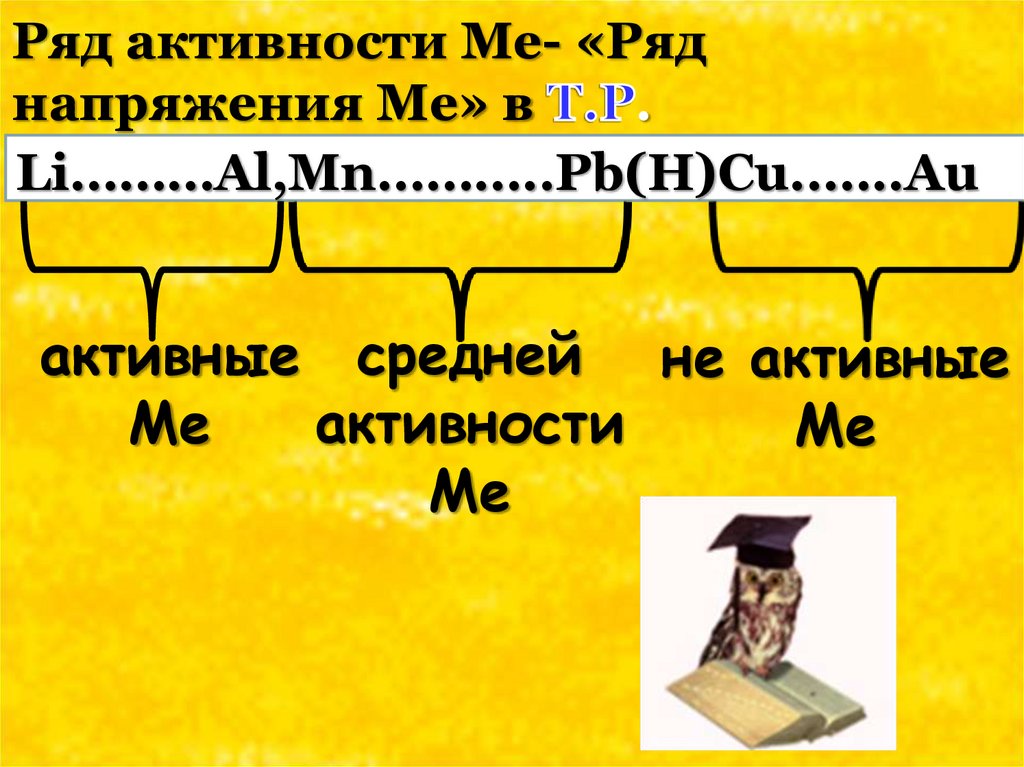
Ряд активности Ме- «Ряднапряжения Ме» в
.
Li………Al,Mn………..Pb(H)Cu..…..Au
активные средней не активные
активности
Ме
Ме
Ме
26.
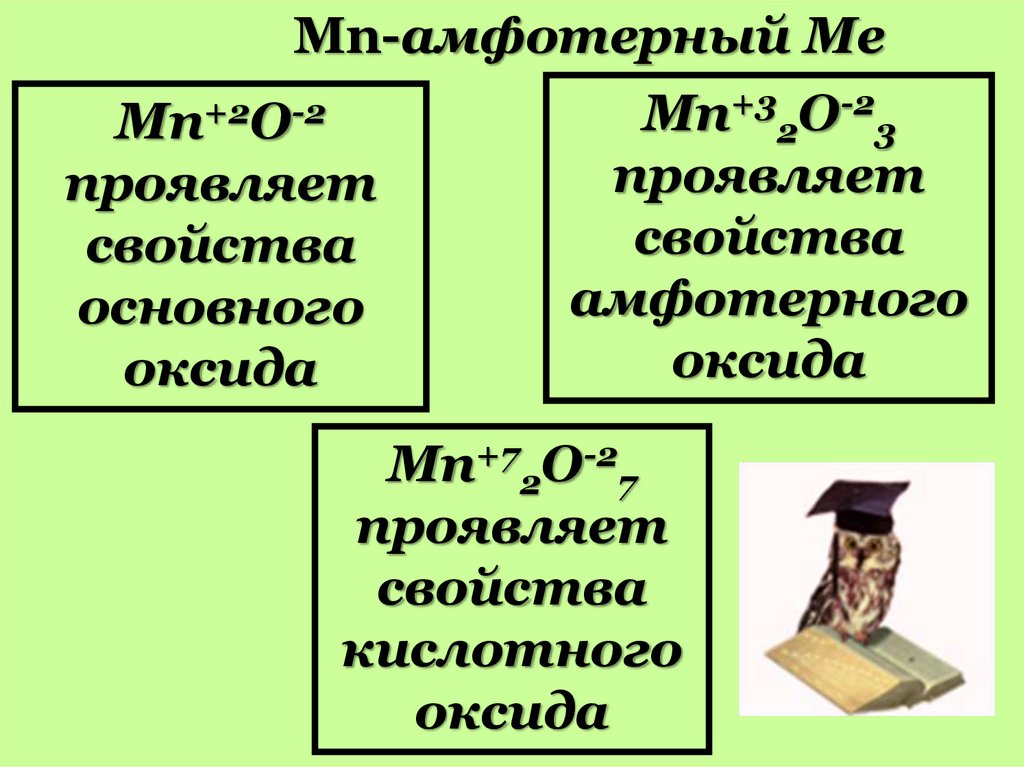
Mn-амфотерный Ме+3 O-2
+2
-2
Mn
Mn O
2
3
проявляет
проявляет
свойства
свойства
амфотерного
основного
оксида
оксида
Mn+72O-27
проявляет
свойства
кислотного
оксида
27. Раствор серной кислоты взаимодействует с основными и амфотерными оксидами.
амфотерный (основной )оксид
МnO + H2SO4 = MnSO4 + H2O
мфотерный(кислотный)
оксид
Mn2O7 + H2SO4 # т.к. Mn2O7
28. H2SO4 взаимодействует с основаниями и амфотерными гидроксидами.
[p][p]
[p]
(М) 2КOН +H2SO4 =К2SO4+
[-]
+ 2H2O
(И.П.)2K+ +2OH- +2H++SO42-=
+
2=2K +SO4 + 2H2O
+
(И.С.) 2ОН + 2H = 2H2O
28
29.
Реакция при недостаткещёлочи :
(М) КOН + H2SO4=КНSO4+
Н2O образуется гидросульфат калия(кислая соль)
(И.П.) К+ +OН-+ 2H++ SO42- =
= К++НSO4-+H2O
+
2(И.С.)OН + 2H + SO4 =НSO4
+H2O
30. ☺ Серная кислота взаимодей-ствует с солями, если образуется газ или осадок.↓
Серная кислота взаимодействует с солями, еслиобразуется газ или осадок.↓
(М)FeS +H2SO4=FeSO4+H2S
сульфид Fe
(И.П.) FeS + 2H+ =Fe2+ +H2S
Mg(NO3)2 + H2SO4 #
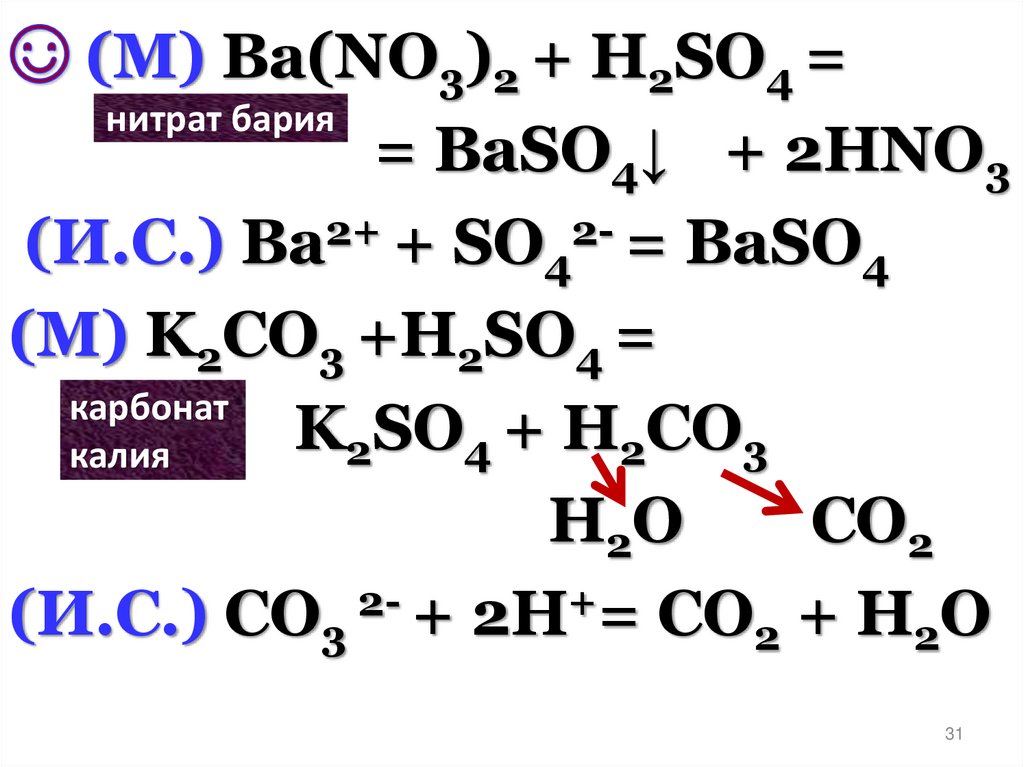
31.
(М) Ba(NO3)2 + H2SO4 =нитрат бария
= BaSO4↓ + 2HNO3
(И.С.) Ba2+ + SO42- = BaSO4
(М) K2CO3 +H2SO4 =
карбонат
K
SO
+
Н
СО
2
4
2
3
калия
H2O
CO2
(И.С.) CO3 2- + 2H+= CO2 + H2O
31
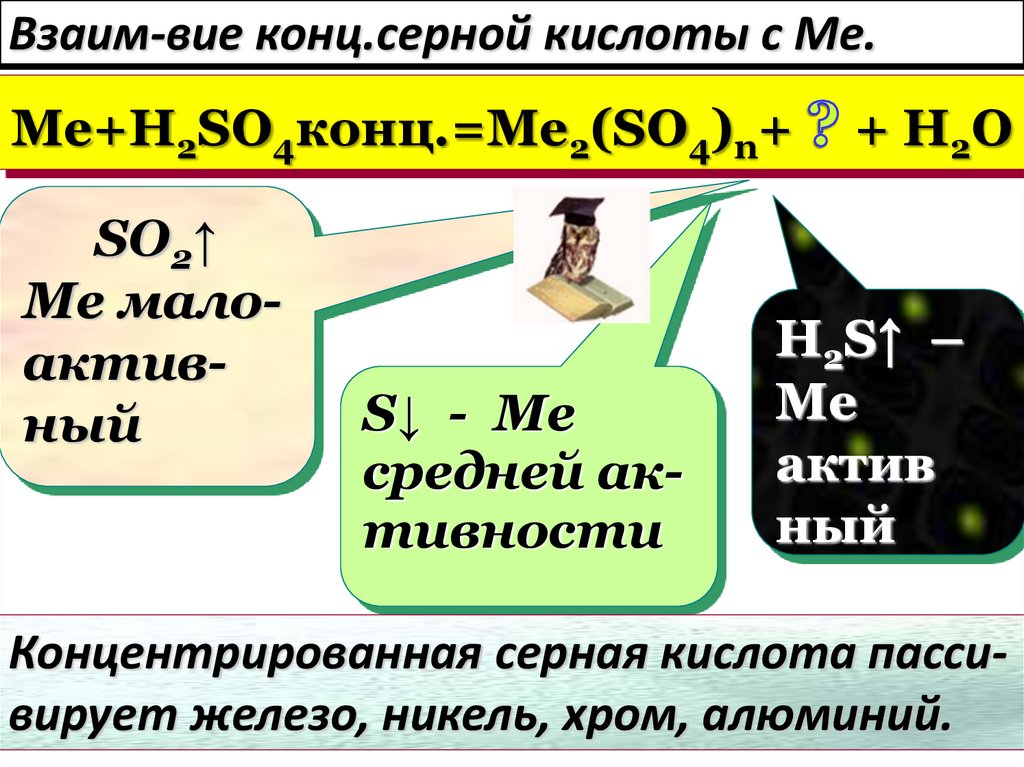
32. Взаим-вие конц.серной кислоты с Ме.
Me+H2SO4конц.=Me2(SO4)n+SO2↑
Ме малоактивный
S↓ - Ме
средней активности
+ H2O
H2S↑ –
Ме
актив
ный
Концентрированная серная кислота пассивирует железо, никель, хром, алюминий.
33. уравнение реакции меди с конц. серной кислотой, испо-льзуя метод э.б., расставить коэффициенты
уравнение реакции меди сконц. серной кислотой, используя метод э.б., расставить
коэффициенты
Cu+2H2SO4конц=CuSO4+SO2↑+
2H2O
Cu0-2e=Cu2+ ок-ние, восс-ль
S+6 +2e= S+4
восс-ние, ок-ль
33
34.
Иa) H2SO4(конц.) + S = SO2 + H2O
Т
(ОВР)
О
б) H2SO4(конц.) + Р= Н3РО4 +
Г
О
+SO2 + H2O (ОВР)
||
в) H2SO4(конц.) + С = СО2 +
45
+SO2 + H2O (ОВР)
б
г) H2SO4(конц.) + Н2S = S + SO2 +
H2O (ОВР)
35.
Обжиг серного колчедана4Fe+2S2-1 +11O20=
2Fe2+3O3-2 +8S+4O-22 (ОВР)
Fe+2 -1ē = Fe+3 -11ē 4 ок-ние
-1
+4
восс-ли
2S -10ē =2S
O20 +4ē =2O-2
+4ē 11 восс-ние
окис-ль
35
36.
ДОМА: к 27.01.подготовиться к Пр.р.
на стр 86
под номерами 1,3,4,6
В рабочей тетради
составить уравнения
реакций.
36
37.
Вулкан Малый СемячикВулканический хребет длиной
около 3 км., на гребне которо
го имеются три кратера. В
южном (кратер Троицкого) на
глубине 170м. находится необычное кислое озеро.Температура этого непрозрачного
озера колеблется от +270С до
+420С, а уровень минерализации соответствует раствору
серной и соляной кислот сред
ней концентрации. Поражают
размеры озера: ширина около
полукилометра, а глубина –до
140м.Существуютпредположения,
что кислотное озеро возникло
сравнительно недавно в результате
извержения вулкана, произошедшего
незаметно для людей.
Кислотные озера































 Химия
Химия








