Похожие презентации:
1 ОВР презентация
1.
Общая и неорганическая химияРаздел: Окислительновосстановительные реакции.
Электрохимические процессы
Тема: Окислительновосстановительные реакции (ОВР)
2.
3.
4.
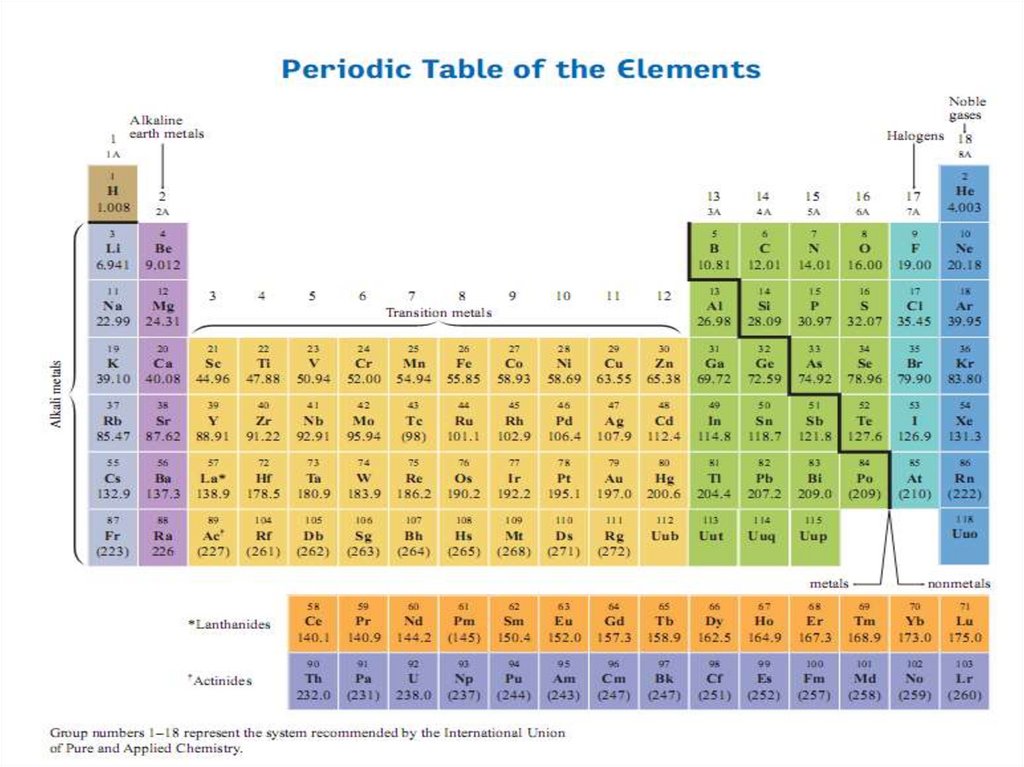
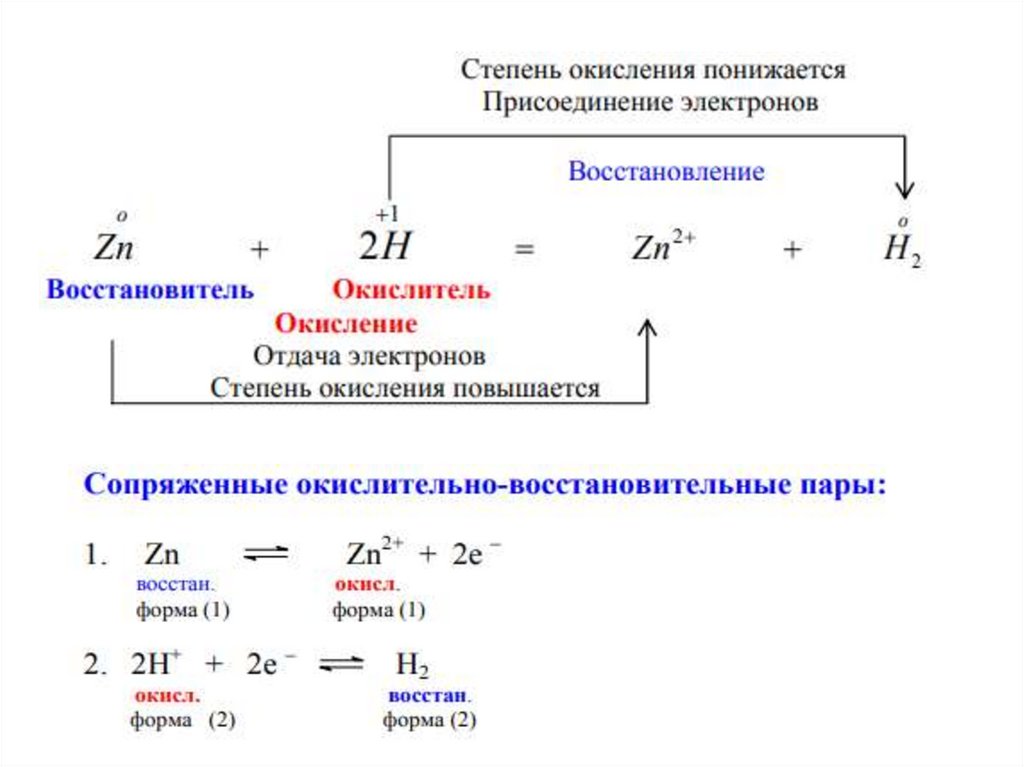
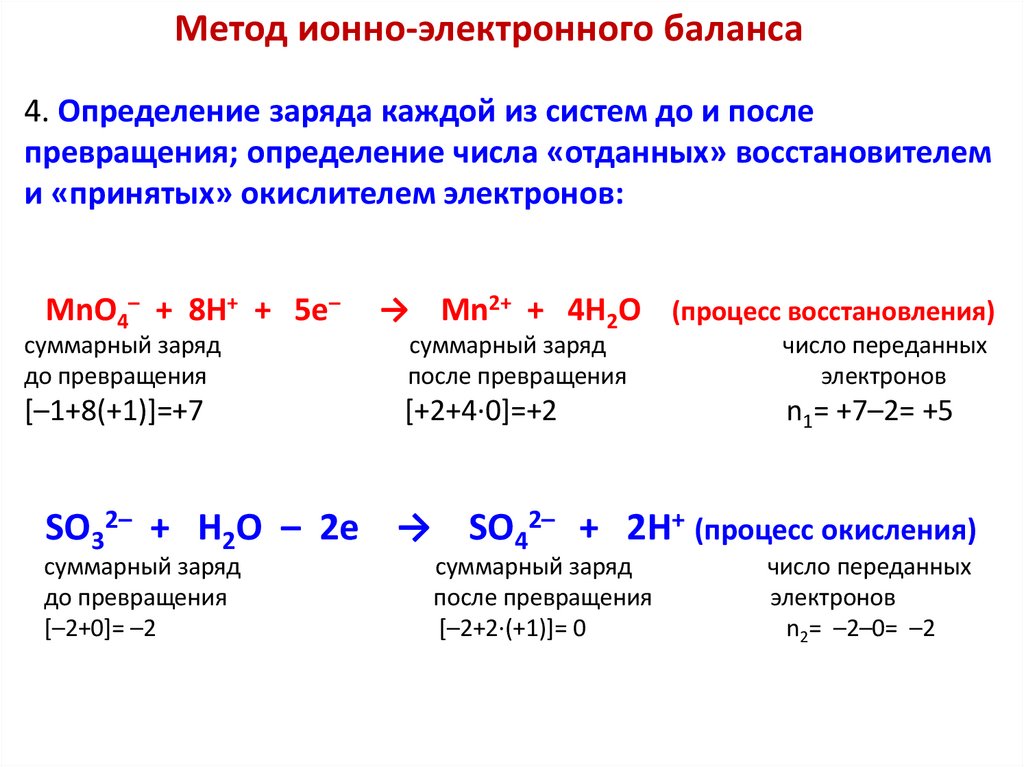
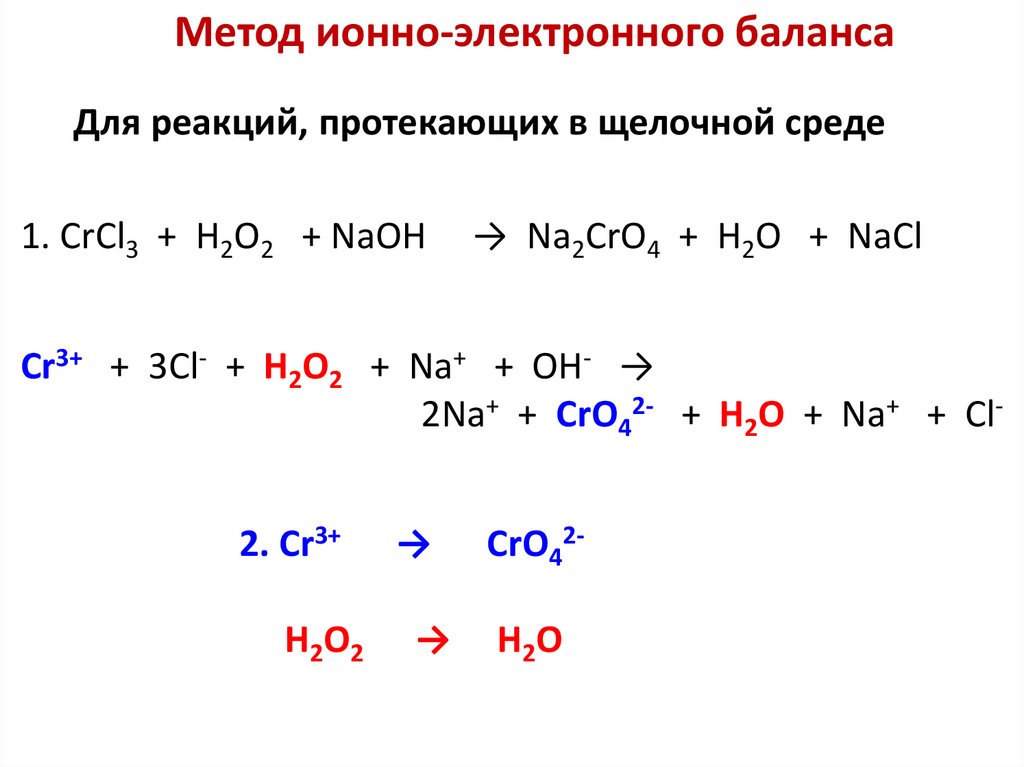
Окислительно-восстановительные процессыРеакции, протекающие с изменением степеней окисления
участвующих в них элементов, называют окислительновосстановительными реакциями (ОВР).
Степень окисления элемента – формальный (условный) заряд,
который был бы на атоме, если бы все связи в соединении были
ионными.
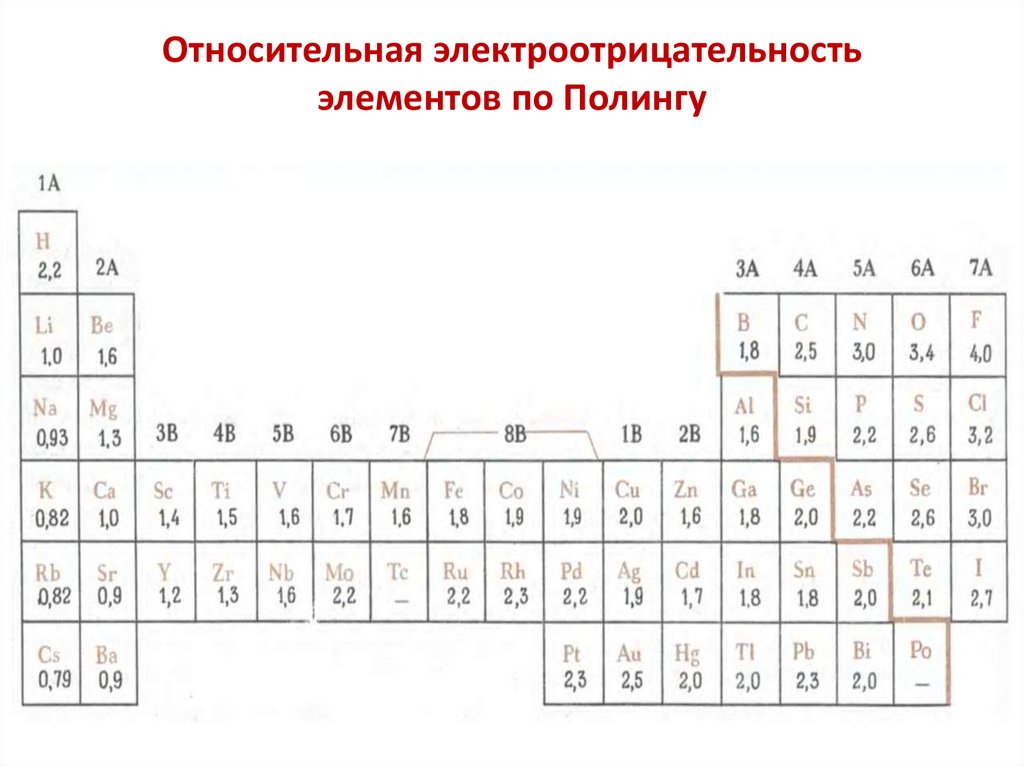
Более электроотрицательному элементу приписывают
отрицательную степень окисления.
Менее электроотрицательному элементу приписывают
положительную степень окисления.
Характерные степени окисления элемента определяются
электронной конфигурацией валентных электронов атома
5.
Относительная электроотрицательностьэлементов по Полингу
6.
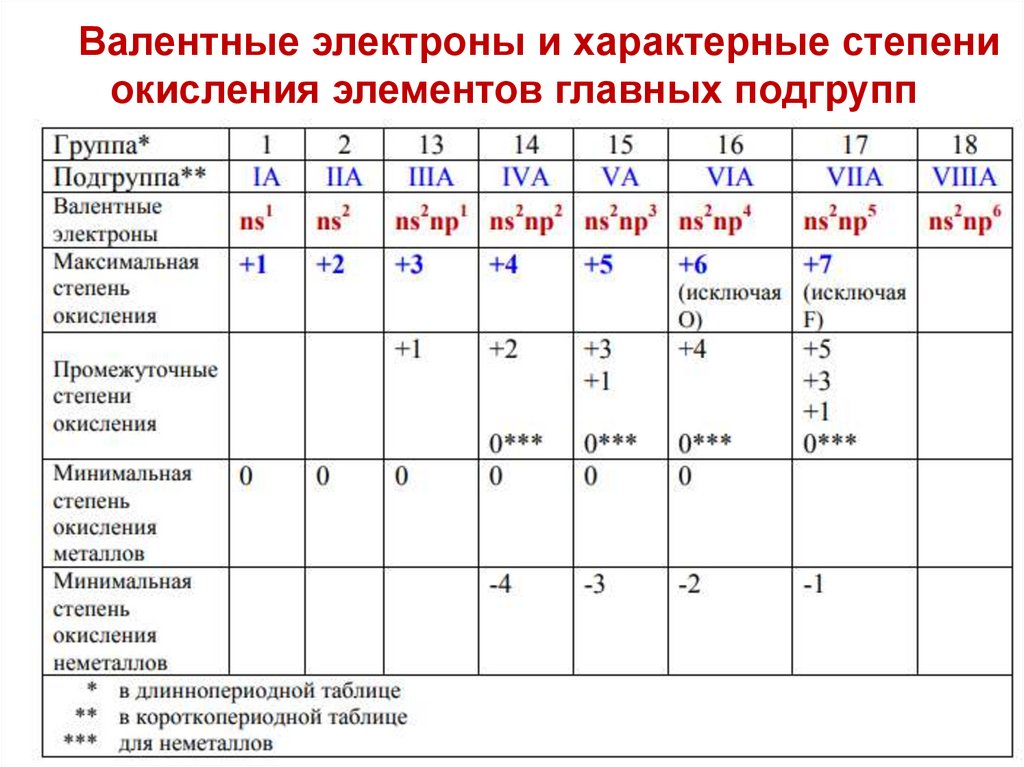
Валентные электроны и характерные степениокисления элементов главных подгрупп
7.
Для элементов главных подгрупп:1. Максимальная положительная степень окисления определяется
числом валентных электронов и совпадает с номером группы.
Исключения F и O.
2. Металлы проявляют только положительные степени окисления
3. Неметаллы могут иметь и положительные и отрицательные степени
окисления. Минимальная отрицательная степень окисления неметалла
совпадает с числом электронов, недостающих до полного заселения
внешнего валентного слоя.
4. Промежуточные степени окисления: наиболее устойчивы
промежуточные степени окисления, четность которых совпадает с
четностью группы
5. Металлы IA. IIA-групп, B, Al, Ga имеют постоянные степени окисления.
6. Устойчивость максимальной степени окисления в главных подгруппах
(сверху вниз) с увеличением заряда ядра уменьшается.
7. Устойчивость минимальной отрицательной степени окисления в
главных подгруппах (сверху вниз) с увеличением заряда ядра
уменьшается.
8.
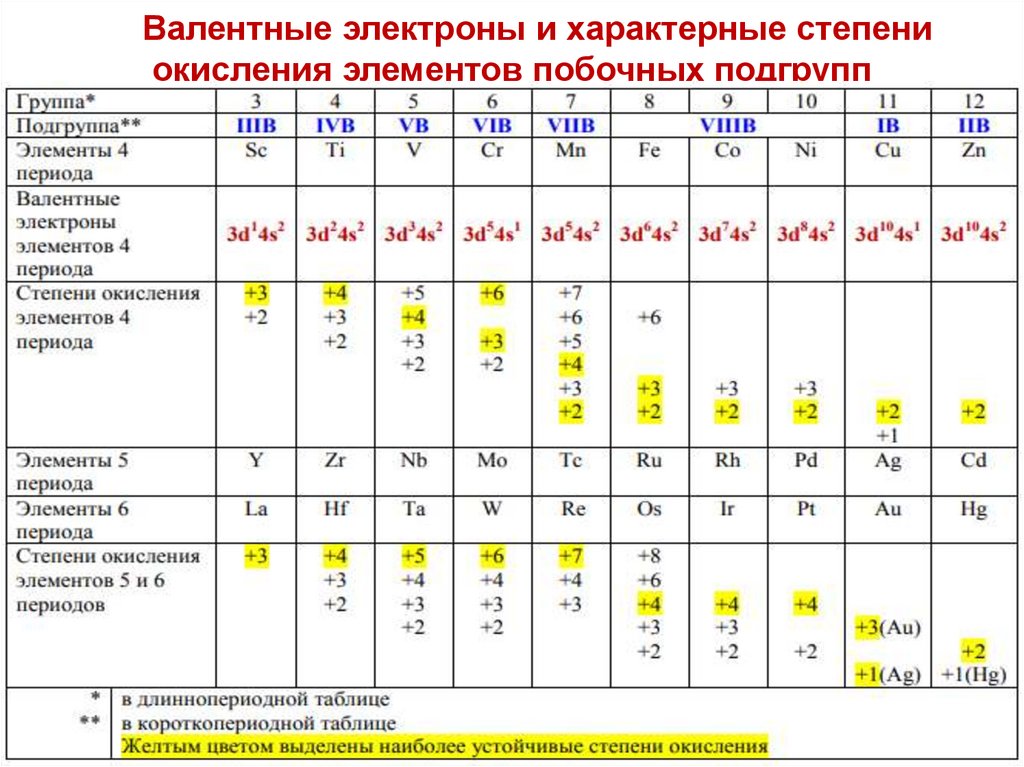
Валентные электроны и характерные степениокисления элементов побочных подгрупп
9.
Общие правила определения степеней окисленияСумма степеней окисления всех атомов молекулы (иона) равна
суммарному заряду частицы:
для молекулы равна 0; для иона равна заряду иона
H2O
H2SO4




























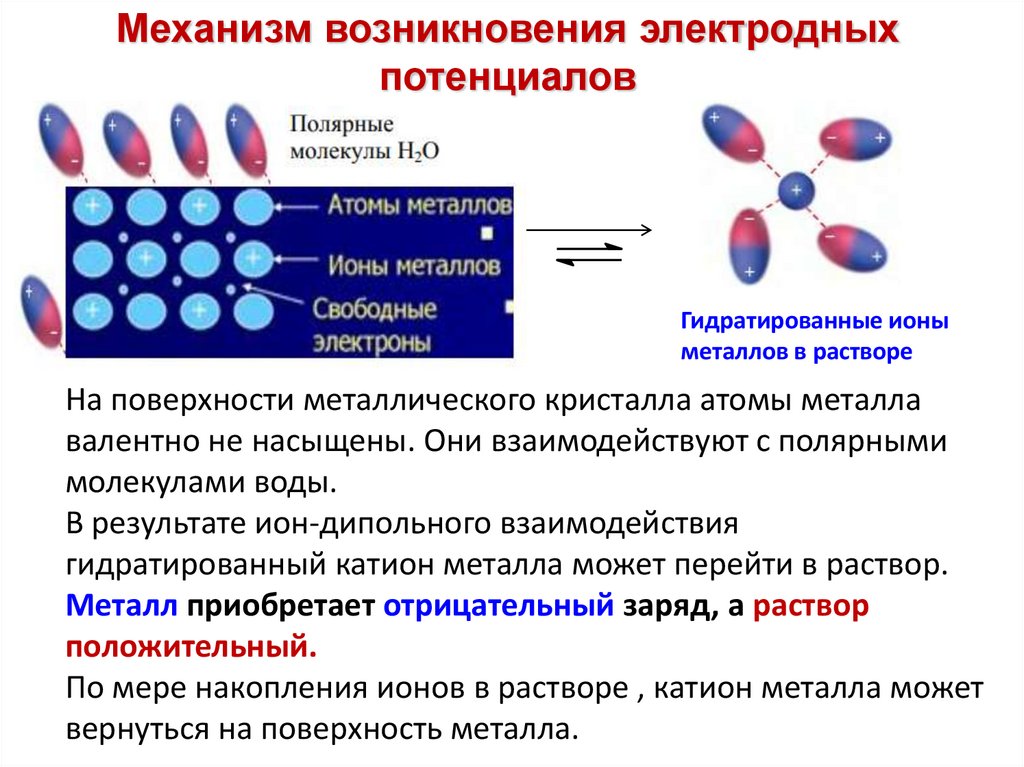


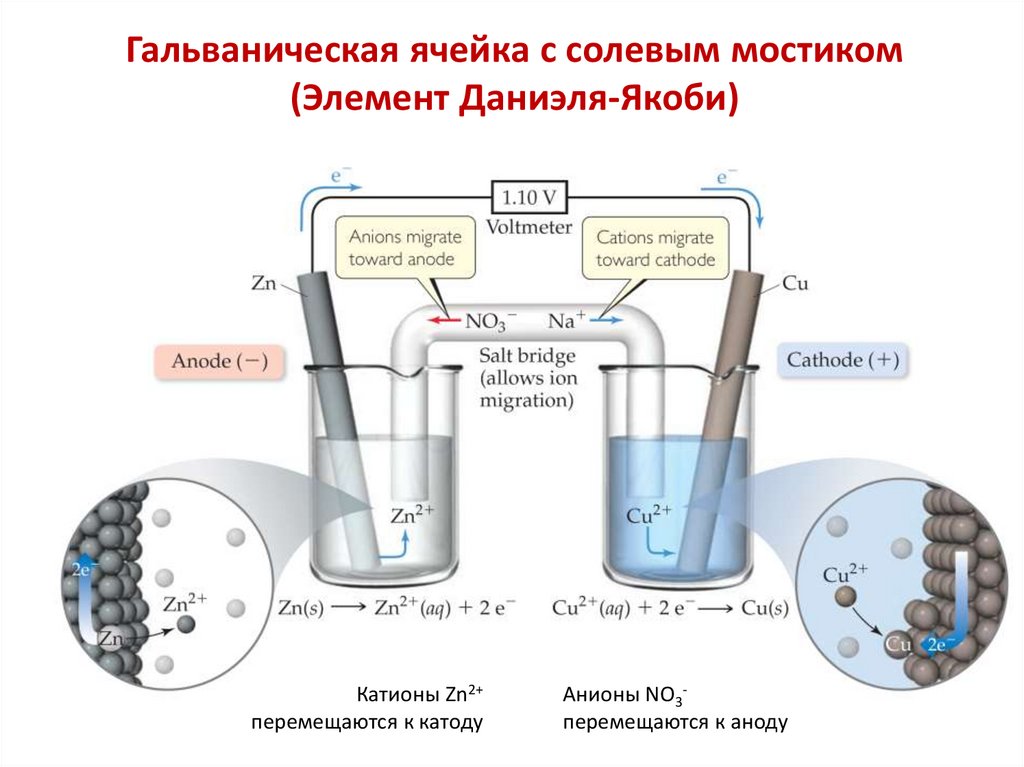
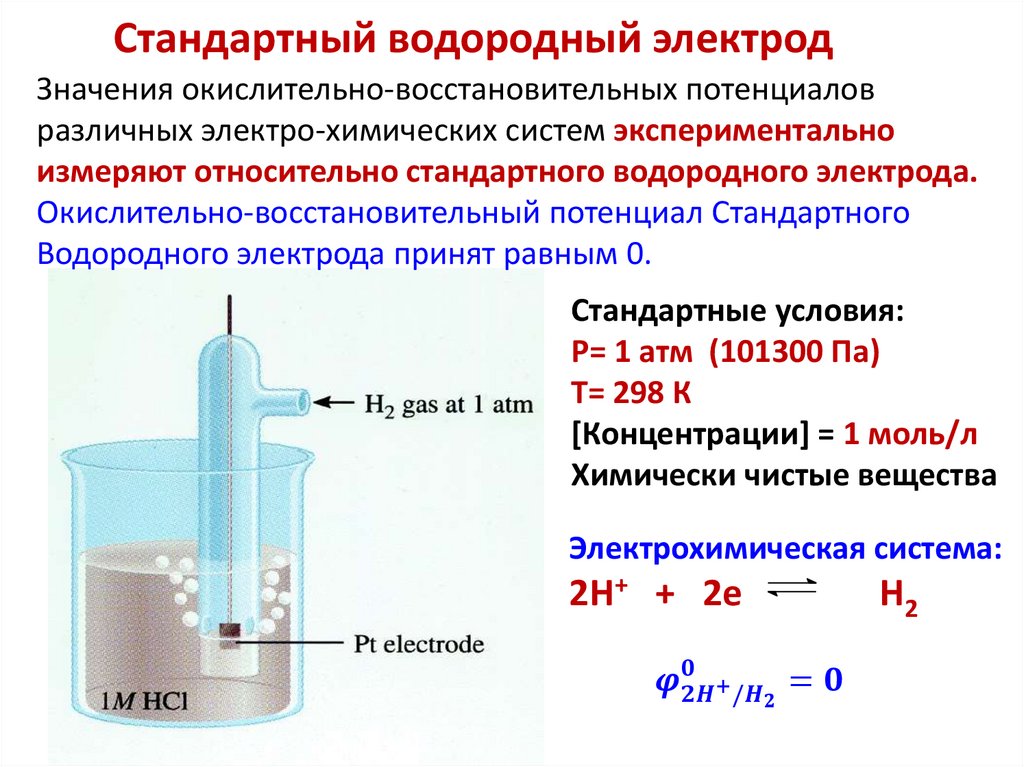
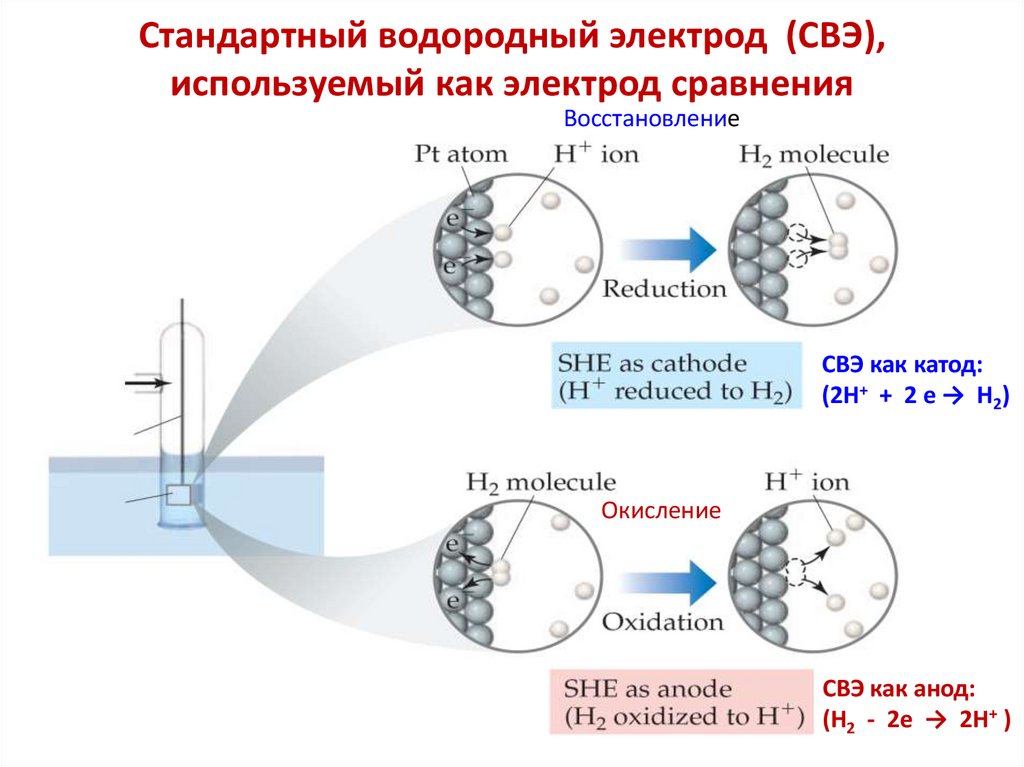









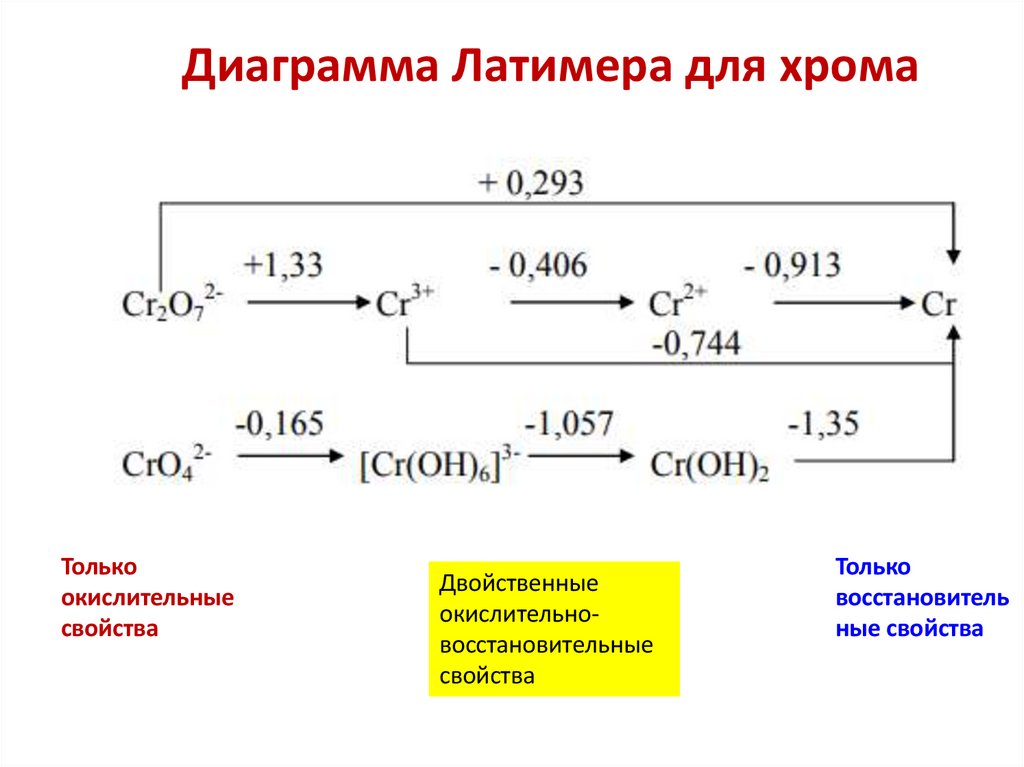

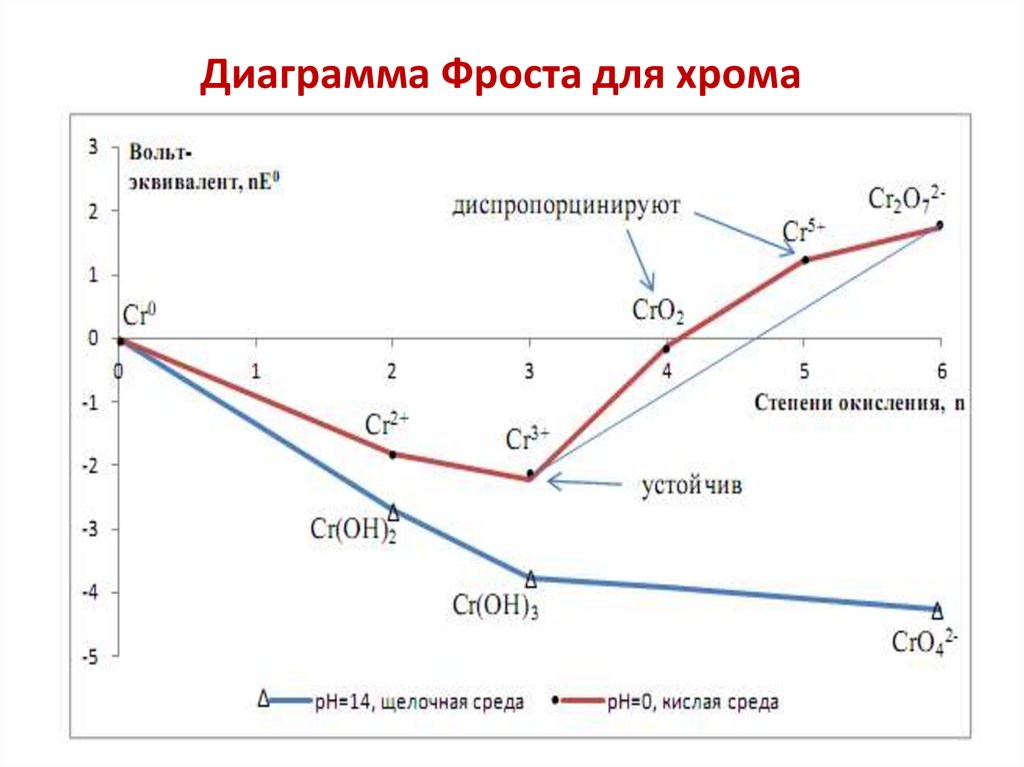
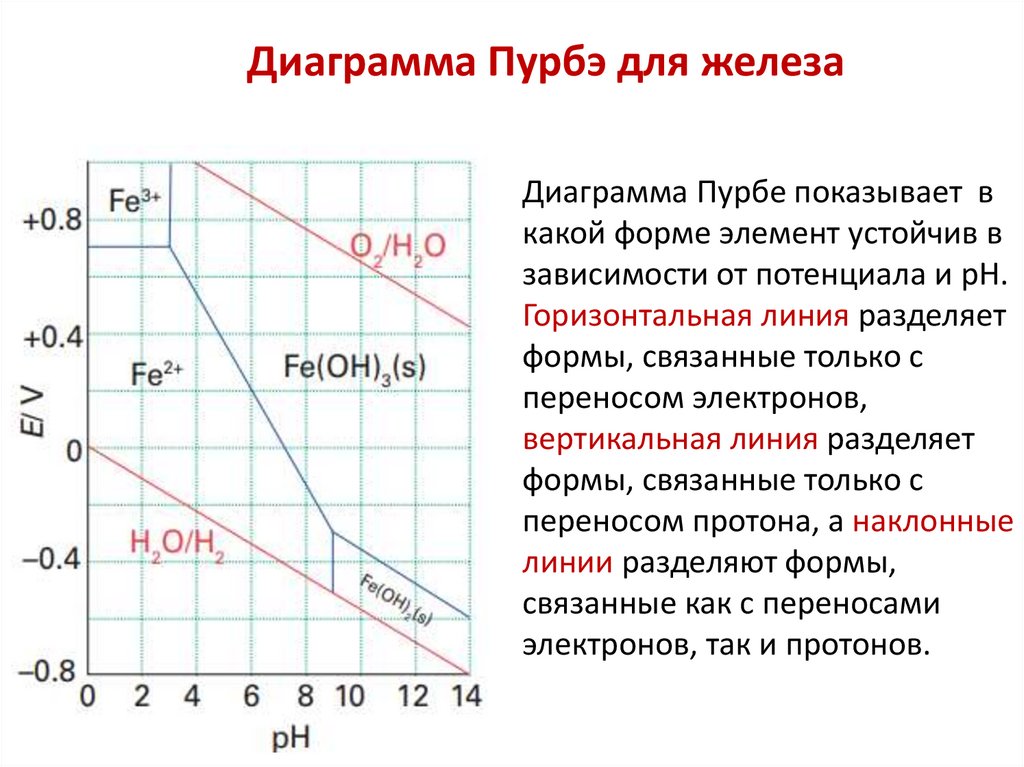






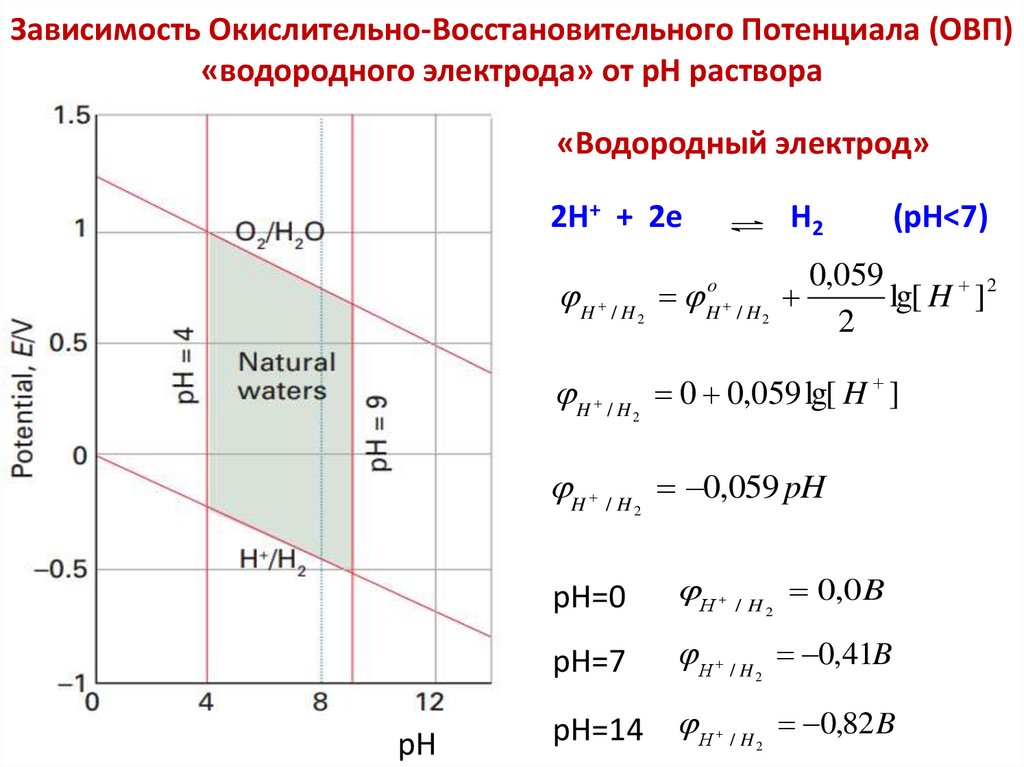




 Химия
Химия








