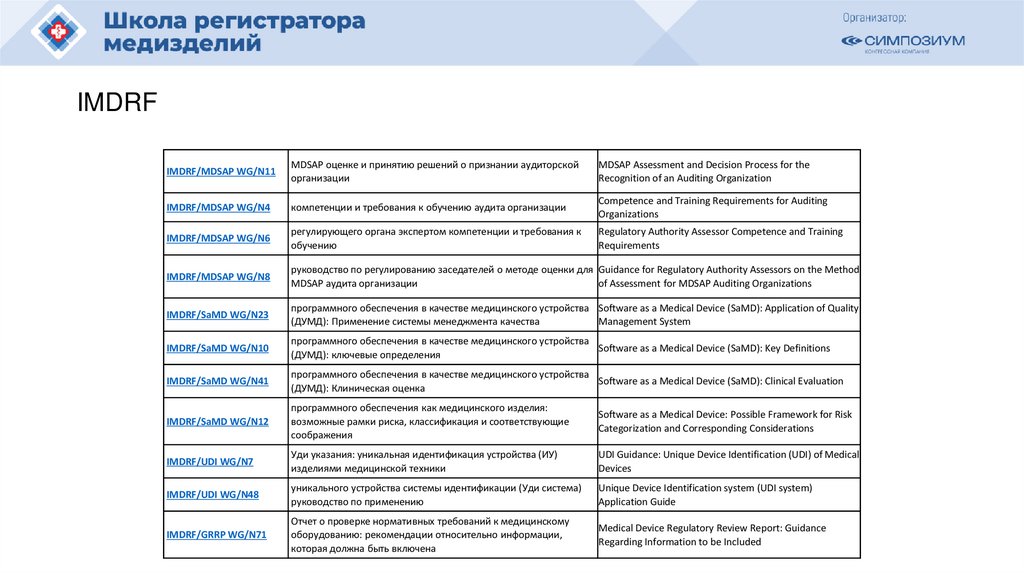
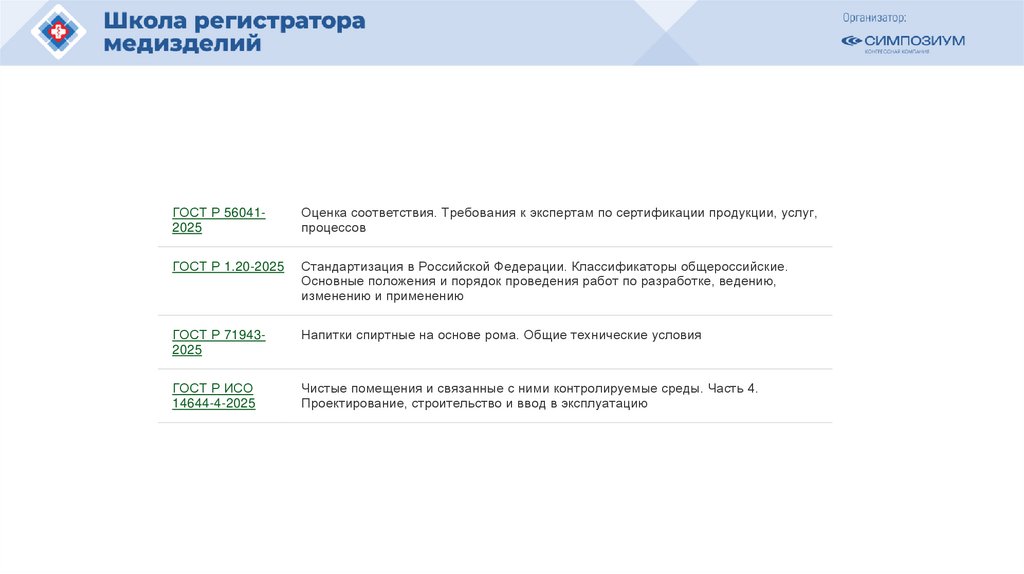
Похожие презентации:
Tarasenko_OA_Praktikumyi_1_2_3_4_SHkola_registratora_MI_17_de
1.
2.
Практикум 1КАК ДЕЛАТЬ АНАЛИЗ КЛЮЧЕВЫХ ПРГОБЛЕМ СТАНДАРТИЗАЦИИ ДЛЯ ПРИНЯТИЯ
ПРАВИЛЬНЫХ РЕШЕНИЙ ПО ПРОИЗВОДСТВУ, РЕГИСТРАЦИИ И ОБРАЩЕНИИ МИ
Ольга Тарасенко, д.м.н., Заместитель директора Федерации
лабораторной медицины России, профессор кафедры госпитальной
эпидемиологии, медицинской паразитологии и тропических
болезней ФГБОУ ДПО РМАНПО Минздрава России
3.
Ключевые темы:Главные документы в сфере стандартизации на декабрь 2025 года: не только как ГОСТы, но и
технические условия (ТУ)
Действительно ли ТУ нужно регистрировать в Росстандарте: с какого времени
Что делать зарубежным производителям МИ в отсутствие своих ТУ
Особенности технического регулирования МИ в РФ и ЕАЭС на 2025-26 гг: как решается данный
вопрос в отсутствии технического регулирования
Как работает на практике добровольное применение стандартов для обязательного
подтверждения соответствия МИ: взгляд на вопрос с позиции регуляторов
Новости в области технического регулирования, стандартизации и единства измерений: как
влияют изменения, внесенные в НПА, и готовящиеся проекты документов
Подводные камни ПП 1847: может ли новый Приказ Минздрава №257н нивелировать
изменения, и какие риски есть для отрасли МИ IVD
4. Федеральный закон от 27 декабря 2002 года №184-ФЗ "О техническом регулировании"
Федеральный закон от 27 декабря 2002 года №184-ФЗ"О техническом регулировании"
1. Настоящий Федеральный закон регулирует отношения, возникающие при:
разработке, принятии, применении и исполнении обязательных требований к продукции, в том числе
зданиям и сооружениям (далее - продукция), или к продукции и связанным с требованиями к продукции
процессам проектирования (включая изыскания), производства, строительства, монтажа, наладки,
эксплуатации, хранения, перевозки, реализации и утилизации;
применении и исполнении на добровольной основе требований к продукции, процессам
проектирования (включая изыскания), производства, строительства, монтажа, наладки, эксплуатации,
хранения, перевозки, реализации и утилизации, а также к выполнению работ или оказанию услуг в
целях добровольного подтверждения соответствия;
оценке соответствия.
5.
4. Настоящий Федеральный закон не регулирует отношения, связанные сразработкой, принятием, применением и исполнением
санитарно-эпидемиологических требований,
требований в сфере обращения лекарственных средств,
требований в области охраны окружающей среды,
требований в области охраны труда,
требований к безопасному использованию атомной энергии, в том числе требований
безопасности объектов использования атомной энергии, требований безопасности
деятельности в области использования атомной энергии, требований к осуществлению
деятельности в области промышленной безопасности, безопасности технологических
процессов на опасных производственных объектах, требований к обеспечению надежности и
безопасности электроэнергетических систем и объектов электроэнергетики, требований к
обеспечению безопасности космической деятельности, за исключением случаев разработки,
принятия, применения и исполнения таких требований к продукции или к продукции и
связанным с требованиями к продукции процессам проектирования (включая изыскания),
производства, строительства, монтажа, наладки, эксплуатации, хранения, перевозки,
реализации и утилизации.
6.
Федеральный закон от 29 июня 2015 года № 162-ФЗ"О стандартизации в Российской Федерации"
7. Статья 2. Основные понятия
Для целей настоящего Федерального закона используются следующие основные понятия:1) документ по стандартизации - документ, в котором для добровольного и многократного
применения устанавливаются общие!!! характеристики объекта стандартизации, а также правила и
общие!!! принципы в отношении объекта стандартизации, за исключением случаев, если
обязательность применения документов по стандартизации устанавливается настоящим
Федеральным законом;
2) документы, разрабатываемые и применяемые в национальной системе стандартизации (далее документы национальной системы стандартизации),
национальный стандарт Российской Федерации (далее - национальный стандарт), в том числе
основополагающий национальный стандарт Российской Федерации (далее - основополагающий
национальный стандарт),
и предварительный национальный стандарт Российской Федерации (далее - предварительный
национальный стандарт),
а также правила стандартизации,
рекомендации по стандартизации,
информационно-технические справочники,
технические спецификации (отчеты) и
стандарты организаций, в том числе технические условия, зарегистрированные!!!! в
установленном порядке в Федеральном информационном фонде стандартов;
8. Категории стандартов и виды стандартов
Все стандарты, действующие в стране, органы и организации по стандартизации образуютГосударственную систему стандартизации (ГСС).
Стандарты ГСС подразделяются на следующие категории:
ГОСТ Р - государственные стандарты Российской Федерации;
ОСТ - отраслевые стандарты;
СТП - стандарты предприятий;
СТО - стандарты научно-технических, инженерных обществ и других общественных
объединений.
ТУ -технические условия
ИСО - Международный стандарт
В зависимости от специфики объекта стандартизации и содержания устанавливаемых к нему
требований разрабатывают стандарты следующих видов:
стандарты основополагающие;
стандарты на продукцию, услуги;
стандарты на процессы;
стандарты на методы контроля (испытаний, измерений, анализа)
9. Межотраслевые системы (комплексы) стандартов
Единые государственные системы стандартов обеспечиваютединообразие и наивысшую эффективность проведения важнейших
видов работ, общих для различных отраслей народного хозяйства. К
подобным системам относятся:
Государственная система стандартизации (ГСС)
Единая система конструкторской документации (ЕСКД)
Единая система технологической подготовки производства (ЕСТПП)
Единая система технологической документации (ЕСТД)
Единая система классификации и кодирования технико-экономической
информации (ЕСКК)
Государственная система обеспечения единства измерений (ГСИ)
Система стандартов безопасности труда (ССБТ)
10.
Проект во 2-м чтенииФЕДЕРАЛЬНЫЙ ЗАКОН
О внесении изменений в Федеральный закон
"О стандартизации в Российской Федерации"
(в части применения стандартов организации и технических условий
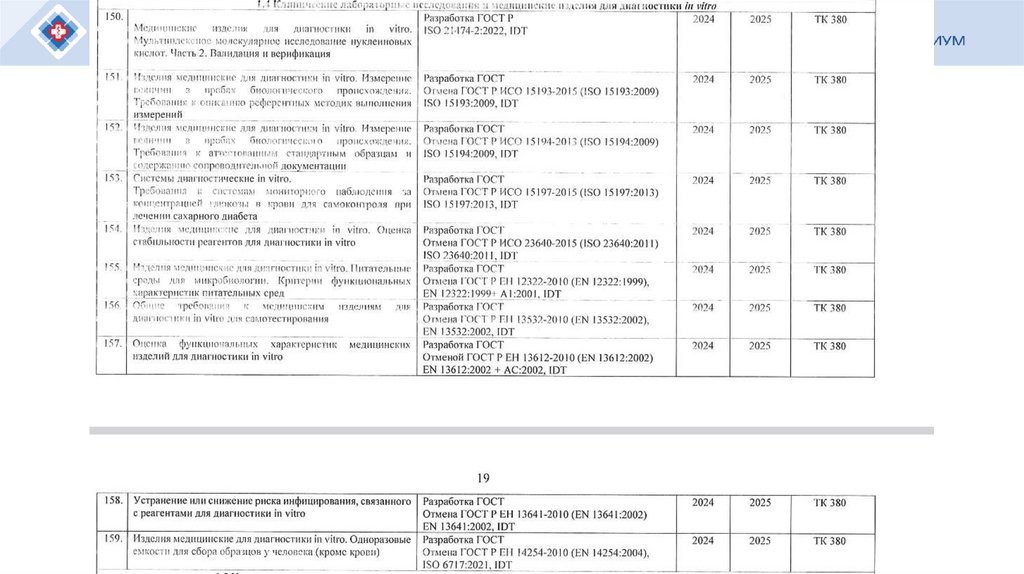
при обращении продукции)
Статья 1
Внести в Федеральный закон от 29 июня 2015 года № 162-ФЗ
"О стандартизации в Российской Федерации" (Собрание законодательства
Российской Федерации, 2015, № 27, ст. 3953; 2016, № 15, ст. 2066; № 27,
ст. 4229; 2021, № 1, ст. 62) следующие изменения:
11.
10.1) программа стандартизации - документ, который разрабатывается иутверждается участником или участниками работ по стандартизации,
предусматривает разработку на перспективу (с учетом целей и
направлений развития стандартизации) документов по стандартизации в
соответствии с настоящим Федеральным законом и (или) внесение в них
изменений (актуализацию) либо их пересмотр;
10.2) публичное заявление о соответствии - применение обозначения
документа по стандартизации в маркировке, в эксплуатационной или
иной документации, в том числе в договорах (контрактах) на поставку
продукции, и (или) маркировке продукции знаком национальной
системы стандартизации;"
12.
13) стандарт организации - документ по стандартизации,утвержденный юридическим лицом (как зарегистрированным на
территории Российской Федерации, так и иностранным) в том
числе
государственной
корпорацией,
саморегулируемой
организацией, а также индивидуальным предпринимателем для
совершенствования производства и обеспечения качества
продукции, выполнения работ, оказания услуг;
13. Глава 3. УЧАСТНИКИ РАБОТ ПО СТАНДАРТИЗАЦИИ
13) устанавливает порядок размещения уведомления о разработкепроекта национального стандарта и уведомления о завершении
публичного обсуждения проекта национального стандарта;
14) устанавливает порядок проведения экспертизы проектов стандартов
организаций, а также проектов технических условий, представляемых
разработчиком в соответствующие технические комитеты по
стандартизации
или
проектные
технические
комитеты
по
стандартизации;
15) устанавливает порядок и сроки рассмотрения жалоб в комиссии по
апелляциям;
14. Статья 9. Федеральный орган исполнительной власти в сфере стандартизации
10) определяет порядок проведения экспертизы проектов документов национальной системы стандартизации;10.1) определяет порядок проведения экспертизы стандартов организаций, в том числе технических условий, и их проектов;
10.2) определяет требования к организациям, осуществляющим экспертизу стандартов организаций, в том числе технических
условий;
10.3) определяет порядок ведения реестра организаций, осуществляющих экспертизу стандартов организаций, в том числе
технических условий;
10.4) осуществляет ведение реестра организаций, осуществляющих экспертизу стандартов организаций, в том числе
технических условия;";
11) организует разработку документов национальной системы стандартизации;
12) утверждает, изменяет (актуализирует), отменяет документы национальной системы стандартизации за исключением
стандартов организаций, в том числе технических условий, устанавливает дату введения их в действие, а также разрабатывает
и регистрирует основополагающие национальные стандарты и правила стандартизации, устанавливает дату введения их в
действие;
15. Статья 9. Федеральный орган исполнительной власти в сфере стандартизации
14) регистрирует в Федеральном информационном фондестандартов документы национальной системы стандартизации,
своды правил, технические спецификации (отчеты), стандарты
организаций, в том числе технические условия, международные
стандарты, региональные стандарты и региональные своды правил,
стандарты иностранных государств и своды правил иностранных
государств; сведения о стандартах организаций, в том числе
технических условиях, и включает их в Федеральный
информационный фонд стандартов
16. Статья 9. Федеральный орган исполнительной власти в сфере стандартизации
24) организует формирование иинформационного фонда стандартов;
ведение
Федерального
24.1) определяет порядок регистрации стандартов организаций, в
том числе технических условий, в Федеральном информационном
фонде стандартов; определяет порядок регистрации сведений и
включения стандартов организаций, в том числе технических
условий, в Федеральный информационный фонд стандартов
17. Статья 21. Стандарты организаций и технические условия
5. Проект стандарта организации, а также проект технических условий перед их утверждением можетпредставляться в соответствующий технический комитет по стандартизации или проектный
технический комитет по стандартизации для проведения экспертизы, по результатам которой
технический комитет по стандартизации или проектный технический комитет по стандартизации
готовит соответствующее заключение.
Утверждённый стандарт организации, в том числе
утвержденные технические условия, или их проект в установленном порядке могут быть
представлены на экспертизу в организацию, включенную в реестр организаций, осуществляющих
экспертизу стандартов организаций, в том числе технических условий, по результатам которой
оформляется экспертное заключение.
На основании экспертного заключения стандарты организаций, в том числе технические условия,
могут быть включены в Федеральный информационный фонд стандартов
18. Статья 21. Стандарты организаций и технические условия
6. Стандарты организаций и технические условия могут быть зарегистрированы в Федеральноминформационном фонде стандартов по инициативе организации, утвердившей данные стандарты
организаций и технические условия. (в ред. Федерального закона от 30.12.2020 N 523-ФЗ) Регистрация
сведений о стандартах организаций, в том числе технических условиях, осуществляется по инициативе
организаций, утвердивших данные стандарты организаций, в том числе технические условия, по
инициативе уполномоченной иностранным изготовителем зарегистрированной в установленном порядке
на территории Российской Федерации организации или по инициативе зарегистрированной на
территории Российской Федерации организации, являющейся импортером продукции, произведенной по
стандартам организации, в том числе по техническим условиям.
Для регистрации сведений о стандартах организаций, в том числе технических условий в Федеральном
информационном фонде стандартов, направляется уведомление в форме электронного документа,
подписанного усиленной квалифицированной электронной подписью с использованием Федеральной
государственной информационной системы "Единый портал государственных и муниципальных услуг
(функций)", в соответствии с порядком, предусмотренным пунктом 241 статьи 9 настоящего Закона."
7. . В случае публичного заявления о соответствии продукции стандарту организации, в том числе
техническим условиям, сведения о таком стандарте организации, в том числе технических условиях,
должны быть зарегистрированы в Федеральном информационном фонде стандартов
19. Федеральный закон от 29.06.2015 № 162-ФЗ "О стандартизации в Российской Федерации" Статья 10. Полномочия федеральных органов
Федеральный закон от 29.06.2015 № 162-ФЗ "О стандартизации в РоссийскойФедерации" Статья 10. Полномочия федеральных органов исполнительной власти,
Государственной корпорации по атомной энергии "Росатом" и иных государственных
корпораций
в
сфере
стандартизации
Федеральные органы исполнительной власти, Государственная корпорация по атомной энергии "Росатом" и иные
государственные корпорации:
1) участвуют в подготовке предложений о формировании государственной политики Российской Федерации в сфере
стандартизации и реализуют государственную политику Российской Федерации в сфере стандартизации в
соответствии с установленными полномочиями;
2) формируют разделы по стандартизации при разработке документов стратегического планирования, в том числе
государственных программ Российской Федерации и государственных программ субъектов Российской Федерации, а
также федеральных целевых программ, ведомственных целевых программ, иных программ, предусматривающих
разработку документов по стандартизации;
3) определяют потребности и направления развития стандартизации в установленной сфере деятельности и
осуществляют подготовку предложений для включения их в программы по стандартизации с учетом положений
настоящего Федерального закона;
4) разрабатывают и утверждают совместно с федеральным органом исполнительной власти в сфере стандартизации
перспективные программы стандартизации по приоритетным направлениям;
5) организуют работы по стандартизации в соответствии с установленными полномочиями;
6) участвуют в работе технических комитетов по стандартизации и проектных технических комитетов по
стандартизации;
7) осуществляют разработку, утверждение, изменение и отмену сводов правил в установленной сфере деятельности
(за исключением иных государственных корпораций).
20. Статья 33. Финансирование в сфере стандартизации
1. За счет бюджетных ассигнований, предоставляемых из федерального бюджета, финансируются расходы на:1) разработку и реализацию программы национальной стандартизации;
2) разработку перспективных программ стандартизации по приоритетным направлениям;
3) разработку документов национальной системы стандартизации и межгосударственных стандартов, включенных в
программу национальной стандартизации;
4) разработку и экспертизу документов по стандартизации, предусмотренных пунктом 5 статьи 14 настоящего
Федерального закона;
5) формирование, ведение и опубликование перечня национальных стандартов и информационно-технических
справочников, ссылки на которые содержатся в нормативных правовых актах;
6) проведение экспертизы проектов национальных стандартов, проектов предварительных национальных стандартов и
проектов межгосударственных стандартов, включенных в программу национальной стандартизации;
7) разработку международных стандартов и региональных стандартов, в разработке которых участвует Российская
Федерация, а также проведение экспертизы отдельных проектов международных стандартов и региональных стандартов;
21. Статья 33. Финансирование в сфере стандартизации
8) уплату взносов Российской Федерации в международные и региональные организации постандартизации;
9) разработку, ведение и официальное опубликование общероссийских классификаторов;
10) разработку,
справочников;
актуализацию
и
официальное
опубликование
информационно-технических
11) формирование и ведение Федерального информационного фонда стандартов, в том числе создание
и эксплуатацию федеральных информационных систем.
2. За счет средств юридических лиц (в том числе государственных корпораций, иных некоммерческих
организаций) и средств физических лиц могут финансироваться расходы на:
1) разработку национальных стандартов, предварительных национальных стандартов и
межгосударственных стандартов, включенных в программу национальной стандартизации, и (или)
перспективных программ стандартизации по приоритетным направлениям;
22. Статья 33. Финансирование в сфере стандартизации
2) разработку и актуализацию информационно-технических справочников;3) проведение научных исследований в области стандартизации;
4) проведение экспертизы отдельных стандартов организаций и технических условий;
5) разработку международных стандартов и региональных стандартов, в разработке которых
участвует Российская Федерация, а также проведение экспертизы отдельных проектов
международных стандартов и региональных стандартов;
6) формирование и ведение Федерального информационного фонда стандартов.
3. Порядок финансирования расходов, предусмотренных
устанавливается Правительством Российской Федерации.
настоящей
статьей,
23.
Утвержденыпостановлением Правительства
Российской Федерации
от 14 апреля 2016 г. N 305
ПРАВИЛА ФИНАНСИРОВАНИЯ РАСХОДОВ В СФЕРЕ
СТАНДАРТИЗАЦИИ
24.
1. Настоящие Правила устанавливают порядок финансирования расходов в сфере стандартизации.2. За счет бюджетных ассигнований, предусмотренных федеральным бюджетом на соответствующий финансовый год
Федеральному агентству по техническому регулированию и метрологии на указанные цели, финансируются расходы:
а) на разработку и реализацию программы национальной стандартизации;
б) на формирование, ведение и опубликование перечня национальных стандартов и информационно-технических
справочников, ссылки на которые содержатся в нормативных правовых актах;
в) на проведение экспертизы проектов национальных стандартов, проектов предварительных национальных стандартов и
проектов межгосударственных стандартов, включенных в программу национальной стандартизации;
г) на формирование и ведение Федерального информационного фонда стандартов, в том числе на создание и эксплуатацию
федеральных информационных систем;
д) на проведение экспертизы отдельных проектов международных стандартов и региональных стандартов;
е) на официальное опубликование информационно-технических справочников и общероссийских классификаторов.
25.
3. За счет бюджетных ассигнований, предусмотренных федеральным бюджетом насоответствующий финансовый год федеральным органам исполнительной власти,
Государственной корпорации по атомной энергии "Росатом" и Государственной корпорации по
космической деятельности "Роскосмос", финансируются расходы:
а) на разработку перспективных программ стандартизации по приоритетным направлениям;
б) на разработку документов национальной системы стандартизации и межгосударственных
стандартов, включенных в программу национальной стандартизации;
в) на разработку и экспертизу документов по стандартизации, предусмотренных пунктом 5
статьи 14 Федерального закона "О стандартизации в Российской Федерации";
г) на разработку международных стандартов и региональных стандартов, в разработке которых
участвует Российская Федерация;
д) на разработку и ведение общероссийских классификаторов, а также на разработку и
актуализацию информационно-технических справочников.
26.
4. Уплату взносов Российской Федерации в международные и региональные организации по стандартизации производятфедеральные органы исполнительной власти, уполномоченные представлять Российскую Федерацию в этих организациях,
за счет бюджетных ассигнований, предусмотренных указанным органам федеральным законом о федеральном бюджете на
соответствующий финансовый год, и лимитов бюджетных обязательств, утвержденных им в установленном порядке.
5. Юридические лица (в том числе государственные корпорации, иные некоммерческие организации) и физические лица за
счет собственных средств могут финансировать расходы:
а) на разработку национальных стандартов, предварительных национальных стандартов и межгосударственных стандартов,
включенных в программу национальной стандартизации, и (или) перспективных программ стандартизации по
приоритетным направлениям;
б) на разработку и актуализацию информационно-технических справочников;
в) на проведение научных исследований в области стандартизации;
г) на проведение экспертизы отдельных стандартов организаций и технических условий;
д) на разработку международных стандартов и региональных стандартов, в разработке которых участвует Российская
Федерация, а также на проведение экспертизы отдельных проектов международных стандартов и региональных стандартов;
е) на формирование и ведение Федерального информационного фонда
27.
6. При осуществлении юридическими лицами (в том числе государственными корпорациями, иныминекоммерческими организациями) расходов, предусмотренных подпунктами "а", "б", "д" и "е" пункта 5
настоящих Правил, может осуществляться софинансирование таких расходов в форме предоставления субсидий
указанным юридическим лицам за счет бюджетных ассигнований, предусмотренных федеральным бюджетом на
соответствующий финансовый год соответствующим федеральным органам исполнительной власти,
Государственной корпорации по атомной энергии "Росатом" и Государственной корпорации по космической
деятельности "Роскосмос" на указанные цели.
Предоставление субсидий, указанных в настоящем пункте, осуществляется в соответствии с нормативными
правовыми актами, принятыми в соответствии с бюджетным законодательством Российской Федерации.
7. Федеральные органы исполнительной власти, Государственная корпорация по атомной энергии "Росатом" и
Государственная корпорация по космической деятельности "Роскосмос" предусматривают необходимые средства
для финансирования расходов, указанных в статье 33 Федерального закона "О стандартизации в Российской
Федерации", в федеральном бюджете на соответствующий финансовый год и в соответствующих подпрограммах
государственных программ Российской Федерации в соответствии с законодательством Российской Федерации.
8. Контроль за целевым и эффективным использованием средств федерального бюджета, представление
отчетности об их использовании осуществляются главными распорядителями средств федерального бюджета и
федеральным органом исполнительной власти, осуществляющим функции по контролю и надзору в финансовобюджетной сфере, в соответствии с законодательством Российской Федерации.
28. 102-ФЗ
Глава 3. Государственное регулирование в области обеспечения единства измеренийСтатья 11. Формы государственного регулирования в области обеспечения единства измерений
Государственное регулирование в области обеспечения единства измерений осуществляется в следующих формах:
1) утверждение типа стандартных образцов или типа средств измерений;
2) поверка средств измерений;
3) метрологическая экспертиза;
4) федеральный государственный метрологический контроль (надзор);
5) аттестация методик (методов) измерений;
6) аккредитация юридических лиц и индивидуальных предпринимателей на выполнение работ и (или) оказание услуг по обеспечению
единства измерений;
7) оценка соответствия эталонов единиц величин обязательным требованиям.
29.
30.
Перечень измерений в сфере государственногорегулирования в здравоохранении
В соответствии со ст. 5 102ФЗ Постановлением правительства РФ от
16.11.2020 №1847 утвержден перечень из 18 видов измерения,
относящихся к сфере государственного регулирования обеспечения
единства измерений и выполняемых при осуществлении деятельности в
области здравоохранения, с указанием обязательных метрологических
требований к измерениям, в том числе показателей точности
измерений.
30
31.
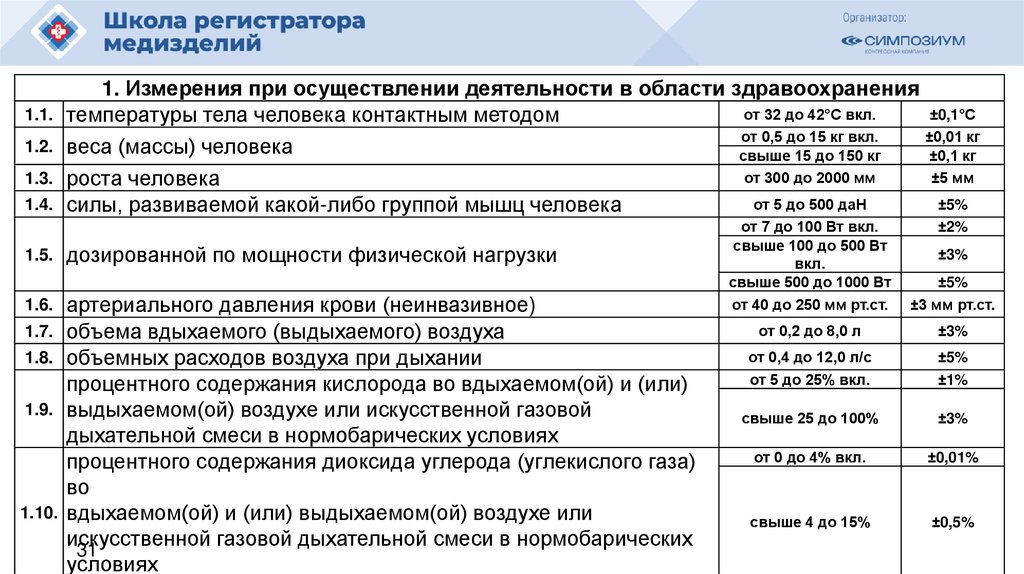
1. Измерения при осуществлении деятельности в области здравоохраненияот 32 до 42°С вкл.
±0,1°С
1.1. температуры тела человека контактным методом
от 0,5 до 15 кг вкл.
±0,01 кг
1.2. веса (массы) человека
свыше 15 до 150 кг
±0,1 кг
от 300 до 2000 мм
±5 мм
1.3. роста человека
от 5 до 500 даН
±5%
1.4. силы, развиваемой какой-либо группой мышц человека
1.5.
дозированной по мощности физической нагрузки
артериального давления крови (неинвазивное)
1.7. объема вдыхаемого (выдыхаемого) воздуха
1.8. объемных расходов воздуха при дыхании
процентного содержания кислорода во вдыхаемом(ой) и (или)
1.9. выдыхаемом(ой) воздухе или искусственной газовой
дыхательной смеси в нормобарических условиях
процентного содержания диоксида углерода (углекислого газа)
во
1.10. вдыхаемом(ой) и (или) выдыхаемом(ой) воздухе или
искусственной
газовой дыхательной смеси в нормобарических
31
условиях
1.6.
от 7 до 100 Вт вкл.
свыше 100 до 500 Вт
вкл.
свыше 500 до 1000 Вт
от 40 до 250 мм рт.ст.
±2%
±5%
±3 мм рт.ст.
от 0,2 до 8,0 л
±3%
от 0,4 до 12,0 л/с
от 5 до 25% вкл.
±5%
±1%
свыше 25 до 100%
±3%
от 0 до 4% вкл.
±0,01%
свыше 4 до 15%
±0,5%
±3%
32.
1. Измерения при осуществлении деятельности в области здравоохраненияот 0 до 0,5 мг/л вкл.
±0,05 мг/л
1.11. массовой концентрации паров этанола в выдыхаемом воздухе
свыше 0,5 до 0,95 мг/л
±10%
1.12.
оптико-физических характеристик наборов пробных очковых
линз
интенсивности тестовых тональных звуковых сигналов
различной частоты при воздушном и костном звукопроведении
при лучевой терапии поглощенной дозы в воде, поглощенной
дозы в биологической ткани, кермы в воздухе:
1.14.
при внешнем облучении
при внутритканевом и полостном облучении
при рентгенодиагностических исследованиях:
поглощенной дозы в воде, поглощенной дозы в биологической
ткани, кермы в воздухе
1.15.
произведения дозы (кермы в воздухе) на площадь
произведения дозы (кермы в воздухе) на длину для
компьютерной томографии
1.13.
32
оптическая сила от
±(0,060,25)
минус 20 до 20 дптр
дптр
призматическое
действие от 0,5 до 10 ±(0,20,3) дптр
дптр
от 125 до 4000 Гц вкл.
±3 дБ
свыше 4000 до 8000 Гц
±5 дБ
от 5·10 до 10 Гр
±3%
от 5·10 до 10 Гр
±5%
от 5·10 до 2·10 Гр
±15%
от 1·10 до 10 Гр·м
±15%
от 3·10 до 50 Гр·см
±15%
33.
1. Измерения при осуществлении деятельности в области здравоохранениямощностей амбиентного и направленного эквивалентов доз на
от 1·10 до 10 Зв
±20%
1.16. рабочих местах персонала и индивидуального эквивалента дозы
для персонала
активности радионуклидов в препаратах, применяемых для
от 10 до 10 Бк
±10%
1.17. микробиологических исследований, диагностики и лечения
заболеваний
от 0 до 2 ед. ОП вкл. ±0,06 ед. ОП
значений оптической плотности (ОП) с последующим
1.18. пересчетом измеренного значения в необходимый параметр
св. 2 до 4 ед. ОП
±0,6 ед. ОП
в соответствии с методикой исследования
33
34.
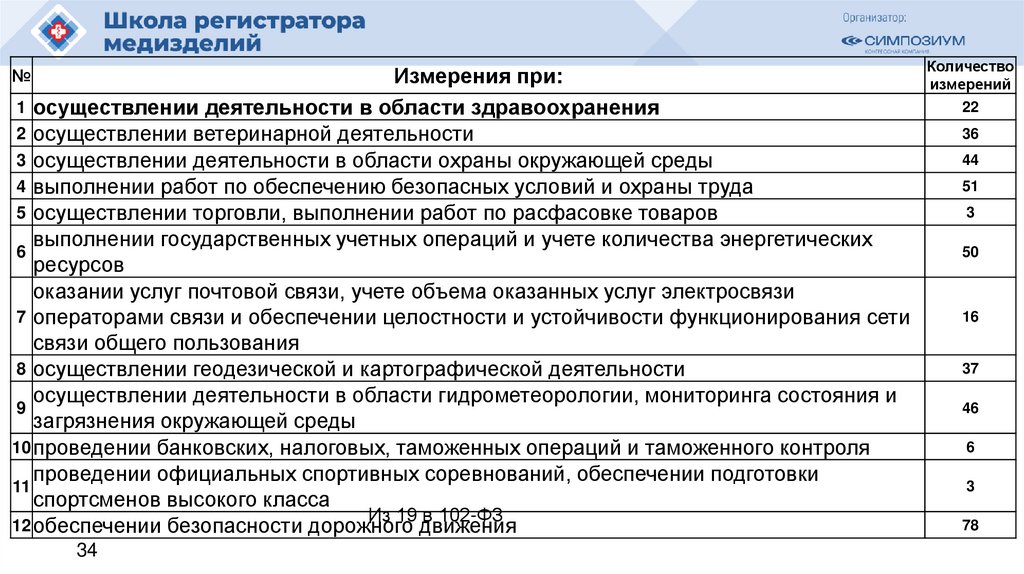
Измерения при:1 осуществлении деятельности в области здравоохранения
2 осуществлении ветеринарной деятельности
3 осуществлении деятельности в области охраны окружающей среды
4 выполнении работ по обеспечению безопасных условий и охраны труда
5 осуществлении торговли, выполнении работ по расфасовке товаров
выполнении государственных учетных операций и учете количества энергетических
6
ресурсов
оказании услуг почтовой связи, учете объема оказанных услуг электросвязи
7 операторами связи и обеспечении целостности и устойчивости функционирования сети
связи общего пользования
8 осуществлении геодезической и картографической деятельности
осуществлении деятельности в области гидрометеорологии, мониторинга состояния и
9
загрязнения окружающей среды
10 проведении банковских, налоговых, таможенных операций и таможенного контроля
проведении официальных спортивных соревнований, обеспечении подготовки
11
спортсменов высокого класса
Из 19 в 102-ФЗ
12 обеспечении безопасности дорожного движения
№
34
Количество
измерений
22
36
44
51
3
50
16
37
46
6
3
78
35. Мнение метрологов Росстандарта
Нет формата межведомственного взаимодействия. Организации,подведомственные Минздраву, не заинтересованы в расширении
перечня
Подведомственные организации Росстандарта вносили
предложения по расширению перечня до 36-44 пунктов
По всем ли «новым» позициям реально обеспечить единство
измерений? Есть мнение, что многие методы измерения
концентрации аналитов в биологических средах на настоящий
момент не могут быть метрологически обеспечены
35
36. Видение метрологов Росстандарта ( на примере бохимических анализаторов)
совмещают в себе блок пробоподготовки, блок измерений, блок обработки результатов ипересчета их в требуемый параметр
«Классическая» поверка блока измерений не обеспечивает правильность измерений всей
автоматизированной системы
Решение производителей – использование калибраторов
Необходимо создание и развитие достаточной базы калибраторов верхнего уровня в
статусе государственных стандартных образцов, прослеживаемых к государственным
первичным эталонам или государственным первичным референтным методикам
измерений (для соответствия Приказу Минздрава России № 181н)
36
37.
38. Видение метрологов Росстандарта
Обеспечение единства измерений ВНЕ сферыгосударственного регулирования в здравоохранении
(184-ФЗ)
38
39. Видение метрологов Росстандарта Технические испытания в целях оценки соответствия
40. Видение метрологов Росстандарта Технические испытания в целях оценки соответст
41. Видение метрологов Росстандарта «Выпавшие» директивы ЕС
90/385/EEC - Медицинские активные имплантаты93/42/EEC - Медицинские приборы
98/79/EC - Медицинское оборудование in vitro
диагностики
2004/22/EC - Измерительные приборы
42. Видение метрологов Росстандарта Особенности сертификации продукции в РФ
Сложность проверки оснащенности испытательныхлабораторий измерительным оборудованием при
аккредитации (в отсутствие обязательных требований)
Заказчик определяет полноту оценки соответствия своей
продукции (в отсутствие обязательных требований
43. SWOT-анализ. Метрологи Росстандарта
Сильные стороны (Strengths)
ВУЗы и институты РАН
ФЛМ
ГНМИ
Промышленные предприятия
Возможности (Opportunities)
Курс на импортозамещение
Приоритет государственных интересов над
коммерческими
Слабые стороны (Weaknesses)
Разобщенность и конкуренция
Отсутствие единой стратегии
Отраслевые/коммерческие интересы
Недоверие
Несовершенство нормативной базы
Дефицит кадров
Угрозы (Threats)
Иностранные реагенты
Стандартизация
Иностранное ПО
Утрата компетенций в лабораториях
43
44. Видение метрологов Росстандарта. Объединить и координировать усилия
• Обеспечение единства измерений ВНЕ сферыгосударственного регулирования
• Смещение приоритетов в сторону решения накопившихся
проблем и минимизация межведомственных конфликтов
интересов
45. Видение метрологов Росстандарта Что же нужно делать.
Актуализация перечня видов измерений в сфере государственногорегулирования при осуществлении деятельности в области
здравоохранения (Постановление правительства от 16.11.2020 №1847)
Разработка новых технических регламентов для проведения технических
испытаний по оценке соответствия продукции (с указанием номенклатуры
продукции, для которой при сертификации применение данного
технического регламента является обязательным)
Проведение анализа полноты базы национальных стандартов,
применяемых при технических испытаниях для оценки соответствия
медицинских изделий, в том числе с измерительными функциями.
Разработка перспективного плана по разработке и пересмотру
национальных стандартов необходимых для проведения испытаний
продукции по новым техническим регламентам (при этом необходимо
предусмотреть проведение метрологической экспертизы всех
разрабатываемых и пересматриваемых национальных стандартов)
46. Видение метрологов Росстандарта Что же нужно делать.
Оснащение испытательных лабораторий средствамиизмерений и стандартными образцами утвержденного типа, а
также методиками измерений, позволяющими проводить
оценку соответствия документам по стандартизации на
испытываемую продукцию.
Стимулирование создания и развития метрологических служб
на базе производств. Аккредитация таких метрологических
служб, оснащение их средствами измерений и стандартными
образцами утвержденного типа, а также методиками
измерений может являться основанием для проведения
технических испытаний по оценке соответствия продукции в
упрощенном порядке (вплоть до замены технических
испытаний декларированием)
47.
48. Сегодняшние реалии. Ветеринария в 1847
49.
50.
51.
СОВЕТ ЕВРАЗИЙСКОЙ ЭКОНОМИЧЕСКОЙ КОМИССИИРЕШЕНИЕ
от 12 февраля 2016 г.№42
ОБ УТВЕРЖДЕНИИ ПЕРЕЧНЯ ВИДОВ МЕДИЦИНСКИХ
ИЗДЕЛИЙ, ПОДЛЕЖАЩИХ ОТНЕСЕНИЮ ПРИ ИХ
РЕГИСТРАЦИИ К СРЕДСТВАМ ИЗМЕРЕНИЙ
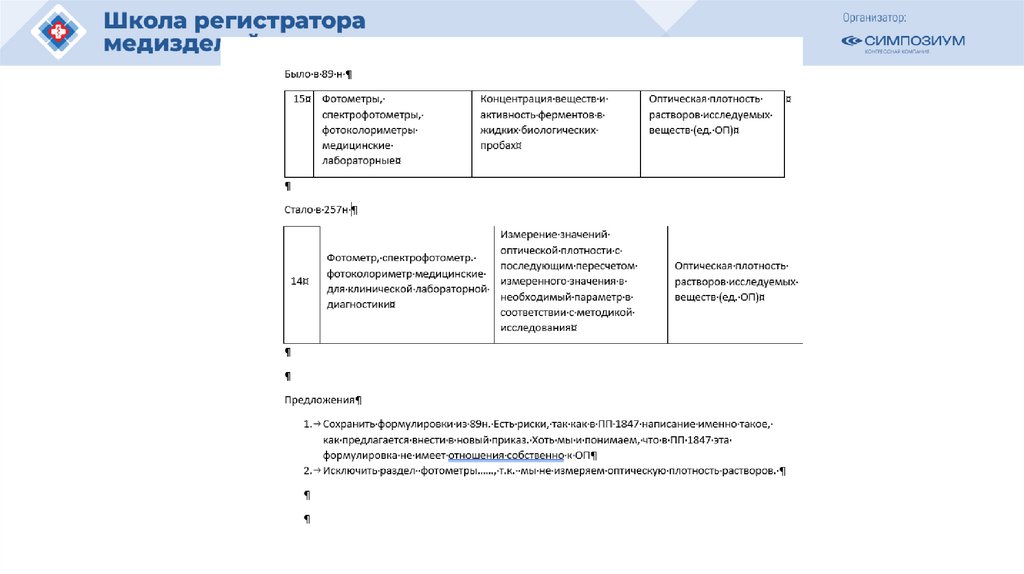
52. ПЕРЕЧЕНЬ ВИДОВ МЕДИЦИНСКИХ ИЗДЕЛИЙ, ПОДЛЕЖАЩИХ ОТНЕСЕНИЮ ПРИ ИХ РЕГИСТРАЦИИ К СРЕДСТВАМ ИЗМЕРЕНИЙ
Вид медицинскогоизделия
Медицинские
характеристики и
величины,
определяемые с
использованием
измерений
Наименования
измеряемых
величин,
единицы
1
2
3
14. Фотометр,
спектрофотометр.
фотоколориметр
медицинские для
клинической
лабораторной
диагностики
оптическая
концентрация веществ, плотность
активность ферментов растворов
в жидких
исследуемых
биологических пробах веществ (ед.
ОП)
Измерения
Диапазон
измерений
Предельно
допустимая
погрешность
4
5
6
измерение значений от 0 до 2 ед. ОП ± 0,06 ед. ОП
оптической плотности включительно
с последующим
пересчетом
измеренного
значения в
необходимый
свыше 2 до 4
параметр в
± 0,6 ед. ОП
ед. ОП
соответствии с
методикой
исследования
53. МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ПРИКАЗ от 29 апреля 2025 года № 257н Об утверждении перечня медицинских
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИПРИКАЗ
от 29 апреля 2025 года № 257н
Об утверждении перечня медицинских изделий, относящихся к средствам измерений в
сфере государственного регулирования обеспечения единства измерений, и порядка
проведения их испытаний в целях утверждения типа средств измерений
Anders Kallner Moscow 2011-03-28
54.
55.
56.
57.
58.
59. В Евросоюзе с целью регулирования в сфере измерений используются следующие две категории измерительных средств:
«device with measuring function» — изделие с измерительнойфункцией —охватывает практически все измерительные
средства; «measuring instrument» — средство измерений —
изделия, которые подпадают под действие Директивы
2004/22/ЕС
60. ДИРЕКТИВА 2004/22/ЕС ЕВРОПЕЙСКОГО ПАРЛАМЕНТА И СОВЕТА 31 марта 2004 г. об измерительных приборах Directive 2004/22/EC of the
European Parliament and of the Council of 31March 2004 on measuring instruments (Текст распространяется Европейское Экономическое
Пространство)
Исправные и привязанные (прослеживаемые) к эталонам средства измерений могут использоваться для
разнообразных измерительных задач. Те из них, которые служат интересам общества, здоровью
населения, безопасности и порядку, защите окружающей среды и потребителей, обложению налогами и
пошлинами, справедливой торговле, которые прямо или косвенно разными путями влияют на
повседневную жизнь граждан, могут требовать применения законодательно контролируемых средств
измерений (СИ).
Законодательный метрологический контроль не должен создавать барьеров в свободном движении СИ.
Касающиеся их положения должны быть идентичными во всех государствах-членах, и подтверждать
соответствие, принимаемое во всем Сообществе.
Законодательный метрологический контроль требует соответствия установленным требованиям к
характеристикам СИ. Эти требования, которым должны отвечать СИ, должны обеспечивать высокий
уровень защиты. Оценка соответствия должна обеспечивать высокий уровень доверия.
61.
Статья 1Область распространения
Настоящая Директива распространяется на приборы и системы с
измерительными функциями, определенными в специальных
инструментальных приложениях, охватывающих:
• счетчики воды (МI-001),
• газосчетчики и приборы преобразования объема (МI-002),
счетчики активной электрической энергии (МI-003),
• теплосчетчики (МI-004),
• измерительные системы для непрерывных и динамических
измерений количеств жидкостей, отличных от воды (МI-005),
автоматические взвешивающие устройства (МI006),
• таксиметры (МI-007),
• материальные меры (МI-008),
• средства линейных измерений
• (МI-009)
• и анализаторы выхлопных газов (МI-010).
62.
Регламент о медицинских изделиях (2017/745/EU) (MDR)и Регламент о медицинских изделиях для диагностики in-vitro (2017/746/ EU)
(IVDR)
приводят законодательство ЕС в соответствие с техническими достижениями,
изменениями в медицинских науках и прогрессом в области нормативного
регулирования.
Новые Регламенты создают надёжную, прозрачную и устойчивую нормативную
базу, которая является международнопризнанной, повысит клиническую
безопасность и создаст равный доступ к рынкам для производителей.
В отличие от Директив, Регламенты не подлежат внедрению в национальное
законодательство. Таким образом, MDR и IVDR снизят риски расхождений в
интерпретации на рынке ЕС. Переходные периоды предусмотрены для плавного
применения новых Регламентов. Тем не менее, вам стоит иметь в виду, что с
приближением установленного срока консультанты, местные специалисты и
нотифицированные органы будут более загружены. Для того чтобы избежать
дестабилизации рынка и позволить плавный переход от Директив к Регламенту,
было введено несколько переходных положений (ст. 120). Некоторые изделия,
сертифицированные в соответствии с Директивами (имеющие сертификаты
AIMDD/MDD), могут размещаться на рынке до 27 мая 2024 г. и быть доступными
до 27 мая 2025 г.
63. MEDDEV 2.1/5 формулируются критерии отнесения медицинских изделий к «медицинским изделиям с измерительными функциями».
a)изделие предназначено изготовителем для количественных измерений физиологических или
анатомических параметров или количественных характеристик энергии или веществ,
введенных или выведенных из человеческого организма
b) результат измерений выражен в узаконенных единицах...
c) предназначение изделия базируется на «правильности» («accuracy») измерений, заявленной
прямо или косвенно, причем несоответствие заявленной точности может привести к
существенному ухудшению здоровья и безопасности пациента.
64. К изделиям для диагностики ин витро, в том числе с измерительной функцией, предъявляются одинаковые требования:
...они должны иметь на должном уровне, принимая во внимание общийуровень развития технологии в этой области, такие характеристики как:
аналитическая чувствительность,
диагностическая чувствительность,
аналитическая специфичность,
диагностическая специфичность,
точность,
воспроизводимость,
повторяемость, включая контроль потенциальной интерференции,
пределы детекции, установленные производителем;
значения калибраторов и контрольных материалов должны быть
гарантированно воспроизводимыми при использовании имеющихся
референсных измерительных процедур и имеющихся референсных
материалов более высокого уровня».
65.
Лабораториям необходимопроверять работу любых
закупаемых устройств для
ин витро диагностики
66.
Верификация,Обеспечение объективного доказательства
того, что данное свойство соответствует
заявленным требованиям
Демонстрирует то, что инструмент или
реагент работает в лаборатории как
указано в документации. Сравнение
между заявленными и полученными
характеристиками
67. Производители и лаборатории, в принципе, используют одинаковые статистические процедуры для верификации
CLSI EP05 Оценка точности процедур количественных
измерений
CLSI EP06 Оценка линейности процедур количественных
измерений
CLSI EP09 Сравнение процедур измерения и оценка
смещения с использованием образцов пациентов
CLSI EP15 Верификация работы лабораторного оборудования
пользователем для оценки прецизионности и правильности
CLSI EP35 оценка эквивалентности или пригодности типов
образцов для медицинских лабораторных процедур
измерений
Статистические методы
различаются
68. ISO GUIDE 80:2014 Руководство по внутрилабораторному изготовлению материалов для контроля качества (МКК)
• Выпуск референсных материалов…. Обеспечениематериалами, необходимыми для ежедневной демонстрации
того, что … система измерения находится под статистическим
контролем.
• Такие материалы не требуют характеристики с помощью
официальных метрологических процедур и могут быть
изготовлены «дома» для выполнения необходимых
контрольных требований.
Тарасенко Ольга Анатольевна
69.
В настоящем Руководстве определены основные характеристики стандартных образцов для контроля качества (КК) и
описаны процессы, с помощью которых эти стандартные образцы могут быть изготовлены квалифицированным персоналом
в рамках предприятия, в котором они будут использоваться (т.е. там, где исключается нестабильность от условий
транспортирования). Содержание настоящего Руководства применимо также к материалам, стабильным по своей природе,
которые могут транспортироваться в другие места без риска возникновения значительных изменений в значениях
исследуемых свойств. Настоящее Руководство предназначено, в первую очередь, для персонала лабораторий, связанного с
изготовлением и применением материалов для целей внутреннего контроля качества. Изготовление МКК в тех случаях, где
транспортирование является необходимым звеном системы поставок, например, на участки лаборатории, находящиеся в
разных местах или для программы проверки квалификации лабораторий, должно отвечать соответствующим требованиям
ISO Guide 34[1] и 35[2]. Производство стандартных образцов (СО), подробно описанное в ISO Guide 34[1] и 35[2], также
применимо к изготовлению материалов для контроля качества (МКК). Однако, требования для МКК «предприятия» менее
жёсткие, чем для сертифицированного стандартного образца (ССО). Изготовление МКК должно включать оценивание
однородности и стабильности и ограниченную характеризацию материала для того, чтобы перед его применением дать
представление о значениях его свойств и их изменениях. В настоящем документе установлены критерии качества, которым
должен удовлетворять материал для соответствия своему назначению - демонстрации нахождения системы измерения под
статистическим контролем. Рекомендации по использованию таких материалов, например, создание контрольной карты,
достаточно полно описаны в других источниках [3],[4],[5], [6] и не включены в настоящее Руководство. Состав и структура
настоящего Руководства включают общую информацию об изготовлении МКК в основных главах и рассмотрение конкретных
примеров для ряда областей в приложениях. Рассмотрение конкретных примеров – это не законченная «инструкция по
технологическим процессам», а освещение некоторых ключевых моментов в процессе изготовления МКК. Исследования
конкретных примеров отличаются по сложности и детализации, включая специфичную для отрасли терминологию, но дают
определённый объём информации для сведения персонала лаборатории. Предполагается, что специалисты, занимающиеся
изготовлениям МКК, получат определённые знания о типе материала, который должен быть приготовлен, и возможных
проблемах, связанных с матричными эффектами, загрязнением и т.д.
Тарасенко Ольга Анатольевна
70. Кто платит?
1. Есть Приказ Минздрава России от 29 апреля 2025 года № 257н «Об утверждении перечнямедицинских изделий, относящихся к средствам измерений в сфере государственного
регулирования обеспечения единства измерений, и порядка проведения их испытаний в
целях утверждения типа средств измерений».
2. Бюджетные средства выделяются на прохождение своевременного метрологического контроля (поверки) в
соответствии с инструкцией производителя медицинских изделий, отнесенных к Средства измерения и
внесенных в Перечень медицинских изделий, относящихся к средствам измерений в сфере государственного
регулирования обеспечения единства измерений, должны.
3. Многие производители анализаторы имеют двойного назначения – для медицины и ветеринарии.
Следовательно, как то соответствуют и внесены в Аршин. Дело производителя. Но почему за их деяния
должны необоснованно платить МО – это нецелевка!!!
71.
Практикум 2СТРАТЕГИЧЕСКИЕ НАПРАВЛЕНИЯ СТАНДАРТИЗАЦИИ МЕДИЦИНСКИХ ИЗДЕЛИЙ В
2026 ГОДУ: КЛЮЧЕВЫЕ МОМЕНТЫ
Ольга Тарасенко, д.м.н., Заместитель директора Федерации
лабораторной медицины России, профессор кафедры госпитальной
эпидемиологии, медицинской паразитологии и тропических
болезней ФГБОУ ДПО РМАНПО Минздрава РФ
72.
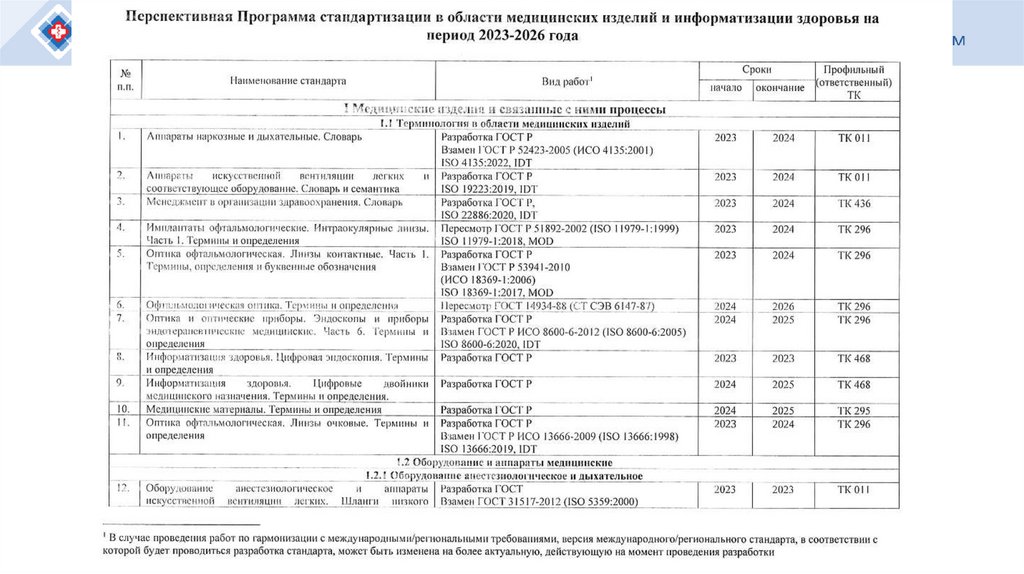
Какова суть и состояние реализации перспективного плана национальнойстандартизации в сфере обращения МИ до 2027 года
Каковые предложения регулятора в сфере обращения МИ и регулятора в сфере
стандартизации на 2026 год: как предложения корреллируют между собой
О ежегодных планах ТК Росстандарта на 2026 год: что они дадут производителям МИ в
плане перспективы появления новых ГОСТов, в том числе разрабатываемых вне
Росстандарта Комитетами в сфере здравоохранения
Национальные ГОСТы и национальные стандарты на основе международных
стандартов: идентичные или модернизированные, как пользоваться на практике
В чем особенности и возможности оценки соответствия МИ для целей импорта
Особенности терминологии стандартов и НПА, разрабатываемых Минздравом РФ
О подходах Росстандарта к разработке стандартов и приказов регулятора в сфере
обращения МИ
73.
74.
75.
76.
77.
78.
79.
80. Классификаторы для МИ
В процессе обращения МИ ИВД вовлечены 6классификаторов
ТНВЭД,
ОКПД2, НКМИ, КТРУ, ФСЛИ, НМУ.
Все эти справочники необходимы в процессах
функционирования как производителей, поставщиков и
потребителей ( КЛД и клинических учреждений ), так и
разнообразных регулирующих и контролирующих госорганов.
ВЭД, процессы закупок и продажи, выдача РУ,
ограничения и льготы, налоги и пошлины.
81. Основные проблемы классификаторов
В настоящий момент систематика классификаторов не в полноймере отражает современное состояние медицинской отрасли.
Как
результат новые МИ включаются не в корректные разделы.
Классификаторы не по всем изделиям коррелируют друг с
другом, а так же не всегда синхронно изменяются, в том
числе не синхронно изменяются алгоритмы перехода с одного
справочника на другой
Не смотря на изменения классификаторов и коррекции
классификаций, в карточках МИ не корректируют коды
классификации.
Это
приводит к накоплению внутри одного кода несоответствующих МИ.
Это вынуждает использовать для одного и того же типа МИ несколько
кодов ОКПД2 ( так сделано в ПП 719 и КТРУ )
Изменения в классификаторах не всегда синхронно отражаются
82. Реалии действия классификаторов
Сложности отнесения МИ к нужному кодуЕсли
правильный код отсутствует, то часто пытаются найти
другой, иногда их несколько.
Производители могут либо ради получения льгот, либо
ради избегания ограничении, либо для организации вместе
с закупщиками заградительных конкурсов присваивать
нужные себе коды.
Регуляторы, изменяя практику присваивания новых кодов
МИ, часто не учитывают, то что эти изменения
затрагивают льготы для производителей из-за отсутствия
аналогичных изменений в других справочниках или НПА.
Возникают сложности или блокирование закупки нужных для
медучреждениям МИ.
83. ТНВЭД
Этот справочник гармонизирован с аналогичным международнымсправочником. В нем содержатся достаточно общие коды и реже
возникают проблемы с присвоения кодов. Однако есть примеры,
когда даже в общих кодах сложно найти правильный. Как
результат присвоение идет по категории «прочие». Пример:
автоматизированные дозирующие станции.
Раздел
XVI. Машины, оборудование и механизмы; электротехническое
оборудование; их части; звукозаписывающая и звуковоспроизводящая
аппаратура, аппаратура для записи и воспроизведения телевизионного
изображения и звука, их части и принадлежности (Группы 84-85)
84
- Реакторы ядерные, котлы, оборудование и механические
устройства; их части
8479
- Машины и механические устройства, имеющие индивидуальные
функции, в другом месте данной группы не поименованные или не
включенные
8479899707
- прочие
84. ОКПД2
Один из самых проблемных справочников для МИ ИВД, при этомоснова для множества НПА по начислению налогов,
предоставлению льгот и ограничений. Это чисто российский
справочник, который отсутствует даже в странах ЕАЭС.
Долгое
время для МИ ИВД присваивались коды, содержащие слово
«диагностический», при этом по смыслу они не соответствовали.
Сейчас
появились правильные коды в правильных группах «Анализаторы
для диагностики инвитро» 26.51.53.141 и 20.59.52.195 — Реагенты для
определения аналитов для диагностики in vitro
Но
до сих пор используется не верный код 26.60.12.119 — Аппараты
электродиагностические прочие
РУ РЗН 2022/16430, 27.06.2025, Система для автоматического выделения и
очистки нуклеиновых кислот из биологического материала Auto-Pure для
диагностики in vitro
Почему
код 26.51.53.142 — Оборудование для диагностики in vitro
попал в группу анализаторов? Для центрифуг есть свой код и
85. НКМИ
НКМИ, так же не соответствует международнымклассификаторам. Страны ЕАЭС используют GMDN. НКМИ должен
отражать более четкую картину по МИ, чем общие
классификаторы, но к сожалению проблемы в нем те же самые.
Пример: 5.01.09 Анализаторы ПЦР
173910Амплификатор изотермический ИВД, лабораторный
173930Амплификатор изотермический ИВД, лабораторный, автоматический
215980Амплификатор нуклеиновых кислот термоциклический (термоциклер)
ИВД, лабораторный
216000Амплификатор нуклеиновых кислот термоциклический (термоциклер)
ИВД, ручной
216020Амплификатор нуклеиновых кислот термоциклический (термоциклер)
ИВД, лабораторный, полуавтоматический
318650Устройство для отделения магнитных частиц ИВД
318660Устройство для подготовки образцов нуклеиновых кислот ИВД
319240Устройство для отделения магнитных частиц ИВД, полуавтоматическое
86. НКМИ
Какое отношение имеет оборудование для выделенияДНК/РНК к анализаторам?
Как разделить по смыслу амплификатор ручной,
полуавтоматический и ручной?
В
результате до сих пор одним и тем же по типу амплификаторам
назначают разные коды НКМИ 215980 и 216020, а это приводит к
манипуляциям в закупках
Почему простой термоциклер отнесен к классу ручной
амплификатор, когда у него нет функции анализа, он
только циклически осуществляет нагрев/охлаждение?
Почему 332060 Секвенатор нуклеиновых кислот ИВД,
секвенирование нового поколения находится в группе 5.05
Реагенты/оборудование/расходные материалы
общелабораторные ИВД, а не в группе Анализаторы?
87. НКМИ
Большую сложность создает отнесение автоматизированныхдозирующих станций, которые могут менять своё назначение в
зависимости от использования разных принадлежностей
5.01.09
Анализаторы ПЦР
318650 Устройство для отделения магнитных частиц ИВД
318660 Устройство для подготовки образцов нуклеиновых кислот ИВД
319240 Устройство для отделения магнитных частиц ИВД,
полуавтоматическое
319250 Устройство для подготовки образцов нуклеиновых кислот ИВД,
полуавтоматическое
5.01.10
Прочие анализаторы ИВД
247380 Система для перемещения лабораторных контейнеров/предметных
стекол роботизированная ИВД
Проблема в этом разнообразии в том, что когда объявляется
конкурс, то указывается код НКМИ. В случае универсальных
станций может оказаться, что прибор по функции подходит, а
88.
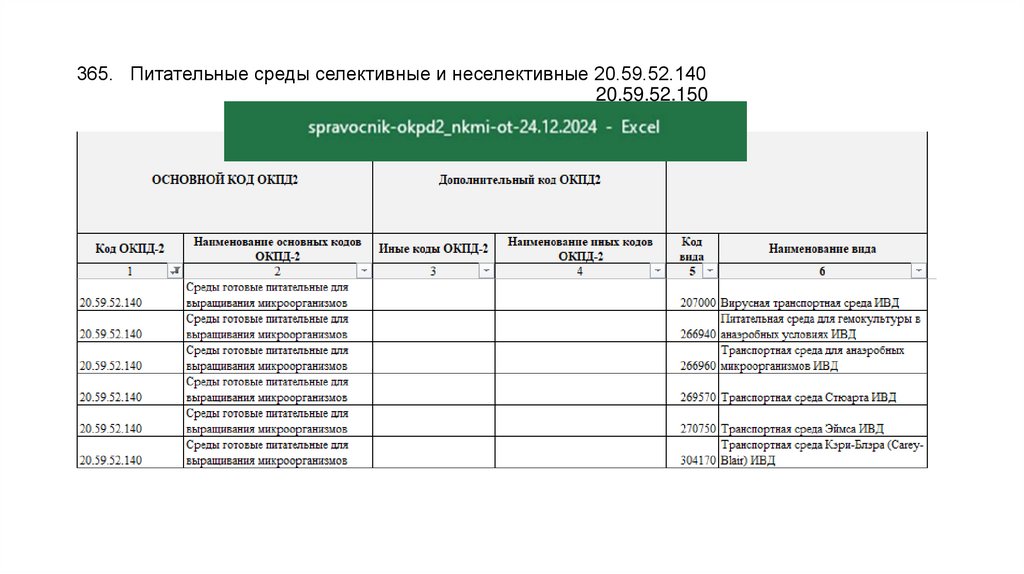
89. 365. Питательные среды селективные и неселективные 20.59.52.140 20.59.52.150
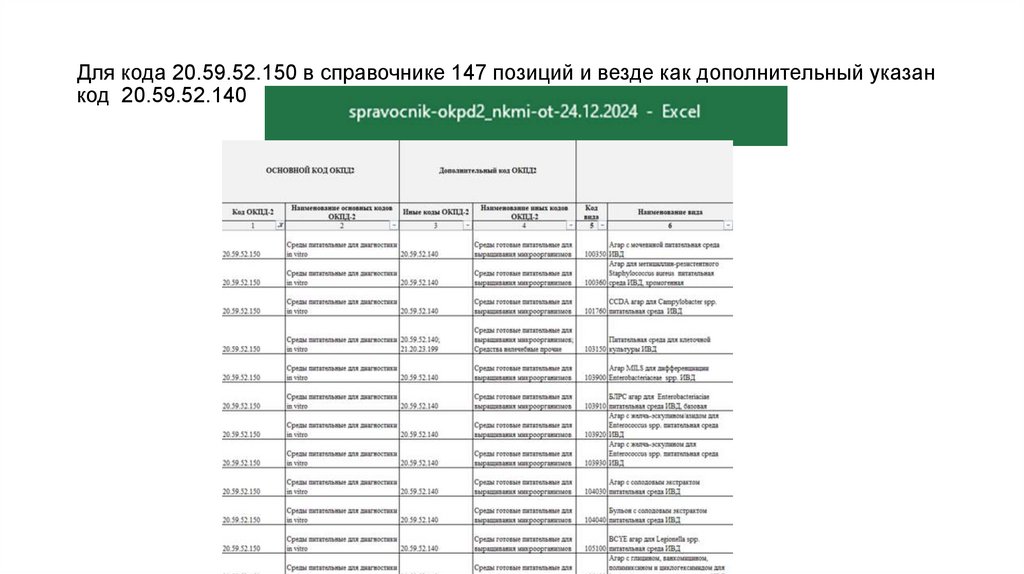
90. Для кода 20.59.52.150 в справочнике 147 позиций и везде как дополнительный указан код 20.59.52.140
91. ПП 719 20.59.52.140 "Среды готовые питательные для выращивания микроорганизмов" - не менее 60 баллов;
ПП 71920.59.52.140 "Среды готовые питательные для выращивания микроорганизмов" - не менее 60 баллов;
92. В реестре на сайте РЗН для ОКПД2 20.59.52.140 имеется 287 записей о зарегистрированных МИ
Основа бактериологических питательных средсухая (ГМФ-основа) по ТУ 9385-057-394844742009
"Питательная среда для выделения шигелл и
сальмонелл сухая (Бактоагар Плоскирева) по
ТУ 20.59.52-112-20401675-2019
"Система транспортная со средой Эймса по ТУ
20.59.52-003-18847814-2021
Транспортная среда для различных
микроорганизмов, полужидкая, готовая к
применению (среда типа Эймса) по ТУ 9385061-39484474-2010
Питательная среда для культивирования
грибов, агар Сабуро в модификациях
(классический, Эммонса, с мальтозой, с 5%
хлорида натрия, с 3 % хлорида натрия), в
бутылках и чашках Петри, готовую к
применению» по ТУ 9385-022-39484474-2012
Питательная среда для определения
чувствительности микроорганизмов к
противомикробным лекарственным средствам
(Мюллера-Хинтон агар) готовая к применению
(в бутылках и чашках Петри)» по ТУ 9385-06839484474-2012
Набор для приготовления питательной среды
для выделения и культивирования
микобактерий (среда Финн-II) по ТУ 9385-03939484474-2012
Питательная среда для выделения
энтеробактерий сухая. Агар Эндо по ТУ 9385053-39484474-2012
Агар хромогенный для Streptococcus B
(S.agalactiae) по ТУ 20.59.52-033-11161893-2024
"Среда с адсорбентом для культивирования
аэробных микроорганизмов во флаконах, на
системе автоматической микробиологической
для in vitro диагностики
"Среды питательные во флаконах для
культивирования и выявления
микроорганизмов к анализаторам культур
крови автоматическим бактериологическим
серии LTS-BMC
Питательная среда для культивирования
грибов, бульон Сабуро в модификациях
(классический, Эммонса), готовая к
применению по ТУ 9385-023-39484474-2012
Однофазные системы для гемокультур в
модификациях готовые к применению по ТУ
9385-072-39484474-2012
Питательная среда для выделения и
культивирования Lactobacillus spp. МРС в
модификациях, жидкая, готовая к
применению по ТУ 9385-018-39484474-2012
Питательный бульон для культивирования
микроорганизмов, мясо-пептонный бульон в
модификациях, готовый к применению (мясопептонный бульон и мясо-пептонный бульон с
1% глюкозы) по ТУ 9385-040-39484474-2012
Питательная среда для культивирования
грибов сухая (бульон Сабуро) по ТУ 9385-03139484474-2012
Питательная среда для выделения и
первичной идентификации облигатноанаэробных сульфитредуцирующих бактерий
рода Clostridium сухая (среда Вильсона-Блера)
по ТУ 9385-064
Пептон для бактериологических питательных
сред сухой по ТУ 9385-060-39484474-2009
93. Постановление правительства РФ от 17 июля 2015 №719 О подтверждении производства промышленной продукции на территории
РоссийскойФедерации (с изменениями на 18 сентября 2025 года
• VII. Медицинские изделия
из 32.50.13.190 Фотометрические анализаторы и биологические микрочипы к нему для молекулярногенетической диагностики инфекционных заболеваний; приборы, оборудование и устройства прочие, не
включенные в другие группировки (тест-системы на микрочипах для лабораторной диагностики социальнозначимых инфекционных заболеваний и фармакогеномики) (…соблюдение процентной доли стоимости
использованных при производстве (изготовлении) иностранных товаров - не более 50 процентов цены
товара; наличие прав на программное обеспечение …)
• из 26.60.12.119 Аппараты для выделения нуклеиновых кислот; интегрированная платформа для
проведения ПЦР-диагностики в автоматическом режиме
• из 26.51.82.160 Микротомы ротационные; микротомы - криостаты с заморозкой для срочных биопсий
• из 26.51.53.141, 26.51.53.190, 26.60.12.119 Прибор для проведения полимеразной цепной реакции (ПЦР) в
режиме реального времени
94.
Для ОКПД 2 32.50.13.190 представлено 1375 НКМИ, но только нет среди нихФотометрические анализаторы и биологические микрочипы к нему для молекулярно-генетической диагностики
инфекционных заболеваний; приборы, оборудование и устройства прочие, не включенные в другие группировки (тестсистемы на микрочипах для лабораторной диагностики социально-значимых инфекционных заболеваний и
фармакогеномики
Ищем Прибор для проведения полимеразной цепной реакции (ПЦР) режиме реального времени из
26.51.53.141, 26.51.53.190, 26.60.12.119
Кода 26.51.53.190 НЕТ в справочнике
26.51.53.141
Анализаторы для диагностики in vitro
Анализатор биопсийного образца
386380 наномеханический ИВД
26.51.53.141
Анализаторы для диагностики in vitro
370690 Анализатор кала ИВД
95. Стандарты оснащения МО: какие есть риски в обеспечении оснащения клиник, связанные с закупками МИ ИВД с привязкой к стандартам
оснащения по НКМИ96.
97.
98.
99.
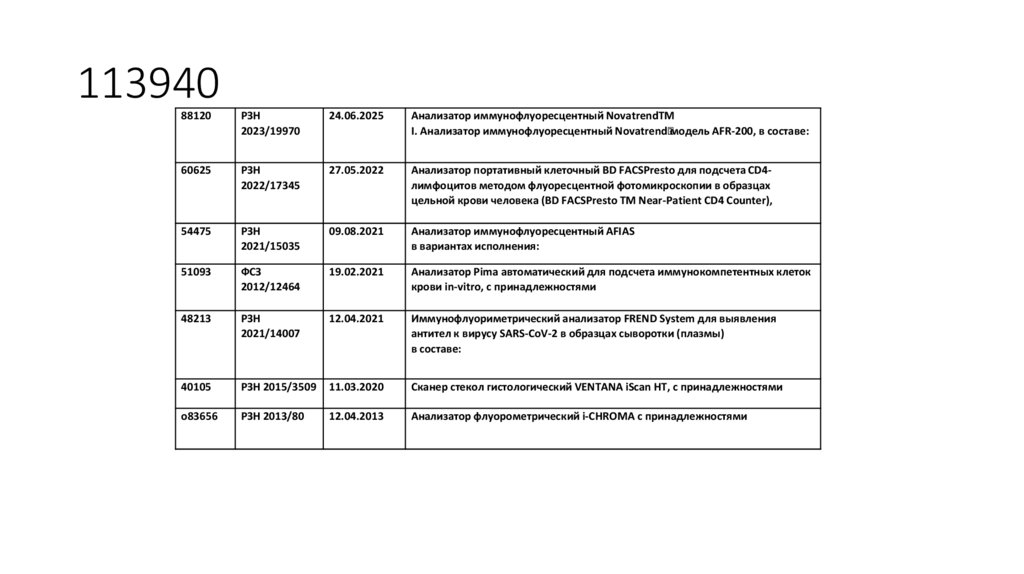
100. 113940
88120РЗН
2023/19970
24.06.2025
Анализатор иммунофлуоресцентный NovatrendTM
I. Анализатор иммунофлуоресцентный Novatrendмодель AFR-200, в составе:
60625
РЗН
2022/17345
27.05.2022
Анализатор портативный клеточный BD FACSPresto для подсчета CD4лимфоцитов методом флуоресцентной фотомикроскопии в образцах
цельной крови человека (BD FACSPresto ТМ Near-Patient CD4 Counter),
54475
РЗН
2021/15035
09.08.2021
Анализатор иммунофлуоресцентный AFIAS
в вариантах исполнения:
51093
ФСЗ
2012/12464
19.02.2021
Анализатор Pima автоматический для подсчета иммунокомпетентных клеток
крови in-vitro, с принадлежностями
48213
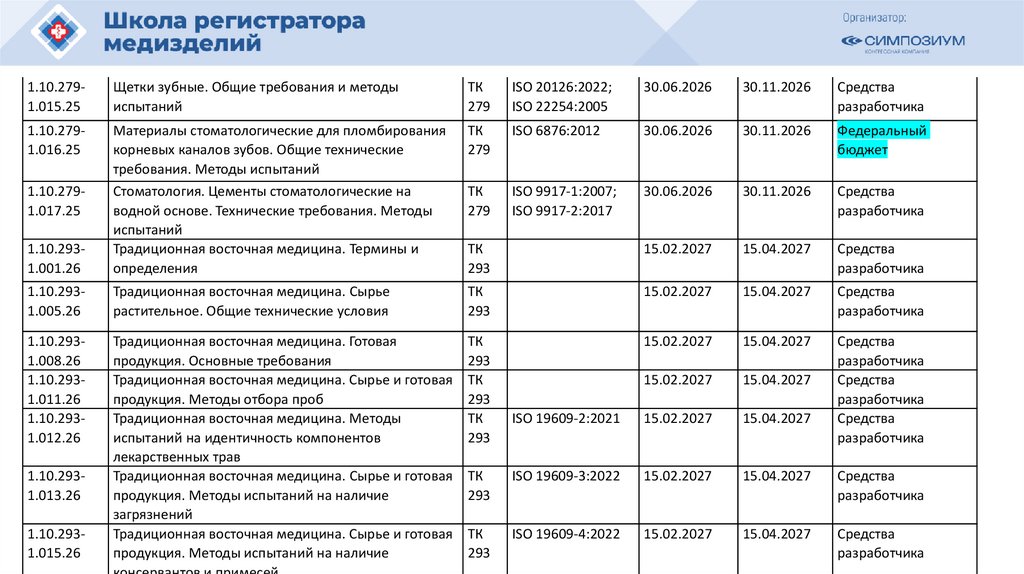
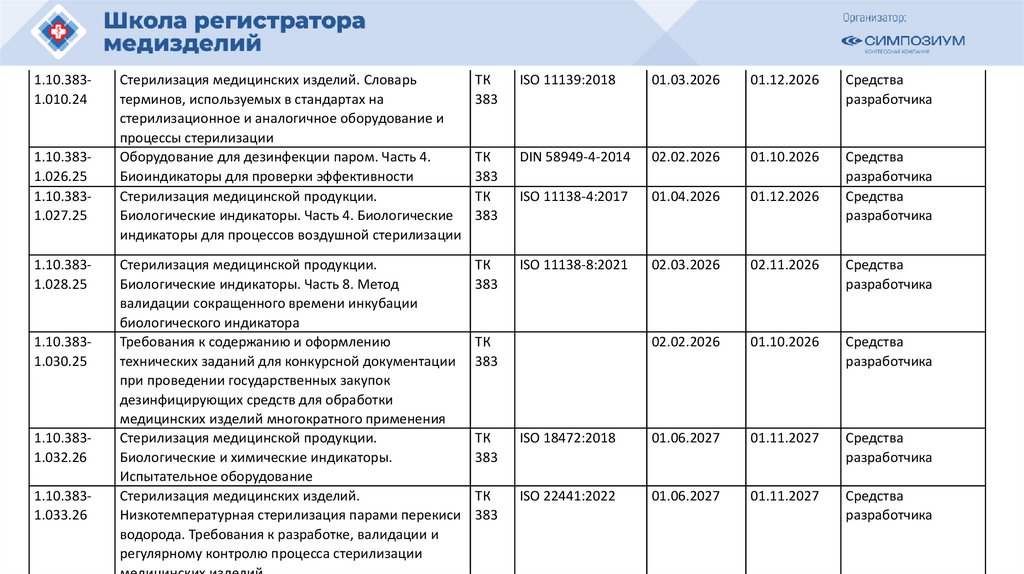
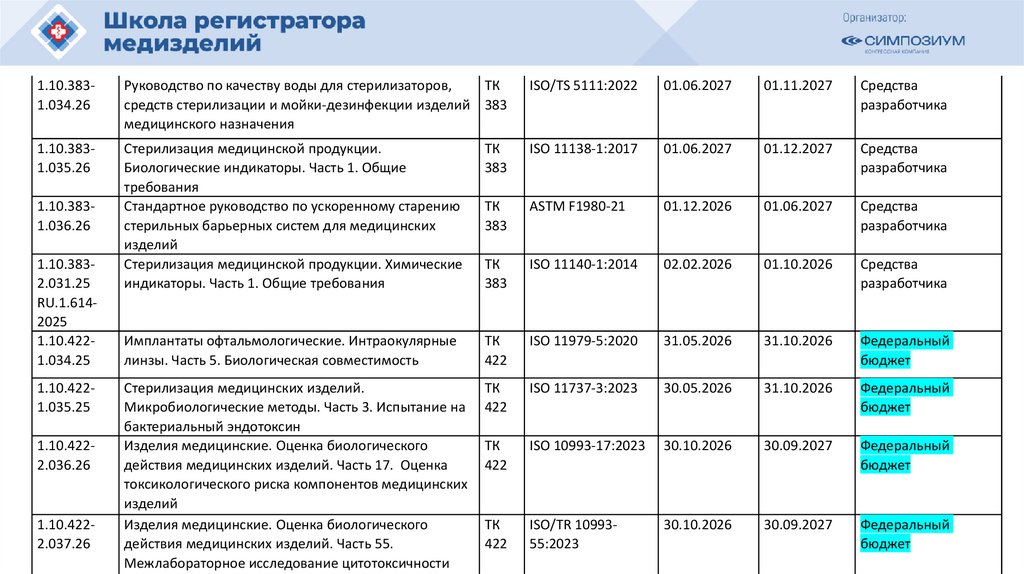
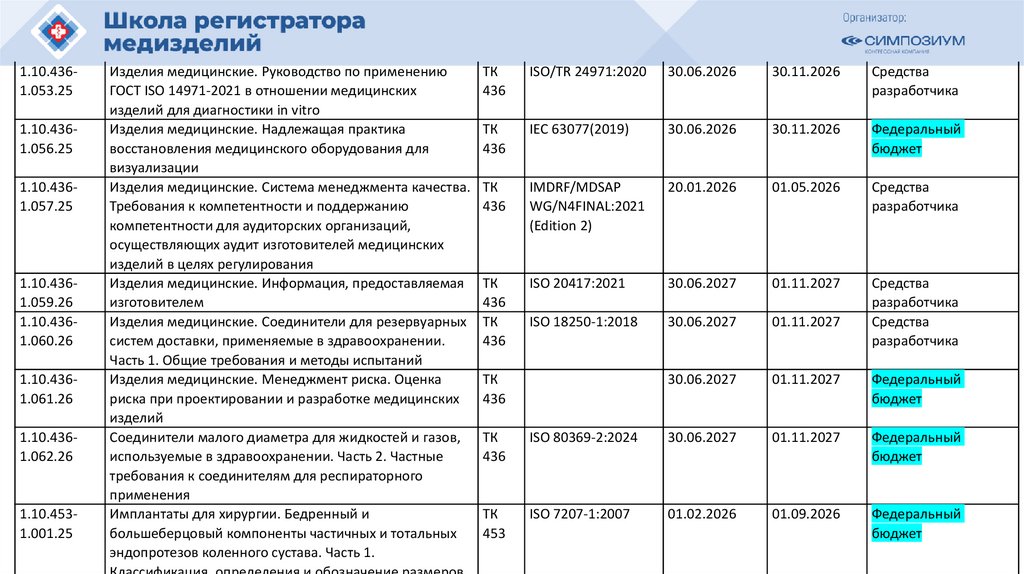
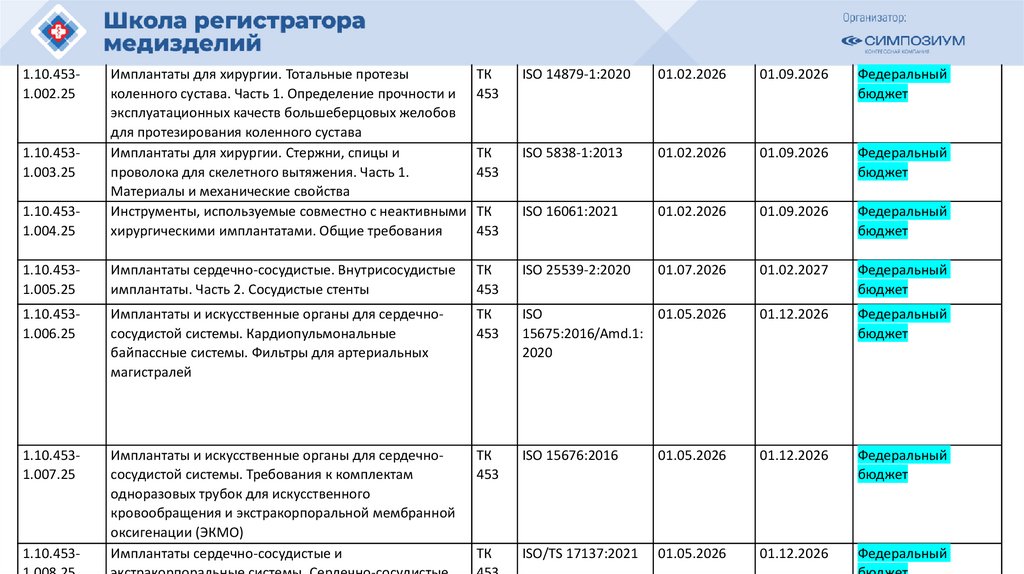
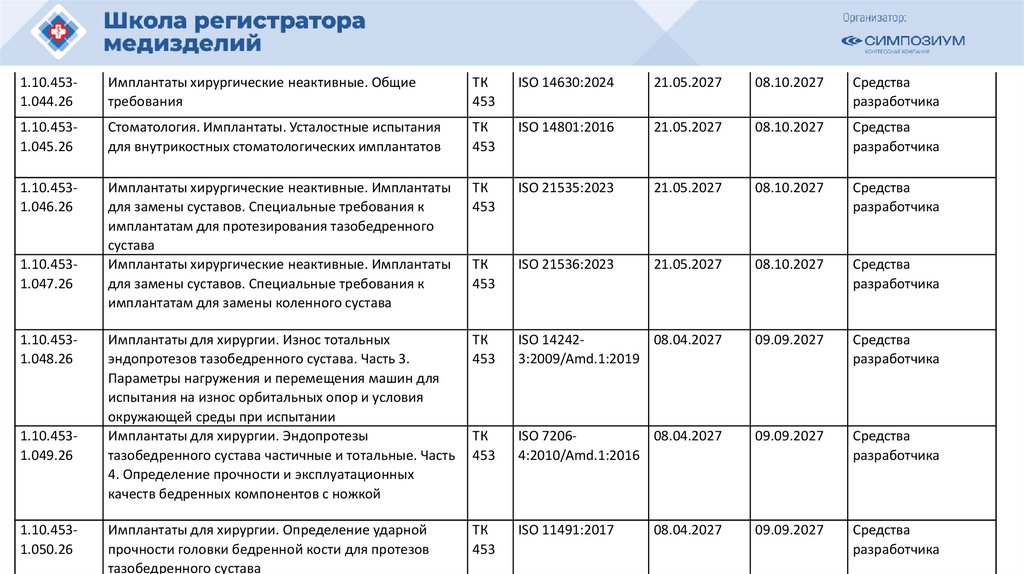
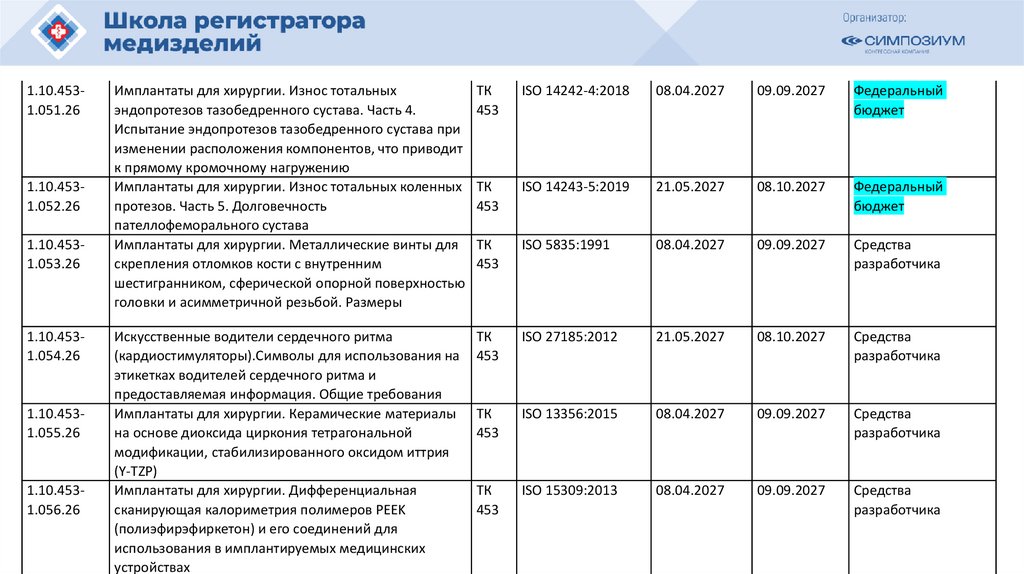
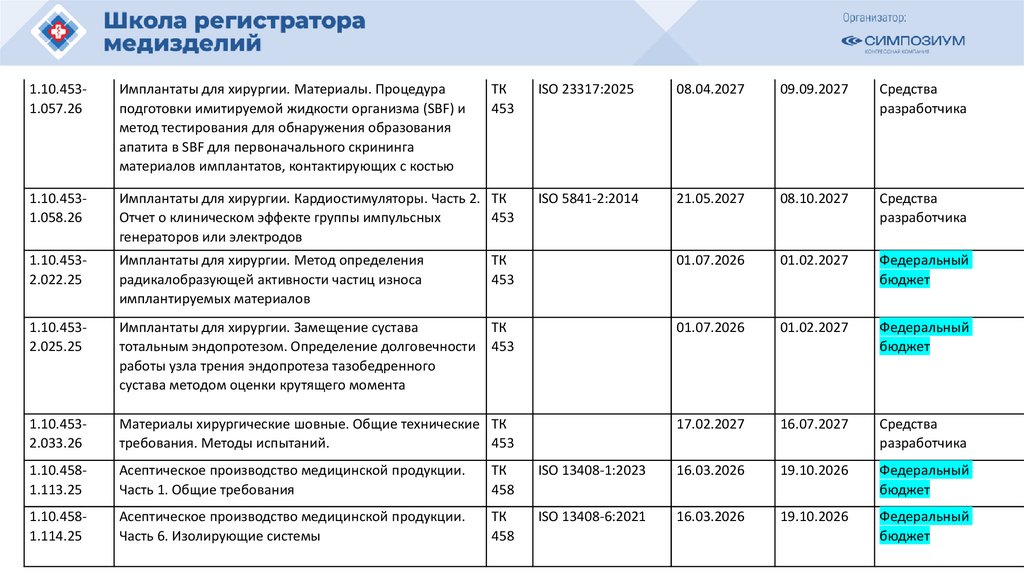
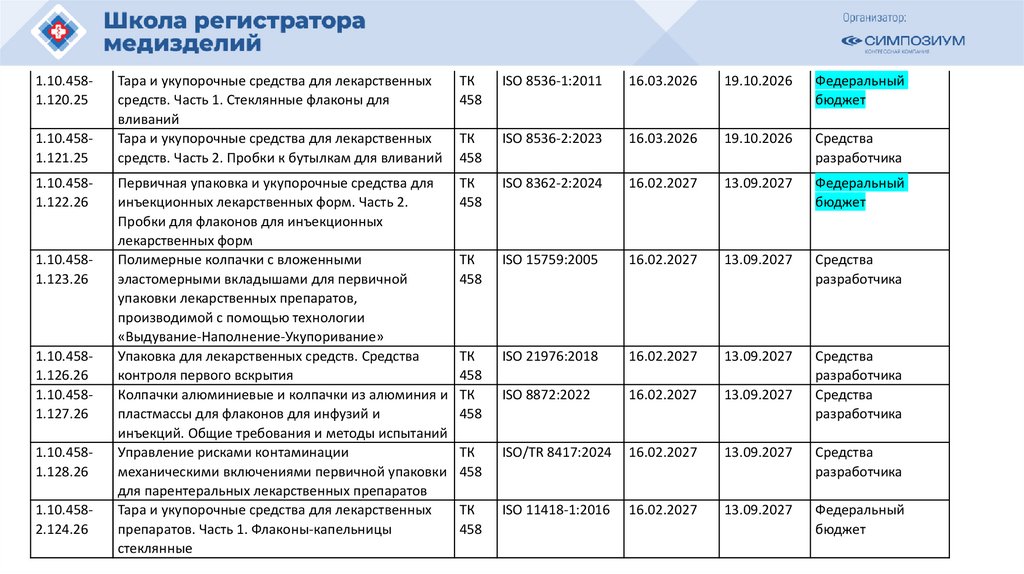
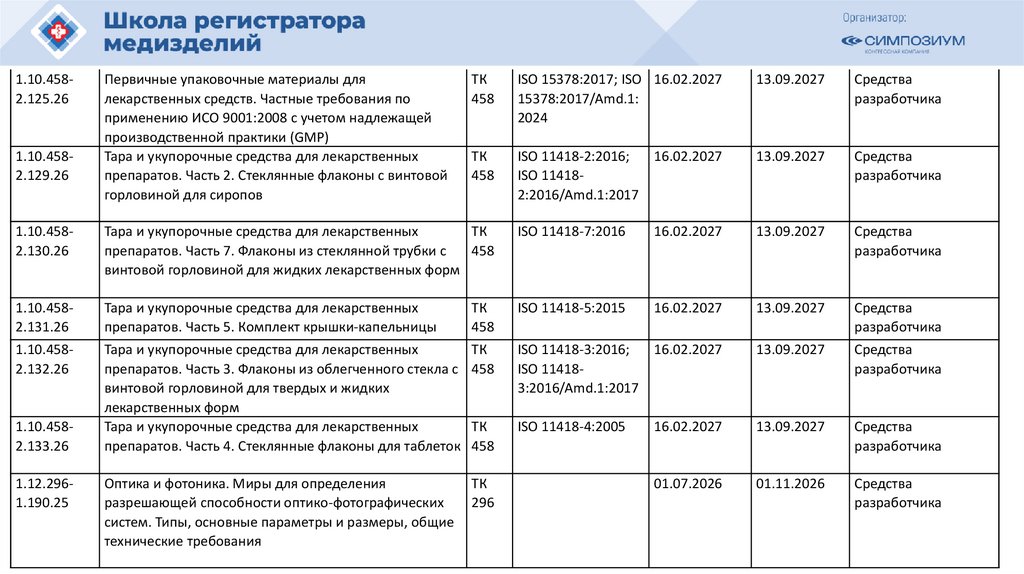
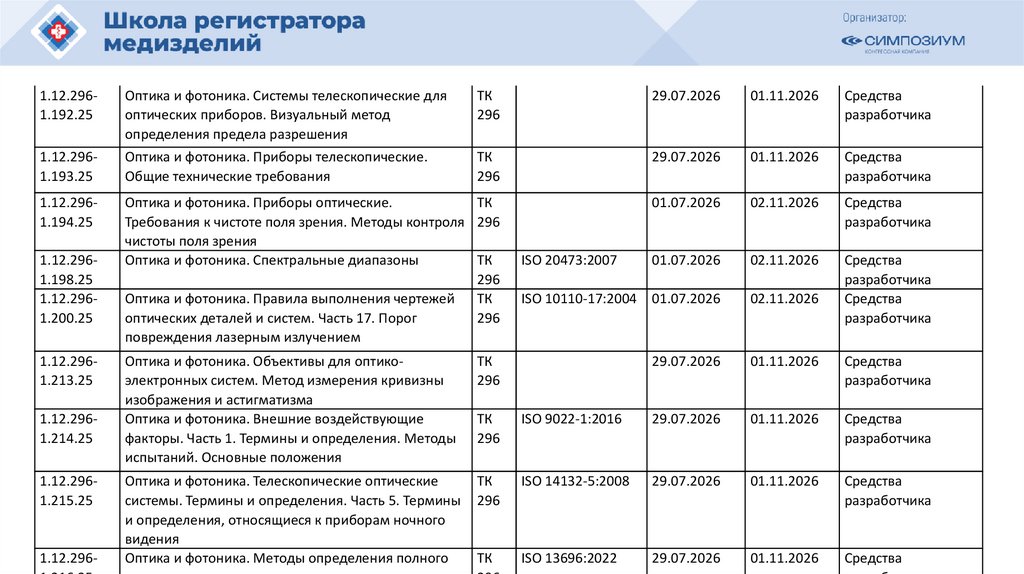
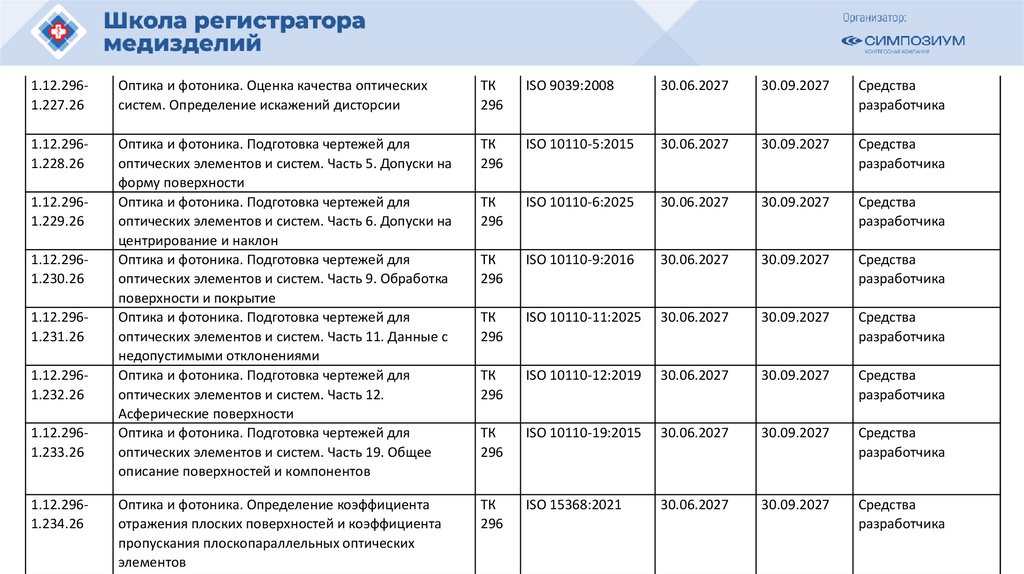
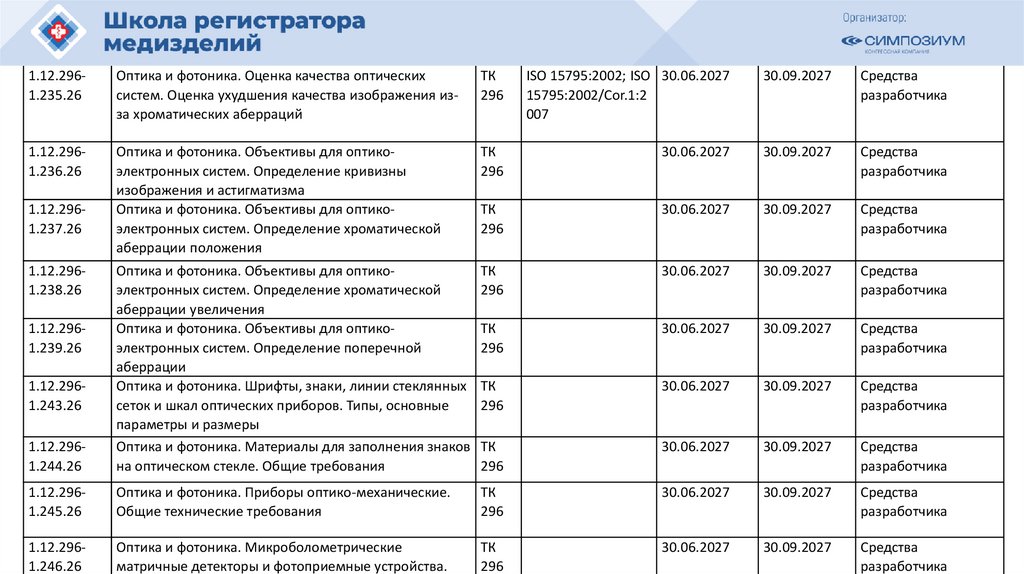
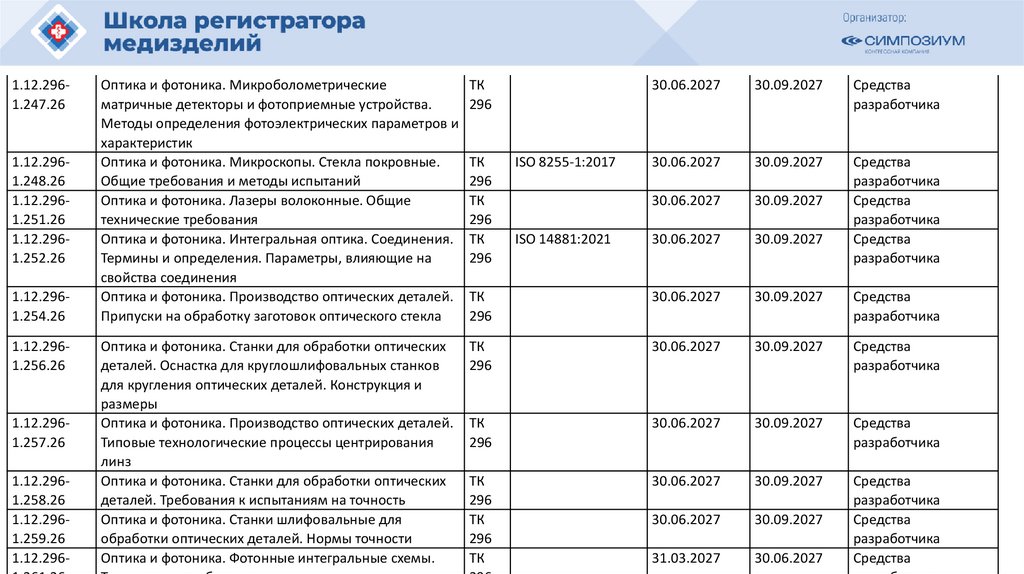
РЗН
2021/14007
12.04.2021
Иммунофлуориметрический анализатор FREND System для выявления
антител к вирусу SARS-CoV-2 в образцах сыворотки (плазмы)
в составе:
40105
РЗН 2015/3509
11.03.2020
Сканер стекол гистологический VENTANA iScan HT, с принадлежностями
o83656
РЗН 2013/80
12.04.2013
Анализатор флуорометрический i-CHROMA с принадлежностями
101. 113990
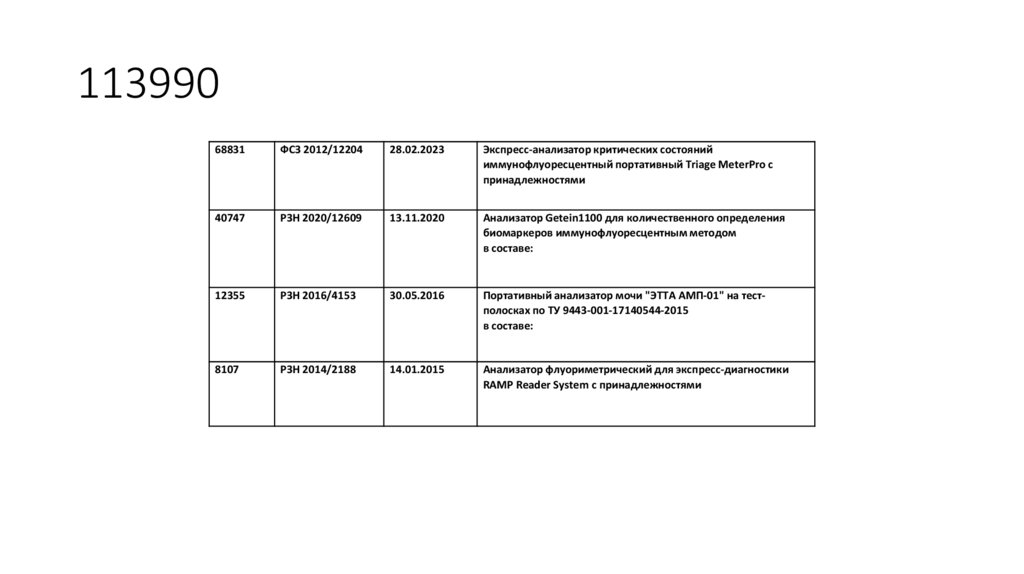
68831ФСЗ 2012/12204
28.02.2023
Экспресс-анализатор критических состояний
иммунофлуоресцентный портативный Triage MeterPro с
принадлежностями
40747
РЗН 2020/12609
13.11.2020
Анализатор Getein1100 для количественного определения
биомаркеров иммунофлуоресцентным методом
в составе:
12355
РЗН 2016/4153
30.05.2016
Портативный анализатор мочи "ЭТТА АМП-01" на тестполосках по ТУ 9443-001-17140544-2015
в составе:
8107
РЗН 2014/2188
14.01.2015
Анализатор флуориметрический для экспресс-диагностики
RAMP Reader System с принадлежностями
102.
И остается нерешенным вопрос, когдаодно МИ ИВД, да и многие МИ
соответствуют нескольким видам….
103. Что делать?
Необходимо в рамках Минпромторга создать организацию,координирующую создание, модернизацию и синхронизацию
справочников, а также коррекцию содержимого
справочников и НПА.
Это
может быть Росстандарт
ИММ,
который показал способность создания бальной системы для
МИ ИВД
Привлечь
к этой работе соответствующие общественные организации
объединяющие производителей и потребителей МИ
104.
Практикум 3ПЕРСПЕКТИВНЫЕ СТАНДАРТЫ В 2026 ГОДУ: ВЛИЯНИЕ НА ПРОИЗВОДИТЕЛЕЙ МИ
Ольга Тарасенко, д.м.н., Заместитель директора Федерации
лабораторной медицины России, профессор кафедры госпитальной
эпидемиологии, медицинской паразитологии и тропических
болезней ФГБОУ ДПО РМАНПО Минздрава РФ
105.
Ключевые вопросы:Какие есть новости из практики новых стандартов (ПНС): состояние разработки и особенности
внедрения и действия на практике, что они меняют для производителей МИ в 2026 году
Как устроена работа Технических Комитетов по разработке стандартов для подтверждения
соответствия МИ: возможности для развития отрасли МИ и исключения риска внезапности
появления стандарта, особенно для МИ, уже проходящих оценку соответствия
Чем определяются сроки введения ГОСТов: возможно ли применять стандарты до их введения в
действие, чтобы при подаче КРД в РЗН не иметь сложностей в связи с проведенными испытаниями
Производителю на заметку: алгоритм утверждения и введения в действие стандартов в России
Эквивалентность стандартов: какова позиция Росстандарта и Росаккредитации, порядок
определения эквивалентности и применимости ГОСТов испытательными лабораториями без
прохождения процедур Росаккредитации
Можно ли применять на территории РФ национальные стандарты по МИ, которые утратили силу и
не являются эквивалентными вновь изданным стандартам
106.
107. Как разрабатывают стандарты
1 Разработка2 Публичное обсуждение
3 Доработка
4 Экспертиза
Этап
1.1 Организация разработки
1.2 Разработка первой редакции
1.3 Отправка в секретариат ТК на публичное обсуждение
Ответственный
Разработчик
Разработчик
Разработчик
2.1 Размещение уведомления о разработке проекта
национального стандарта, рассылка проекта членам ТК
Секретариат ТК, ФОИВ в сфере стандартизации
2.2 Рассмотрение проекта и составление отзывов
Члены ТК, заинтересованные лица
2.3 Завершение публичного обсуждения
Секретариат ТК, ФОИВ в сфере стандартизации
3.1 Редактирование проекта в соответствии с отзывами
Разработчик
3.2 При необходимости рассмотрение второй и последующих
редакций
Разработчик, члены ТК
3.3 Подготовка окончательной редакции
4.1 Экспертиза проекта
4.2 Составление экспертного заключения и мотивированного
предложения по результатам экспертизы
Разработчик
Члены ТК
Секретариат ТК
4.3 Достижение консенсуса
5 Подготовка к утверждению, 5.1 Нормоконтроль
утверждение
5.2 Отправка комплекта документов в ФОИВ в сфере
стандартизации
5.3 Принятие решения об утверждении
5.4 Регистрация
5.5 Опубликование
ТК
Разработчик, уполномоченная организация, одобренная
организация (в случае проведения ею нормоконтроля)
Секретариат ТК
ФОИВ в сфере стандартизации
ФОИВ в сфере стандартизации
ФОИВ в сфере стандартизации
108.
Дату введения национального стандарта в действие устанавливают в организационнораспорядительном документе Росстандарта, с учетом времени, необходимого дляреализации организационно-технических мероприятий, проводимых при внедрении
данного стандарта перед его практическим применением, но не ранее тридцати дней
после утверждения этого стандарта.
При этом срок действия национального стандарта не ограничивают, за исключением
случаев, когда это обусловлено законодательными или иными нормативными
правовыми
актами
Российской
Федерации.
В случае утверждения стандарта, разработанного взамен стандарта, включенного в
доказательную базу технического регламента или в соответствии с ПП РФ № 2425 "Об
утверждении единого перечня продукции, подлежащей обязательной сертификации,,
дата введения в действие устанавливается По решению федерального органа
исполнительной власти в сфере стандартизации при установлении даты введения
национального стандарта в действие предоставляется право досрочного применения
национального стандарта со дня его опубликования.
В
вышеуказанном организационно-распорядительном документе Росстандарта,
устанавливают закрепление вновь утвержденного национального стандарта за ТК, а
также, где применимо, приводят данные об эквивалентности стандарта.
В случае утверждения стандарта, разработанного взамен стандарта, включенного в
доказательную базу технического регламента или в ПП РФ № 2425 федеральный орган
исполнительной власти в сфере стандартизации устанавливает дату введения в
действие не менее одного года после утверждения национального стандарта и
предусматривает право досрочного применения национального стандарта со дня его
опубликования.
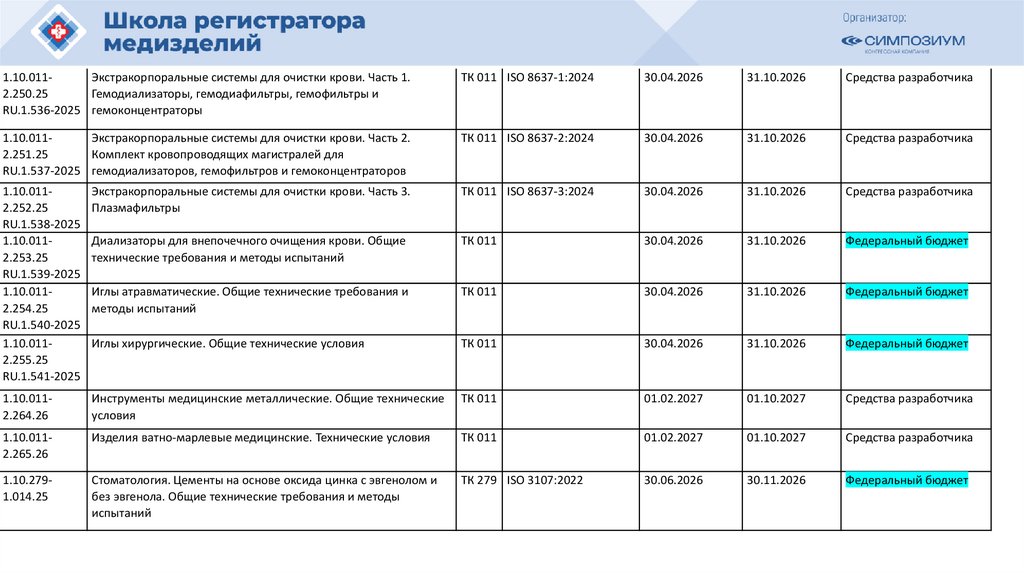
109.
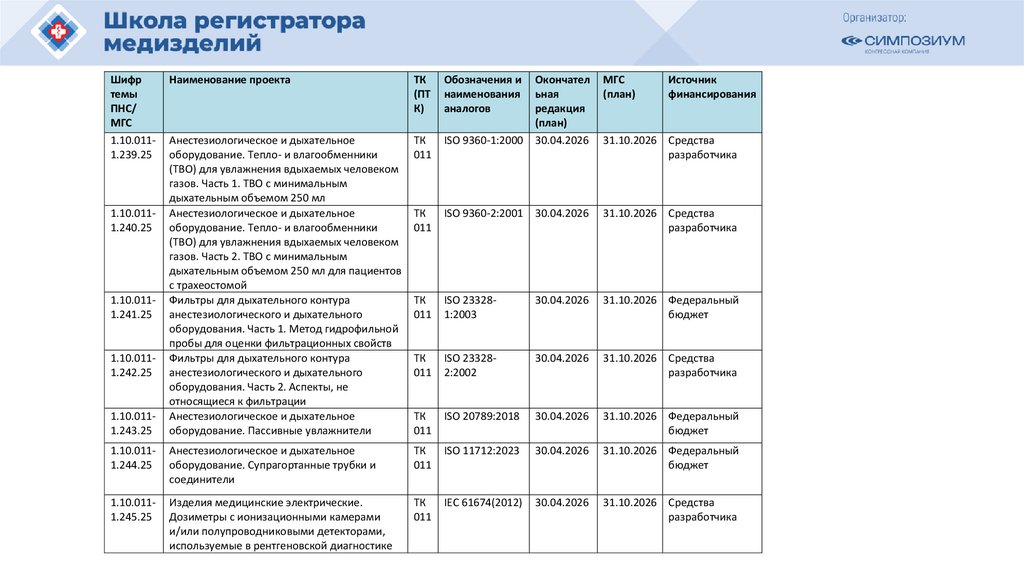
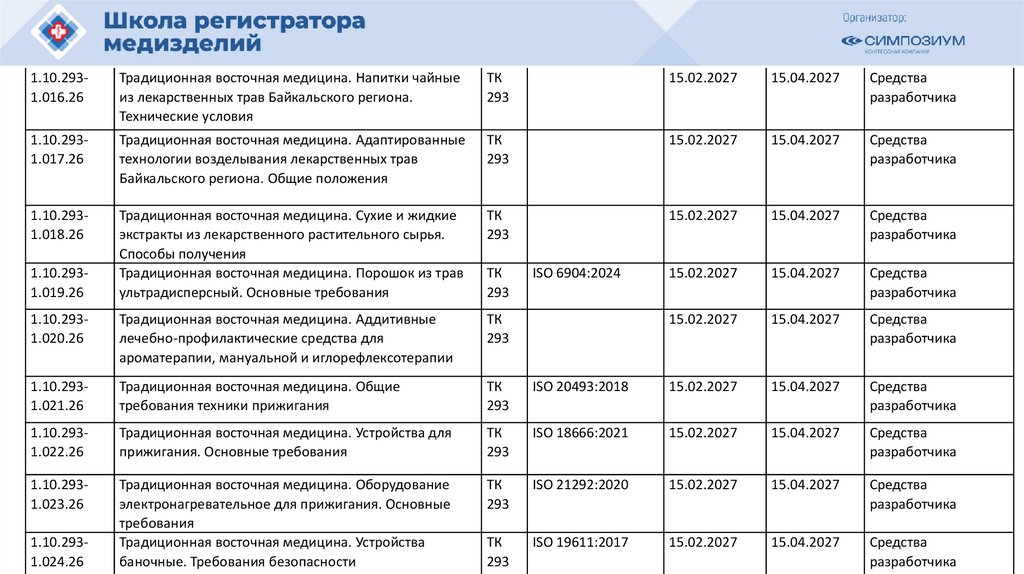
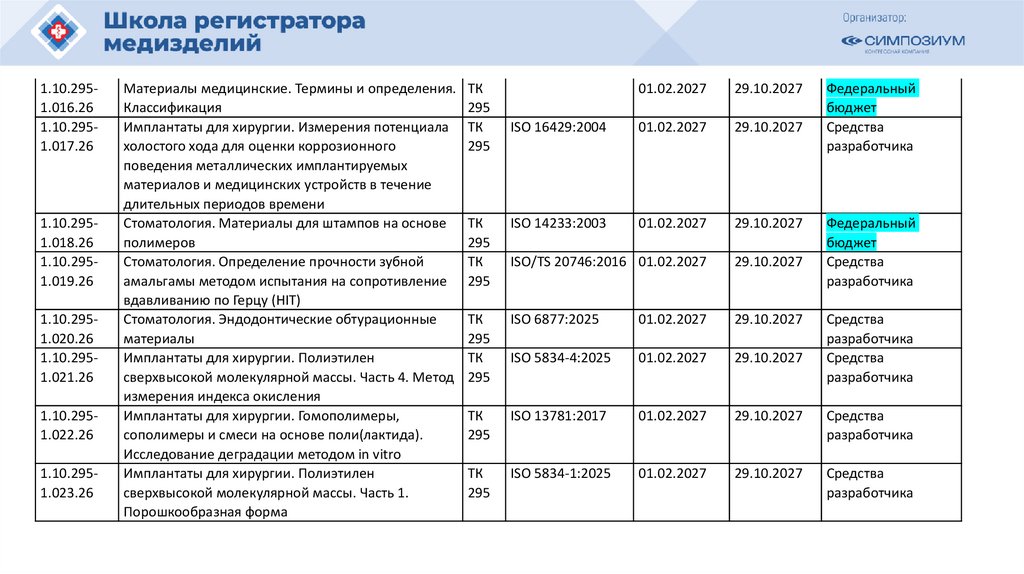
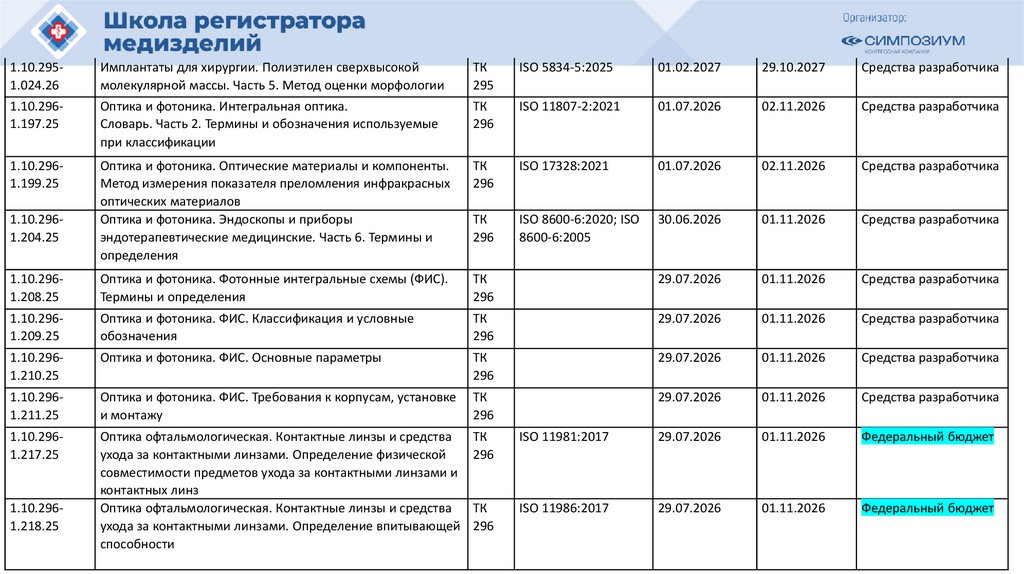
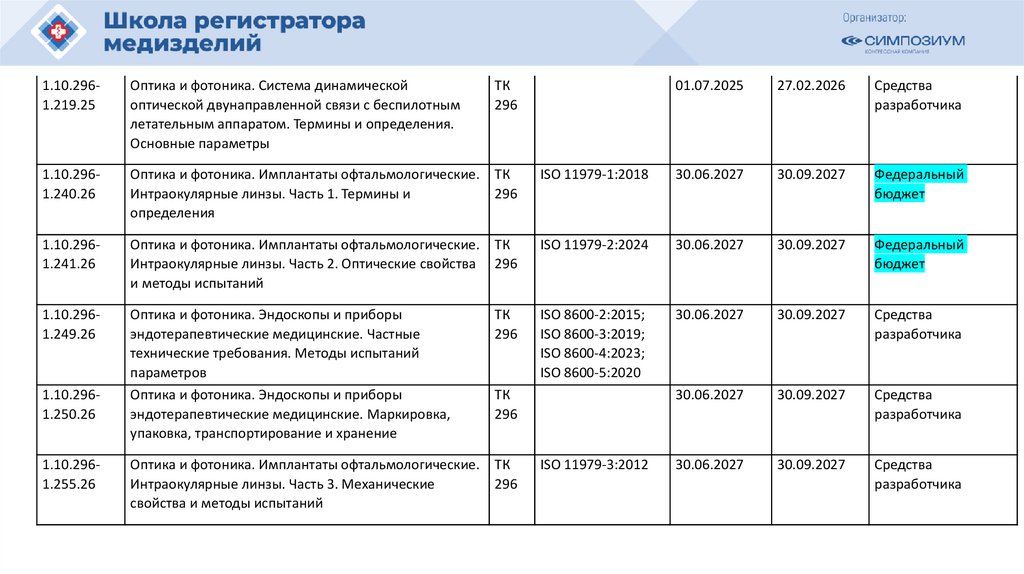
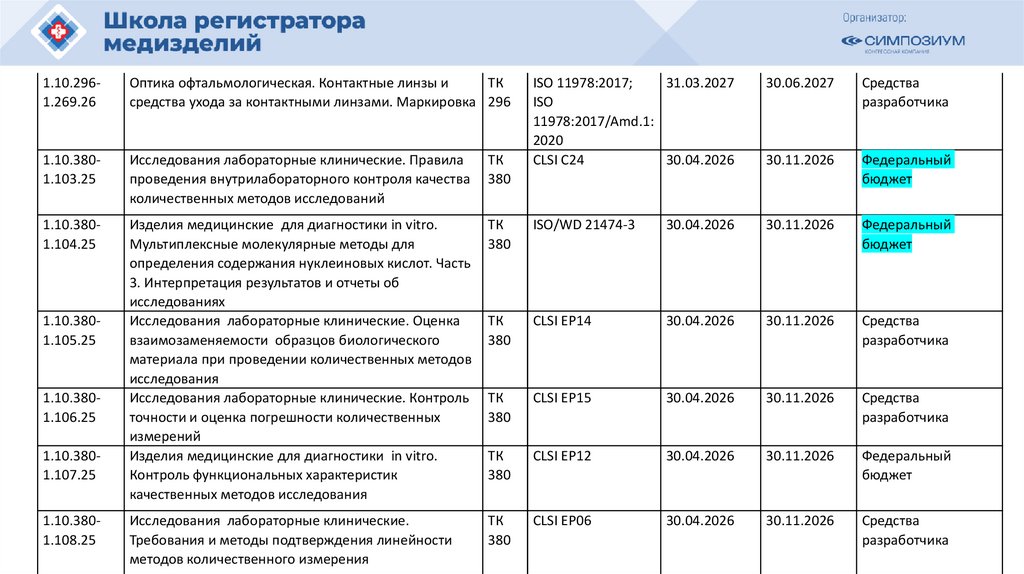
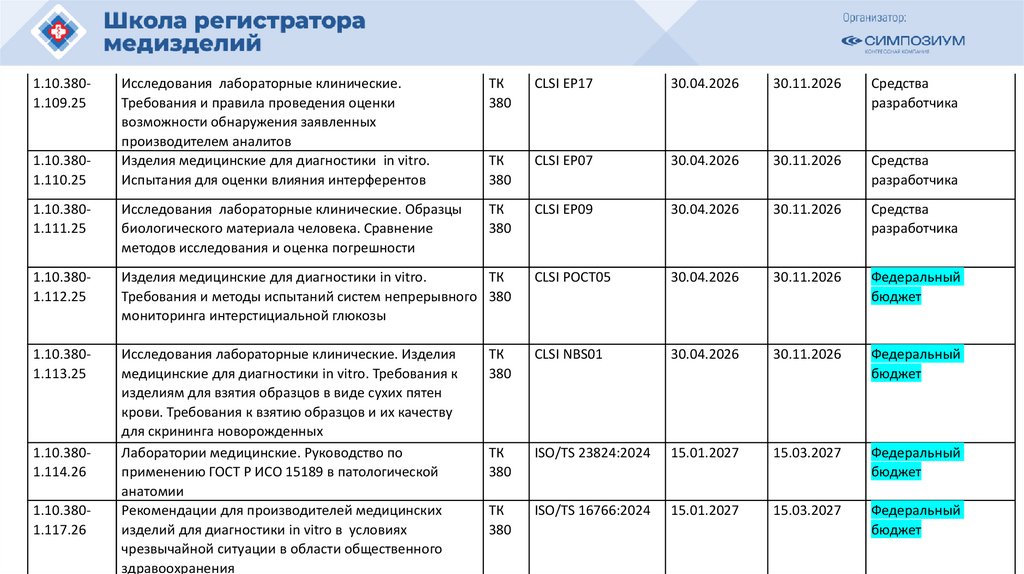
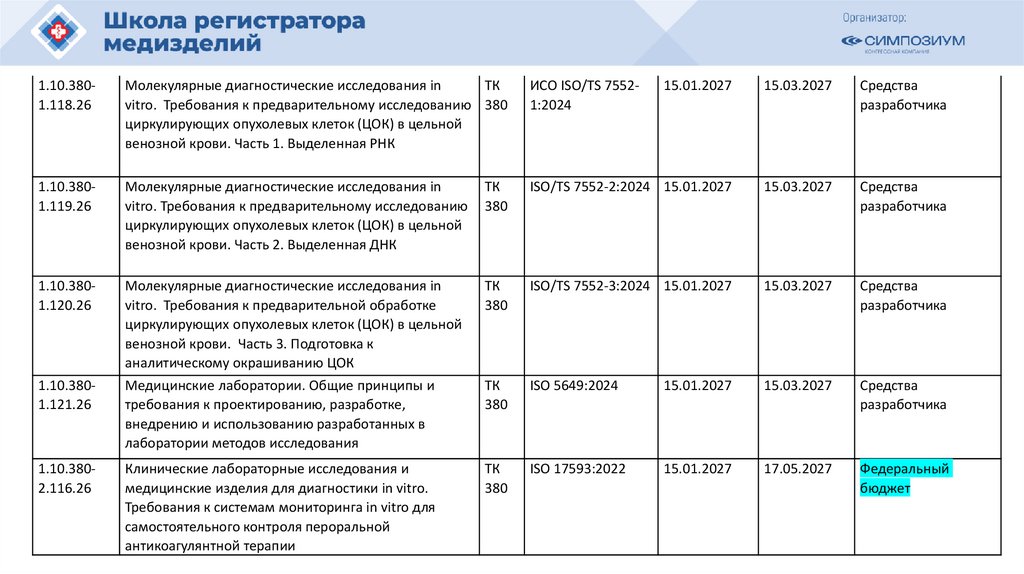
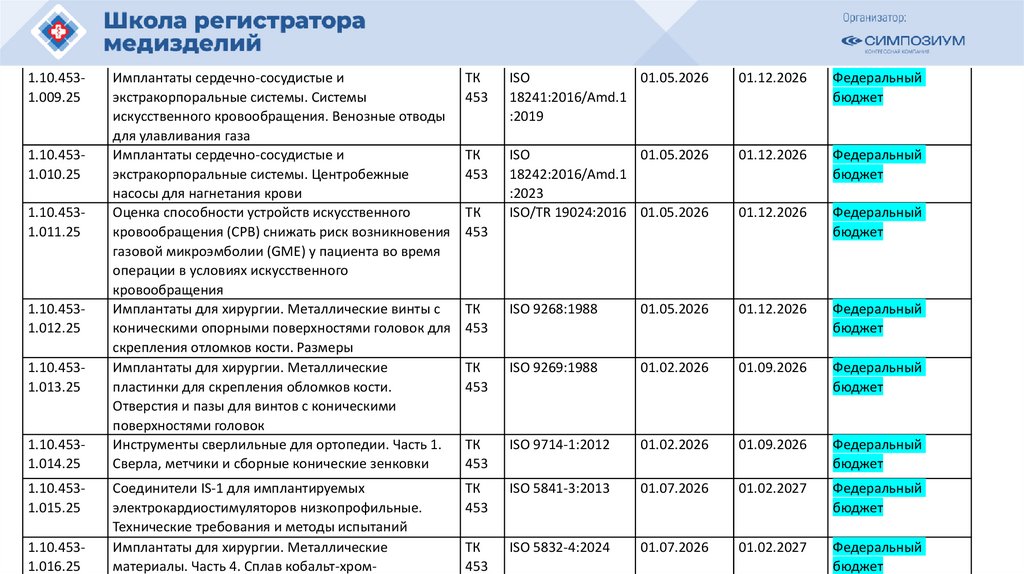
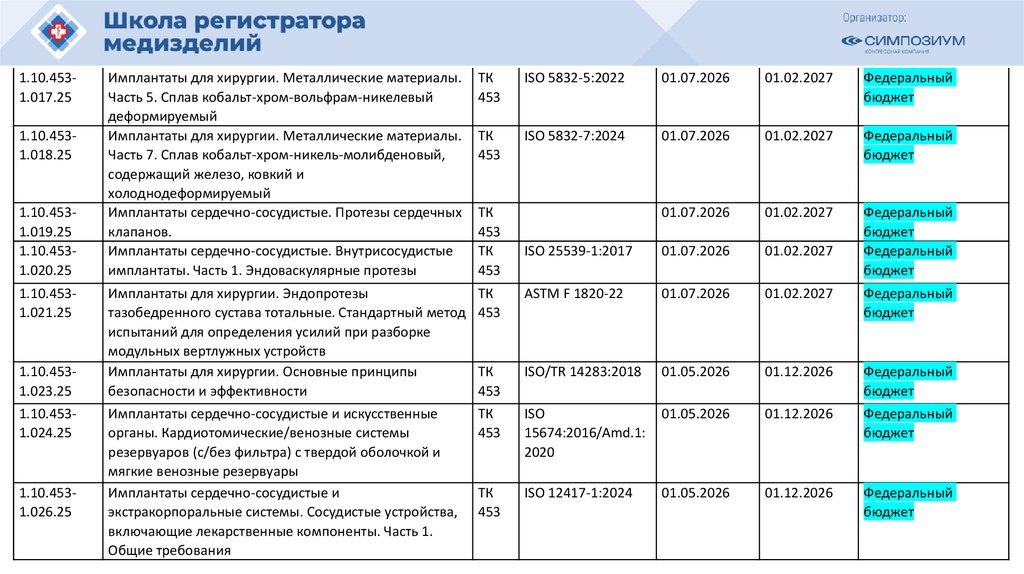
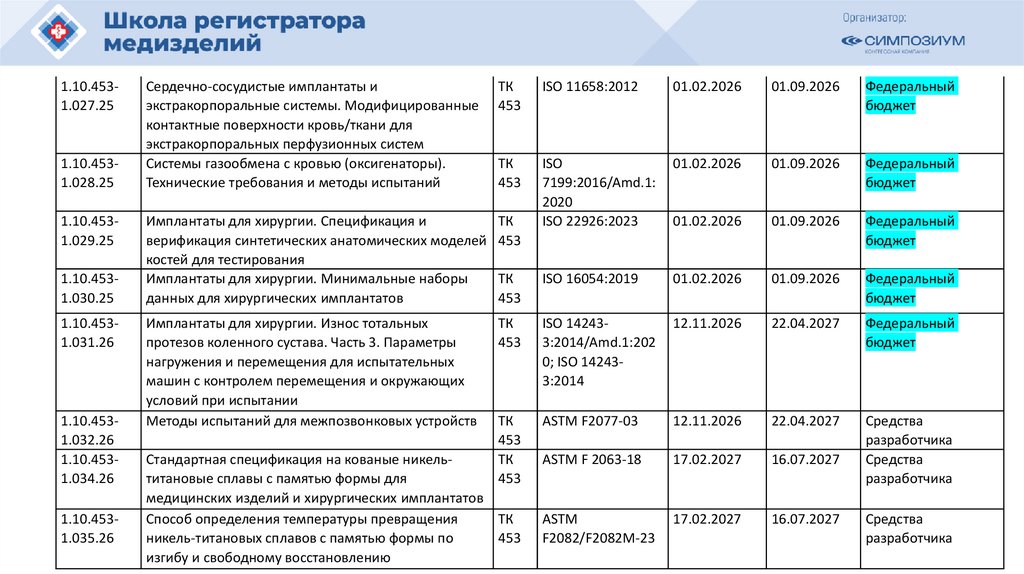
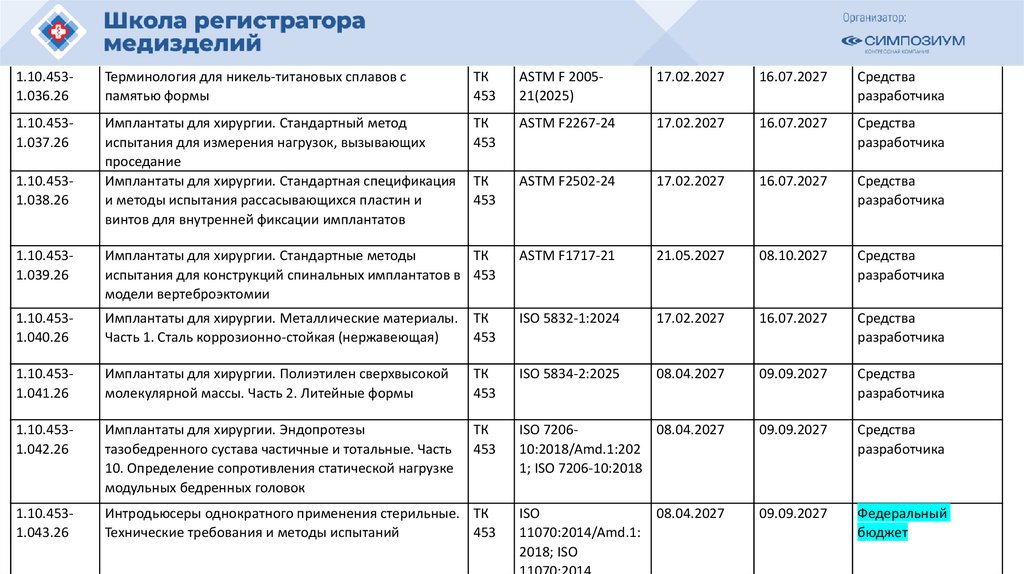
План национальной стандартизации 2026110.
Шифртемы
ПНС/
МГС
1.10.0111.239.25
Наименование проекта
ТК
(ПТ
К)
Анестезиологическое и дыхательное
оборудование. Тепло- и влагообменники
(ТВО) для увлажнения вдыхаемых человеком
газов. Часть 1. ТВО с минимальным
дыхательным объемом 250 мл
Анестезиологическое и дыхательное
оборудование. Тепло- и влагообменники
(ТВО) для увлажнения вдыхаемых человеком
газов. Часть 2. ТВО с минимальным
дыхательным объемом 250 мл для пациентов
с трахеостомой
Фильтры для дыхательного контура
анестезиологического и дыхательного
оборудования. Часть 1. Метод гидрофильной
пробы для оценки фильтрационных свойств
Фильтры для дыхательного контура
анестезиологического и дыхательного
оборудования. Часть 2. Аспекты, не
относящиеся к фильтрации
Анестезиологическое и дыхательное
оборудование. Пассивные увлажнители
ТК
011
1.10.0111.244.25
1.10.0111.245.25
1.10.0111.240.25
1.10.0111.241.25
1.10.0111.242.25
1.10.0111.243.25
Обозначения и
наименования
аналогов
Окончател
ьная
редакция
(план)
ISO 9360-1:2000 30.04.2026
МГС
(план)
Источник
финансирования
ТК
011
ISO 9360-2:2001 30.04.2026
31.10.2026 Средства
разработчика
ТК
011
ISO 233281:2003
30.04.2026
31.10.2026 Федеральный
бюджет
ТК
011
ISO 233282:2002
30.04.2026
31.10.2026 Средства
разработчика
ТК
011
ISO 20789:2018
30.04.2026
31.10.2026 Федеральный
бюджет
Анестезиологическое и дыхательное
оборудование. Супрагортанные трубки и
соединители
ТК
011
ISO 11712:2023
30.04.2026
31.10.2026 Федеральный
бюджет
Изделия медицинские электрические.
Дозиметры с ионизационными камерами
и/или полупроводниковыми детекторами,
используемые в рентгеновской диагностике
ТК
011
IEC 61674(2012)
30.04.2026
31.10.2026 Средства
разработчика
31.10.2026 Средства
разработчика
111.
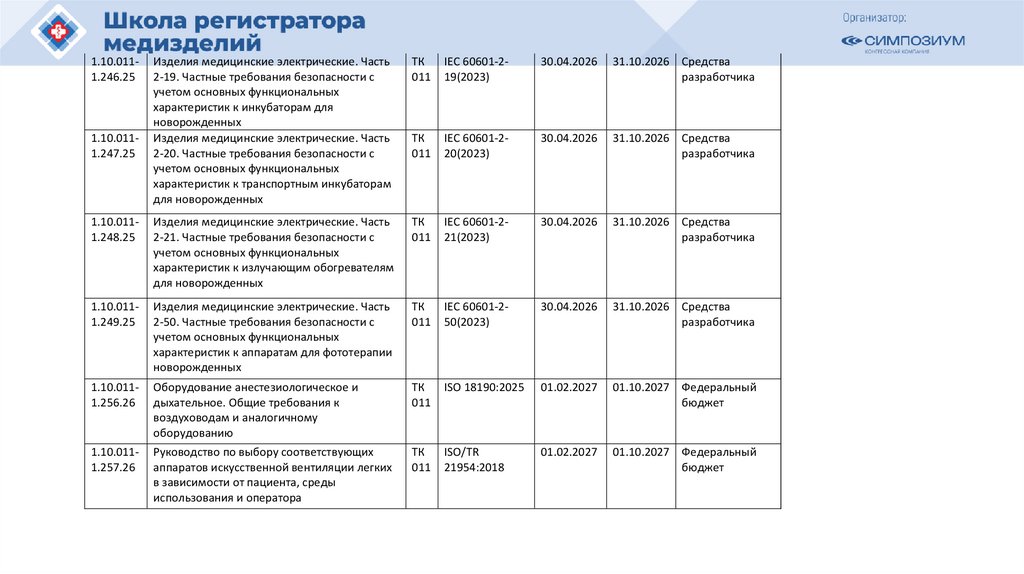
1.10.0111.246.25Изделия медицинские электрические. Часть
2-19. Частные требования безопасности с
учетом основных функциональных
характеристик к инкубаторам для
новорожденных
Изделия медицинские электрические. Часть
2-20. Частные требования безопасности с
учетом основных функциональных
характеристик к транспортным инкубаторам
для новорожденных
ТК
011
IEC 60601-219(2023)
30.04.2026
31.10.2026 Средства
разработчика
ТК
011
IEC 60601-220(2023)
30.04.2026
31.10.2026 Средства
разработчика
1.10.0111.248.25
Изделия медицинские электрические. Часть
2-21. Частные требования безопасности с
учетом основных функциональных
характеристик к излучающим обогревателям
для новорожденных
ТК
011
IEC 60601-221(2023)
30.04.2026
31.10.2026 Средства
разработчика
1.10.0111.249.25
Изделия медицинские электрические. Часть
2-50. Частные требования безопасности с
учетом основных функциональных
характеристик к аппаратам для фототерапии
новорожденных
ТК
011
IEC 60601-250(2023)
30.04.2026
31.10.2026 Средства
разработчика
1.10.0111.256.26
Оборудование анестезиологическое и
дыхательное. Общие требования к
воздуховодам и аналогичному
оборудованию
ТК
011
ISO 18190:2025
01.02.2027
01.10.2027 Федеральный
бюджет
1.10.0111.257.26
Руководство по выбору соответствующих
аппаратов искусственной вентиляции легких
в зависимости от пациента, среды
использования и оператора
ТК
011
ISO/TR
21954:2018
01.02.2027
01.10.2027 Федеральный
бюджет
1.10.0111.247.25
112.
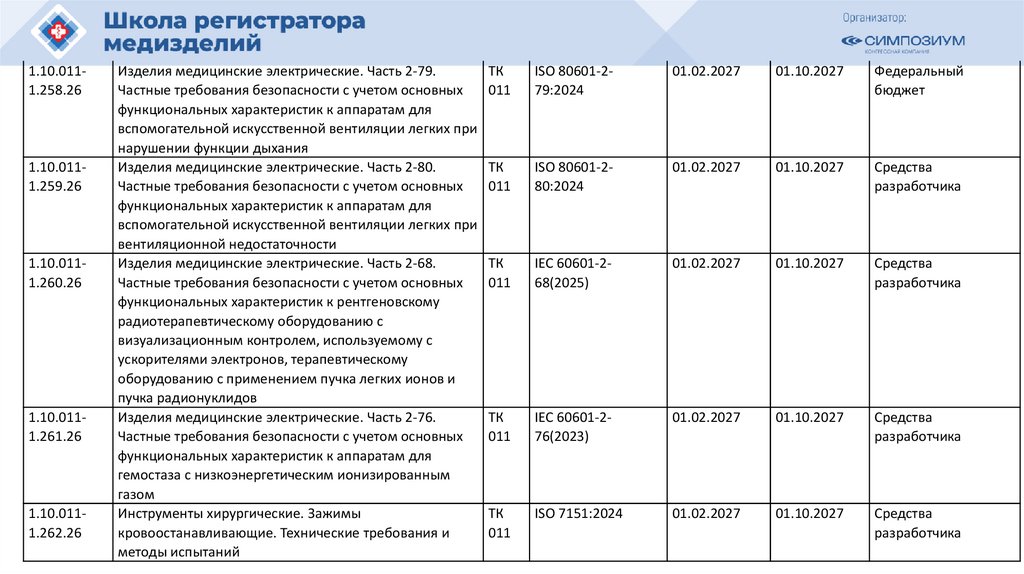
1.10.0111.258.261.10.0111.259.26
1.10.0111.260.26
1.10.0111.261.26
1.10.0111.262.26
Изделия медицинские электрические. Часть 2-79.
Частные требования безопасности с учетом основных
функциональных характеристик к аппаратам для
вспомогательной искусственной вентиляции легких при
нарушении функции дыхания
Изделия медицинские электрические. Часть 2-80.
Частные требования безопасности с учетом основных
функциональных характеристик к аппаратам для
вспомогательной искусственной вентиляции легких при
вентиляционной недостаточности
Изделия медицинские электрические. Часть 2-68.
Частные требования безопасности с учетом основных
функциональных характеристик к рентгеновскому
радиотерапевтическому оборудованию с
визуализационным контролем, используемому с
ускорителями электронов, терапевтическому
оборудованию с применением пучка легких ионов и
пучка радионуклидов
Изделия медицинские электрические. Часть 2-76.
Частные требования безопасности с учетом основных
функциональных характеристик к аппаратам для
гемостаза с низкоэнергетическим ионизированным
газом
Инструменты хирургические. Зажимы
кровоостанавливающие. Технические требования и
методы испытаний
ТК
011
ISO 80601-279:2024
01.02.2027
01.10.2027
Федеральный
бюджет
ТК
011
ISO 80601-280:2024
01.02.2027
01.10.2027
Средства
разработчика
ТК
011
IEC 60601-268(2025)
01.02.2027
01.10.2027
Средства
разработчика
ТК
011
IEC 60601-276(2023)
01.02.2027
01.10.2027
Средства
разработчика
ТК
011
ISO 7151:2024
01.02.2027
01.10.2027
Средства
разработчика
113.
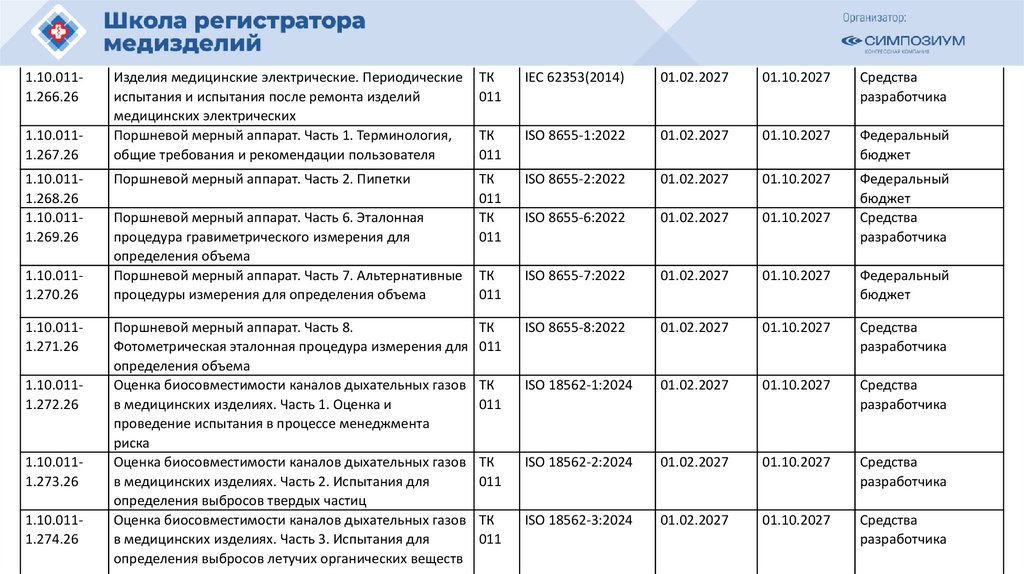
1.10.0111.266.261.10.0111.267.26
1.10.0111.268.26
1.10.0111.269.26
1.10.0111.270.26
1.10.0111.271.26
1.10.0111.272.26
1.10.0111.273.26
1.10.0111.274.26
Изделия медицинские электрические. Периодические
испытания и испытания после ремонта изделий
медицинских электрических
Поршневой мерный аппарат. Часть 1. Терминология,
общие требования и рекомендации пользователя
ТК
011
IEC 62353(2014)
01.02.2027
01.10.2027
Средства
разработчика
ТК
011
ISO 8655-1:2022
01.02.2027
01.10.2027
Федеральный
бюджет
Поршневой мерный аппарат. Часть 2. Пипетки
ТК
011
ТК
011
ISO 8655-2:2022
01.02.2027
01.10.2027
ISO 8655-6:2022
01.02.2027
01.10.2027
Федеральный
бюджет
Средства
разработчика
ТК
011
ISO 8655-7:2022
01.02.2027
01.10.2027
Федеральный
бюджет
Поршневой мерный аппарат. Часть 8.
ТК
Фотометрическая эталонная процедура измерения для 011
определения объема
Оценка биосовместимости каналов дыхательных газов ТК
в медицинских изделиях. Часть 1. Оценка и
011
проведение испытания в процессе менеджмента
риска
Оценка биосовместимости каналов дыхательных газов ТК
в медицинских изделиях. Часть 2. Испытания для
011
определения выбросов твердых частиц
Оценка биосовместимости каналов дыхательных газов ТК
в медицинских изделиях. Часть 3. Испытания для
011
определения выбросов летучих органических веществ
ISO 8655-8:2022
01.02.2027
01.10.2027
Средства
разработчика
ISO 18562-1:2024
01.02.2027
01.10.2027
Средства
разработчика
ISO 18562-2:2024
01.02.2027
01.10.2027
Средства
разработчика
ISO 18562-3:2024
01.02.2027
01.10.2027
Средства
разработчика
Поршневой мерный аппарат. Часть 6. Эталонная
процедура гравиметрического измерения для
определения объема
Поршневой мерный аппарат. Часть 7. Альтернативные
процедуры измерения для определения объема
114.
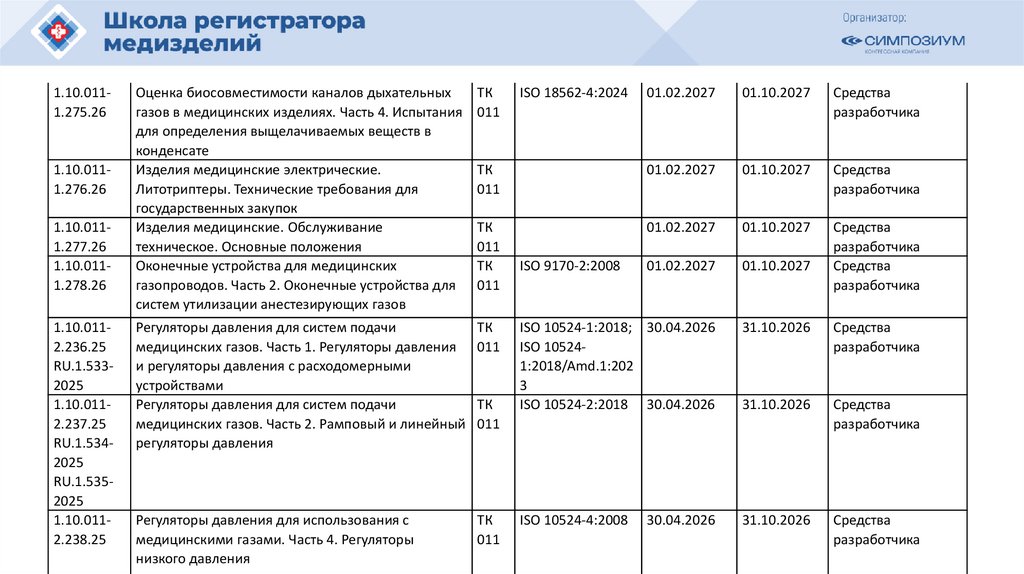
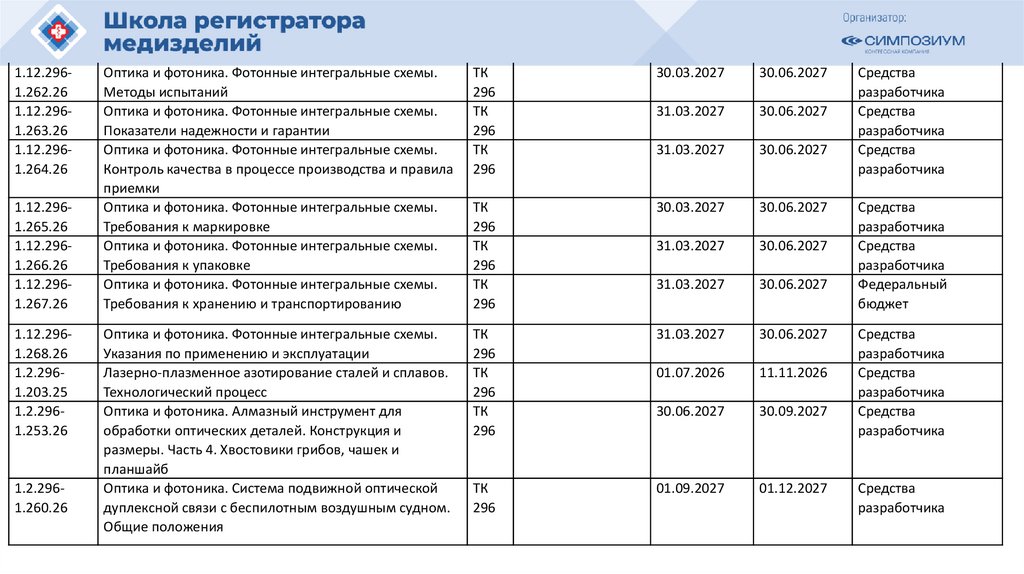
1.10.0111.275.261.10.0111.276.26
1.10.0111.277.26
1.10.0111.278.26
1.10.0112.236.25
RU.1.5332025
1.10.0112.237.25
RU.1.5342025
RU.1.5352025
1.10.0112.238.25
Оценка биосовместимости каналов дыхательных
газов в медицинских изделиях. Часть 4. Испытания
для определения выщелачиваемых веществ в
конденсате
Изделия медицинские электрические.
Литотриптеры. Технические требования для
государственных закупок
Изделия медицинские. Обслуживание
техническое. Основные положения
Оконечные устройства для медицинских
газопроводов. Часть 2. Оконечные устройства для
систем утилизации анестезирующих газов
ТК
011
Регуляторы давления для систем подачи
медицинских газов. Часть 1. Регуляторы давления
и регуляторы давления с расходомерными
устройствами
Регуляторы давления для систем подачи
медицинских газов. Часть 2. Рамповый и линейный
регуляторы давления
ТК
011
01.02.2027
01.10.2027
Средства
разработчика
ТК
011
01.02.2027
01.10.2027
Средства
разработчика
ТК
011
ТК
011
01.02.2027
01.10.2027
01.02.2027
01.10.2027
Средства
разработчика
Средства
разработчика
ISO 10524-1:2018; 30.04.2026
ISO 105241:2018/Amd.1:202
3
ISO 10524-2:2018 30.04.2026
31.10.2026
Средства
разработчика
31.10.2026
Средства
разработчика
Регуляторы давления для использования с
медицинскими газами. Часть 4. Регуляторы
низкого давления
ТК
011
ISO 10524-4:2008
31.10.2026
Средства
разработчика
ТК
011
ISO 18562-4:2024
ISO 9170-2:2008
30.04.2026
115.
1.10.011Экстракорпоральные системы для очистки крови. Часть 1.2.250.25
Гемодиализаторы, гемодиафильтры, гемофильтры и
RU.1.536-2025 гемоконцентраторы
ТК 011 ISO 8637-1:2024
30.04.2026
31.10.2026
Средства разработчика
1.10.011Экстракорпоральные системы для очистки крови. Часть 2.
2.251.25
Комплект кровопроводящих магистралей для
RU.1.537-2025 гемодиализаторов, гемофильтров и гемоконцентраторов
ТК 011 ISO 8637-2:2024
30.04.2026
31.10.2026
Средства разработчика
1.10.0112.252.25
RU.1.538-2025
1.10.0112.253.25
RU.1.539-2025
1.10.0112.254.25
RU.1.540-2025
1.10.0112.255.25
RU.1.541-2025
Экстракорпоральные системы для очистки крови. Часть 3.
Плазмафильтры
ТК 011 ISO 8637-3:2024
30.04.2026
31.10.2026
Средства разработчика
Диализаторы для внепочечного очищения крови. Общие
технические требования и методы испытаний
ТК 011
30.04.2026
31.10.2026
Федеральный бюджет
Иглы атравматические. Общие технические требования и
методы испытаний
ТК 011
30.04.2026
31.10.2026
Федеральный бюджет
Иглы хирургические. Общие технические условия
ТК 011
30.04.2026
31.10.2026
Федеральный бюджет
1.10.0112.264.26
Инструменты медицинские металлические. Общие технические
условия
ТК 011
01.02.2027
01.10.2027
Средства разработчика
1.10.0112.265.26
Изделия ватно-марлевые медицинские. Технические условия
ТК 011
01.02.2027
01.10.2027
Средства разработчика
1.10.2791.014.25
Стоматология. Цементы на основе оксида цинка с эвгенолом и
без эвгенола. Общие технические требования и методы
испытаний
ТК 279 ISO 3107:2022
30.06.2026
30.11.2026
Федеральный бюджет
116.
1.10.2791.015.25Щетки зубные. Общие требования и методы
испытаний
ТК
279
ISO 20126:2022;
ISO 22254:2005
30.06.2026
30.11.2026
Средства
разработчика
1.10.2791.016.25
ТК
279
ISO 6876:2012
30.06.2026
30.11.2026
Федеральный
бюджет
ТК
279
ISO 9917-1:2007;
ISO 9917-2:2017
30.06.2026
30.11.2026
Средства
разработчика
1.10.2931.001.26
Материалы стоматологические для пломбирования
корневых каналов зубов. Общие технические
требования. Методы испытаний
Стоматология. Цементы стоматологические на
водной основе. Технические требования. Методы
испытаний
Традиционная восточная медицина. Термины и
определения
ТК
293
15.02.2027
15.04.2027
Средства
разработчика
1.10.2931.005.26
Традиционная восточная медицина. Сырье
растительное. Общие технические условия
ТК
293
15.02.2027
15.04.2027
Средства
разработчика
1.10.2931.008.26
1.10.2931.011.26
1.10.2931.012.26
Традиционная восточная медицина. Готовая
продукция. Основные требования
Традиционная восточная медицина. Сырье и готовая
продукция. Методы отбора проб
Традиционная восточная медицина. Методы
испытаний на идентичность компонентов
лекарственных трав
Традиционная восточная медицина. Сырье и готовая
продукция. Методы испытаний на наличие
загрязнений
Традиционная восточная медицина. Сырье и готовая
продукция. Методы испытаний на наличие
ТК
293
ТК
293
ТК
293
15.02.2027
15.04.2027
15.02.2027
15.04.2027
ISO 19609-2:2021
15.02.2027
15.04.2027
Средства
разработчика
Средства
разработчика
Средства
разработчика
ТК
293
ISO 19609-3:2022
15.02.2027
15.04.2027
Средства
разработчика
ТК
293
ISO 19609-4:2022
15.02.2027
15.04.2027
Средства
разработчика
1.10.2791.017.25
1.10.2931.013.26
1.10.2931.015.26
117.
1.10.2931.016.26Традиционная восточная медицина. Напитки чайные
из лекарственных трав Байкальского региона.
Технические условия
ТК
293
15.02.2027
15.04.2027
Средства
разработчика
1.10.2931.017.26
Традиционная восточная медицина. Адаптированные
технологии возделывания лекарственных трав
Байкальского региона. Общие положения
ТК
293
15.02.2027
15.04.2027
Средства
разработчика
1.10.2931.018.26
Традиционная восточная медицина. Сухие и жидкие
экстракты из лекарственного растительного сырья.
Способы получения
Традиционная восточная медицина. Порошок из трав
ультрадисперсный. Основные требования
ТК
293
15.02.2027
15.04.2027
Средства
разработчика
15.02.2027
15.04.2027
Средства
разработчика
1.10.2931.020.26
Традиционная восточная медицина. Аддитивные
лечебно-профилактические средства для
ароматерапии, мануальной и иглорефлексотерапии
ТК
293
15.02.2027
15.04.2027
Средства
разработчика
1.10.2931.021.26
Традиционная восточная медицина. Общие
требования техники прижигания
ТК
293
ISO 20493:2018
15.02.2027
15.04.2027
Средства
разработчика
1.10.2931.022.26
Традиционная восточная медицина. Устройства для
прижигания. Основные требования
ТК
293
ISO 18666:2021
15.02.2027
15.04.2027
Средства
разработчика
1.10.2931.023.26
Традиционная восточная медицина. Оборудование
электронагревательное для прижигания. Основные
требования
Традиционная восточная медицина. Устройства
баночные. Требования безопасности
ТК
293
ISO 21292:2020
15.02.2027
15.04.2027
Средства
разработчика
ТК
293
ISO 19611:2017
15.02.2027
15.04.2027
Средства
разработчика
1.10.2931.019.26
1.10.2931.024.26
ТК
293
ISO 6904:2024
118.
1.10.2951.005.25ТК
295
ISO 1135-3:2016
19.01.2026
19.10.2026
Федеральный
бюджет
ТК
295
ISO 8536-6:2016
26.01.2026
28.09.2026
Федеральный
бюджет
ТК
295
ISO 8536-7:2009
26.01.2026
28.09.2026
Федеральный
бюджет
ТК
295
ISO 5834-3:2019
02.02.2026
05.10.2026
Федеральный
бюджет
ТК
295
ISO 19213:2017
26.01.2026
05.10.2026
Средства
разработчика
ТК
295
ISO 13179-1:2021
02.02.2026
19.10.2026
Федеральный
бюджет
ТК
295
ISO/IEC 35321:2023
09.02.2026
05.10.2026
Федеральный
бюджет
1.10.2951.014.25
Аппараты медицинские для переливания крови.
Часть 3. Комплекты для забора крови одноразового
применения
Аппараты медицинские для вливания. Часть 6.
Колпачки для лиофильной сушки под флаконом для
вливания
Устройства инфузионные медицинского назначения.
Часть 7. Колпачки комбинированные из алюминия и
пластмассы для инфузионных бутылок
Имплантаты для хирургии. Полиэтилен сверхвысокой
молекулярной массы. Часть 3. Методика ускоренного
старения
Имплантаты для хирургии. Методы тестирования
материала для использования в качестве модели
кортикальной кости
Имплантаты для хирургии. Покрытия из
нелегированного титана, наносимые плазменным
распылением на металлические хирургические
имплантаты. Часть 1. Общие требования
Информационные технологии. Моделирование на
основе медицинских изображений для 3D-печати.
Часть 1. Общие требования
Стоматология. Материалы для стоматологических
инструментов. Часть 1. Нержавеющая сталь
ТК
295
ISO 21850-1:2020
30.01.2026
28.09.2026
Федеральный
бюджет
1.10.2951.015.25
Стоматология. Метод определения
рентгеноконтрастности материалов
ТК
295
ISO 13116:2014
26.01.2026
31.08.2026
Федеральный
бюджет
1.10.2951.008.25
1.10.2951.009.25
1.10.2951.010.25
1.10.2951.011.25
1.10.2951.012.25
1.10.2951.013.25
119.
1.10.2951.016.261.10.2951.017.26
1.10.2951.018.26
1.10.2951.019.26
1.10.2951.020.26
1.10.2951.021.26
1.10.2951.022.26
1.10.2951.023.26
Материалы медицинские. Термины и определения.
Классификация
Имплантаты для хирургии. Измерения потенциала
холостого хода для оценки коррозионного
поведения металлических имплантируемых
материалов и медицинских устройств в течение
длительных периодов времени
Стоматология. Материалы для штампов на основе
полимеров
Стоматология. Определение прочности зубной
амальгамы методом испытания на сопротивление
вдавливанию по Герцу (HIT)
Стоматология. Эндодонтические обтурационные
материалы
Имплантаты для хирургии. Полиэтилен
сверхвысокой молекулярной массы. Часть 4. Метод
измерения индекса окисления
Имплантаты для хирургии. Гомополимеры,
сополимеры и смеси на основе поли(лактида).
Исследование деградации методом in vitro
Имплантаты для хирургии. Полиэтилен
сверхвысокой молекулярной массы. Часть 1.
Порошкообразная форма
ТК
295
ТК
295
01.02.2027
29.10.2027
Федеральный
бюджет
Средства
разработчика
ISO 16429:2004
01.02.2027
29.10.2027
ТК
295
ТК
295
ISO 14233:2003
01.02.2027
29.10.2027
ISO/TS 20746:2016 01.02.2027
29.10.2027
ТК
295
ТК
295
ISO 6877:2025
01.02.2027
29.10.2027
ISO 5834-4:2025
01.02.2027
29.10.2027
ТК
295
ISO 13781:2017
01.02.2027
29.10.2027
Средства
разработчика
ТК
295
ISO 5834-1:2025
01.02.2027
29.10.2027
Средства
разработчика
Федеральный
бюджет
Средства
разработчика
Средства
разработчика
Средства
разработчика
120.
1.10.2951.024.26Имплантаты для хирургии. Полиэтилен сверхвысокой
молекулярной массы. Часть 5. Метод оценки морфологии
ТК
295
ISO 5834-5:2025
01.02.2027
29.10.2027
Средства разработчика
1.10.2961.197.25
Оптика и фотоника. Интегральная оптика.
Словарь. Часть 2. Термины и обозначения используемые
при классификации
ТК
296
ISO 11807-2:2021
01.07.2026
02.11.2026
Средства разработчика
1.10.2961.199.25
Оптика и фотоника. Оптические материалы и компоненты.
Метод измерения показателя преломления инфракрасных
оптических материалов
Оптика и фотоника. Эндоскопы и приборы
эндотерапевтические медицинские. Часть 6. Термины и
определения
ТК
296
ISO 17328:2021
01.07.2026
02.11.2026
Средства разработчика
ТК
296
ISO 8600-6:2020; ISO
8600-6:2005
30.06.2026
01.11.2026
Средства разработчика
1.10.2961.208.25
Оптика и фотоника. Фотонные интегральные схемы (ФИС).
Термины и определения
ТК
296
29.07.2026
01.11.2026
Средства разработчика
1.10.2961.209.25
Оптика и фотоника. ФИС. Классификация и условные
обозначения
ТК
296
29.07.2026
01.11.2026
Средства разработчика
1.10.2961.210.25
Оптика и фотоника. ФИС. Основные параметры
ТК
296
29.07.2026
01.11.2026
Средства разработчика
1.10.2961.211.25
Оптика и фотоника. ФИС. Требования к корпусам, установке
и монтажу
ТК
296
29.07.2026
01.11.2026
Средства разработчика
1.10.2961.217.25
Оптика офтальмологическая. Контактные линзы и средства
ухода за контактными линзами. Определение физической
совместимости предметов ухода за контактными линзами и
контактных линз
Оптика офтальмологическая. Контактные линзы и средства
ухода за контактными линзами. Определение впитывающей
способности
ТК
296
ISO 11981:2017
29.07.2026
01.11.2026
Федеральный бюджет
ТК
296
ISO 11986:2017
29.07.2026
01.11.2026
Федеральный бюджет
1.10.2961.204.25
1.10.2961.218.25
121.
1.10.2961.219.25Оптика и фотоника. Система динамической
оптической двунаправленной связи с беспилотным
летательным аппаратом. Термины и определения.
Основные параметры
1.10.2961.240.26
Оптика и фотоника. Имплантаты офтальмологические. ТК
Интраокулярные линзы. Часть 1. Термины и
296
определения
1.10.2961.241.26
1.10.2961.249.26
1.10.2961.250.26
1.10.2961.255.26
ТК
296
01.07.2025
27.02.2026
Средства
разработчика
ISO 11979-1:2018
30.06.2027
30.09.2027
Федеральный
бюджет
Оптика и фотоника. Имплантаты офтальмологические. ТК
Интраокулярные линзы. Часть 2. Оптические свойства 296
и методы испытаний
ISO 11979-2:2024
30.06.2027
30.09.2027
Федеральный
бюджет
Оптика и фотоника. Эндоскопы и приборы
эндотерапевтические медицинские. Частные
технические требования. Методы испытаний
параметров
Оптика и фотоника. Эндоскопы и приборы
эндотерапевтические медицинские. Маркировка,
упаковка, транспортирование и хранение
ISO 8600-2:2015;
ISO 8600-3:2019;
ISO 8600-4:2023;
ISO 8600-5:2020
30.06.2027
30.09.2027
Средства
разработчика
30.06.2027
30.09.2027
Средства
разработчика
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
ТК
296
Оптика и фотоника. Имплантаты офтальмологические. ТК
Интраокулярные линзы. Часть 3. Механические
296
свойства и методы испытаний
ISO 11979-3:2012
122.
1.10.2961.269.26Оптика офтальмологическая. Контактные линзы и
ТК
средства ухода за контактными линзами. Маркировка 296
1.10.3801.103.25
Исследования лабораторные клинические. Правила
проведения внутрилабораторного контроля качества
количественных методов исследований
ТК
380
1.10.3801.104.25
Изделия медицинские для диагностики in vitro.
Мультиплексные молекулярные методы для
определения содержания нуклеиновых кислот. Часть
3. Интерпретация результатов и отчеты об
исследованиях
Исследования лабораторные клинические. Оценка
взаимозаменяемости образцов биологического
материала при проведении количественных методов
исследования
Исследования лабораторные клинические. Контроль
точности и оценка погрешности количественных
измерений
Изделия медицинские для диагностики in vitro.
Контроль функциональных характеристик
качественных методов исследования
Исследования лабораторные клинические.
Требования и методы подтверждения линейности
методов количественного измерения
1.10.3801.105.25
1.10.3801.106.25
1.10.3801.107.25
1.10.3801.108.25
ISO 11978:2017;
31.03.2027
ISO
11978:2017/Amd.1:
2020
CLSI C24
30.04.2026
30.06.2027
Средства
разработчика
30.11.2026
Федеральный
бюджет
ТК
380
ISO/WD 21474-3
30.04.2026
30.11.2026
Федеральный
бюджет
ТК
380
CLSI EP14
30.04.2026
30.11.2026
Средства
разработчика
ТК
380
CLSI EP15
30.04.2026
30.11.2026
Средства
разработчика
ТК
380
CLSI EP12
30.04.2026
30.11.2026
Федеральный
бюджет
ТК
380
CLSI EP06
30.04.2026
30.11.2026
Средства
разработчика
123.
1.10.3801.109.25Исследования лабораторные клинические.
Требования и правила проведения оценки
возможности обнаружения заявленных
производителем аналитов
Изделия медицинские для диагностики in vitro.
Испытания для оценки влияния интерферентов
ТК
380
CLSI EP17
30.04.2026
30.11.2026
Средства
разработчика
ТК
380
CLSI EP07
30.04.2026
30.11.2026
Средства
разработчика
1.10.3801.111.25
Исследования лабораторные клинические. Образцы
биологического материала человека. Сравнение
методов исследования и оценка погрешности
ТК
380
CLSI EP09
30.04.2026
30.11.2026
Средства
разработчика
1.10.3801.112.25
Изделия медицинские для диагностики in vitro.
ТК
Требования и методы испытаний систем непрерывного 380
мониторинга интерстициальной глюкозы
CLSI POCT05
30.04.2026
30.11.2026
Федеральный
бюджет
1.10.3801.113.25
Исследования лабораторные клинические. Изделия
медицинские для диагностики in vitro. Требования к
изделиям для взятия образцов в виде сухих пятен
крови. Требования к взятию образцов и их качеству
для скрининга новорожденных
Лаборатории медицинские. Руководство по
применению ГОСТ Р ИСО 15189 в патологической
анатомии
Рекомендации для производителей медицинских
изделий для диагностики in vitro в условиях
чрезвычайной ситуации в области общественного
здравоохранения
ТК
380
CLSI NBS01
30.04.2026
30.11.2026
Федеральный
бюджет
ТК
380
ISO/TS 23824:2024
15.01.2027
15.03.2027
Федеральный
бюджет
ТК
380
ISO/TS 16766:2024
15.01.2027
15.03.2027
Федеральный
бюджет
1.10.3801.110.25
1.10.3801.114.26
1.10.3801.117.26
124.
1.10.3801.118.26Молекулярные диагностические исследования in
ТК
vitro. Требования к предварительному исследованию 380
циркулирующих опухолевых клеток (ЦОК) в цельной
венозной крови. Часть 1. Выделенная РНК
ИСО ISO/TS 75521:2024
15.01.2027
15.03.2027
Средства
разработчика
1.10.3801.119.26
Молекулярные диагностические исследования in
vitro. Требования к предварительному исследованию
циркулирующих опухолевых клеток (ЦОК) в цельной
венозной крови. Часть 2. Выделенная ДНК
ТК
380
ISO/TS 7552-2:2024 15.01.2027
15.03.2027
Средства
разработчика
1.10.3801.120.26
Молекулярные диагностические исследования in
vitro. Требования к предварительной обработке
циркулирующих опухолевых клеток (ЦОК) в цельной
венозной крови. Часть 3. Подготовка к
аналитическому окрашиванию ЦОК
Медицинские лаборатории. Общие принципы и
требования к проектированию, разработке,
внедрению и использованию разработанных в
лаборатории методов исследования
ТК
380
ISO/TS 7552-3:2024 15.01.2027
15.03.2027
Средства
разработчика
ТК
380
ISO 5649:2024
15.01.2027
15.03.2027
Средства
разработчика
Клинические лабораторные исследования и
медицинские изделия для диагностики in vitro.
Требования к системам мониторинга in vitro для
самостоятельного контроля пероральной
антикоагулянтной терапии
ТК
380
ISO 17593:2022
15.01.2027
17.05.2027
Федеральный
бюджет
1.10.3801.121.26
1.10.3802.116.26
125.
1.10.3831.010.241.10.3831.026.25
1.10.3831.027.25
1.10.3831.028.25
1.10.3831.030.25
1.10.3831.032.26
1.10.3831.033.26
Стерилизация медицинских изделий. Словарь
терминов, используемых в стандартах на
стерилизационное и аналогичное оборудование и
процессы стерилизации
Оборудование для дезинфекции паром. Часть 4.
Биоиндикаторы для проверки эффективности
Стерилизация медицинской продукции.
Биологические индикаторы. Часть 4. Биологические
индикаторы для процессов воздушной стерилизации
ТК
383
ISO 11139:2018
01.03.2026
01.12.2026
Средства
разработчика
ТК
383
ТК
383
DIN 58949-4-2014
02.02.2026
01.10.2026
ISO 11138-4:2017
01.04.2026
01.12.2026
Средства
разработчика
Средства
разработчика
Стерилизация медицинской продукции.
Биологические индикаторы. Часть 8. Метод
валидации сокращенного времени инкубации
биологического индикатора
Требования к содержанию и оформлению
технических заданий для конкурсной документации
при проведении государственных закупок
дезинфицирующих средств для обработки
медицинских изделий многократного применения
Стерилизация медицинской продукции.
Биологические и химические индикаторы.
Испытательное оборудование
Стерилизация медицинских изделий.
Низкотемпературная стерилизация парами перекиси
водорода. Требования к разработке, валидации и
регулярному контролю процесса стерилизации
ТК
383
ISO 11138-8:2021
02.03.2026
02.11.2026
Средства
разработчика
02.02.2026
01.10.2026
Средства
разработчика
ТК
383
ТК
383
ISO 18472:2018
01.06.2027
01.11.2027
Средства
разработчика
ТК
383
ISO 22441:2022
01.06.2027
01.11.2027
Средства
разработчика
126.
1.10.3831.034.26Руководство по качеству воды для стерилизаторов,
ТК
средств стерилизации и мойки-дезинфекции изделий 383
медицинского назначения
ISO/TS 5111:2022
01.06.2027
01.11.2027
Средства
разработчика
1.10.3831.035.26
Стерилизация медицинской продукции.
Биологические индикаторы. Часть 1. Общие
требования
Стандартное руководство по ускоренному старению
стерильных барьерных систем для медицинских
изделий
Стерилизация медицинской продукции. Химические
индикаторы. Часть 1. Общие требования
ТК
383
ISO 11138-1:2017
01.06.2027
01.12.2027
Средства
разработчика
ТК
383
ASTM F1980-21
01.12.2026
01.06.2027
Средства
разработчика
ТК
383
ISO 11140-1:2014
02.02.2026
01.10.2026
Средства
разработчика
Имплантаты офтальмологические. Интраокулярные
линзы. Часть 5. Биологическая совместимость
ТК
422
ISO 11979-5:2020
31.05.2026
31.10.2026
Федеральный
бюджет
Стерилизация медицинских изделий.
Микробиологические методы. Часть 3. Испытание на
бактериальный эндотоксин
Изделия медицинские. Оценка биологического
действия медицинских изделий. Часть 17. Оценка
токсикологического риска компонентов медицинских
изделий
Изделия медицинские. Оценка биологического
действия медицинских изделий. Часть 55.
Межлабораторное исследование цитотоксичности
ТК
422
ISO 11737-3:2023
30.05.2026
31.10.2026
Федеральный
бюджет
ТК
422
ISO 10993-17:2023
30.10.2026
30.09.2027
Федеральный
бюджет
ТК
422
ISO/TR 1099355:2023
30.10.2026
30.09.2027
Федеральный
бюджет
1.10.3831.036.26
1.10.3832.031.25
RU.1.6142025
1.10.4221.034.25
1.10.4221.035.25
1.10.4222.036.26
1.10.4222.037.26
127.
1.10.4361.053.251.10.4361.056.25
1.10.4361.057.25
1.10.4361.059.26
1.10.4361.060.26
1.10.4361.061.26
1.10.4361.062.26
1.10.4531.001.25
Изделия медицинские. Руководство по применению
ГОСТ ISO 14971-2021 в отношении медицинских
изделий для диагностики in vitro
Изделия медицинские. Надлежащая практика
восстановления медицинского оборудования для
визуализации
Изделия медицинские. Система менеджмента качества.
Требования к компетентности и поддержанию
компетентности для аудиторских организаций,
осуществляющих аудит изготовителей медицинских
изделий в целях регулирования
Изделия медицинские. Информация, предоставляемая
изготовителем
Изделия медицинские. Соединители для резервуарных
систем доставки, применяемые в здравоохранении.
Часть 1. Общие требования и методы испытаний
Изделия медицинские. Менеджмент риска. Оценка
риска при проектировании и разработке медицинских
изделий
Соединители малого диаметра для жидкостей и газов,
используемые в здравоохранении. Часть 2. Частные
требования к соединителям для респираторного
применения
Имплантаты для хирургии. Бедренный и
большеберцовый компоненты частичных и тотальных
эндопротезов коленного сустава. Часть 1.
ТК
436
ISO/TR 24971:2020
30.06.2026
30.11.2026
Средства
разработчика
ТК
436
IEC 63077(2019)
30.06.2026
30.11.2026
Федеральный
бюджет
ТК
436
IMDRF/MDSAP
WG/N4FINAL:2021
(Edition 2)
20.01.2026
01.05.2026
Средства
разработчика
ТК
436
ТК
436
ISO 20417:2021
30.06.2027
01.11.2027
ISO 18250-1:2018
30.06.2027
01.11.2027
Средства
разработчика
Средства
разработчика
30.06.2027
01.11.2027
Федеральный
бюджет
ТК
436
ТК
436
ISO 80369-2:2024
30.06.2027
01.11.2027
Федеральный
бюджет
ТК
453
ISO 7207-1:2007
01.02.2026
01.09.2026
Федеральный
бюджет
128.
1.10.4531.002.25ISO 14879-1:2020
01.02.2026
01.09.2026
Федеральный
бюджет
ISO 5838-1:2013
01.02.2026
01.09.2026
Федеральный
бюджет
1.10.4531.004.25
Имплантаты для хирургии. Тотальные протезы
ТК
коленного сустава. Часть 1. Определение прочности и 453
эксплуатационных качеств большеберцовых желобов
для протезирования коленного сустава
Имплантаты для хирургии. Стержни, спицы и
ТК
проволока для скелетного вытяжения. Часть 1.
453
Материалы и механические свойства
Инструменты, используемые совместно с неактивными ТК
хирургическими имплантатами. Общие требования
453
ISO 16061:2021
01.02.2026
01.09.2026
Федеральный
бюджет
1.10.4531.005.25
Имплантаты сердечно-сосудистые. Внутрисосудистые
имплантаты. Часть 2. Сосудистые стенты
ТК
453
ISO 25539-2:2020
01.07.2026
01.02.2027
Федеральный
бюджет
1.10.4531.006.25
Имплантаты и искусственные органы для сердечнососудистой системы. Кардиопульмональные
байпассные системы. Фильтры для артериальных
магистралей
ТК
453
ISO
01.05.2026
15675:2016/Amd.1:
2020
01.12.2026
Федеральный
бюджет
1.10.4531.007.25
Имплантаты и искусственные органы для сердечнососудистой системы. Требования к комплектам
одноразовых трубок для искусственного
кровообращения и экстракорпоральной мембранной
оксигенации (ЭКМО)
Имплантаты сердечно-сосудистые и
ТК
453
ISO 15676:2016
01.05.2026
01.12.2026
Федеральный
бюджет
ТК
ISO/TS 17137:2021
01.05.2026
01.12.2026
Федеральный
1.10.4531.003.25
1.10.453-
129.
1.10.4531.009.251.10.4531.010.25
1.10.4531.011.25
1.10.4531.012.25
1.10.4531.013.25
1.10.4531.014.25
1.10.4531.015.25
1.10.4531.016.25
Имплантаты сердечно-сосудистые и
экстракорпоральные системы. Системы
искусственного кровообращения. Венозные отводы
для улавливания газа
Имплантаты сердечно-сосудистые и
экстракорпоральные системы. Центробежные
насосы для нагнетания крови
Оценка способности устройств искусственного
кровообращения (CPB) снижать риск возникновения
газовой микроэмболии (GME) у пациента во время
операции в условиях искусственного
кровообращения
Имплантаты для хирургии. Металлические винты с
коническими опорными поверхностями головок для
скрепления отломков кости. Размеры
Имплантаты для хирургии. Металлические
пластинки для скрепления обломков кости.
Отверстия и пазы для винтов с коническими
поверхностями головок
Инструменты сверлильные для ортопедии. Часть 1.
Сверла, метчики и сборные конические зенковки
ТК
453
ISO
01.05.2026
18241:2016/Amd.1
:2019
01.12.2026
Федеральный
бюджет
ТК
453
ISO
01.05.2026
18242:2016/Amd.1
:2023
ISO/TR 19024:2016 01.05.2026
01.12.2026
Федеральный
бюджет
01.12.2026
Федеральный
бюджет
ТК
453
ISO 9268:1988
01.05.2026
01.12.2026
Федеральный
бюджет
ТК
453
ISO 9269:1988
01.02.2026
01.09.2026
Федеральный
бюджет
ТК
453
ISO 9714-1:2012
01.02.2026
01.09.2026
Федеральный
бюджет
Соединители IS-1 для имплантируемых
электрокардиостимуляторов низкопрофильные.
Технические требования и методы испытаний
Имплантаты для хирургии. Металлические
материалы. Часть 4. Сплав кобальт-хром-
ТК
453
ISO 5841-3:2013
01.07.2026
01.02.2027
Федеральный
бюджет
ТК
453
ISO 5832-4:2024
01.07.2026
01.02.2027
Федеральный
бюджет
ТК
453
130.
1.10.4531.017.251.10.4531.018.25
1.10.4531.019.25
1.10.4531.020.25
1.10.4531.021.25
1.10.4531.023.25
1.10.4531.024.25
1.10.4531.026.25
Имплантаты для хирургии. Металлические материалы.
Часть 5. Сплав кобальт-хром-вольфрам-никелевый
деформируемый
Имплантаты для хирургии. Металлические материалы.
Часть 7. Сплав кобальт-хром-никель-молибденовый,
содержащий железо, ковкий и
холоднодеформируемый
Имплантаты сердечно-сосудистые. Протезы сердечных
клапанов.
Имплантаты сердечно-сосудистые. Внутрисосудистые
имплантаты. Часть 1. Эндоваскулярные протезы
ТК
453
ISO 5832-5:2022
01.07.2026
01.02.2027
Федеральный
бюджет
ТК
453
ISO 5832-7:2024
01.07.2026
01.02.2027
Федеральный
бюджет
01.07.2026
01.02.2027
ISO 25539-1:2017
01.07.2026
01.02.2027
Федеральный
бюджет
Федеральный
бюджет
Имплантаты для хирургии. Эндопротезы
тазобедренного сустава тотальные. Стандартный метод
испытаний для определения усилий при разборке
модульных вертлужных устройств
Имплантаты для хирургии. Основные принципы
безопасности и эффективности
ТК
453
ASTM F 1820-22
01.07.2026
01.02.2027
Федеральный
бюджет
ТК
453
ISO/TR 14283:2018
01.05.2026
01.12.2026
Федеральный
бюджет
Имплантаты сердечно-сосудистые и искусственные
органы. Кардиотомические/венозные системы
резервуаров (с/без фильтра) с твердой оболочкой и
мягкие венозные резервуары
Имплантаты сердечно-сосудистые и
экстракорпоральные системы. Сосудистые устройства,
включающие лекарственные компоненты. Часть 1.
Общие требования
ТК
453
ISO
15674:2016/Amd.1:
2020
01.05.2026
01.12.2026
Федеральный
бюджет
ТК
453
ISO 12417-1:2024
01.05.2026
01.12.2026
Федеральный
бюджет
ТК
453
ТК
453
131.
1.10.4531.027.251.10.4531.028.25
1.10.4531.029.25
1.10.4531.030.25
1.10.4531.031.26
1.10.4531.032.26
1.10.4531.034.26
1.10.4531.035.26
Сердечно-сосудистые имплантаты и
экстракорпоральные системы. Модифицированные
контактные поверхности кровь/ткани для
экстракорпоральных перфузионных систем
Системы газообмена с кровью (оксигенаторы).
Технические требования и методы испытаний
ТК
453
ISO 11658:2012
01.02.2026
01.09.2026
Федеральный
бюджет
ТК
453
01.02.2026
01.09.2026
Федеральный
бюджет
Имплантаты для хирургии. Спецификация и
верификация синтетических анатомических моделей
костей для тестирования
Имплантаты для хирургии. Минимальные наборы
данных для хирургических имплантатов
ТК
453
ISO
7199:2016/Amd.1:
2020
ISO 22926:2023
01.02.2026
01.09.2026
Федеральный
бюджет
ТК
453
ISO 16054:2019
01.02.2026
01.09.2026
Федеральный
бюджет
Имплантаты для хирургии. Износ тотальных
протезов коленного сустава. Часть 3. Параметры
нагружения и перемещения для испытательных
машин с контролем перемещения и окружающих
условий при испытании
Методы испытаний для межпозвонковых устройств
ТК
453
ISO 142433:2014/Amd.1:202
0; ISO 142433:2014
12.11.2026
22.04.2027
Федеральный
бюджет
ТК
453
ТК
453
ASTM F2077-03
12.11.2026
22.04.2027
ASTM F 2063-18
17.02.2027
16.07.2027
Средства
разработчика
Средства
разработчика
ASTM
F2082/F2082M-23
17.02.2027
16.07.2027
Стандартная спецификация на кованые никельтитановые сплавы с памятью формы для
медицинских изделий и хирургических имплантатов
Способ определения температуры превращения
ТК
никель-титановых сплавов c памятью формы по
453
изгибу и свободному восстановлению
Средства
разработчика
132.
1.10.4531.036.26Терминология для никель-титановых сплавов с
памятью формы
ТК
453
ASTM F 200521(2025)
17.02.2027
16.07.2027
Средства
разработчика
1.10.4531.037.26
Имплантаты для хирургии. Стандартный метод
испытания для измерения нагрузок, вызывающих
проседание
Имплантаты для хирургии. Стандартная спецификация
и методы испытания рассасывающихся пластин и
винтов для внутренней фиксации имплантатов
ТК
453
ASTM F2267-24
17.02.2027
16.07.2027
Средства
разработчика
ТК
453
ASTM F2502-24
17.02.2027
16.07.2027
Средства
разработчика
1.10.4531.039.26
Имплантаты для хирургии. Стандартные методы
ТК
испытания для конструкций спинальных имплантатов в 453
модели вертеброэктомии
ASTM F1717-21
21.05.2027
08.10.2027
Средства
разработчика
1.10.4531.040.26
Имплантаты для хирургии. Металлические материалы.
Часть 1. Сталь коррозионно-стойкая (нержавеющая)
ТК
453
ISO 5832-1:2024
17.02.2027
16.07.2027
Средства
разработчика
1.10.4531.041.26
Имплантаты для хирургии. Полиэтилен сверхвысокой
молекулярной массы. Часть 2. Литейные формы
ТК
453
ISO 5834-2:2025
08.04.2027
09.09.2027
Средства
разработчика
1.10.4531.042.26
Имплантаты для хирургии. Эндопротезы
тазобедренного сустава частичные и тотальные. Часть
10. Определение сопротивления статической нагрузке
модульных бедренных головок
ТК
453
ISO 720608.04.2027
10:2018/Amd.1:202
1; ISO 7206-10:2018
09.09.2027
Средства
разработчика
1.10.4531.043.26
Интродьюсеры однократного применения стерильные. ТК
Технические требования и методы испытаний
453
ISO
11070:2014/Amd.1:
2018; ISO
11070:2014
09.09.2027
Федеральный
бюджет
1.10.4531.038.26
08.04.2027
133.
1.10.4531.044.26Имплантаты хирургические неактивные. Общие
требования
ТК
453
ISO 14630:2024
21.05.2027
08.10.2027
Средства
разработчика
1.10.4531.045.26
Стоматология. Имплантаты. Усталостные испытания
для внутрикостных стоматологических имплантатов
ТК
453
ISO 14801:2016
21.05.2027
08.10.2027
Средства
разработчика
1.10.4531.046.26
Имплантаты хирургические неактивные. Имплантаты
для замены суставов. Специальные требования к
имплантатам для протезирования тазобедренного
сустава
Имплантаты хирургические неактивные. Имплантаты
для замены суставов. Специальные требования к
имплантатам для замены коленного сустава
ТК
453
ISO 21535:2023
21.05.2027
08.10.2027
Средства
разработчика
ТК
453
ISO 21536:2023
21.05.2027
08.10.2027
Средства
разработчика
Имплантаты для хирургии. Износ тотальных
эндопротезов тазобедренного сустава. Часть 3.
Параметры нагружения и перемещения машин для
испытания на износ орбитальных опор и условия
окружающей среды при испытании
Имплантаты для хирургии. Эндопротезы
тазобедренного сустава частичные и тотальные. Часть
4. Определение прочности и эксплуатационных
качеств бедренных компонентов с ножкой
ТК
453
ISO 1424208.04.2027
3:2009/Amd.1:2019
09.09.2027
Средства
разработчика
ТК
453
ISO 720608.04.2027
4:2010/Amd.1:2016
09.09.2027
Средства
разработчика
Имплантаты для хирургии. Определение ударной
прочности головки бедренной кости для протезов
тазобедренного сустава
ТК
453
ISO 11491:2017
09.09.2027
Средства
разработчика
1.10.4531.047.26
1.10.4531.048.26
1.10.4531.049.26
1.10.4531.050.26
08.04.2027
134.
1.10.4531.051.261.10.4531.052.26
1.10.4531.053.26
1.10.4531.054.26
1.10.4531.055.26
1.10.4531.056.26
Имплантаты для хирургии. Износ тотальных
эндопротезов тазобедренного сустава. Часть 4.
Испытание эндопротезов тазобедренного сустава при
изменении расположения компонентов, что приводит
к прямому кромочному нагружению
Имплантаты для хирургии. Износ тотальных коленных
протезов. Часть 5. Долговечность
пателлофеморального сустава
Имплантаты для хирургии. Металлические винты для
скрепления отломков кости с внутренним
шестигранником, сферической опорной поверхностью
головки и асимметричной резьбой. Размеры
ТК
453
ISO 14242-4:2018
08.04.2027
09.09.2027
Федеральный
бюджет
ТК
453
ISO 14243-5:2019
21.05.2027
08.10.2027
Федеральный
бюджет
ТК
453
ISO 5835:1991
08.04.2027
09.09.2027
Средства
разработчика
Искусственные водители сердечного ритма
(кардиостимуляторы).Символы для использования на
этикетках водителей сердечного ритма и
предоставляемая информация. Общие требования
Имплантаты для хирургии. Керамические материалы
на основе диоксида циркония тетрагональной
модификации, стабилизированного оксидом иттрия
(Y-TZP)
Имплантаты для хирургии. Дифференциальная
сканирующая калориметрия полимеров PEEK
(полиэфирэфиркетон) и его соединений для
использования в имплантируемых медицинских
устройствах
ТК
453
ISO 27185:2012
21.05.2027
08.10.2027
Средства
разработчика
ТК
453
ISO 13356:2015
08.04.2027
09.09.2027
Средства
разработчика
ТК
453
ISO 15309:2013
08.04.2027
09.09.2027
Средства
разработчика
135.
1.10.4531.057.26Имплантаты для хирургии. Материалы. Процедура
подготовки имитируемой жидкости организма (SBF) и
метод тестирования для обнаружения образования
апатита в SBF для первоначального скрининга
материалов имплантатов, контактирующих с костью
ТК
453
ISO 23317:2025
08.04.2027
09.09.2027
Средства
разработчика
1.10.4531.058.26
Имплантаты для хирургии. Кардиостимуляторы. Часть 2. ТК
Отчет о клиническом эффекте группы импульсных
453
генераторов или электродов
ISO 5841-2:2014
21.05.2027
08.10.2027
Средства
разработчика
1.10.4532.022.25
Имплантаты для хирургии. Метод определения
радикалобразующей активности частиц износа
имплантируемых материалов
ТК
453
01.07.2026
01.02.2027
Федеральный
бюджет
1.10.4532.025.25
Имплантаты для хирургии. Замещение сустава
тотальным эндопротезом. Определение долговечности
работы узла трения эндопротеза тазобедренного
сустава методом оценки крутящего момента
ТК
453
01.07.2026
01.02.2027
Федеральный
бюджет
1.10.4532.033.26
Материалы хирургические шовные. Общие технические ТК
требования. Методы испытаний.
453
17.02.2027
16.07.2027
Средства
разработчика
1.10.4581.113.25
Асептическое производство медицинской продукции.
Часть 1. Общие требования
ТК
458
ISO 13408-1:2023
16.03.2026
19.10.2026
Федеральный
бюджет
1.10.4581.114.25
Асептическое производство медицинской продукции.
Часть 6. Изолирующие системы
ТК
458
ISO 13408-6:2021
16.03.2026
19.10.2026
Федеральный
бюджет
136.
1.10.4581.120.251.10.4581.121.25
1.10.4581.122.26
1.10.4581.123.26
1.10.4581.126.26
1.10.4581.127.26
1.10.4581.128.26
1.10.4582.124.26
Тара и укупорочные средства для лекарственных
средств. Часть 1. Стеклянные флаконы для
вливаний
Тара и укупорочные средства для лекарственных
средств. Часть 2. Пробки к бутылкам для вливаний
ТК
458
ISO 8536-1:2011
16.03.2026
19.10.2026
Федеральный
бюджет
ТК
458
ISO 8536-2:2023
16.03.2026
19.10.2026
Средства
разработчика
Первичная упаковка и укупорочные средства для
инъекционных лекарственных форм. Часть 2.
Пробки для флаконов для инъекционных
лекарственных форм
Полимерные колпачки с вложенными
эластомерными вкладышами для первичной
упаковки лекарственных препаратов,
производимой с помощью технологии
«Выдувание-Наполнение-Укупоривание»
Упаковка для лекарственных средств. Средства
контроля первого вскрытия
Колпачки алюминиевые и колпачки из алюминия и
пластмассы для флаконов для инфузий и
инъекций. Общие требования и методы испытаний
Управление рисками контаминации
механическими включениями первичной упаковки
для парентеральных лекарственных препаратов
Тара и укупорочные средства для лекарственных
препаратов. Часть 1. Флаконы-капельницы
стеклянные
ТК
458
ISO 8362-2:2024
16.02.2027
13.09.2027
Федеральный
бюджет
ТК
458
ISO 15759:2005
16.02.2027
13.09.2027
Средства
разработчика
ТК
458
ТК
458
ISO 21976:2018
16.02.2027
13.09.2027
ISO 8872:2022
16.02.2027
13.09.2027
Средства
разработчика
Средства
разработчика
ТК
458
ISO/TR 8417:2024
16.02.2027
13.09.2027
Средства
разработчика
ТК
458
ISO 11418-1:2016
16.02.2027
13.09.2027
Федеральный
бюджет
137.
1.10.4582.125.261.10.4582.129.26
Первичные упаковочные материалы для
лекарственных средств. Частные требования по
применению ИСО 9001:2008 с учетом надлежащей
производственной практики (GMP)
Тара и укупорочные средства для лекарственных
препаратов. Часть 2. Стеклянные флаконы с винтовой
горловиной для сиропов
ТК
458
ISO 15378:2017; ISO 16.02.2027
15378:2017/Amd.1:
2024
13.09.2027
Средства
разработчика
ТК
458
ISO 11418-2:2016;
16.02.2027
ISO 114182:2016/Amd.1:2017
13.09.2027
Средства
разработчика
1.10.4582.130.26
Тара и укупорочные средства для лекарственных
ТК
препаратов. Часть 7. Флаконы из стеклянной трубки с
458
винтовой горловиной для жидких лекарственных форм
ISO 11418-7:2016
16.02.2027
13.09.2027
Средства
разработчика
1.10.4582.131.26
Тара и укупорочные средства для лекарственных
препаратов. Часть 5. Комплект крышки-капельницы
ТК
458
ISO 11418-5:2015
16.02.2027
13.09.2027
Средства
разработчика
1.10.4582.132.26
Тара и укупорочные средства для лекарственных
препаратов. Часть 3. Флаконы из облегченного стекла с
винтовой горловиной для твердых и жидких
лекарственных форм
Тара и укупорочные средства для лекарственных
препаратов. Часть 4. Стеклянные флаконы для таблеток
ТК
458
ISO 11418-3:2016;
16.02.2027
ISO 114183:2016/Amd.1:2017
13.09.2027
Средства
разработчика
ТК
458
ISO 11418-4:2005
16.02.2027
13.09.2027
Средства
разработчика
Оптика и фотоника. Миры для определения
разрешающей способности оптико-фотографических
систем. Типы, основные параметры и размеры, общие
технические требования
ТК
296
01.07.2026
01.11.2026
Средства
разработчика
1.10.4582.133.26
1.12.2961.190.25
138.
1.12.2961.192.25Оптика и фотоника. Системы телескопические для
оптических приборов. Визуальный метод
определения предела разрешения
ТК
296
29.07.2026
01.11.2026
Средства
разработчика
1.12.2961.193.25
Оптика и фотоника. Приборы телескопические.
Общие технические требования
ТК
296
29.07.2026
01.11.2026
Средства
разработчика
1.12.2961.194.25
Оптика и фотоника. Приборы оптические.
ТК
Требования к чистоте поля зрения. Методы контроля 296
чистоты поля зрения
Оптика и фотоника. Спектральные диапазоны
ТК
296
Оптика и фотоника. Правила выполнения чертежей ТК
оптических деталей и систем. Часть 17. Порог
296
повреждения лазерным излучением
01.07.2026
02.11.2026
Средства
разработчика
ISO 20473:2007
01.07.2026
02.11.2026
ISO 10110-17:2004
01.07.2026
02.11.2026
Средства
разработчика
Средства
разработчика
29.07.2026
01.11.2026
Средства
разработчика
1.12.2961.198.25
1.12.2961.200.25
1.12.2961.213.25
1.12.2961.214.25
1.12.2961.215.25
1.12.296-
Оптика и фотоника. Объективы для оптикоэлектронных систем. Метод измерения кривизны
изображения и астигматизма
Оптика и фотоника. Внешние воздействующие
факторы. Часть 1. Термины и определения. Методы
испытаний. Основные положения
ТК
296
ТК
296
ISO 9022-1:2016
29.07.2026
01.11.2026
Средства
разработчика
Оптика и фотоника. Телескопические оптические
системы. Термины и определения. Часть 5. Термины
и определения, относящиеся к приборам ночного
видения
Оптика и фотоника. Методы определения полного
ТК
296
ISO 14132-5:2008
29.07.2026
01.11.2026
Средства
разработчика
ТК
ISO 13696:2022
29.07.2026
01.11.2026
Средства
139.
1.12.2961.227.26Оптика и фотоника. Оценка качества оптических
систем. Определение искажений дисторсии
ТК
296
ISO 9039:2008
30.06.2027
30.09.2027
Средства
разработчика
1.12.2961.228.26
Оптика и фотоника. Подготовка чертежей для
оптических элементов и систем. Часть 5. Допуски на
форму поверхности
Оптика и фотоника. Подготовка чертежей для
оптических элементов и систем. Часть 6. Допуски на
центрирование и наклон
Оптика и фотоника. Подготовка чертежей для
оптических элементов и систем. Часть 9. Обработка
поверхности и покрытие
Оптика и фотоника. Подготовка чертежей для
оптических элементов и систем. Часть 11. Данные с
недопустимыми отклонениями
Оптика и фотоника. Подготовка чертежей для
оптических элементов и систем. Часть 12.
Асферические поверхности
Оптика и фотоника. Подготовка чертежей для
оптических элементов и систем. Часть 19. Общее
описание поверхностей и компонентов
ТК
296
ISO 10110-5:2015
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
ISO 10110-6:2025
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
ISO 10110-9:2016
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
ISO 10110-11:2025
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
ISO 10110-12:2019
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
ISO 10110-19:2015
30.06.2027
30.09.2027
Средства
разработчика
Оптика и фотоника. Определение коэффициента
отражения плоских поверхностей и коэффициента
пропускания плоскопараллельных оптических
элементов
ТК
296
ISO 15368:2021
30.06.2027
30.09.2027
Средства
разработчика
1.12.2961.229.26
1.12.2961.230.26
1.12.2961.231.26
1.12.2961.232.26
1.12.2961.233.26
1.12.2961.234.26
140.
1.12.2961.235.26Оптика и фотоника. Оценка качества оптических
систем. Оценка ухудшения качества изображения изза хроматических аберраций
ТК
296
ISO 15795:2002; ISO 30.06.2027
15795:2002/Cor.1:2
007
30.09.2027
Средства
разработчика
1.12.2961.236.26
Оптика и фотоника. Объективы для оптикоэлектронных систем. Определение кривизны
изображения и астигматизма
Оптика и фотоника. Объективы для оптикоэлектронных систем. Определение хроматической
аберрации положения
ТК
296
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
30.06.2027
30.09.2027
Средства
разработчика
30.06.2027
30.09.2027
Средства
разработчика
30.06.2027
30.09.2027
Средства
разработчика
30.06.2027
30.09.2027
Средства
разработчика
1.12.2961.244.26
Оптика и фотоника. Объективы для оптикоТК
электронных систем. Определение хроматической
296
аберрации увеличения
Оптика и фотоника. Объективы для оптикоТК
электронных систем. Определение поперечной
296
аберрации
Оптика и фотоника. Шрифты, знаки, линии стеклянных ТК
сеток и шкал оптических приборов. Типы, основные
296
параметры и размеры
Оптика и фотоника. Материалы для заполнения знаков ТК
на оптическом стекле. Общие требования
296
30.06.2027
30.09.2027
Средства
разработчика
1.12.2961.245.26
Оптика и фотоника. Приборы оптико-механические.
Общие технические требования
ТК
296
30.06.2027
30.09.2027
Средства
разработчика
1.12.2961.246.26
Оптика и фотоника. Микроболометрические
матричные детекторы и фотоприемные устройства.
ТК
296
30.06.2027
30.09.2027
Средства
разработчика
1.12.2961.237.26
1.12.2961.238.26
1.12.2961.239.26
1.12.2961.243.26
141.
1.12.2961.247.261.12.2961.248.26
1.12.2961.251.26
1.12.2961.252.26
1.12.2961.254.26
1.12.2961.256.26
1.12.2961.257.26
1.12.2961.258.26
1.12.2961.259.26
1.12.296-
Оптика и фотоника. Микроболометрические
ТК
матричные детекторы и фотоприемные устройства.
296
Методы определения фотоэлектрических параметров и
характеристик
Оптика и фотоника. Микроскопы. Стекла покровные.
ТК
Общие требования и методы испытаний
296
Оптика и фотоника. Лазеры волоконные. Общие
ТК
технические требования
296
Оптика и фотоника. Интегральная оптика. Соединения. ТК
Термины и определения. Параметры, влияющие на
296
свойства соединения
Оптика и фотоника. Производство оптических деталей. ТК
Припуски на обработку заготовок оптического стекла
296
Оптика и фотоника. Станки для обработки оптических
деталей. Оснастка для круглошлифовальных станков
для кругления оптических деталей. Конструкция и
размеры
Оптика и фотоника. Производство оптических деталей.
Типовые технологические процессы центрирования
линз
Оптика и фотоника. Станки для обработки оптических
деталей. Требования к испытаниям на точность
Оптика и фотоника. Станки шлифовальные для
обработки оптических деталей. Нормы точности
Оптика и фотоника. Фотонные интегральные схемы.
30.06.2027
30.09.2027
Средства
разработчика
30.06.2027
30.09.2027
30.06.2027
30.09.2027
30.06.2027
30.09.2027
Средства
разработчика
Средства
разработчика
Средства
разработчика
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
30.06.2027
30.09.2027
Средства
разработчика
ТК
296
ТК
296
ТК
30.06.2027
30.09.2027
30.06.2027
30.09.2027
31.03.2027
30.06.2027
Средства
разработчика
Средства
разработчика
Средства
ISO 8255-1:2017
ISO 14881:2021
142.
1.12.2961.262.261.12.2961.263.26
1.12.2961.264.26
1.12.2961.265.26
1.12.2961.266.26
1.12.2961.267.26
1.12.2961.268.26
1.2.2961.203.25
1.2.2961.253.26
1.2.2961.260.26
Оптика и фотоника. Фотонные интегральные схемы.
Методы испытаний
Оптика и фотоника. Фотонные интегральные схемы.
Показатели надежности и гарантии
Оптика и фотоника. Фотонные интегральные схемы.
Контроль качества в процессе производства и правила
приемки
Оптика и фотоника. Фотонные интегральные схемы.
Требования к маркировке
Оптика и фотоника. Фотонные интегральные схемы.
Требования к упаковке
Оптика и фотоника. Фотонные интегральные схемы.
Требования к хранению и транспортированию
ТК
296
ТК
296
ТК
296
30.03.2027
30.06.2027
31.03.2027
30.06.2027
31.03.2027
30.06.2027
ТК
296
ТК
296
ТК
296
30.03.2027
30.06.2027
31.03.2027
30.06.2027
31.03.2027
30.06.2027
Оптика и фотоника. Фотонные интегральные схемы.
Указания по применению и эксплуатации
Лазерно-плазменное азотирование сталей и сплавов.
Технологический процесс
Оптика и фотоника. Алмазный инструмент для
обработки оптических деталей. Конструкция и
размеры. Часть 4. Хвостовики грибов, чашек и
планшайб
Оптика и фотоника. Система подвижной оптической
дуплексной связи с беспилотным воздушным судном.
Общие положения
ТК
296
ТК
296
ТК
296
31.03.2027
30.06.2027
01.07.2026
11.11.2026
30.06.2027
30.09.2027
ТК
296
01.09.2027
01.12.2027
Средства
разработчика
Средства
разработчика
Средства
разработчика
Средства
разработчика
Средства
разработчика
Федеральный
бюджет
Средства
разработчика
Средства
разработчика
Средства
разработчика
Средства
разработчика
143. 03-00 Вопросы, связанные с соблюдением требований критериев аккредитации
Аккредитованное лицо вправе проводить исследования (испытания) и измерения в соответствиис ранее действующими версиями документов в области стандартизации, правил и методов
исследований (испытаний) и измерений, в том числе правил отбора образцов (проб),
содержащихся в перечне международных и региональных (межгосударственных) стандартов, а в
случае их отсутствия – национальных (государственных) стандартов, содержащих правила и
методы исследований (испытаний) и измерений, в том числе правила отбора образцов,
необходимые для применения и исполнения требований технического регламента Евразийского
экономического союза (далее – Союз) и осуществления оценки соответствия объектов
технического регулирования, включенными в утвержденную область аккредитации, которые
прекратили свое действие на территории Российской Федерации и не были заменены на иные
правила и методы исследований (испытаний) и измерений, в том числе правила отбора образцов
(проб), но продолжают действовать на территории других государств – членов Союза.
При этом основания, случаи и процедуры использования ранее действующих версий таких
документов должны быть отражены в системе менеджмента аккредитованного лица и должны
соблюдаться.
Соответствие реализации порядка проведения исследований (испытаний), измерений
требованиям указанных выше документов оценивается при подтверждении компетентности
испытательной лаборатории (центра) в соответствии со статьей 24 Федерального закона от
28.12.2013 № 412-ФЗ «Об аккредитации в национальной системе аккредитации».
144. Отмена национального стандарта
На основании п.8.1 ГОСТ Р 1.2-2020 Росстандарт может отменить действующий национальный стандарт по следующим основаниям:а) при утверждении и введении в действие взамен данного стандарта другого национального стандарта, в том числе при включении
положений данного стандарта в другой стандарт;
б) при утверждении национального стандарта или введении в действие в этом качестве межгосударственного стандарта, который
распространяется на тот же объект и аспект стандартизации;
в) при полном прекращении выпуска продукции, проведения работ или оказания услуг, которые осуществлялись по данному стандарту;
г) если требования стандарта:
- противоречат Конституции Российской Федерации, федеральным конституционным законам, международным договорам Российской
Федерации, федеральным законам, актам Президента Российской Федерации, актам Правительства Российской Федерации, нормативным
правовым актам федеральных органов исполнительной власти и нормативным правовым актам Государственной корпорации по атомной
энергии "Росатом" и иных государственных корпораций, изданным в соответствии с установленными полномочиями, техническим
регламентам, в том числе техническим регламентам ЕАЭС, относящимся к данному объекту и/или аспекту стандартизации;
- дублируют нормы законодательства Российской Федерации;
- изменяют права участников гражданско-правовых отношений, установленные законодательством Российской Федерации или
нормативными правовыми актами федеральных органов исполнительной власти;
- устанавливают ответственность организаций, должностных лиц и отдельных работников за нарушение требований национального
стандарта;
- дублируют требования и правила действующих национальных стандартов, межгосударственных стандартов, введенных в качестве
национальных стандартов Российской Федерации, если не планируется отмена действующих национальных стандартов на тот же объект или
аспект стандартизации;
д) в случае принятия решения об отмене на заседании Комиссии по апелляциям при Росстандарте;
е) в других случаях, когда стандарт утратил свою актуальность в связи с изменением направлений работ по национальной стандартизации
в данной области.
145. Письмо Евразийской экономической комиссии от 17 июня 2021 года № 16-1398
Департамент технического регулирования и аккредитации Евразийской экономической комиссии (далее соответственно Департамент, Комиссия) в пределах своих полномочий, установленных Договором о Евразийском экономическом союзе от 29 мая2014 года (далее соответственно - Договор, Союз), рассмотрел обращение Национального Лифтового Союза от 9 июня 2021 г. №
103 и сообщает следующее.
Согласно статье 1 Договора в Союзе обеспечивается свобода движения товаров, услуг, капитала и рабочей силы, проведение
скоординированной, согласованной или единой политики в отраслях экономики, определенных указанным Договором и
международными договорами в рамках Союза. Одной из целей Союза является стремление к формированию единого рынка
товаров.
Комиссия, являющаяся одним из органов Союза, осуществляет свою деятельность в пределах полномочий, предусмотренных
Договором и международными договорами в рамках Союза, в том числе, в сфере технического регулирования (приложение № 1 к
Договору).
Вопросы правового регулирования отношений в области установления, применения и исполнения обязательных требований к
продукции, а также в области оценки соответствия регламентированы соответствующими положениями Договора (раздел X
Договора, Протокол о техническом регулировании в рамках Евразийского экономического союза (приложение № 9 к Договору) и
актами Комиссии.
При этом отмечаем, что пунктом 4 Протокола о техническом регулировании в рамках Евразийского экономического союза
(приложение № 9 к Договору) (далее - Протокол) определено, что в технических регламентах Союза устанавливаются
обязательные требования к объектам технического регулирования, а также правила идентификации продукции, формы, схемы и
процедуры оценки соответствия.
146. Письмо Евразийской экономической комиссии от 17 июня 2021 года № 16-1398
Письмо Евразийской экономической комиссии от 17 июня 2021 года № 161398В соответствии с пунктом 4 Протокола в целях выполнения требований технического
регламента Союза Комиссией утверждается перечень международных и региональных
(межгосударственных) стандартов, а в случае их отсутствия - национальных
(государственных) стандартов, в результате применения которых на добровольной основе
обеспечивается соблюдение требований технического регламента Союза.
Применение на добровольной основе соответствующих стандартов, включенных в
указанный перечень, является достаточным условием соблюдения требований
соответствующего технического регламента Союза.
Неприменение стандартов, включенных в указанный перечень, не может рассматриваться
как несоблюдение требований технического регламента Союза.
В случае неприменения стандартов, включенных в указанный перечень,
оценка соответствия осуществляется на основе анализа рисков…….
147.
С учетом изложенного, в целях соблюдения в рамках Союза единства правил иметодов исследований (испытаний) и измерений при проведении процедур
обязательной оценки соответствия, при оценке соответствия объектов
технического регулирования требованиям технического регламента Союза
должны применяться межгосударственные стандарты, а в случае их отсутствия
- национальные (государственные) стандарты или аттестованные методики,
включенные в Перечень стандартов, в том числе действие которых на
территории государства - члена Союза отменено.!!!!!
148.
149.
150.
Практикум 4СОСТОЯНИЕ ГАРМОНИЗАЦИИ СТАНДАРТОВ В СФЕРЕ МИ 2025-26:
МЕЖДУНАРОДНЫЕ И ЕВРАЗИЙСКИЕ ТРЕБОВАНИЯ ДЛЯ ПРОИЗВОДИТЕЛЕЙ МИ
Ольга Тарасенко, д.м.н., Заместитель директора Федерации
лабораторной медицины России, профессор кафедры госпитальной
эпидемиологии, медицинской паразитологии и тропических
болезней ФГБОУ ДПО РМАНПО Минздрава РФ
151.
Ключевые темы:Состояние и проекты внедрения международных стандартов, и их применимость при
производстве и обращении МИ в России и ЕАЭС
Состояние действующих и новых межгосударственных стандартов и особенности их
использования при производстве МИ в России
Нюансы обеспечения применимости зарубежных, международных стандартов, не
гармонизированных в РФ: ключевые НПА Минпромторга и Росстандарта на 2025-26 гг
Как производителю МИ найти информацию о международных и зарубежных стандартах,
если нужен стандарт на продукцию и методы испытаний, которых нет в национальных
стандартах
Межгосударственный Совет по стандартизации, метрологии и сертификации ЕАЭС:
принципы разработки стандартов, внесения изменений, принятия и применения,
введения в действие национальных стандартов и методик исследований и измерений
Обязательно ли национальные стандарты перерабатывать в межгосударственные и в
каких случаях это необходимо делать
152.
Министерство промышленности и торговли Российской ФедерацииФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И
МЕТРОЛОГИИ
ПРИКАЗ
от 21 июня 2021 года № 1061
Об определении Порядка и условий применения международных
стандартов, региональных стандартов, межгосударственных
стандартов и региональных сводов правил, а также стандартов
иностранных государств и сводов правил иностранных государств
153. 1. Настоящие Порядок и условия применения международных стандартов, региональных стандартов, межгосударственных стандартов и
региональныхсводов правил, а также стандартов иностранных государств и сводов правил
иностранных государств применяются:
а) при поставках товаров, выполнении работ, оказании услуг, в том числе осуществлении
закупок товаров, работ, услуг для обеспечения государственных и муниципальных нужд,
а также в конструкторской, проектной и иной технической документации;
б) при выполнении работ и оказании услуг в соответствии с межправительственными
соглашениями, а также договорами и контрактами, заключаемыми предприятиями,
организациями и корпорациями с иностранными партнерами.
154.
3. Стандарты подлежат применению со дня их регистрации вФедеральном информационном фонде стандартов в соответствии
с Порядком регистрации федеральным органом исполнительной власти в
сфере стандартизации документов, разрабатываемых и применяемых в
национальной системе стандартизации, сводов правил, международных
стандартов,
региональных
стандартов,
стандартов
иностранных
государств
и
сводов
правил
иностранных
государств,
утвержденным приказом Министерства промышленности и торговли
Российской Федерации от 27 мая 2016 г. №1716 (зарегистрирован
Министерством юстиции Российской Федерации 30 сентября 2016 г.,
регистрационный № 43878).
155. 4. Условиями применения стандартов являются
а) отсутствие национальных стандартов Российской Федерациии предварительных национальных
стандартов Российской Федерации
в отношении объектов стандартизации, предусмотренных
международными стандартами, региональными стандартами, межгосударственными стандартами и
региональными сводами правил, а также стандартами иностранных государств и сводами правил
иностранных государств;
б) соблюдение основополагающих национальных стандартов;
в) соответствие документов по стандартизации действующим на территории Российской Федерации
техническим регламентам;
г) соответствие стандартов современному уровню развития науки, техники и технологий, передовому
зарубежному опыту ;
д) наличие разрешения от правообладателя на использование стандарта и выполнение его перевода
на русский язык;
е) соответствие стандартов межправительственным соглашениям, а также договорам и контрактам,
заключаемым предприятиями, организациями и корпорациями с иностранными партнерами.
156.
МИНИСТЕРСТВО ПРОМЫШЛЕННОСТИ И ТОРГОВЛИРОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 27 мая 2016 года № 1716
Об утверждении Порядка регистрации федеральным органом
исполнительной власти в сфере стандартизации документов,
разрабатываемых и применяемых в национальной системе
стандартизации, сводов правил, международных стандартов,
региональных стандартов и региональных сводов правил,
стандартов иностранных государств и сводов правил
иностранных государств
157. 2. При регистрации документов по стандартизации в Фонде стандартов им присваивают следующие обозначения:
а) обозначение национального стандарта Российской Федерации, в том числе основополагающего национальногостандарта Российской Федерации состоит из индекса "ГОСТ Р", регистрационного номера и отделенного от него тире
года утверждения;
б) обозначение предварительного национального стандарта Российской Федерации состоит из индекса "ПНСТ",
регистрационного номера и отделенного от него тире года утверждения;
в) при регистрации правил стандартизации и рекомендаций по стандартизации им присваивают обозначение,
состоящее из индекса "ПР", означающего правила, или индекса "Р", означающего рекомендации, кода разработчика,
отделенного от индекса интервалом и присвоенного в соответствии с Общероссийским классификатором органов
государственной власти и управления, условного цифрового обозначения кода направления деятельности правил
или рекомендаций по стандартизации, отделенного от кода разработчика точкой, отделенного от него точкой
трехзначного регистрационного номера документа и отделенного от него тире года принятия документа;
г) сводам правил при регистрации присваивается обозначение, состоящее из названий начальных букв слов "свод
правил" - "СП", порядкового регистрационного номера, кода разработчика, утвердившего свод правил, присвоенного
в соответствии с Общероссийским классификатором органов государственной власти и управления, и года
утверждения свода правил;
д) международные стандарты, региональные стандарты и региональные своды правил, стандарты иностранных
государств и своды правил иностранных государств регистрируются в Фонде стандартов с применением
оригинальных регистрационных обозначений, присвоенных разработчиком документа, на русском языке и языке
оригинала.
158. 6. Регистрацию документов по стандартизации в Фонде стандартов осуществляет Росстандарт в следующие сроки:
а) документов, разрабатываемых и применяемых в национальной системестандартизации, - в течение 3 рабочих дней со дня их утверждения Росстандартом;
б) сводов правил - в течение 3 рабочих дней со дня поступления от разработчика
утвержденных сводов правил;
в) международных стандартов, региональных стандартов и региональных сводов
правил, стандартов иностранных государств и сводов правил иностранных государств
- в течение 30 рабочих дней со дня внесения Росстандартом записи в реестр
документов по стандартизации в отношении указанных документов по
стандартизации.
159.
МИНИСТЕРСТВО ПРОМЫШЛЕННОСТИ ИТОРГОВЛИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ
РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ПИСЬМО
от 19 октября 2021 г. № АШ-2889/11
160.
В части подпункта д) пункта 4 указанного Порядка на территории Российской Федерации могутприменяться
зарубежные
документы
по
стандартизации,
зарегистрированные
в Федеральном
информационном фонде стандартов (далее - Фонд), при этом решение о регистрации документа по
стандартизации в Фонде принимает Росстандарт на основании обращения заинтересованного лица и по
результатам экспертизы профильного технического - комитета по стандартизации. Необходимыми
условиями для принятия решения о регистрации документа по стандартизации в Фонде является
наличие у национального органа по стандартизации (Росстандарта) соглашения с обладателем
авторских
прав
зарегистрировать.
.
на
нормативно-технический
документ,
перевод
которого
предполагается
161.
В соответствии со статьей 29 Федерального закона от 29 июня 2015 года № 162ФЗ "О стандартизации в Российской Федерации" Федеральный информационный фондстандартов (далее - Фонд) является государственным информационным ресурсом и
составляет документы: национальной системы стандартизации,
• общероссийские классификаторы,
• международные стандарты,
• региональные стандарты,
• стандарты иностранных государств,
• своды правил,
• региональные своды правил,
• своды правил иностранных государств,
• надлежащим образом заверенные переводы!!! на русский язык международных
стандартов, региональных стандартов и региональных сводов правил, стандартов
иностранных государств и сводов правил иностранных государств, которые приняты на
учет федеральным органом исполнительной власти в сфере стандартизации,
документы по стандартизации международных организаций по стандартизации,
региональных организаций по стандартизации и иные документы по стандартизации
иностранных государств
162. Федеральный закон «О внесении изменений в Федеральный закон «Об обеспечении единства измерений»
Отсутствует возможность применения ТСУИФ; установлениеобязательных требований и оценка соответствия их данным
требованиям
предусмотрены
только
в
соответствии
с
законодательством Российской Федерации о техническом
регулировании, реализуемым в основном в рамках ЕАЭС, что
накладывает существенные ограничения
А что сейчас есть в 102-ФЗ
163. Федеральный закон от 26.06.2008 №102-ФЗ «Об обеспечении единства измерений»
Статья 10. Технические системы и устройства с измерительными функциями
1. Обязательные требования к техническим системам и устройствам с измерительными
функциями, а также формы оценки их соответствия указанным требованиям устанавливаются
законодательством Российской Федерации о техническом регулировании.
2. Порядок отнесения технических средств к техническим системам и устройствам с
измерительными функциями устанавливается федеральным органом исполнительной власти,
осуществляющим функции по выработке государственной политики и нормативно-правовому
регулированию в области обеспечения единства измерений.
3. Обеспечение единства измерений при разработке, производстве и эксплуатации технических
систем и устройств с измерительными функциями осуществляется в соответствии с
законодательством Российской Федерации об обеспечении единства измерений.
164.
МИНИСТЕРСТВО ПРОМЫШЛЕННОСТИ И ТОРГОВЛИ РОССИЙСКОЙФЕДЕРАЦИИ
ПРИКАЗ
от 15 декабря 2015 г. №4092
ОБ УТВЕРЖДЕНИИ ПОРЯДКА ОТНЕСЕНИЯ ТЕХНИЧЕСКИХ
СРЕДСТВ К ТЕХНИЧЕСКИМ СИСТЕМАМ И УСТРОЙСТВАМ С
ИЗМЕРИТЕЛЬНЫМИ ФУНКЦИЯМИ
165. Приказ Минпромторга России от 15.12.2015 № 4092 "Об утверждении Порядка отнесения технических средств к техническим системам и
Приказ Минпромторга России от 15.12.2015 № 4092"Об утверждении Порядка отнесения технических средств к техническим
системам и устройствам с измерительными функциями"
3. Для целей настоящего Порядка применяются понятия, установленные в Федеральном законе № 102-ФЗ, а
также следующие термины и соответствующие им определения:
а) идентификация технического средства, имеющего измерительные функции - определение
принадлежности технического средства, имеющего измерительные функции, к техническим системам и
устройствам с измерительными функциями посредством установления наличия у них общих или частных
признаков (условий), перечисленных в пункте 6 настоящего Порядка, с учетом их возможностей для
решения конкретных измерительных задач, которые могут быть реализованы в аппаратной, аппаратнопрограммной или программной части таких технических средств;
б) измерительная функция технического средства - функция, реализованная в аппаратной, аппаратнопрограммной или программной части технического средства, предназначенная для решения конкретной
измерительной задачи;
в) функция назначения (основная функция) технического средства - функция, реализация которой является
основной целью создания технического средства.
166.
г) реализованная в составных частях технического средства измерительная
функция не признается функцией назначения (основной функцией)
технического средства для конструктивно законченного средства измерений;
д) в составе аппаратной и (или) программной составляющей технического
средства невозможно выделить обособленные конструктивные отдельные
элементы (блоки, модули) и (или) элементы программного обеспечения,
которые при осуществлении техническим средством функции назначения
(основной функции) реализуют только измерительные функции;
е) измерительные функции технического средства реализуются с помощью
входящих в его состав (встроенных) средств измерений, являющихся
составными частями этого технического средства, при этом алгоритм
реализации его функции назначения (основной функции) предполагает
преобразование измерительной информации, поступающей с таких средств
измерений, вследствие чего метрологические характеристики технического
средства не являются идентичными метрологическим характеристикам
входящих в его состав средств измерений;
ж) ни одна из измерительных функций технического средства не является его
функцией назначения (основной функцией).
167. 6. После регистрации заявки осуществляется идентификация технического средства, при проведении которой Росстандарт в случае
необходимости обращается в соответствующиегосударственные научные метрологические институты для проведения ими документарной
проверки функции назначения (основной функции) технического средства и соответствия его
следующим признакам (условиям):
• а) техническое средство наряду с основной функцией выполняет измерительные
функции, имеющие соответствующие метрологические характеристики, причем
измерительные функции являются дополнительными (вспомогательными) функциями,
а результаты измерений, полученные в процессе выполнения техническим средством
основной функции, используются в областях деятельности, на которые
распространяется сфера государственного регулирования обеспечения единства
измерений, или для других целей;
• б) измерительные функции технического средства должны быть реализованы в
процессе применения технического средства по функции назначения (основной
функции);
• в) техническое средство не должно использоваться для измерений вне выполнения
функции назначения (основной функции);
168.
Законопроектомпредлагается
расширить
возможности
установления обязательных метрологических требований к
ТСУИФ и оценки соответствия данным требованиям не только в
соответствии с законодательством о техническом регулировании,
поскольку данное законодательство распространяется не на все
регулируемые отношения, где возможно применение ТСУИФ, но и
на возможность установления обязательных требований к ТСУИФ и
оценки соответствия данным требованиям в соответствии с другим
законодательством Российской Федерации. А именно закрепить
полномочие Правительства Российской Федерации по утверждению
перечня федеральных органов исполнительной власти, актами
которых будут устанавливаться обязательные требования к
техническим системам и устройствам с измерительными функциями
в соответствии с особенностями сфер регулирования, к которым они
отнесены.
169.
Вносится ПравительствомРоссийской Федерации
Проект
ФЕДЕРАЛЬНЫЙ ЗАКОН
О внесении изменений в Федеральный закон «Об обеспечении
единства измерений»
Статья 1
Внести в Федеральный закон от 26 июня 2008 года № 102-ФЗ «Об обеспечении
единства измерений» (Собрание законодательства Российской Федерации, 2008, №
26, ст. 3021; 2012, № 31, ст.4322; 2014, № 26, ст. 3366; № 30, ст. 4255; 2019, № 52, ст.
7814; 2020, № 44, ст. 6890; 2024, № 8, ст. 1045) следующие изменения:
1) в статье 2:
а) дополнить пунктом 1.1 в следующей редакции:
«1.1)
аттестация
технических
систем
и
устройств
с
измерительными
функциями – теоретические и (или) экспериментальные исследования технических
систем и устройств с измерительными функциями и подтверждение их соответствия
обязательным требованиям, включая обязательные метрологические требования;»;
б) дополнить пунктом 8.1 в следующей редакции:
«8.1)
измерительная
функция
–
функция,
обеспечивающая
получение
результата измерений;»;
в) в пункте 23 дополнить словами «, необходимые для реализации основных
функций»;
2) в статье 10:
а) часть 1 изложить в следующей редакции:
«1. Обязательные требования, включая обязательные метрологические требования,
к техническим системам и устройствам с измерительными функциями
170.
атакже
формы
оценки
их
соответствия
указанным
требованиям
устанавливаются законодательством Российской Федерации.
Правительством Российской Федерации утверждается перечень федеральных
органов исполнительной власти, в сферу ведения которых входят технические
средства, отнесенные к техническим системам и устройствам с измерительными
функциями.
Оценка соответствия технических систем и устройств с измерительными
функциями
обязательным
требованиям
осуществляется
в
форме
аттестации
технических систем и устройств с измерительными функциями. К применению в
сфере
государственного
регулирования
обеспечения
единства
измерений
допускаются технические системы и устройства с измерительными функциями,
соответствующие обязательным требованиям.»;
б) дополнить частью 1.1 следующего содержания:
«1.1.
Аттестация
технических
систем
и
устройств
с
измерительными
функциями осуществляется в соответствии с порядком, предусмотренным частью 2
настоящей статьи, государственными научными метрологическими институтами,
государственными региональными центрами метрологии, а также юридическими
лицами,
аккредитованными
в
соответствии
с
законодательством
Российской
Федерации об аккредитации в национальной системе аккредитации на выполнение
аттестации технических систем и устройств с измерительными функциями. До ввода
в эксплуатацию технические системы и устройства с измерительными функциями
подлежат первичной аттестации, в процессе эксплуатации, в том числе после
ремонта
–
периодической
аттестации.
По
результатам
первичной
аттестации
технических систем и устройств с измерительными функциями устанавливаются
методика аттестации и периодичность аттестации.»;
в) часть 2 изложить в следующей редакции:
«2. Порядок и критерии отнесения технических средств к техническим системам и
устройствам с измерительными функциями, порядок аттестации технических
систем и устройств с измерительными функциями, требования к методикам
аттестации, их содержанию и оформлению устанавливаются
171.
федеральным органом исполнительной власти, осуществляющим функции повыработке государственной политики и нормативно-правовому регулированию в
области обеспечения единства измерений. Решение об отнесении технических
средств к техническим системам и устройствам с измерительными функциями
принимает федеральный орган исполнительной власти, осуществляющий функции
по оказанию государственных услуг и управлению государственным имуществом в
области обеспечения единства измерений.»;
г) дополнить частями 4 – 7 следующего содержания:
«4. Технические системы и устройства с измерительными функциями должны
иметь заводские, серийные номера или другие буквенно-цифровые обозначения,
однозначно идентифицирующие каждый экземпляр технической системы и
устройства с измерительными функциями, конструкция технических систем и
устройств с измерительными функциями должна обеспечивать ограничение доступа
к определенным частям технической системы и устройства с измерительными
функциями,
включая
программное
обеспечение,
в
целях
предотвращения
несанкционированных настройки и вмешательства, которые могут привести к
искажениям результатов измерений. Место, способ и форма нанесения номера или
другого обозначения должны обеспечивать возможность прочтения и сохранность в
процессе эксплуатации технической системы и устройства с измерительными
функциями.
5. Применение технических систем и устройств с измерительными функциями
в сфере государственного регулирования обеспечения единства измерений для
измерений, не связанных с реализацией их основных функций, не допускается.
6. Сведения о результатах аттестации технических систем и устройств с
измерительными функциями передаются государственными научными
метрологическими институтами, государственными региональными центрами
метрологии, а также юридическими лицами, аккредитованными в соответствии с
законодательством Российской Федерации об аккредитации в национальной
системе аккредитации на выполнение аттестации технических систем и устройств с
измерительными функциями, проводившими аттестацию, в Федеральный
172.
информационный фонд по обеспечению единства измерений в срок,установленный в порядке аттестации технических систем и устройств с
измерительными функциями, предусмотренном частью 2 настоящей статьи. Состав
сведений
о
результатах
аттестации
технических
систем
и
устройств
с
измерительными функциями, а также порядок передачи указанных сведений в
Федеральный информационный фонд по обеспечению единства измерений
устанавливается в порядке, предусмотренном частью 3 статьи 20 настоящего
Федерального закона.
7. Юридические лица и индивидуальные предприниматели, применяющие
технические
системы
и
устройства
с
измерительными
функциями,
не
предназначенные для применения в сфере государственного регулирования
обеспечения единства измерений, могут в добровольном порядке представлять их на
аттестацию в соответствии с порядок аттестации технических систем и устройств с
измерительными функциями, предусмотренным частью 2 настоящей статьи.»;
3) в статье 11:
а) дополнить пунктом 8 следующего содержания:
«8) аттестация технических систем и устройств с измерительными
функциями.»;
4) в статье 17:
а) в пункте 2 части 3 слова «стандартных образцов и средств измерений»
заменить словами «стандартных образцов, средств измерений, технических систем и
устройств с измерительными функциями»;
б) в пункте 2 части 4 слова «, не удовлетворяющих» заменить словами «и
технических
систем
и
устройств
с
измерительными
функциями,
не
соответствующих»;
в) пункт 3 части 4 изложить в следующей редакции:
«3) наносить на средства измерений, технические системы и устройства с
измерительными функциями, эталоны единиц величин знак непригодности в
случаях, когда средство измерений, техническая система и устройство с
измерительными
функциями,
эталон
единиц
величин
не
соответствуют
173.
г) в части 5 после слов «средств измерений» дополнить словами «, техническихсистем и устройств с измерительными функциями»;
5) в статье 20:
в части 1 после слов «сведения об эталонах единиц величин, используемых в
сфере государственного регулирования обеспечения единства измерений, и
результатах оценки их соответствия обязательным требованиям» включить
дополнить словами «сведения о результатах аттестации технических систем и
устройств с измерительными функциями,» далее по тексту;
6) в статье 26:
в части 2 после слов «калибровке средств измерений» включить дополнить
словами «, аттестации технических систем и устройств с измерительными
функциями» далее по тексту.
Статья 2
Настоящий Федеральный закон вступает в силу с 1 марта 2027 года.
Президент
Российской Федерации
174.
Затраты субъектов регулирования на соблюдение обязательныхтребований за 6 лет с предполагаемой даты вступления в силу
проекта акта составят более 3 млрд рублей
175. СБОРНИК СТАНДАРТОВ ASTM
176.
Стандартные тесты ASTM для медицинских устройствASTM – один из ведущих разработчиков стандартов
медицинского оборудования. EUROLAB Лаборатория;
Стандарты ASTM для медицинского оборудования
охватывают действительно широкий спектр: 24 категории,
охватывающие все: от хирургических инструментов до
автоматизированного анализа. Поскольку в медицинскую
промышленность уходит много исследований и образования,
стандартизация играет ключевую роль в эффективном
выполнении этих усилий. Ниже для вашего удобства
представлено более 300 стандартов по использованию,
отраслям и темам.
177. Стандарты испытаний ASTM относятся к следующим категориям:
• Медицинские/Хирургические Инструменты• Редакция и терминология
• Авантюрные агенты Безопасность
• Приложения ГУ
• Артропластика
• Клинические испытания на людях
• Оценка для TEMP
• Имплантируемые слуховые аппараты (ИСС)
• Методы испытаний на биосовместимость
• Методы испытаний материалов
• Биоматериалы и биомолекулы для ТЭМП
• Металлургические материалы
• Сердечно-сосудистые стандарты
• Стандарты нейрохирургии
• Сотовый сигнал
• Остеосинтез
• Клетки и структуры тканевой инженерии для
TEMP
• Пластическая и реконструктивная хирургия
• Керамические материалы
• Классификация и терминология для TEMP
• Компьютерные системы ортопедической
хирургии
• Полимерные материалы
• Устройства для позвоночника
• Урологические материалы и устройства
178. Артропластика
F2582-20 Стандартный метод испытания для динамического воздействия между компонентами бедренного иацетабулярного тазобедренного суставов
F1223-20 Стандартный метод испытания для определения общего ограничения замены колена
F2978-20 Руководство по оптимизации скан-последовательностей для клинической диагностической оценки
устройств артропластики тазобедренного сустава металла на металле с использованием магнитно-резонансной
томографии
F3143-20 Стандартный метод испытания для определения коэффициента трения крутящего момента и коэффициента
трения для подшипников замены тазобедренного сустава в стандартных условиях с использованием взаимного
треска
F3446-20 Стандартный метод испытания для определения фрикционного крутящего момента и коэффициента трения
для имплантатов тазобедренного сустава с использованием симулятора анатомического движения
F3334-19 Стандартная практика анализа конечных элементов (FEA) металлических ортопедических полновых
большеберцовых компонентов коленного сустава
F2345-21 Стандартные методы испытаний для определения циклической усталости прочности керамических
модульных головок из колы
F2665-21 Стандартная спецификация для полного протеза замены лодыжки
F2724-21 Стандартный метод испытаний для оценки дислокации коленного сустава мобильного подшипника
F2722-21 Стандартная практика для оценки подвижного подшипника коленчатой оснастающей пластины вращения
179. Артропластика
F2723-21 Стандартный метод испытаний для оценки подвижного подшипника коленчатой базовойпластины/сопротивления при динамической диссоциации
F1781-21 Стандартная спецификация для эластомерных гибких шарнирных шцевых штанов
F1378-18e1 Стандартная спецификация для плечевых протезов
F1800-19e1 Стандартная практика для циклического испытания утомительных лотков металлических большеберцовых
лотков общей замены коленного сустава
F1820-22 Стандартный метод испытаний для определения сил для разборки модульных приусадочных устройств
F3210-22e1 Стандартный метод испытания для испытания утомляемости общих компонентов коленного сустава в
условиях закрытия
F1814-22 Стандартное руководство по оценке компонентов модульного тазобедренного и коленного суставов
F1875-98(2022) Стандартная практика тестирования коррозии модульных имплантатов: Hip Femoral Head-Bore и
конусный интерфейс
F1357-23 Стандартная спецификация для согласования общих наручных имплантатов
F1829-23 Стандартный метод испытания статической оценки анатомического механизма гленоидной блокировки в
сдвига
F2887-23 Стандартная спецификация для всего локтя протезов
F3141-23 Стандартное руководство для профиля полной замены коленного сустава
F3047M-23 Стандартное руководство по высокому требованию симулятора Hip, тестируя жесткие формулировки
180. Артропластика
F2582-20 Стандартный метод испытания для динамического воздействия между компонентами бедренного и ацетабулярного тазобедренного суставовF1223-20 Стандартный метод испытания для определения общего ограничения замены колена
F2978-20 Руководство по оптимизации скан-последовательностей для клинической диагностической оценки устройств артропластики тазобедренного сустава металла
на металле с использованием магнитно-резонансной томографии
F3143-20 Стандартный метод испытания для определения коэффициента трения крутящего момента и коэффициента трения для подшипников замены тазобедренного
сустава в стандартных условиях с использованием взаимного треска
F3446-20 Стандартный метод испытания для определения фрикционного крутящего момента и коэффициента трения для имплантатов тазобедренного сустава с
использованием симулятора анатомического движения
•F3334-19 Стандартная практика анализа конечных элементов (FEA) металлических ортопедических полновых большеберцовых компонентов коленного сустава
•F2345-21 Стандартные методы испытаний для определения циклической усталости прочности керамических модульных головок из колы
•F2665-21 Стандартная спецификация для полного протеза замены лодыжки
•F2724-21 Стандартный метод испытаний для оценки дислокации коленного сустава мобильного подшипника
•F2722-21 Стандартная практика для оценки подвижного подшипника коленчатой оснастающей пластины вращения
•F2723-21 Стандартный метод испытаний для оценки подвижного подшипника коленчатой базовой пластины/сопротивления при динамической диссоциации
•F1781-21 Стандартная спецификация для эластомерных гибких шарнирных шцевых штанов
181. Артропластика
F1378-18e1 Стандартная спецификация для плечевых протезовF1800-19e1 Стандартная практика для циклического испытания утомительных лотков металлических большеберцовых лотков общей замены коленного сустава
F3129-24 Стандартное руководство по характеристикам потери материала от конических узлов в общем соединительном протезировании
F3090-24 Стандартный метод испытаний для испытания утомительных устройств для полной замены тазобедренного сустава и требований к производительности
F2385-15 (2024) Стандартная практика определения проникновения головки бедренной кости в акетабулярные компоненты полной замены тазобедренного сустава с использованием клинических
рентгенограмм
F2580-24 Стандартный метод испытания для оценки модульного соединения проксимально закрепленных грудных протезов бедренных киев
F2943-25 Стандартное руководство по представлению информации о маркировке конечных пользователей для скелетных имплантатов опорно-двигательного аппарата
F2979-20 (2025) Стандартное руководство по характеристикам износа сочлененных поверхностей в извлеченных металлах на металле и других жестких протезах тазобедренного сустава
F3738-25 Стандартный метод испытаний для тестирования сортировки метеорологических метеорологических сортировок на полиэтилене в неблагоприятных условиях с использованием частиц
третьего тела
F2033-25 Стандартная спецификация для поверхностей подшипников тазобедренного сустава
F3018-25 Стандартное руководство по оценке жесткой артикуляции в общей замене тазобедренного сустава и восстановлении шлифовки тазобедренного сустава
F1714-96(2025) Стандартное руководство по оценке гравиметрического износа протезирования тазобедренного сустава в устройствах-симуляторах
F2025-06(2025) Стандартная практика гравитационного измерения полимерных компонентов для оценки износа
F2028-25a Стандартные методы испытаний для динамической оценки ослабления гленоидов
F2009-25 Стандартный метод испытания для определения силы осевой разборки суженных соединений модульных протезов
182. Артропластика
F1820-22 Стандартный метод испытаний для определения сил для разборки модульных приусадочных устройствF3210-22e1 Стандартный метод испытания для испытания утомляемости общих компонентов коленного сустава в условиях закрытия
F1814-22 Стандартное руководство по оценке компонентов модульного тазобедренного и коленного суставов
F1875-98(2022) Стандартная практика тестирования коррозии модульных имплантатов: Hip Femoral Head-Bore и конусный интерфейс
F1357-23 Стандартная спецификация для согласования общих наручных имплантатов
F1829-23 Стандартный метод испытания статической оценки анатомического механизма гленоидной блокировки в сдвига
F2887-23 Стандартная спецификация для всего локтя протезов
F3141-23 Стандартное руководство для профиля полной замены коленного сустава
F3047M-23 Стандартное руководство по высокопо требованию симулятора Hip, тестируя жесткие формулировки
F3495-23 Стандартные методы испытаний для определения статической отсталости нагрузка керамических коленных суставов
F2777-23 Стандартный метод испытания для оценки подшипника колена (требристая вставка) Выносливость и деформация при высокой гибкости
F3140-23 Стандартный метод испытания для циклической испытания усталости металлических большеберцовых лотков однокондиционных коленных суставов
F3161-24 Стандартный метод испытания для анализа конечных элементов (FEA) металлических ортопедических компонентов кишечной полости колена в условиях закрытия
F2996-24 Стандартный метод испытания для анализа конечных элементов (FEA) не модульных металлических ортопедических бедренных стеблей бедра
183. Оценка для ТЕМП
F2529-13 (2021) Стандартное руководство по in vivoоценке остеоиндуктивного потенциала для материалов, содержащих деминерализованные кости (DBM)F3223-17 Стандартное руководство по характеристикам и оценке разработанных для тканей медицинских изделий (ТЕМП) для хирургического ремонта и/или
реконструкции коленного мениска
F3207-17 Стандартное руководство для in vivo оценки кроличьей поясничной интертрансверс-технологии модели спинного синтеза
F3224-17 Стандартный метод испытаний для оценки роста инженерной хрящевой ткани с использованием магнитно-резонансной томографии
F3368-19 Стандартное руководство по анализу клеточной мощи для клеточной терапии и тканевых инженерных продуктов
F2451-05(2010) Стандартное руководство по оценке имплантируемых устройств in vivo, предназначенных для ремонта или регенерации суставного хряща
(снятое с 2019)
F2884-21 Стандартное руководство для доклинической in vivoоценки спинального синтеза
F3225-17 (2022) Стандартное руководство по характеристикам и оценке сосудистых лекарственных средств (TEMP)
F2721-09 (2023) Стандартное руководство по доклинической оценке in vivo в сегментальных дефектах костей критического размера
F3645-25 Стандартное руководство для доклинического тестирования материалов, используемых для регенерации мышц после тучных повреждений мышечной
массы
F3666-25 Стандартное руководство по характеристикам и оценке медицинских изделий, разработанных сердечным клапаном (TEMP)
184. Методы испытаний биосовместимости
•F1408-20a Стандартная практика для подкожного скринингового испытания материалов имплантата•F750-20 Стандартная практика оценки острой системной токсичности экстрактов материалов методом системной инъекции в мыши
•F1903-18 Стандартная практика для тестирования клеточных реакций на частицы in vitro
•F2888-19 Стандартная практика для подсчета лейкоцитов тромбоцитов - In-Vitro мера для оценки гемосовместимости сердечно-сосудистых материалов
•Стандартное руководство F2901-19 по выбору тестов для оценки потенциальной нейротоксичности медицинских изделий
•F749-20 Стандартная практика оценки экстрактов материалов путем внутрикотического введения в кролика
•F813-20 Стандартная практика оценки культуры прямого контакта клеток для медицинских изделий
•F763-22 Стандартная практика для краткосрочного внутримышечного скрининга имплантируемых материалов медицинского оборудования
•F2808-23 Стандартный метод тестирования для выполнения теста за коленом (BTK) для оценки реакции раздражения кожи на продукты и материалы, которые
вступают в повторный или расширенный контакт с кожей
•F1983-23 Стандартная практика оценки воздействия поглощающих биоматериалов на ткани для применения имплантатов
•F1904-23 Стандартное руководство по тестированию биологических реакций на содержание мусора в отделе твердых частиц медицинского оборудования и
продукты деградации in vivo
•F981-23 Стандартная практика оценки реакции мышечной и костной ткани на долгосрочные имплантируемые материалы, используемые в медицинских изделиях
•F2382-24 Стандартный метод испытаний для оценки циркулирующих кроваво-контактных материалов медицинского оборудования на частичное время
тромбопластина (ПТТ)
•F1877-24 Стандартная практика для характеристики частиц
•E1262-24 Стандартное руководство по производительности китайской яичницы хомяка/гипоксантина гуанинфосфорибозилтрансплантация ген мутации
•F1439-24 Стандартное руководство по эффективности пожизненного биоанализа для опыления опыления опухолью имплантата
•Стандартный метод испытаний F720-24 для тестирования морских свинок на контактные аллергены: тест на максимизацию гусеничной свиньи
•F2147-01(2025) Стандартная практика для морской свиньи: сплит-адъювант и закрытое тестирование патчей для контактных аллергенов
•F895-25 Стандартный метод испытаний для скрининга культуры диффузионных клеток Agar на цитотоксичность
•F748-25 Стандартная практика выбора методов биологических испытаний материалов и устройств
•F1984-25 Стандартная практика тестирования на активацию всего комплемента в сыворотке на твердые материалы
•F719-20 (2025) Стандартная практика испытаний материалов у кроликов на первичное раздражение кожи
•F619-20 (2025) Стандартная практика извлечения материалов, используемых в медицинских изделиях
•F756-17(2025) Стандартная практика оценки гемолитических свойств материалов
•F2148-25 Стандартная практика оценки гиперчувствительности замедленного контакта с использованием анализа морского местного лимфатического узла
(LLNA)
185. Биоматериалы и биомолекулы для ТЕМП
F3354-19 Стандартное руководство по оценке процессов децеллюляризации внеклеточных матриц
F2150-19 Стандартное руководство по характеристикам и тестированию каркасов биоматериалов, используемых в регенеративной медицине и тканевых медицинских изделиях
F3274-21 Стандартное руководство по тестированию и характеристикам аллиганатных пенопластовых лесов, используемых в тканевой медицинской продукции (TEMPs)
F3510-21 Стандартное руководство по характеристикам волоконно-оптических конструкций для техногенных медицинских изделий
F3515-21 Стандартное руководство по характеристикам и тестированию свиного фибриногена в качестве исходного материала для использования в биомедицинских и тканевых видах
медицинского оборудования
F2450-18 Стандартное руководство для оценки микроструктуры полимерных каркасов для использования в тканевой инженерной медицинской продукции
F2603-06 (2020) Стандартное руководство для интерпретации изображений микромерных тканевых каркасов
F2131-21 Стандартный метод испытаний для биологической активности In vitro рекомбинантного костного борфогенетического белка 2 (rhBMP-2) с использованием мышиной стромальной
клеточной линии W-20
F2952-22Стандартное руководство для определения среднего коэффициента проницаемости дарси для пористого тканевого каркаса
F2791-24 Стандартное руководство по оценке поверхностной текстуры непорообразных биоматериалов в двух измерениях
F2605-16(2025) Стандартный метод испытаний для определения молярной массы альгината натрия по размеру Хроматография с многоугольным световым рассеянием (SEC-MALS)
F2027-25 Стандартное руководство по характеристикам и испытаниям сырья или стартовых материалов для техногенно-инженерных медицинских изделий
F3142-24 Стандартное руководство по оценке высвобождения биомолекуляров in vitro из каркасов биоматериалов для ТЕМП
F2900-25 Стандартное руководство по характеристикам гидрогелей, используемых в регенеративной медицине
F2259-25 Стандартный метод испытаний для определения химического состава и последовательности в альгинате с помощью протонной ядерной магнитной резонансной (1 H NMR)
спектроскопии
F2212-25 Стандартное руководство по характеристикам коллагена типа I как исходного материала для хирургических имплантатов и субстратов для тканевых инженерных медицинских
изделий (TEMP)
F3089-25 Стандартное руководство по характеристикам и стандартизации полимеризуемых коллагеновых продуктов и связанных с ними коллаген-клеточных взаимодействий
F2064-25 Стандартное руководство по характеристикам и испытаниям альгинатов в качестве исходных материалов, предназначенных для использования в биомедицинских и тканевых
видах медицинского оборудования
F2260-18(2025) Стандартный метод испытаний для определения степени деацетилирования в солях хитозана методом протонного ядерного магнитного резонанса (1 H NMR)
спектроскопия
F2602-18(2025) Стандартный метод испытаний для определения молярной массы солей хитозана и читана по размеру исключительная хроматография с многоугольным световым
рассеянием (SEC-MALS)
F2103-18(2025) Стандартное руководство по характеристикам и испытаниям солей хитозана как стартовых материалов, предназначенных для использования в биомедицинских и тканеинженерных видах медицинского оборудования
F3259-17(2025) Стандартное руководство по микрокомпьютерной томографии из тканестроенных каркасов
186. Сердечно-сосудистые стандарты
•F3067-14 (2021) Стандартное руководство по лучевой загрузке воздушно-экспендируемых и саморасширяющихся сосудистых стентов•F2606-08(2021) Стандартное руководство по трехточечному изгибу воздушно-экспандентируемых ресторационных стентов и стент-систем
•F3172-15 (2021) Стандартное руководство по размеру устройства для проверки дизайна и выбора размера образца для эндоваскулярных устройств
•F2514-21 Стандартное руководство по анализу конечных элементов (FEA) металлических сосудистых стентов, подвергаемых равномерной радиальной
погрузке
•F3505-21 Стандартный метод испытания стент и эндоваскулярного протезирования резистентности
•Стандартное руководство по активной фиксации эндоваскулярных протезов
•F3036-21 Стандартное руководство по тестированию поглощающих стентов
•F2079-09(2022) Стандартный метод испытания для измерения внутренней эластичной отдачи от стентов, распространяются на воздушные шары
•F2081-06 (2022) Стандартное руководство по характеристикам и представлению размерных ресгуречных стентов
•F2394-07(2022) Стандартное руководство по измерению безопасности воздушно-экспонируемого ресгурка, устанавливаемого на системе доставки
•F2914-12 (2024) Стандартное руководство по идентификации атрибутов тестирования на срок годности для эндоваскулярных устройств
•F3575-24 Стандартное руководство по разработке моделей для тестирования конъюнктурных эндоваскулярных устройств на твердых частицах
•F2477-24 Стандартные методы испытаний для испытаний пульсирующей долговечности in vitro на основе сосудистых стентов и эндоваскулярных
протезов
•F3320-18 (2024) Стандартное руководство по характеристике покрытия воздушных шаров, покрытых лекарственным покрытием
•F2743-11 (2024) Стандартное руководство по осмотру покрытий и острой характеристике твердых частиц покрытых лекарственных средств,
содержащих сосудистые стенты
•F1830-19 (2024) Стандартная практика сбора и подготовки крови для динамической in vitroоценки гемолиза в крови
•F1841-25 Стандартная практика оценки гемолиза в насосах крови
•F2942-25 Стандартное руководство по тестированию на прочность сосудистых стентов и сосудистых стентов in vitro, изгиба, торсиальной и сжатой
стойкости сосудистых стентов
•F3211-17(2025) Стандартное руководство по методологии усталости до перелома (FtF) для сердечно-сосудистых медицинских устройств
187. Сигнализация клеток
F3294-18 (2024) Стандартное руководство по выполнениюколичественных измерений интенсивности флуоресценции в
клеточных анализах с помощью широкоугольной
эпифтороцентричной микроскопии
F2998-24 Стандартное руководство по использованию
флуоресцентной микроскопии для количественной оценки
области распространения стационарных клеток
188. Клетки и тканевые инженерные конструкции для ТЕМП
F2739-19 Стандартное руководство по количественной оценке жизнеспособности клеток и связанных с ней атрибутов в каркасахбиоматериалов
F2315-18 Стандартное руководство по иммобилизации или инкапсуляции живых клеток или тканей в альгинатных гелях
F2997-21 Стандартная практика количественной оценки залежей кальция в остеогенной культуре клеток-предшественников с
использованием анализа флуоресцентных изображений
F2664-19e1 Стандартное руководство по оценке прикрепления клеток к биоматериальным поверхностям с помощью физических методов
F3369-19e1 Стандартное руководство по оценке фенотипа скелетного миобласта
F2944-20 Стандартная практика для автоматизированного корпусообразующего блока (CFU) Анализы -Приобретение и анализ изображения
для перечисления и характеристик клеток и колоний в культуре
F3504-21 Стандартная практика количественного распространения клеток в 3D-каркасах с помощью неразрушающего контроля
F3106-22 Стандартное руководство по анализу дифференцировки остеобластов in vitro
F3088-22 Стандартная практика использования метода центрифугирования для количественной оценки/изучения клетно-материальных
адгезивных взаимодействий
F3570-22 Стандартная терминология, связанная с микрофизиологическими системами
F3209-24a Стандартное руководство по аутологичной плазме, гелям для тромбоцитов и гелей из цельной крови для использования в
тканевой инженерии и клеточной терапии
F2149-24 Стандартный метод испытаний для автоматизированного анализа клеток — метод электрической зоны зонирования для
перечисления и калибровки одноклеточных подвесок
F3716-25 Стандартный метод испытаний для совокупного удвоения населения анализа распространения препаратов клеток позвоночных
Стандартное руководство по оценке цитосовместимости медицинских устройств с помощью клеточной терапии
189. Керамические материалы
F1659-95 Стандартный метод испытания для испытания на изгиб и сдвига фосфатныхF2224-09 (2020) Стандартная спецификация для высокоочищенных гемигидрата или дигидрата сульфата кальция для хирургических
имплантатов
F2024-10(2021) Стандартная практика определения рентгеновской дифракции фазового содержания плазмопровизированных
гидроксиапатитовых покрытий
F1088-23 Стандартная спецификация для медицинского бета-тракальциума фосфатного сырья для имплантируемых медицинских изделий
F1185-23 Стандартная спецификация состава поликлиматического гидроксилапатита для хирургических имплантатов
F1609-23 Стандартная спецификация для фосфатных покрытий кальция для имплантируемых материалов
Стандартная спецификация F1538-24 для стеклянных и стеклянных керамических биоматериалов для имплантации
F1581-08(2025) Стандартная спецификация состава анорганической кости для хирургических имплантатов
F603-12(2025) Стандартная спецификация для высокочистого плотного оксида алюминия для медицинского применения
F2393-12(2025) Стандартная спецификация для высокочистых плотных магнитных магнитов частично стабилизированной цирконии (MgPSZ) для хирургических имплантатов
F1926/F1926M-25 Стандартный метод испытания для испытания растворения фосфатных гранул калия, изготовленных форм и покрытий
190. Потребительские Резиновые Продукты
• D3772-15 (2021) Стандартная спецификация для промышленных резиновых пальчиков• D8389-21 Стандартная Спецификация эффективности для мягких катетеров мочи
• D7907-14 (2019) Стандартные методы испытаний для определения эффективности бактерий на
поверхности перчаток для медицинского освидетельствования
• D4679-21 Стандартная спецификация для резиновых общих перчаток, бытовых или косметических
перчаток
• D8419-21 Стандартная спецификация для мешков для анестезии
• D7246-06(2021) Стандартный метод испытаний для обнаружения отверстий в перчатках для
питьеленовых пищевых продуктов
• D6355-07(2022) Стандартный метод испытаний для повторного тестирования патча для патча
медицинских перчаток
• D6124-06 (2022) Стандартный метод испытания остаточного порошка на медицинских перчатках
• D7866-23 Стандартная спецификация для радиационных лютенюирующих защитных перчаток
• D3579-77 (2023) Стандартная спецификация для резиновых хирургических дренажных труб,
Penrose-Type
• D6324-11 (2023) Стандартная спецификация мужских презервативов, изготовленных из
полиуретана
191. Потребительские Резиновые Продукты
• D7160-16 (2023) Стандартная практика определения срока годности для медицинских перчаток• D7161-16 (2023) Стандартная практика определения истечения срока действия зрелых медицинских
перчаток, хранящихся в типичных условиях склада
• D7198-05 (2023) Стандартная спецификация для одноразовых бальзамирующих перчаток для одноразовых
применений
• D6284-17 (2023) Стандартный метод испытаний для резинового свойства - Эффект водных растворов с
доступными хлором и хлорамином
• D3577-19 (2023) Стандартная спецификация для резиновых хирургических перчаток
• D5250-19 (2023) Стандартная спецификация для перчаток поли(винилхлорида) для медицинского
применения
• D3578-19 (2023) Стандартная спецификация для резиновых экзаменационных перчаток
• D5151-19 (2023) Стандартный метод испытаний для обнаружения отверстий в медицинских перчатках
• D6319-19 (2023) Стандартная спецификация для перчаток для обработки нитриловых для медицинского
применения
• D6977-19 (2023) Стандартная спецификация для полихлорночастотных перчаток для медицинского
применения
• D6978-05 (2023) Стандартная практика оценки резистентности медицинских перчаток к проникновению с
192. Потребительские Резиновые Продукты
• D7103-19 (2023) Стандартное руководство по оценке медицинских перчаток• D7661-23 Стандартный метод испытаний для определения совместимости персональных смазочных материалов с
натуральными резиновыми латексными презервативами
• D4316-95 (2023) Стандартная Спецификация для эластомерных бутылок с водой
• D7850-24 Стандартная спецификация для биологических свойств отраслевых эталонных материалов (IRM)
• D6499-24 Стандартный метод испытаний иммунологического измерения антигенного белка в Hevea Natural Rubber
(HNR) и его продуктов
• D8238-24 Стандартный метод испытания иммунологического анализа для количественной очистки экстрагируемых
гуаюле Natural Rubber (GNR)
• D7329-07 (2024) Стандартная спецификация для приготовления пищи и обработки пищевых продуктов (пищевое
обслуживание) Перчатки
• D7558-09 (2024) Стандартный метод испытаний для колориметрической/спектротрофотометрической процедуры для
количественной оценки экстрагируемых химических диалкильдитикарбамат, тиурам и меркаптонзотиазол в
натуральных резиновых латексных и нитриловых перчатках
• D3492-24 Стандартная спецификация для резиновых контрацептивов (мужские презервативы)
• D7102-17(2022)e1 Стандартное руководство по определению эндотоксина на стерильных медицинских перчатках
• D6976-13 (2024) Стандартная спецификация для резиновых контрацептивов — вагинальные диафрагмы
• D5712-15(2025) Стандартный метод испытаний для анализа водного экстрагируемого белка в латексной,
натуральной резине и эластомерных продуктах с использованием модифицированного метода низкого уровня
• F623-25 Стандартная Спецификация производительности для катетера Foley
193. Материалы Методы испытаний
• F3208-20 Стандартное руководство по выбору испытательных почв для проверки методов очистки длямногоразовых медицинских устройств
• Стандартное руководство F3487-20 для оценки срока службы кисти, предназначенной для очистки медицинского
устройства
• F3357-19 Стандартное руководство по проектированию многоразовых медицинских устройств для очистки
• F2381-19 Стандартный метод испытаний для оценки выходности транс-винилена в облученных
сверхвысокомолекулярных полиэтиленовых формах, предназначенных для хирургических имплантатов с
помощью инфракрасной спектроскопии
• F3044-20 Стандартный метод тестирования для оценки потенциала гальванической коррозии для медицинских
имплантатов
• F746-04(2021) Стандартный метод испытания для коррозии питтинга или трещины металлических хирургических
имплантатов
• F2102-17 Стандартное руководство по оценке степени окисления в полиэтилентоловых формах,
предназначенных для хирургических имплантатов
• F2847-17 Стандартная практика отчетности и оценки остатков по одноразовым имплантатам и одноразовым
стерильным инструментам
• F561-19 Стандартная практика поиска и анализа медицинских изделий, связанных с ними тканей и жидкостей
• F3306-19 Стандартный метод испытания для оценки ионного высвобождения медицинских имплантатов
• F897-19 Стандартный метод испытания для измерения коррозии остеосинтезирующих пластин и винтов
194. Материалы Методы испытаний
Стандартное руководство по оценке удаления остатков присадочных производств в медицинских устройствах, изготовленных с
помощью порошкового слияния
F2182-19e2 Стандартный метод испытания для измерения радиочастотного нагрева на пассивных имплантатах или вблизи них во
время магнитно-резонансной томографии
F2754/F2754M-21 Стандартный метод испытания для измерения камбера, слепка, спирали и направления спирали спирального
провода
F2118-14 (2020) Стандартный метод испытаний для постоянной амплитуды управляемой силы испытания акриловых костных
цементных материалов
F2977-20 Стандартный метод испытаний для тестирования полимерных биоматериалов, используемых в хирургических
имплантатах
F1801-20 Стандартная практика испытаний коррозионной усталости металлических имплантатов
F3268-18a Стандартное руководство по испытаниям на деградацию in vitro поглощающих металлов
Стандартное руководство F3275-22 по использованию силового тестера для оценки производительности детали кисти,
предназначенной для очистки внутреннего канала медицинского устройства
F3336-22 Стандартная практика для липидной предварительной кондиционирования сверхвысокомолекулярного полиэтилена
для ускоренного старения
Стандартное руководство F3276-22 по использованию силового тестера для оценки производительности детали кисти,
предназначенной для очистки внешней поверхности медицинского устройства
F2052-21 Стандартный метод испытания для измерения магнитно-индуцированной силы смещения на медицинских устройствах
в магнитно-резонансной среде
F2516-22 Стандартный метод испытаний для испытания натяжения никель-титановых сверхупругих материалов
195. Материалы Методы испытаний
F1978-22 Стандартный метод испытания для измерения истираностойости металлических термальных распылительных
покрытий с помощью Taber Abraser
F3127-22 Стандартное руководство по проверке процессов очистки, используемых во время изготовления медицинских изделий
F2003-02 (2022) Стандартная практика для ускоренного старения полиэтилена сверхвысокого молекулярного веса после гаммаоблучения в воздухе
F640-23 Стандартные методы испытаний для определения радиостаматичности для медицинского применения
F3109-23 Стандартная практика проверки многоосевых платформ измерения сил
F3602-23 Стандартное руководство по оценке совместимости очищающей щетки с различными субстратами, используемыми при
строительстве медицинских изделий
F2214-23 Стандартный метод испытаний для определения на месте сетевых параметров сшитого сверхвысокого молекулярного
веса полиэтилена (UHMWPE)
F2537-23 Стандартная практика калибровки систем датчиков линейного смещение, используемых для измерения микродвижения
F2082/F2082M-23 Стандартный метод испытаний для определения температуры трансформации никель-титановой формы
сплавов памяти путем изгиба и свободного восстановления
F2503-23e1 Стандартная практика маркировки медицинских изделий и других предметов для безопасности в магнитнорезонансной среде
Стандартное руководство F2995-24 для доставки, возможно, инфекционных материалов, тканей и жидкостей
F3438-24 Стандартное руководство по обнаружению и количественной оценке очистных маркеров (аналитов) для проверки
методов очистки для многоразовых медицинских изделий
F2625-24 Стандартный метод испытаний для измерения энтальпии синтеза, процентной кристалличности и температуры
плавления полиэтилена сверхвысокого молекулярного веса с помощью дифференциальной сканирующей калориметрии
196. Материалы Методы испытаний
• F1147-24 Стандартный метод испытаний для испытания натяжения фосфата кальция и металлических покрытий• F2119-24 Стандартный метод испытания для оценки MR-изображений из пассивных имплантатов
• F2004-24 Стандартный метод испытаний температуры трансформации никель-титановых сплавов методом
термального анализа
• F2819-24 Стандартные методы испытаний для измерения прямолинейности штанги, стержня, трубки и провода,
которые будут использоваться для медицинских изделий
• F2458-05(2024) Стандартный метод испытания крепости затмения раны клеев и герметиков
• F2255-24 Стандартный метод испытания прочности на прочность тканевых клеев в Lap-Shear при натяжной
нагрузке
• F2256-24 Стандартный метод испытания прочности тканевых клеев в T-Peel путем натяжной нагрузки
• F2392-24 Стандартный метод испытания на прочность хирургических герметиков
• F2258-24 Стандартный метод испытания на прочность свойств тканевых клеев в натяжении
• F1635-24 Стандартный метод испытаний для испытаний на деградацию в экстракорпоральном состоянии
гидролитически разлагаемых полимерных смол и фабрикованных форм для хирургических имплантатов
• F2459-24 Стандартный метод испытаний для извлечения остатка из медицинских компонентов и количественной
оценки с помощью гравиметрического анализа
• F3718-24 Стандартная практика поддержания окислительной способности тестовых растворов для
деградационного скрининга неабсорбируемых полимеров
197. Материалы Методы испытаний
• F1089-24 Стандартный метод испытания для коррозии хирургических инструментов• F2129-25 Стандартный метод испытаний для проведения циклических потенциодинамических поляризационных
измерений для определения восприимчивости к коррозии устройств малых имплантатов
• F732-17(2025) Стандартный метод испытаний для износа полимерных материалов, используемых в общих
соединительных протезах
• Стандартное руководство по применению испытательных почв для проверки методов очистки для многоразовых
медицинских устройств
• F3321-25 Стандартное руководство по методам извлечения испытательных почв для проверки методов очистки
многоразовых медицинских изделий
• F1854-25 Стандартный метод испытаний для стереологической оценки пористых покрытий на медицинских
имплантатах с использованием цифровых изображений
• F2778-09(2025) Стандартный метод испытаний для измерения процентной кристалличности
полиэтерэзерэкетоновых (PEEK) полимеров средствами с помощью спектропрофилактики Фурье преобразовать
инфракрасную спектроскопию (R-FTIR)
• F3260-25 Стандартный метод испытаний для определения гибкости медицинского текстиля
• F1160-25 Стандартный метод испытаний для сдвига и изгиба тестирования усталости фосфата кальция и
металлических медицинских и композитных фосфатов/металлических покрытий кальция
• F1044-25 Стандартный метод испытания для сдвига фосфатных покрытий кальция и металлических покрытий
• F2213-25 Стандартный метод испытания для измерения магнитно-индуцированного крутящего момента на
медицинских изделиях в магнитно-резонансной среде
198. IMDRF
Код IMDRFТехнический документ
IMDRF/Standards
WG/N72
Рамочная программа IMDRF по взаимодействию со стандартами
IMDRF/Standards
WG/N72
Медицинские устройства с поддержкой машинного обучения:
ключевые термины и определения
IMDRF/AIMD WG/N67
Medical Devices: Post-Market Surveillance: National
Медицинские изделия: пострыночный надзор: критерии
обмена отчетами национальных компетентных органов и форма Competent Authority Report Exchange Criteria and Report
Form
отчета
IMDRF/NCAR WG/N14
требованиями регулирующего органа для признания органов по Requirements for Regulatory Authority Recognition of
Conformity Assessment Bodies Conducting Medical Device
оценке соответствия проводят медицинские устройства
Regulatory Reviews
нормативно-комментарии
IMDRF/GRRP WG/N59
оценке и принятию решений о признании оценки соответствия Assessment and Decision Process for the Recognition of a
органа, осуществляющего медицинские устройства нормативно- Conformity Assessment Body Conducting Medical Device
Regulatory Reviews
комментарии
IMDRF/GRRP WG/N66
компетенции и требования к обучению регулирующий орган
эксперты органов по оценке соответствия проводят
медицинские устройства нормативно-комментарии
Competence and Training Requirements for Regulatory
Authority Assessors of Conformity Assessment Bodies
Conducting Medical Device Regulatory Reviews
IMDRF/GRRP WG/N63
органа регулирования метод оценки распознавания и
наблюдения органов по оценке соответствия проводят
медицинские устройства нормативно-комментарии
Regulatory Authority Assessment Method for Recognition
and Surveillance of Conformity Assessment Bodies
Conducting Medical Device Regulatory Reviews
IMDRF/GRRP WG/N61
Terminologies for Categorized Adverse Event Reporting
терминов по категории отчетности о неблагоприятных событиях
(AER): terms, terminology and codes
(аэр): условия, терминологии и кодов,
IMDRF/AE WG/N43
принципы и практика медицинской службы кибербезопасности Principles and Practices for Medical Device Cybersecurity
IMDRF Standards Liaison Program Framework
Machine Learning-enabled Medical Devices: Key Terms
and Definitions
199. IMDRF
Terminologies for Categorized Adverse Event Reporting(AER): terms, terminology and codes
IMDRF/AE WG/N43
терминов по категории отчетности о неблагоприятных событиях
(аэр): условия, терминологии и кодов,
IMDRF/CYBER WG/N60
принципы и практика медицинской службы кибербезопасности
Principles and Practices for Medical Device Cybersecurity
IMDRF/PMD WG/N49
определения индивидуальной медицинской техники
Definitions for Personalized Medical Devices
IMDRF/PMD WG/N58
персонализированные медицинские изделия - регулирования
Personalized Medical Devices - Regulatory Pathways
IMDRF MDCE WG/N57
клиническое исследование
Clinical Investigation
IMDRF MDCE WG/N56
клинической оценки
Clinical Evaluation
IMDRF/MDCE WG/N65
пост-Маркет клинических катамнестических исследованиях
Post-Market Clinical Follow-Up Studies
IMDRF MDCE WG/N55
клинические данные - ключевые определения и понятия,
Clinical Evidence - Key Definitions and Concepts
IMDRF/GRRP WG/N52
принципы маркировки на изделия медицинского назначения и
медицинской техники ИВД
Principles of Labelling for Medical Devices and IVD Medical
Devices
IMDRF/RPS WG/N9
не в пробирке диагностические устройства рынка авторизации
Оглавление (nIVD Ма Оглавление)
Non-In Vitro Diagnostic Device Market Authorization Table
of Contents (nIVD MA ToC)
IMDRF/RPS WG/N13
диагностики в лабораторных условиях рынка медицинских
устройств авторизации Оглавление (ИВД Ма Оглавление)
In Vitro Diagnostic Medical Device Market Authorization
Table of Contents (IVD MA ToC)
IMDRF/IVD WG/N64
Принципы ин витро диагностики (ИВД) Медицинские приборы
классификация
Principles of In Vitro Diagnostic (IVD) Medical Devices
Classification
200. IMDRF
IMDRF/RPS WG/N27сборку и техническое руководство для IMDRF содержание
материалов
Assembly and Technical Guide for IMDRF Table of Contents
Submissions
IMDRF/Standards WG/N5
оптимизация стандартов для регулирования использования
Optimizing Standards for Regulatory Use
IMDRF/GRRP WG/N47
важнейшие принципы безопасности и эффективности
медицинских изделий и медицинских приборов ИВД
Essential Principles of Safety and Performance of Medical
Devices and IVD Medical Devices
IMDRF/GRRP WG/N40
компетенции, обучение, и проведения регуляторных требований
по рецензенты
Competence, Training, and Conduct Requirements for
Regulatory Reviewers
IMDRF/Registry WG/N46
инструменты для оценки удобства использования реестров в
поддержку регуляторных решений
Tools for Assessing the Usability of Registries in Support of
Regulatory Decision-Making
IMDRF/Registry WG/N42
методологические принципы использования международных
медицинских устройств реестр сведения
Methodological Principles in the Use of International Medical
Device Registry Data
IMDRF/Registry WG/N33
принципы международной системы реестров связаны с другими
данными источниками и инструментами,
Principles of International System of Registries Linked to
Other Data Sources and Tools
IMDRF/RPS WG/N19
Общие сведения элементы медицинского устройства
идентификации
Common Data Elements for Medical Device Identification
IMDRF/MDSAP WG/N3
требования для медицинского изделия аудиторских организаций Requirements for Medical Device Auditing Organizations for
для регулирования признания
Regulatory Authority Recognition
IMDRF/MDSAP WG/N24
медицинского устройства регулирования аудита отчетов
Medical Device Regulatory Audit Reports
201. IMDRF
IMDRF/MDSAP WG/N11MDSAP оценке и принятию решений о признании аудиторской
организации
MDSAP Assessment and Decision Process for the Recognition
of an Auditing Organization
IMDRF/MDSAP WG/N4
компетенции и требования к обучению аудита организации
Competence and Training Requirements for Auditing
Organizations
IMDRF/MDSAP WG/N6
регулирующего органа экспертом компетенции и требования к
обучению
Regulatory Authority Assessor Competence and Training
Requirements
IMDRF/MDSAP WG/N8
руководство по регулированию заседателей о методе оценки для Guidance for Regulatory Authority Assessors on the Method
MDSAP аудита организации
of Assessment for MDSAP Auditing Organizations
IMDRF/SaMD WG/N23
программного обеспечения в качестве медицинского устройства
(ДУМД): Применение системы менеджмента качества
Software as a Medical Device (SaMD): Application of Quality
Management System
IMDRF/SaMD WG/N10
программного обеспечения в качестве медицинского устройства
(ДУМД): ключевые определения
Software as a Medical Device (SaMD): Key Definitions
IMDRF/SaMD WG/N41
программного обеспечения в качестве медицинского устройства
(ДУМД): Клиническая оценка
Software as a Medical Device (SaMD): Clinical Evaluation
IMDRF/SaMD WG/N12
программного обеспечения как медицинского изделия:
возможные рамки риска, классификация и соответствующие
соображения
Software as a Medical Device: Possible Framework for Risk
Categorization and Corresponding Considerations
IMDRF/UDI WG/N7
Уди указания: уникальная идентификация устройства (ИУ)
изделиями медицинской техники
UDI Guidance: Unique Device Identification (UDI) of Medical
Devices
202. IMDRF
IMDRF/MDSAP WG/N11MDSAP оценке и принятию решений о признании аудиторской
организации
MDSAP Assessment and Decision Process for the
Recognition of an Auditing Organization
IMDRF/MDSAP WG/N4
компетенции и требования к обучению аудита организации
Competence and Training Requirements for Auditing
Organizations
IMDRF/MDSAP WG/N6
регулирующего органа экспертом компетенции и требования к
обучению
Regulatory Authority Assessor Competence and Training
Requirements
IMDRF/MDSAP WG/N8
руководство по регулированию заседателей о методе оценки для Guidance for Regulatory Authority Assessors on the Method
MDSAP аудита организации
of Assessment for MDSAP Auditing Organizations
IMDRF/SaMD WG/N23
программного обеспечения в качестве медицинского устройства Software as a Medical Device (SaMD): Application of Quality
(ДУМД): Применение системы менеджмента качества
Management System
IMDRF/SaMD WG/N10
программного обеспечения в качестве медицинского устройства
Software as a Medical Device (SaMD): Key Definitions
(ДУМД): ключевые определения
IMDRF/SaMD WG/N41
программного обеспечения в качестве медицинского устройства
Software as a Medical Device (SaMD): Clinical Evaluation
(ДУМД): Клиническая оценка
IMDRF/SaMD WG/N12
программного обеспечения как медицинского изделия:
возможные рамки риска, классификация и соответствующие
соображения
Software as a Medical Device: Possible Framework for Risk
Categorization and Corresponding Considerations
IMDRF/UDI WG/N7
Уди указания: уникальная идентификация устройства (ИУ)
изделиями медицинской техники
UDI Guidance: Unique Device Identification (UDI) of Medical
Devices
IMDRF/UDI WG/N48
уникального устройства системы идентификации (Уди система)
руководство по применению
Unique Device Identification system (UDI system)
Application Guide
IMDRF/GRRP WG/N71
Отчет о проверке нормативных требований к медицинскому
оборудованию: рекомендации относительно информации,
которая должна быть включена
Medical Device Regulatory Review Report: Guidance
Regarding Information to be Included
203. ГОСТ и ГОСТ Р, утвержденные в 2025 г.
ОбозначениеНаименование
ГОСТ Р 578922025
Корсеты ортопедические и головодержатели жесткой фиксации и полужесткой
фиксации. Общие технические условия
ГОСТ Р 582352025
Специальные средства при нарушении функции выделения. Термины и
определения. Классификация
ГОСТ Р 582372025
Средства ухода за кишечными стомами: калоприемники, вспомогательные средства
и средства ухода за кожей вокруг стомы. Характеристики и основные т ребования.
Методы испытаний
ГОСТ Р 582682025
Ортезы. Термины и определения. Классификация
ГОСТ Р 594492025
Средства ухода за уростомами, средства для отведения и сбора мочи.
Характеристики и основные требования
ГОСТ Р 598822025
Аппараты ортопедические на тазобедренные суставы. Общие технические
требования. Классификация
ГОСТ Р
59988.08.3-2025
Системы автоматизированного проектирования электроники. Информационное
обеспечение. Технические характеристики электронных компонентов. Приборы
фоточувствительные. Классификация
ГОСТ Р 60.0.7.62025
Роботы и робототехнические устройства. Общая информационная модель.
Описание общей информационной модели
204.
ГОСТ Р72304.2.1-2025
Технические данные для автоматизированного проектирования. Часть 2.1.
Устройства комплектные низковольтные распределения и управления.
Классификатор свойств
ГОСТ Р 724212025
Протезирование и ортезирование. Функциональные дефекты. Описание пациента,
проходящего курс реабилитации с применением протезов верхних конечностей,
функциональные клинические цели реабилитации и функциональные требования к
протезам верхних конечностей
ПНСТ 1036-2025
Проведение оценки реабилитационной эффективности протезирования верхних
конечностей клиническим методом. Общие требования
ГОСТ Р 60.0.0.222025
Роботы и робототехнические устройства. Общая информационная модель.
Термины и определения
ГОСТ Р 60.0.0.232025
Роботы и робототехнические устройства. Общая информационная модель. Общие
положения
ГОСТ Р 592312025
Аппараты ортопедические на нижние конечности с микропроцессорным
управлением. Общие технические требования. Классификация
ГОСТ Р 724072025
Протезы и ортезы. Факторы, учитываемые при определении характеристик ортезов
для пользователя с нарушением двигательных функций нижних конечностей
205.
ГОСТ Р 724082025Уровни активности для обозначения реабилитационного потенциала людей с
ампутацией нижних конечностей. Общие положения
ГОСТ Р 582672025
Протезы верхних конечностей. Термины и определения. Классификация
ГОСТ Р 584472025
Протезы нижних конечностей с микропроцессорным управлением. Общие
технические требования
ГОСТ Р 723882025
Управление идеями в организации. Системы управления идеями. Основные
положения
ГОСТ Р ИСО
16840-11-2025
Сиденья кресел-колясок. Часть 11. Определение характеристик рассеивания
ощущаемого пота в подушках сидений
ГОСТ Р ИСО
16840-3-2025
Сиденья кресел-колясок. Часть 3. Определение статической, ударной и
усталостной прочности для устройств поддержания позы
ГОСТ Р 723682025
Контроль неразрушающий. Разработка и аттестация методик неразрушающего
контроля. Общие требования
ГОСТ Р 723712025
Методы лабораторной диагностики вирусной диареи крупного рогатого скота
206.
ГОСТ Р ИСО10535-2025
Вспомогательные средства. Подъемники для инвалидов. Требования и методы
испытаний
ГОСТ Р ИСО
16840-2-2025
Сиденья кресел-колясок. Часть 2. Определение физико-механических
характеристик подушек сидений, предназначенных для сохранения целостности
тканей
ГОСТ Р 723132025
Системы поддержки принятия врачебных решений с применением искусственного
интеллекта для извлечения данных из неструктурированных медицинских записей.
Методы формирования набора данных для обучения и тестирования. Метрики
оценки качества
ГОСТ Р 723562025
Системы прогнозной аналитики на основе искусственного интеллекта в клинической
медицине для анализа электронных медицинских карт. Методы испытаний. Общие
требования
ГОСТ Р 723572025
Системы поддержки принятия врачебных решений с применением искусственного
интеллекта для анализа данных в лекарственной терапии. Методы формирования
набора данных для обучения и тестирования. Метрики оценки качества
ПНСТ 1032-2025
Воздух рабочей зоны. Часть 2. Газоанализаторы. Выбор, установка, использование
и обслуживание газоанализаторов токсичных газов и паров
ПНСТ 1034-2025
Руководящие указания по организации внутреннего аудита
207.
ГОСТ Р ИСО20399-2025
Биотехнология. Средства лекарственные биологические для медицинского
применения. Вспомогательные материалы, используемые при производстве
клеточных препаратов
ГОСТ Р 723222025
Композиты полимерные. Определение температуры стеклования аморфных и
полукристаллических полимеров методом динамического механического анализа
ГОСТ Р 723462025
Биотехнология. Общие требования и принципы аутентификации клеточной линии
млекопитающих
ГОСТ Р 723472025
Воздух рабочей зоны. Определение твердых частиц кадмия и его соединений.
Метод атомно-абсорбционного анализа с пламенной и электротермической
атомизацией
ГОСТ Р 723492025
Композиты полимерные. Метод испытания на сжатие при нормальной, повышенной
и пониженной температурах
ГОСТ Р 723502025
Композиты полимерные. Метод испытания на сопротивление повреждению при
ударе падающим грузом
ГОСТ Р ИСО
18209-1-2025
Биотехнология. Биобанкинг паразитов. Часть 1. Гельминты
ГОСТ Р ИСО
20397-1-2025
Биотехнология. Массовое параллельное секвенирование. Часть 1. Подготовка
нуклеиновой кислоты и библиотеки
208.
ГОСТ Р ИСО24421-2025
Биотехнология. Минимальные требования к измерению оптических сигналов
фотометрическими методами для биологических проб
ПНСТ 1031-2025
Воздух рабочей зоны. Часть 1. Газоанализаторы. Требования к эксплуатационным
характеристикам газоанализаторов токсичных газов и паров
ГОСТ Р ИСО
20688-2-2025
Биотехнология. Синтез нуклеиновых кислот. Часть 2. Требования к производству и
контролю качества синтезированных фрагментов генов, генов и геномов
ГОСТ Р ИСО
21438-1-2025
Воздух рабочей зоны. Определение неорганических кислот методом ионной
хроматографии. Часть 1. Нелетучие кислоты (серная и фосфорная)
ПНСТ 1029-2025
Приборы осветительные, источники света электрические. Порядок расчета
атрибутов цветового восприятия с использованием модели CIECAM16
ГОСТ Р ИСО
10009-2025
Менеджмент качества. Руководство по инструментам качества и их применению
ПНСТ 1024-2025
Реабилитационные социальные услуги несовершеннолетним, имеющим опыт
употребления психоактивных веществ. Общие требования
ГОСТ Р 530632025
Социальное обслуживание граждан. Рекомендации по контролю качества
социальных услуг семьям
209.
ГОСТ Р 723082025Безопасность оборудования. Руководство по функциональной безопасности
системы управления, связанной с безопасностью
ГОСТ Р ИСО
18192-3-2025
Имплантаты для хирургии. Износ полных протезов межпозвонковых дисков. Часть
3. Испытание на износ при ударе и соответствующие условия окружающей среды
для испытания поясничных протезов в неблагоприятных кинематических условиях
ГОСТ Р ИСО
5832-11-2025
Имплантаты для хирургии. Металлические материалы. Часть 11. Деформируемый
сплав титан – 6 алюминия – 7 ниобия
ГОСТ Р ИСО
17327-1-2025
Имплантаты хирургические неактивные. Покрытие для имплантатов. Часть 1.
Общие требования
ГОСТ Р ИСО
5832-3-2025
Имплантаты для хирургии. Металлические материалы. Часть 3. Деформируемый
сплав титан – 6 алюминия – 4 ванадия
ПНСТ 1022-2025
Информационные технологии. Биометрия. Применение биометрических технологий
для граждан пожилого возраста
ГОСТ Р 58624.42025
Информационные технологии. Биометрия. Обнаружение атаки на биометрическое
предъявление. Часть 4. Профиль для испытаний на мобильных устройствах
ГОСТ Р 723032025
Информационные технологии. Биометрия. Биометрическое сравнение на
идентификационной карте. Механизм распределения
210.
ПНСТ 1019-2025Информационные технологии. Биометрия. Методология оценки эксплуатационных
характеристик биометрических систем с использованием статистических моделей
ГОСТ Р 723022025
Стерилизация медицинской продукции. Радиационная стерилизация. Часть 4.
Руководство по контролю процесса стерилизации медицинских изделий
ГОСТ Р 574482025
Платформы подъемные для инвалидов и других маломобильных групп населения.
Ввод в эксплуатацию. Общие требования
ГОСТ Р ИСО
11137-3-2025
Стерилизация медицинской продукции. Радиационная стерилизация. Часть 3.
Руководство по использованию дозиметрии при разработке, валидации и текущем
контроле процесса стерилизации медицинских изделий
ГОСТ Р 722482025
Менеджмент риска. Руководство по менеджменту новых рисков для повышения
адаптивности
ГОСТ Р 722542025
Менеджмент риска. Руководящие указания по применению ГОСТ Р ИСО 31000-2019
в системах менеджмента
ГОСТ Р ИСО
28000-2025
Безопасность и устойчивость. Системы менеджмента безопасности. Требования
ГОСТ Р ИСО
31022-2025
Менеджмент риска. Руководство по менеджменту правовых рисков
211.
ГОСТ Р ИСО13004-2025
Стерилизация медицинских изделий. Радиационная стерилизация. Обоснование
стерилизующей дозы: метод VDmaxSD
ГОСТ Р 722132025
Медицинские изделия. Непрерывный мониторинг концентрации глюкозы в
интерстициальной жидкости
ГОСТ Р 719512025
Оптика и фотоника. Стекло оптическое бесцветное. Общие технические условия
ГОСТ Р 719522025
Оптика и фотоника. Материалы оптические. Основные параметры и классификация
ГОСТ Р 720152025
Оптика и фотоника. Стекло оптическое бесцветное. Физико-химические
характеристики
ГОСТ Р 720662025
Оптика и фотоника. Фильтры оптические объемного поглощения. Классификация.
Основные положения
ГОСТ Р МЭК
60846-1-2025
Приборы радиационной защиты. Измерители и/или измерители-сигнализаторы
амбиентного и/или направленного эквивалента дозы (мощности) бета-,
рентгеновского и гамма-излучений. Часть 1. Требования к переносным
измерителям и измерителям-сигнализаторам для мониторинга рабочих мест и
окружающей среды
212.
ГОСТ Р МЭК60846-2-2025
Приборы радиационной защиты. Измерители и/или измерители-сигнализаторы
амбиентного и/или направленного эквивалента дозы (мощности) бета-,
рентгеновского и гамма-излучений. Часть 2. Портативные приборы для измерений
высоких доз и мощностей доз фотонного и бета-излучения для условий аварийных
ситуаций
ГОСТ Р 721642025
Реабилитация инвалидов. Устройства мобильные погружные для инвалидов.
Технические условия
ГОСТ Р 721222025
Адаптивный спорт. Спортивное оборудование и инвентарь для игровых дисциплин
спорта лиц с поражением опорно-двигательного аппарата. Основные положения
ГОСТ Р 721232025
Адаптивный спорт. Игровые дисциплины спорта глухих. Спортивное оборудование
и инвентарь. Основные положения
ГОСТ Р 721242025
Адаптивный спорт. Игровые дисциплины спорта лиц с интеллектуальными
нарушениями. Спортивное оборудование и инвентарь. Основные положения
ГОСТ Р 721252025
Адаптивный спорт. Неигровые дисциплины спорта лиц с поражением опорнодвигательного аппарата. Спортивное оборудование и инвентарь для оснащения
спортивных залов. Основные положения
ГОСТ Р 721262025
Адаптивный спорт. Оборудование для фехтования на колясках. Общие технические
требования
213.
ГОСТ Р 721602025Менеджмент риска. Управление рисками проектов
ГОСТ Р 721202025
Статистические методы. Воспроизводимость уровня обнаружения (LOD) бинарных
методов в совместных и внутрилабораторных валидационных исследованиях
ГОСТ Р ИСО
10576-2025
Статистические методы. Руководство по оценке соответствия установленным
требованиям
ПНСТ 1007-2025
Критическая информационная инфраструктура. Программно-аппаратные
комплексы. Классификация по назначению
ГОСТ Р 721172025
Безопасность машин. Поддерживающая система обеспечения безопасности
ГОСТ Р ИСО
13408-2-2025
Асептическое производство медицинской продукции. Часть 2. Стерилизующая
фильтрация
ГОСТ Р 721062025
Вакуумная технология. Размеры быстроразъемных соединений зажимного типа
ГОСТ Р 70262.22025
Защита информации. Идентификация и аутентификация. Уровни доверия
аутентификации
214.
ГОСТ Р 44.0012025Система технологической подготовки производства. Основные положения
ГОСТ Р 44.0022025
Система технологической подготовки производства. Термины и определения
ГОСТ Р 44.1012025
Система технологической подготовки производства. Технологические регламенты.
Основные положения
ГОСТ Р 44.3012025
Система технологической подготовки производства. Технологические процессы.
Порядок разработки
ГОСТ Р 44.6012025
Система технологической подготовки производства. Порядок выполнения опытно технологических работ. Основные положения
ГОСТ Р 720932025
Клинические лабораторные исследования. Требования к применению метода
тандемной масс-спектрометрии для выявления наследственных болезней обмена
веществ
ГОСТ Р 560332025
Руководство по разработке и включению аспектов безопасности в международные
стандарты для медицинских изделий
ГОСТ Р 720672025
Медицинские лаборатории. Частные требования к качеству и компетентности при
изготовлении медицинских изделий для диагностики in vitro и их использовании в
медицинских лабораториях
215.
ГОСТ Р 720712025Изделия медицинские. Основные принципы обеспечения безопасности и
функциональных характеристик медицинских изделий и медицинских изделий для
диагностики in vitro
ГОСТ Р 720752025
Источники ионизирующего излучения радионуклидные закрытые.
Радиометрический контроль радиоактивного загрязнения поверхности методом
мазка
ГОСТ Р ИСО
13408-7-2025
Асептическое производство медицинской продукции. Часть 7. Альтернативные
процессы при производстве медицинских изделий и комбинированной медицинской
продукции
ГОСТ Р ИСО
13926-3-2025
Шприц-ручки для медицинского применения. Часть 3. Защитные колпачки для
шприц-ручек
ГОСТ Р МЭК
60601-1-6-2025
Изделия медицинские электрические. Часть 1-6. Общие требования безопасности с
учетом основных функциональных характеристик. Дополнительный стандарт.
Эксплуатационная пригодность
ГОСТ Р ИСО
20658-2025
Исследования медицинские лабораторные. Требования к взятию и
транспортированию образцов
ГОСТ Р 8.10432025
Государственная система обеспечения единства измерений.
Жидкосцинтилляционные радиометры. Методика поверки
216.
ГОСТ Р 720262025Клинические лабораторные исследования. Метод полимеразной цепной реакции в
реальном времени для выявления первичных иммунодефицитных состояний и
спинальной мышечной атрофии в образцах сухих пятен крови
ГОСТ Р ИСО
22442-1-2025
Изделия медицинские, использующие ткани и их производные животного
происхождения. Часть 1. Применение менеджмента риска
ГОСТ Р ИСО
22442-2-2025
Изделия медицинские, использующие ткани и их производные животного
происхождения. Часть 2. Контроль отбора, сбора и обработки
ГОСТ Р 523542025
Изделия из бумаги бытового и санитарно-гигиенического назначения. Общие
технические условия
ГОСТ Р 712292025
Устройства ввода-вывода человеко-машинного интерфейса. Типы, основные
параметры, общие технические требования
ГОСТ Р 720022025
Фильтры очистки воздуха общего назначения. Испытания установленных фильтров
и фильтрующих систем в условиях применения для определения эффективности
улавливания частиц заданного размера и перепада давления
ГОСТ Р 575582025
Аддитивные технологии. Базовые принципы. Термины и определения
ГОСТ Р 546592025
Оценка соответствия. Правила проведения добровольной сертификации услуг
(работ)
217.
ГОСТ Р 560412025Оценка соответствия. Требования к экспертам по сертификации продукции, услуг,
процессов
ГОСТ Р 1.20-2025
Стандартизация в Российской Федерации. Классификаторы общероссийские.
Основные положения и порядок проведения работ по разработке, ведению,
изменению и применению
ГОСТ Р 719432025
Напитки спиртные на основе рома. Общие технические условия
ГОСТ Р ИСО
14644-4-2025
Чистые помещения и связанные с ними контролируемые среды. Часть 4.
Проектирование, строительство и ввод в эксплуатацию