Похожие презентации:
24791016656642f08e38b1b366ad596c
1.
Неметаллы – химические элементы,простые вещества. Химические
свойства , получение.
Айрапетян Л.Р.
2020 г
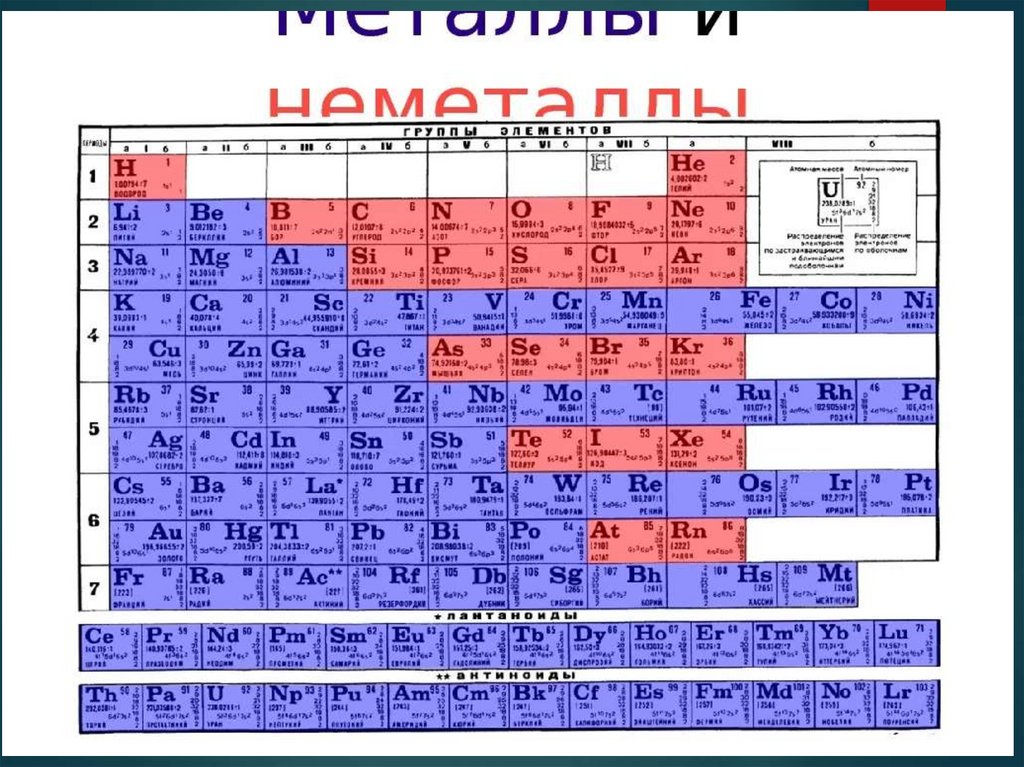
2. Неметаллы. Общая характеристика
К неметаллам относят 22 элемента.Положение неметаллических элементов в периодической
системе химических элементов
Если в Периодической системе Д.И. Менделеева провести
условную диагональ от водорода через бор до астата
и элемента № 118, таблица неметаллов займет правый
верхний угол.
Каждый горизонтальный период таблицы заканчивается
элементом с завершенным внешним энергетическим
уровнем. Эта группа элементов носит название
благородные газы.
Вещества, образующие диагональ бор-кремнийгерманий-мышьяк-теллур, являются уникальными,
и в зависимости от реакции и реагента могут проявлять как
металлические, так и неметаллические свойства.
Их называют металлоиды.
3. Неметаллы. Общая характеристика
4. Неметаллы. Общая характеристика
Физические свойства неметаллов. АллотропияВ отличие от металлов неметаллы могут иметь молекулярное
и немолекулярное строение. Благодаря различиям
в строении, простые вещества неметаллы существуют в трех
агрегатных состояниях:
Молекулярные:
Летучие, газообразные, бесцветные кислород, водород.
Газообразные, окрашенные хлор, азот, фтор.
Единственный жидкий представитель — темно-красный
бром.
Твердые, но хрупкие вещества с невысокой температурой
плавления — кристаллы йода, серы, белого фосфора.
Немолекулярные:
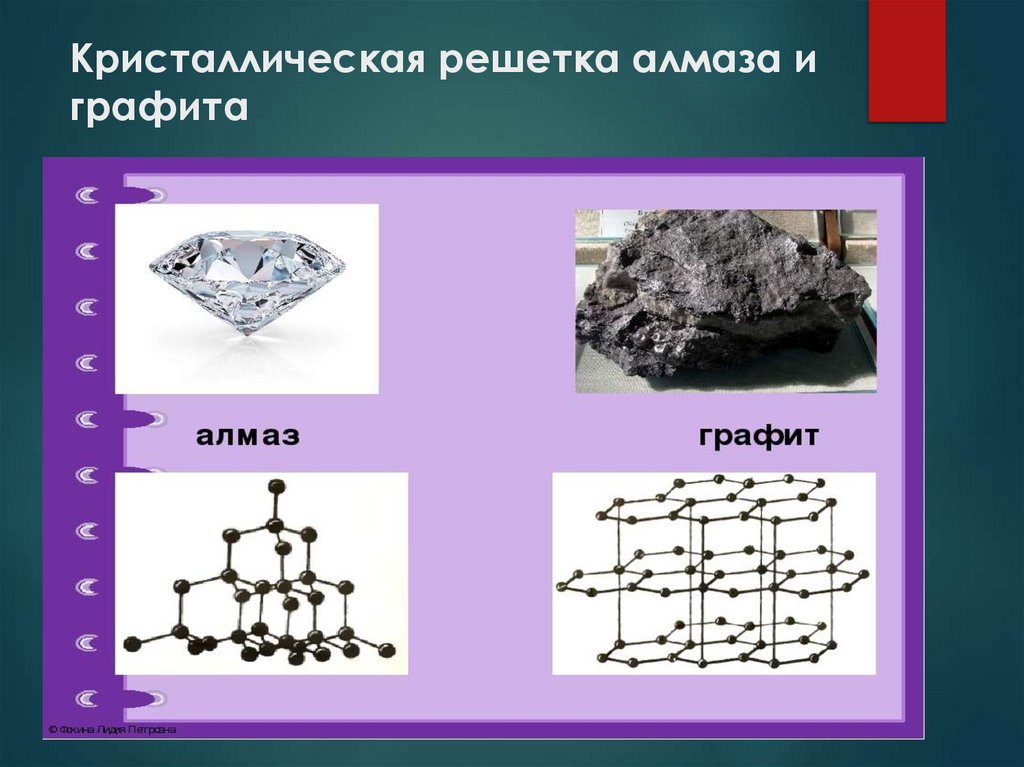
Твердые вещества с высокой температурой плавления —
кремний, графит, алмаз и красный фосфор.
5. Неметаллы. Общая характеристика
Физические свойства неметаллов. АллотропияБольшинство из неметаллических веществ плохо проводят
электричество и тепло. Исключением является графит —
разновидность углерода.
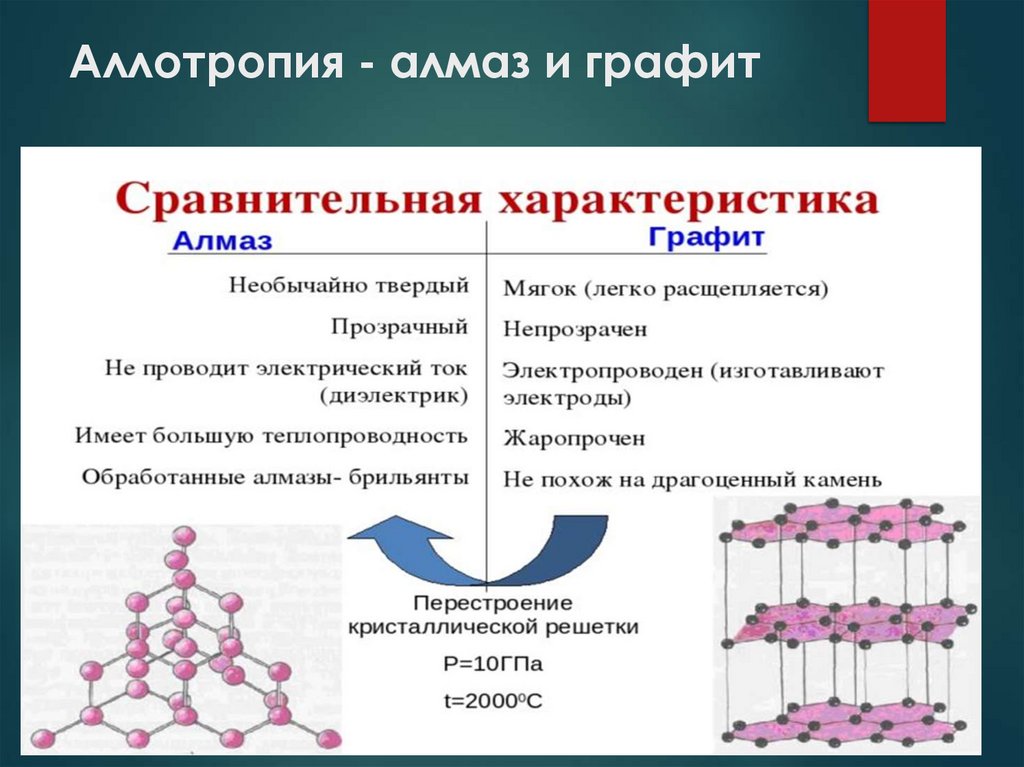
Аллотропия — уникальная способность неметаллов
образовывать несколько простых веществ. В естественной
среде существуют аллотропные модификации элементов,
которые отличаются физическими и химическими
свойствами. К ним относятся озон и кислород, графит и
алмаз.
6. Неметаллы. Общая характеристика
7. Кристаллическая решетка алмаза и графита
8. Аллотропия - алмаз и графит
9. Аллотропия - олово белое и серое
10. Аллотропия – кислород и озон
11. Химические свойства неметаллов
В ряду F, O, N, CL, Br, I, S, C, Se, P, As, Si, Hокислительные свойства уменьшаются.
Восстановительные свойства кислород может
проявлять только в отношении фтора.
Неметаллы как окислители
Окислительные свойства неметаллов проявляются
при их взаимодействии:
с металлами: 2Hg + S = HgS (реакция используется
для сбора ртути – процесс демеркуризации)
с водородом: H2 + Cl2 = 2HCl
12. Химические свойства неметаллов
Неметаллы как восстановители1. Все неметаллы (кроме фтора) проявляют
восстановительные свойства при взаимодействии с
кислородом:
S + O2 = SO2,
2H2 + O2 = 2H2О.
2. Многие неметаллы проявляют восстановительные
свойства при взаимодействии со сложными
веществами:
ZnO + C = Zn + CO
3S + 2KClO3 = 2KCl + 3SO2 (реакция серы и фосфора с
бертолетовой солью лежит в основе зажигания спички)
13. Химические свойства неметаллов
Неметаллы как восстановители3. Существуют и такие реакции, в которых один и тот же
неметалл является одновременно и окислителем и
восстановителем:
Cl2 + H2О = HCl + HClO.
4. Фтор ― самый типичный неметалл, которому
нехарактерны восстановительные свойства, т.е.
способность отдавать электроны в химических реакциях.
Ряд активности галогенов
F2 >Cl2 >Br2 >I2
Например,
Cl2 + 2KBr = 2KCl + Br2
Br2 + 2KI = 2KBr + I2
14. Химические свойства неметаллов
В двухатомных молекулах галогенов атомы связаныковалентной неполярной связью Г· ·Г или Г―Г и имеют
молекулярную кристаллическую решетку.
При обычных условиях F2 ― ярко-желтый, с оранжевым
оттенком газ, Cl2 ― желто-зеленый ядовитый газ с
характерным удушливым запахом, Br2 ― легколетучая
бурая жидкость (пары брома сильно ядовиты, ожоги
бромом очень болезненны и долго не заживают), а I2 ―
твердое кристаллическое вещество, способное к
возгонке. В ряду F2, Сl2, Br2, I2 ― плотность простых веществ
растет, а интенсивность окраски увеличивается.
Следовательно, в изменении свойств атомов и простых
веществ ― галогенов проявляется одинаковая
закономерность: с увеличением порядкового номера
неметаллические свойства ослабевают, а металлические
― усиливаются.
15. Химические свойства неметаллов
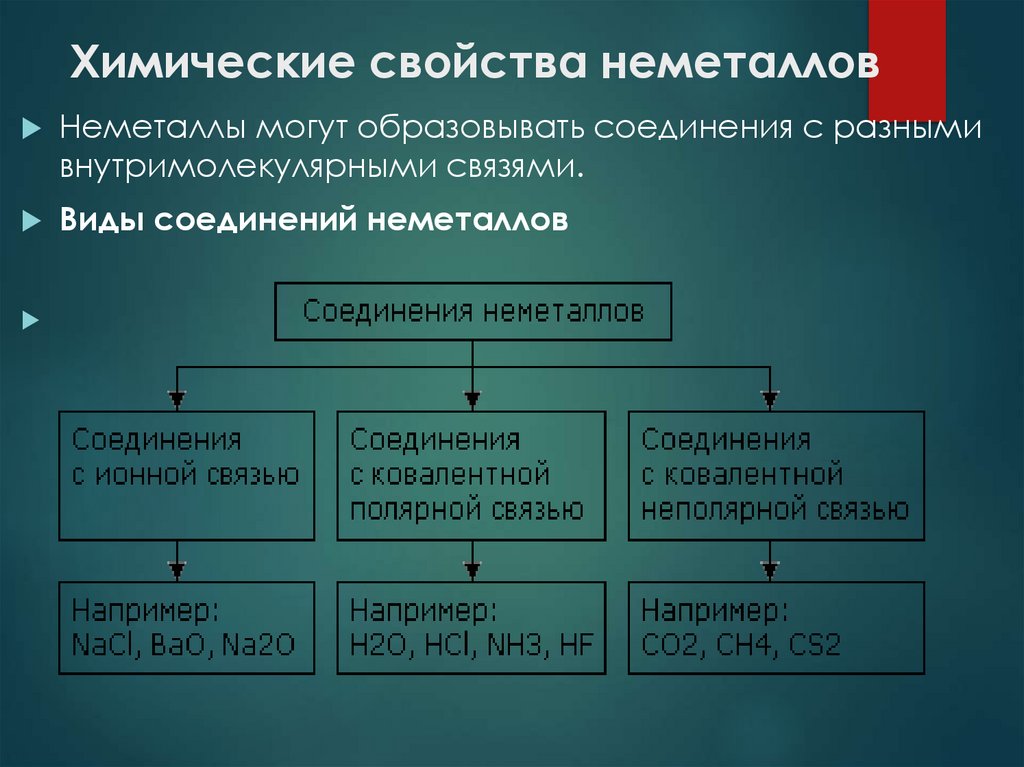
Неметаллы могут образовывать соединения с разнымивнутримолекулярными связями.
Виды соединений неметаллов
16. Получение неметаллов
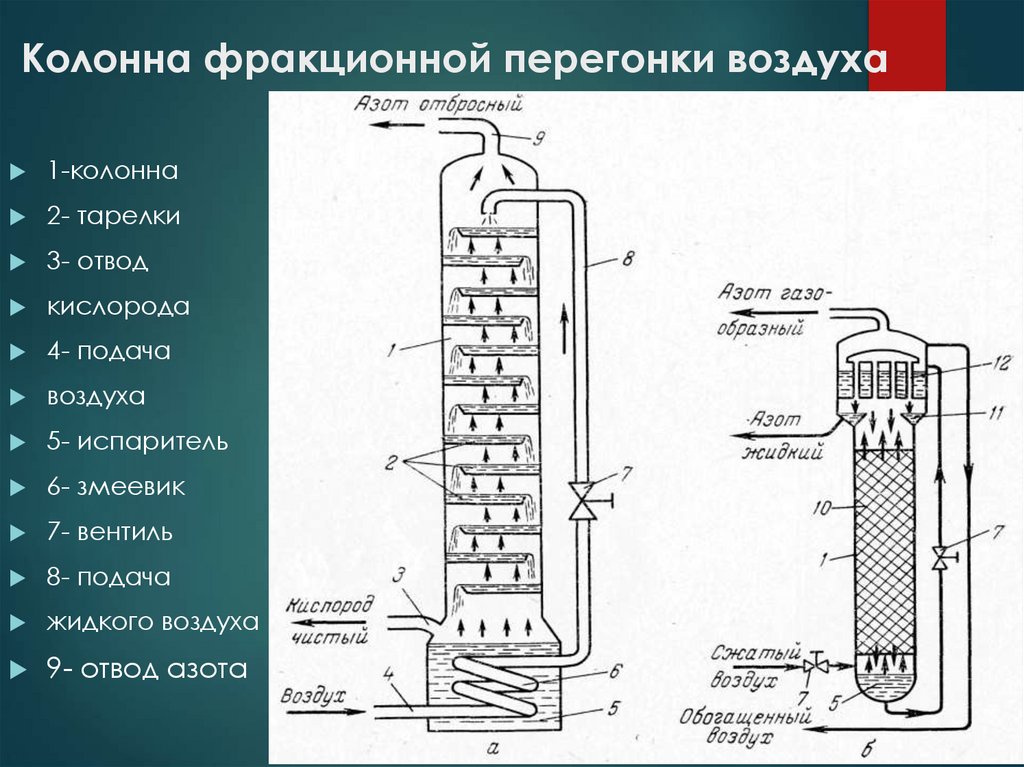
Азот и кислород получают методом фракционнойперегонки жидкого воздуха в ректификационной колонне.
Этот способ сводится к фракционной перегонке
сжиженного атмосферного воздуха, и основан на различии
в температурах кипения (испарения) его составных частей:
азота, кислорода, аргона и других газов. Процесс
заключается в следующем: вначале, атмосферный воздух
сжимается до высокого давления. После сжатия, из сжатого
воздуха удаляются твердые примеси, влага, а также
углекислый газ CO2. Очищенный сжатый воздух подвергается
обратному расширению, в результате чего охлаждается до
степени сжижения составляющих его газов. После этого,
полученная жидкость постепенно испаряется, и по мере
испарения из нее пофракционно извлекаются азот
(температура кипения -196°C), кислород (температура
кипения -183°C), аргон и другие редкие газы.
17. Колонна фракционной перегонки воздуха
1-колонна2- тарелки
3- отвод
кислорода
4- подача
воздуха
5- испаритель
6- змеевик
7- вентиль
8- подача
жидкого воздуха
9- отвод азота
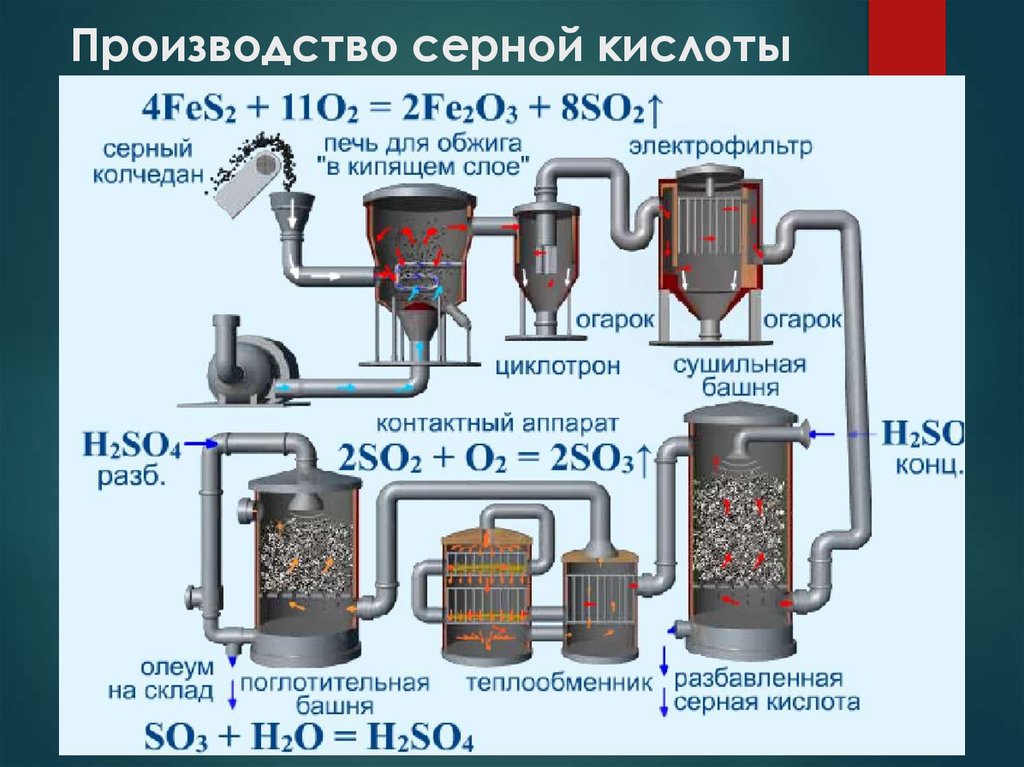
18. Производство серной кислоты
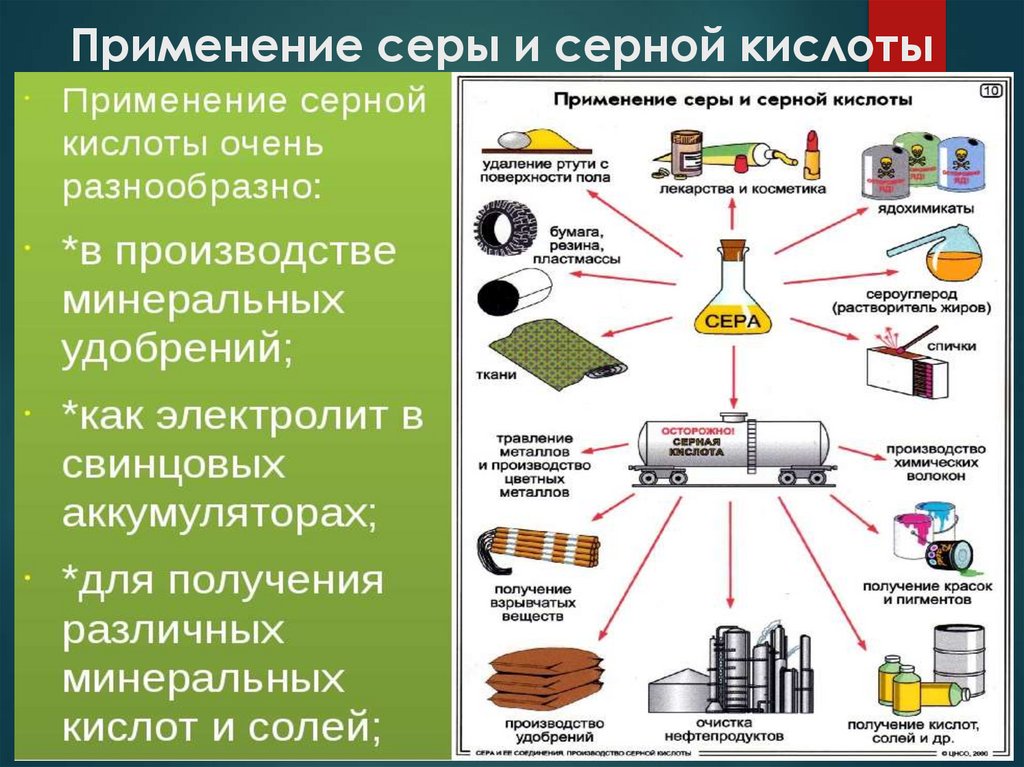
Ежегодно в мире получают свыше 150 тонн серной кислоты,основное количество которой расходуют на производство
минеральных удобрений и на очистку нефти и нефтепродуктов.
Серная кислота также находит применение в металлургии, при
получении красителей и лекарств, других кислот и солей, как
электролит в аккумуляторах.
Сырье: пирит FeS2, самородная сера, серосодержащие газы —
отходы цветной металлургии, воздух.
1-я стадия – обжиг пирита - получение оксида серы (IV)
4FeS2 + 11 O2 = 2Fe2O3 + 8SO2 + 3310 кДж
2-я стадия – окисление SО2 - получение оксида серы (VI)
2SО2 + О2 = 2SО3 +197,8 кДж
3-я стадия – получение серной кислоты
SО3 + Н2О = Н2SО4
Процесс растворения SО3 осуществляют не в воде, а в концентрированной серной кислоте. Полученный раствор наз. олеум.
При растворении олеума в воде образуется серная кислота.
19. Производство серной кислоты
20. Применение серы и серной кислоты
21. Домашнее задание
Раздел 7.4.Вопросы №1- 4 стр. 130.
Раздел 7.5. Вопрос № 3 стр. 134.















 Химия
Химия








