Похожие презентации:
4_IV_A_gruppa (2) (1)
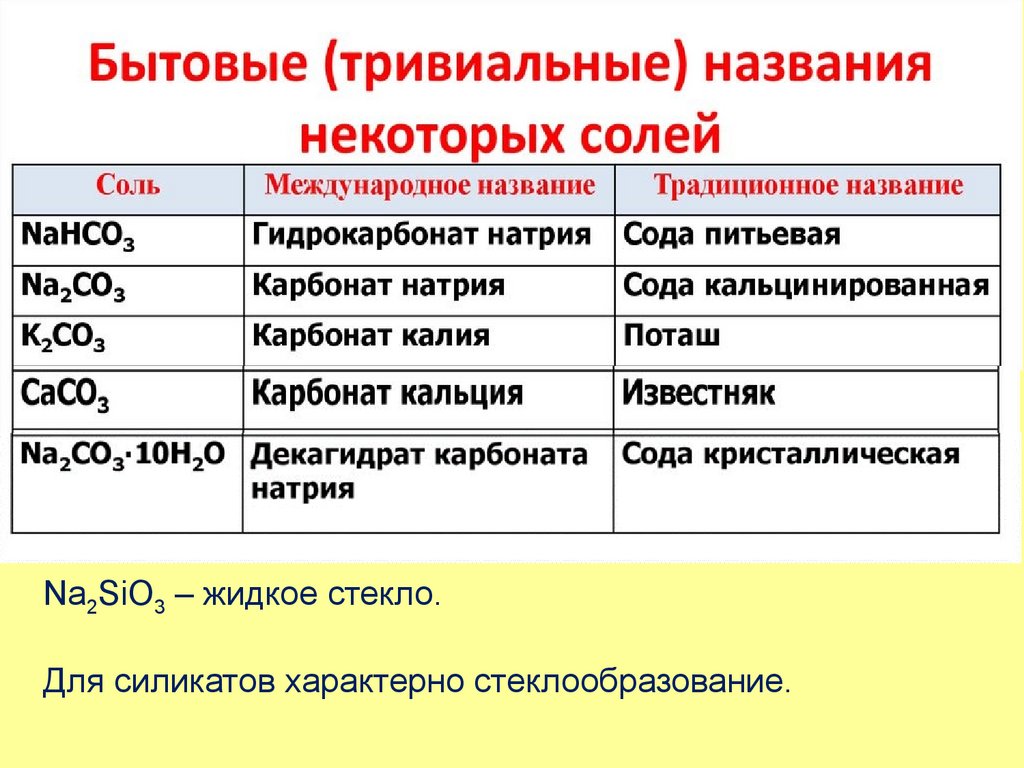
1. IV А группа
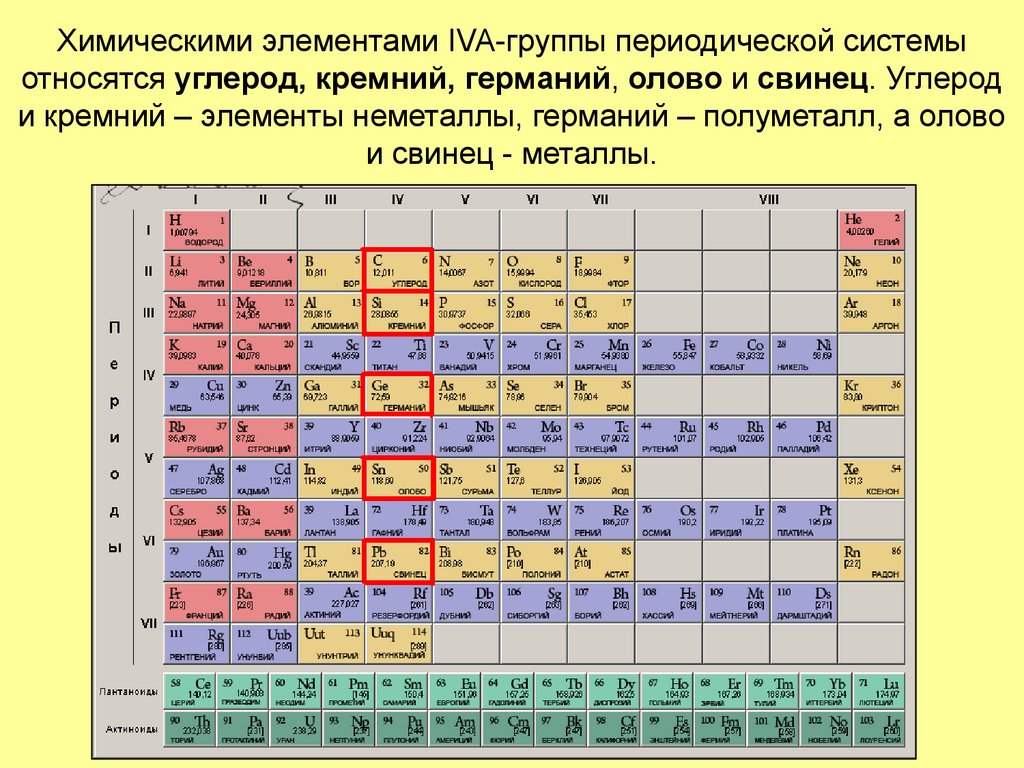
2. Химическими элементами IVA-группы периодической системы относятся углерод, кремний, германий, олово и свинец. Углерод и кремний
– элементы неметаллы, германий – полуметалл, а оловои свинец - металлы.
3. Углерод известен с древности в виде сажи, древесного угля. Углерод - рождающий уголь, (лат. Carbogenium). Кремний открыл
Названия и открытиеУглерод известен с древности в виде сажи, древесного
угля. Углерод - рождающий уголь, (лат. Carbogenium).
Кремний открыл Берцеллиус в 1823 г:
SiF4 + 4K = 4KF + Si
Кремний (лат. Silicium, от лат. silex — кремень, камень).
Германий открыл Винклер в 1886 г и назвал в честь своей
Родины – Германии.
Олово и свинец известны с древности, за 2-3 тыс лет до
н.э. Русское название олова означает белый (от лат.
albus). Происхождение русского названия свинец неясно.
Латинское «plumbum» от «plumber» - водопроводчик
(когда-то трубы зачеканивали мягким свинцом).
4.
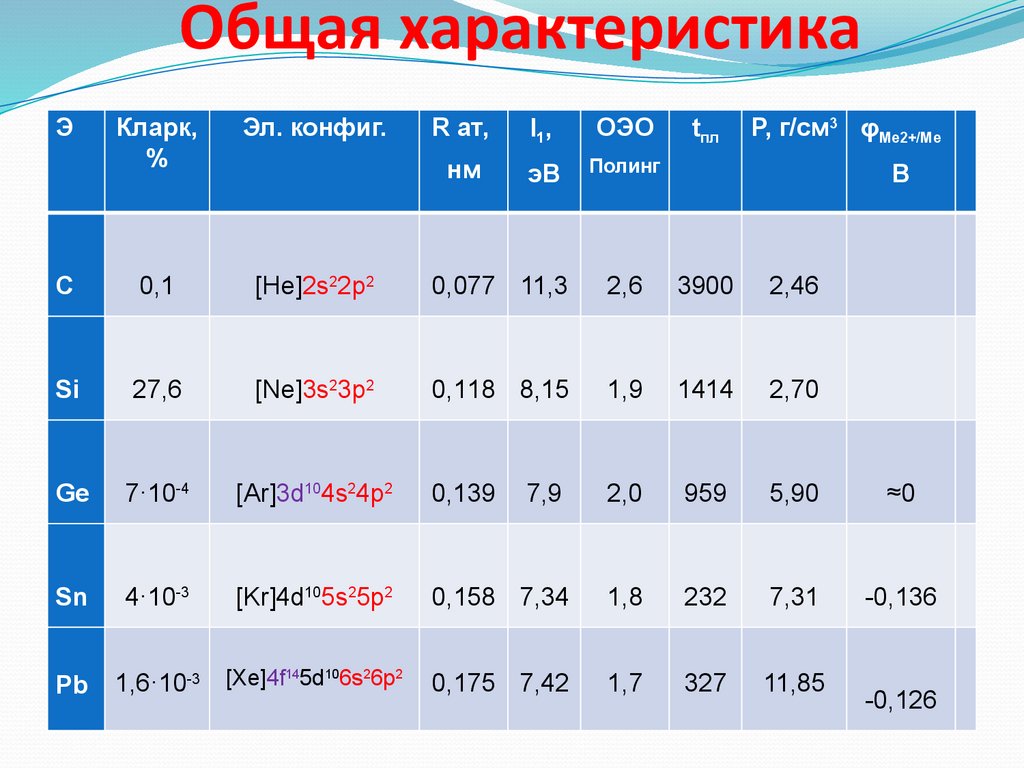
Общая характеристикаЭ
Кларк,
%
Эл. конфиг.
R ат,
I1,
ОЭО
нм
эВ
Полинг
C
0,1
[He]2s22p2
0,077 11,3
2,6
3900
2,46
Si
27,6
[Ne]3s23p2
0,118 8,15
1,9
1414
2,70
Ge
7·10-4
[Ar]3d104s24p2
0,139
7,9
2,0
959
5,90
≈0
Sn
4·10-3
[Kr]4d105s25p2
0,158 7,34
1,8
232
7,31
-0,136
Pb
1,6·10-3
[Xe]4f145d106s26p2
0,175 7,42
1,7
327
11,85
tпл
Ρ, г/см3 φMe2+/Me
B
-0,126
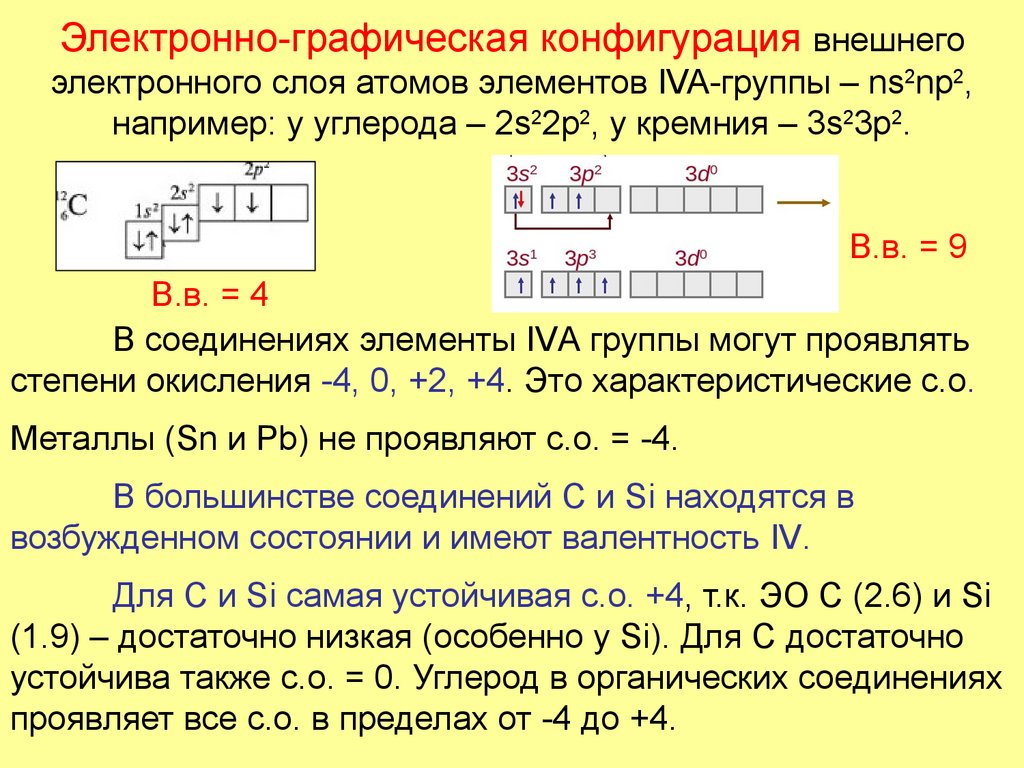
5. Электронно-графическая конфигурация внешнего электронного слоя атомов элементов IVA-группы – ns2np2, например: у углерода –
2s22p2, у кремния – 3s23p2.В.в. = 9
В.в. = 4
В соединениях элементы IVА группы могут проявлять
степени окисления -4, 0, +2, +4. Это характеристические с.о.
Металлы (Sn и Pb) не проявляют с.о. = -4.
В большинстве соединений С и Si находятся в
возбужденном состоянии и имеют валентность IV.
Для С и Si cамая устойчивая с.о. +4, т.к. ЭО C (2.6) и Si
(1.9) – достаточно низкая (особенно у Si). Для С достаточно
устойчива также с.о. = 0. Углерод в органических соединениях
проявляет все с.о. в пределах от -4 до +4.
6.
СSi
Ge
Sn
Pb
Изменение устойчивости максимальной
степени окисления
Увеличивается число электронных слоев, увеличивается
эффект проникновения ns-электронов к ядру, усиливается
их связь с ядром, уменьшается способность атомов отдавать
s-электроны, уменьшается устойчивость с.о. +4,
увеличивается устойчивость с.о. +2.
Для свинца эффект проникновения 6s-электронов к ядру
особенно силен (эффект инертной 6s-электронной пары, т.к.
перед 6s-электронами находится 4f-кайносимметричная
орбиталь, а также 5d, поэтому эффект проникновения очень
велик. 6s-электроны сильно притягиваются с ядру и не склонны
к образованию связей. Поэтому с.o. +2 для свинца особенно
устойчива, а с.о. +4 – неустойчива.
1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p2
7. Устойчивые степени окисления
СSi
Ge
Sn
Pb
+4
+4
+4
+2, +4
+2
8. Изменение устойчивости минимальной отрицательной степени окисления (-4)
СSi
Ge
Sn
Pb
Увеличивается радиус, ослабевает
притяжение электронов к ядру,
увеличиваются металлические
свойства, уменьшается способность
принимать электроны, уменьшается
устойчивость с.о. -4.
Для металлов Sn и Pb с.о. -4 не характерна.
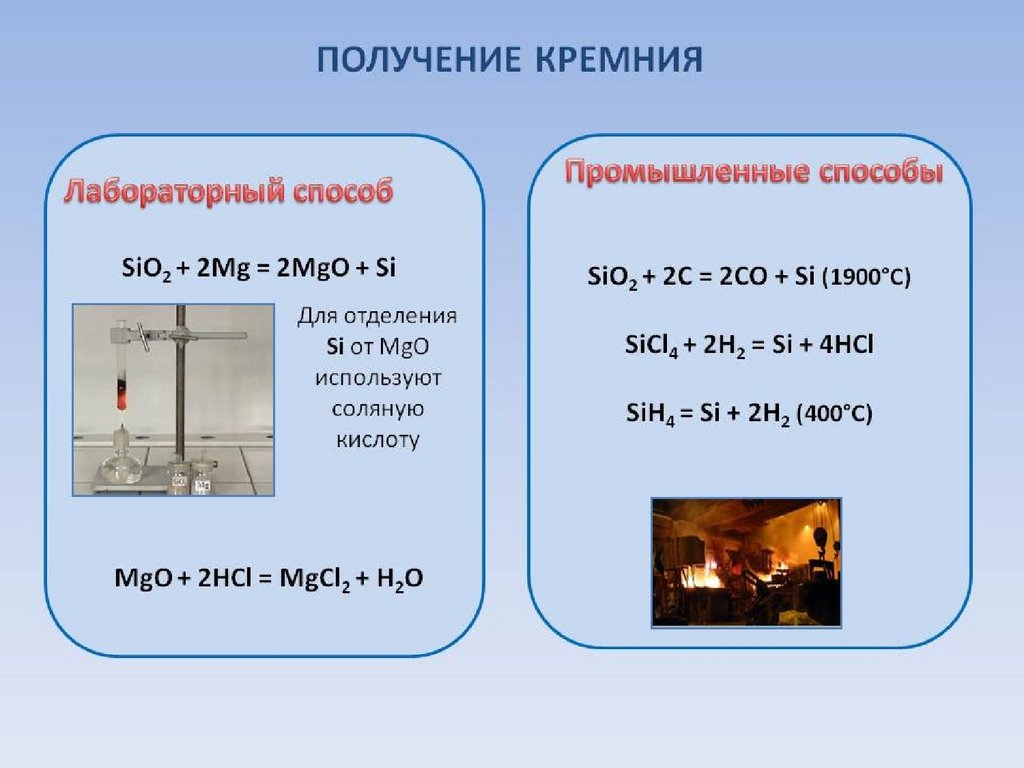
9. Нахождение в природе и получение
Т.к. + 4 – самая устойчивая с.о. для углерода,кремния, германия и олова, все они содержатся
в природе в виде соединений в с.о.+4.
Для свинца самая устойчивая с.о. +2, поэтому в
природе он содержится в виде соединений в с.о.
+2.
Для углерода также устойчива с.о.=0, поэтому он
есть в природе и в виде простого вещества.
10.
11. Уголь, торф, нефть и природный газ - продукты разложения растительного мира Земли древнейших времен. Самое мягкое ископаемое –
торф – содержит остатки растений, в нем имеется неболее 50-60% углерода. Бурый уголь содержит 65-70% углерода.
Каменный уголь содержит 75-95% углерода. Самый твердый уголь
– антрацит – может содержать 91-98% углерода.
В отрицательных с.о. углерод содержится в углеводородах
нефти и газа CxHy
В виде углекислого газа углерод входит в состав
атмосферы (0,03% по объему).
12. Получение углерода 1. Коксование каменного угля
13. 2. Пиролиз древесины – нагревание древесины без доступа воздуха. В результате образуется древесный уголь
14. Распространения кремния в природе
Кремний – второй по распространенности на Землеэлемент после кислорода (27,6% от массы земной коры). Т.к.
с.о. = + 4 – единственно устойчивая для кремния, то в
природе он встречается в виде в виде кремнезема SiO2 и
различных алюмосиликатов xAl2O3·ySiO2.
Например, гранит содержит более 60% кремнезема, а
кристаллический кварц является самым чистым из природных
соединений кремния с кислородом.
15. SiO2
16. Листья крапивы покрыты колючими волосками из чистого оксида кремния (IV), которые представляют собой полые трубочки длинной 1-2
мм. Трубочки заполнены жидкостью,содержащей муравьиную кислоту. При легком прикосновении
листьев крапивы к телу волоски проникают сквозь кожу и
кислота попадает внутрь, вызывая жжение.
17.
18.
Германий – рассеянный элементGeS2 + 3O2 = GeO2 + 2SO2
GeO2 + 2C = Ge + 2CO
19.
Все соединения свинца очень ядовиты!20. Строение и физические свойства простых веществ
Т.к. в возбужденном состоянии у атомов IVА группы 4неспаренных электрона, то возможны разные способы
соединения атомов с образованием разных простых
веществ, т.е. возможна аллотропия.
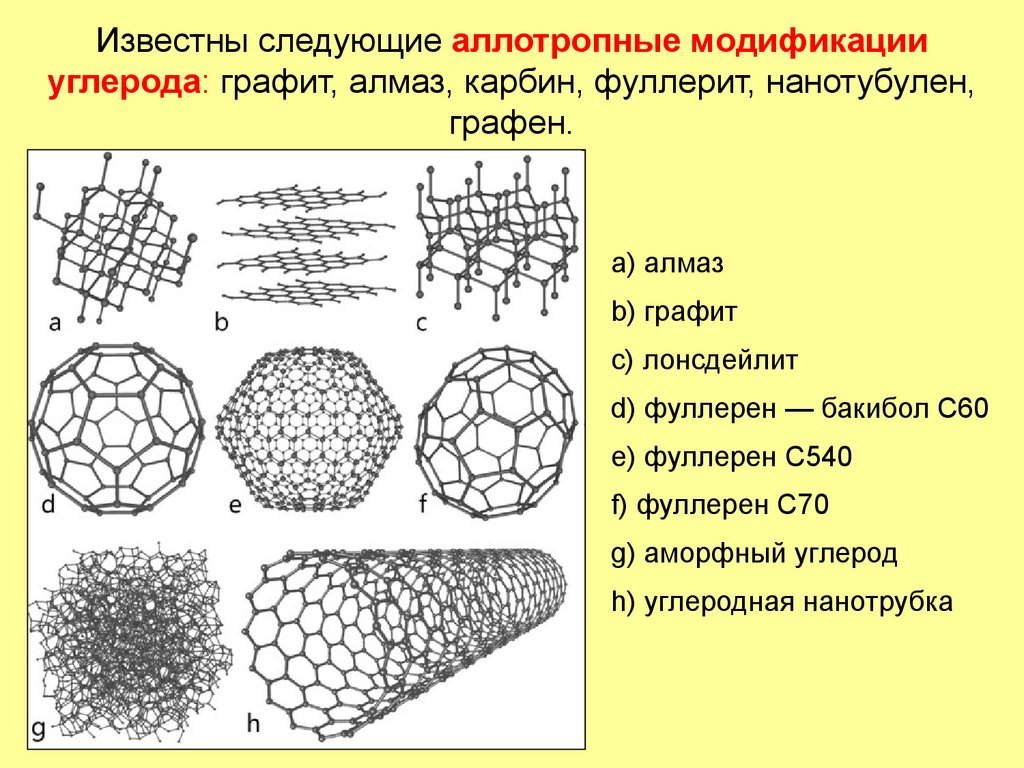
21. Известны следующие аллотропные модификации углерода: графит, алмаз, карбин, фуллерит, нанотубулен, графен.
a) алмазb) графит
c) лонсдейлит
d) фуллерен — бакибол C60
e) фуллерен C540
f) фуллерен C70
g) аморфный углерод
h) углеродная нанотрубка
22. Алмаз имеет атомную кристаллическую решетку, каждый атом углерода окружен такими же атомами, расположенными в вершинах
правильного тетраэдра.Углерод в алмазе находится в состоянии sp3 – гибридизации. Такое
строение обуславливает особые физические свойства алмаза и прежде
всего его твердость. Алмаз переводится как «несокрушимый». Алмаз
служит эталоном твердости, которая по десятибалльной системе
оценивается высшим балом 10. Используется для резки стекла,
изготовления шлифовальных порошков.
Алмаз плохо проводит теплоту и почти не проводит электрический
ток. Ограненные прозрачные алмазы называются бриллиантами.
23. Графит имеет атомное слоистое строение: Атомы углерода расположены слоями, состоящими из шестичленных колец. Углерод в графите
находится в состоянии sp2 – гибридизации.3 электрона образуют σ-связи, четвертый делокализован и свободно
перемещается по кристаллу.
Слоистая структура графита обуславливает его мягкость: он
легко оставляет след на бумаге. Название «графит» происходит от
ит. «grafitto» - рисую.
Графит электропроводен за счет свободных электронов.
Используется в качестве электродов при электролизе
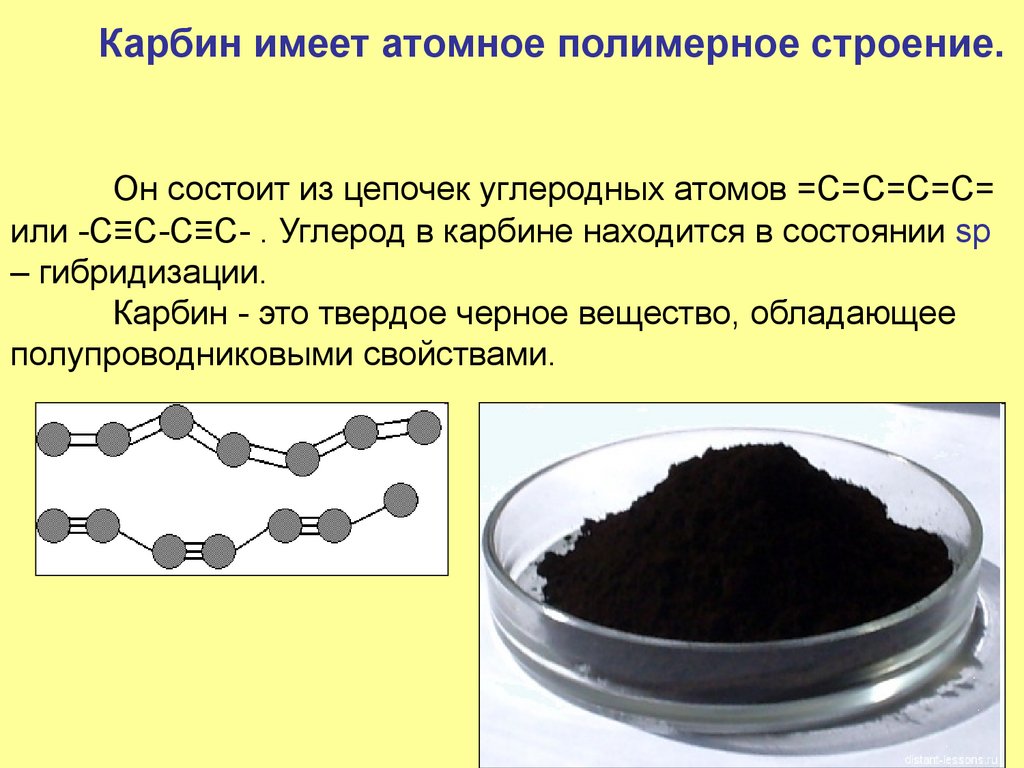
24. Карбин имеет атомное полимерное строение. Он состоит из цепочек углеродных атомов =С=С=С=С= или -C≡C-C≡C- . Углерод в карбине
находится в состоянии sp– гибридизации.
Карбин - это твердое черное вещество, обладающее
полупроводниковыми свойствами.
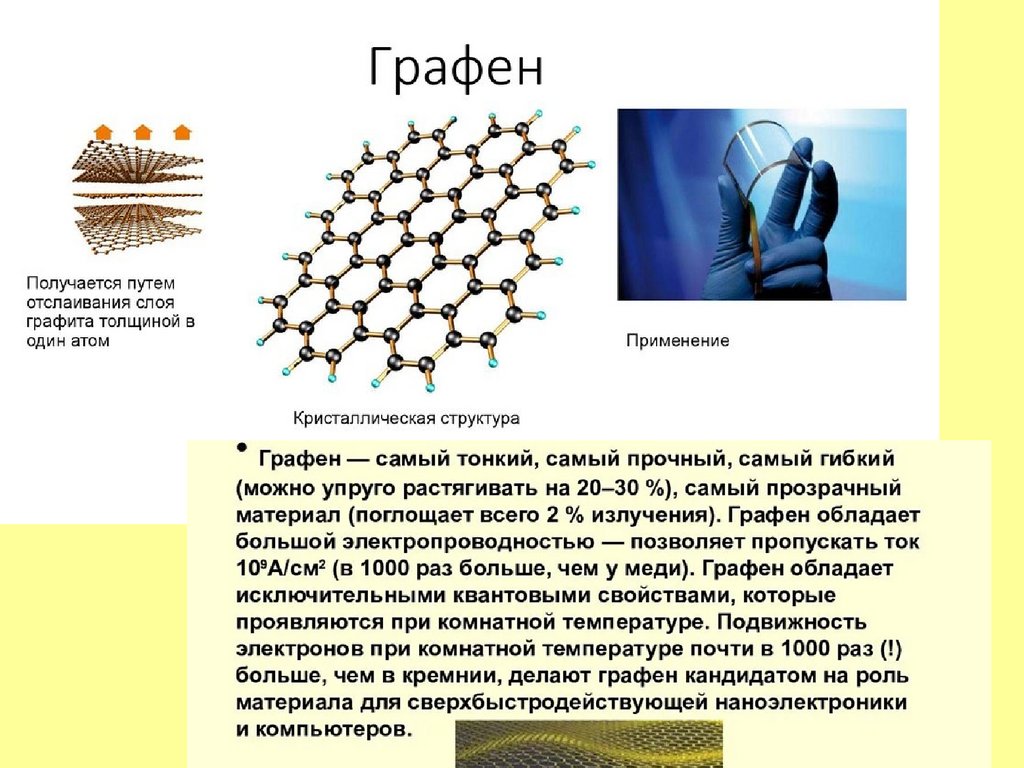
25. В конце XX – начале XXI века искусственно получены новые модификации углерода – - фуллерит (фуллерен), - нанотубулен
(углеродные нано-трубки),- графен.
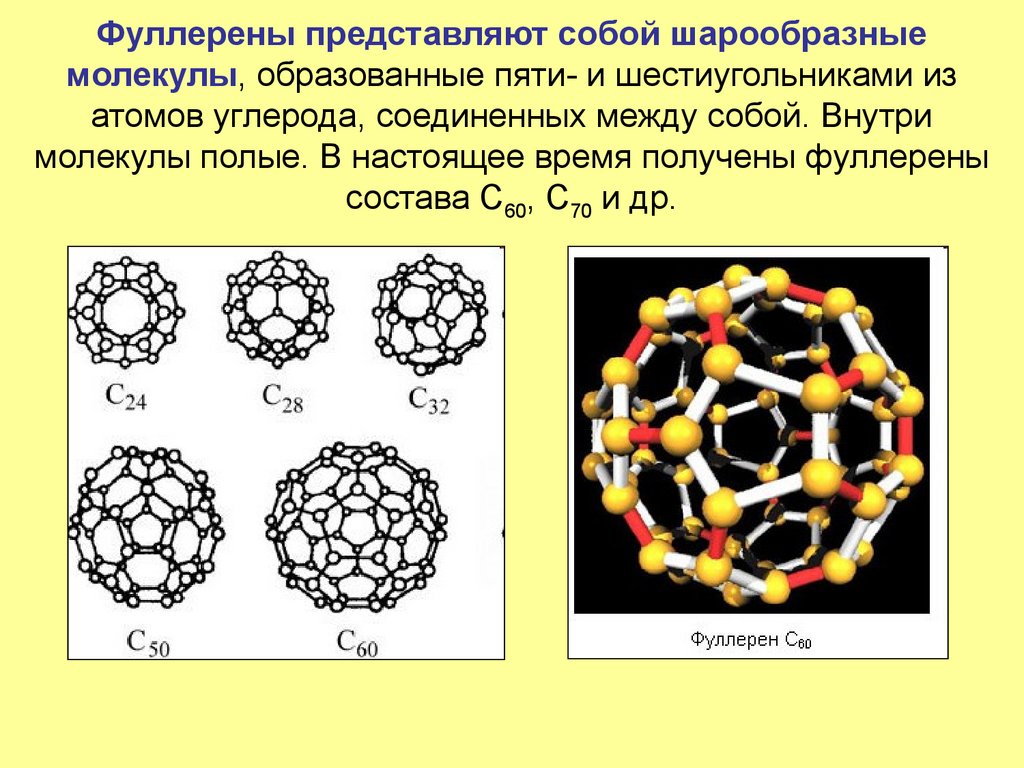
26. Фуллерены представляют собой шарообразные молекулы, образованные пяти- и шестиугольниками из атомов углерода, соединенных между
собой. Внутримолекулы полые. В настоящее время получены фуллерены
состава С60, С70 и др.
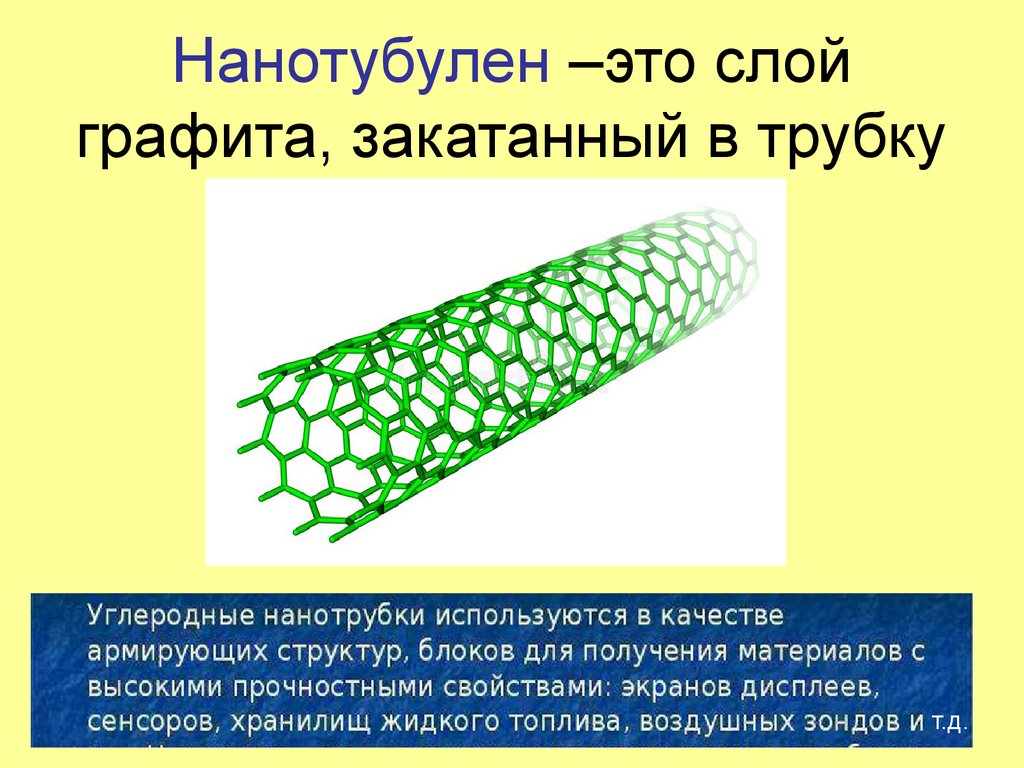
27. Нанотубулен –это слой графита, закатанный в трубку
т.д.28.
29.
В аморфном углероде, в отличие откристаллического, отсутствует дальний порядок
30.
Si находитсяв состоянии
sp3 –
гибридизации
У кремния также есть графитоподобная неустойчивая
модификация, в которой атомы Si находятся в состоянии
sp2 – гибридизации.
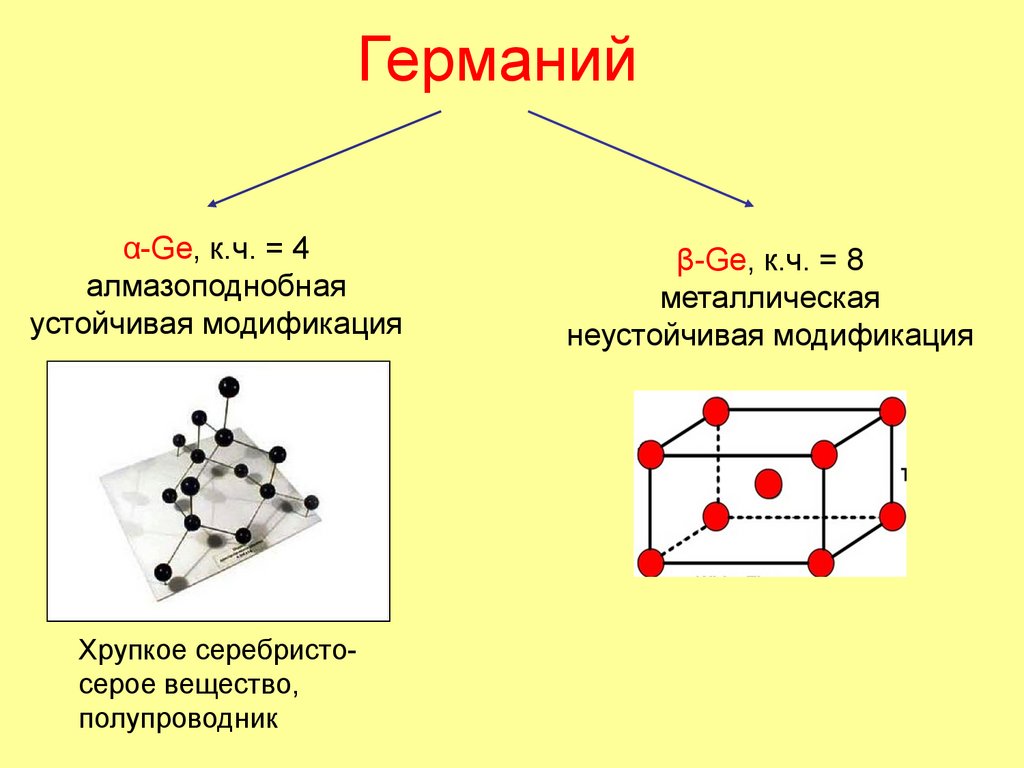
31. Германий
α-Ge, к.ч. = 4алмазоподнобная
устойчивая модификация
Хрупкое серебристосерое вещество,
полупроводник
β-Ge, к.ч. = 8
металлическая
неустойчивая модификация
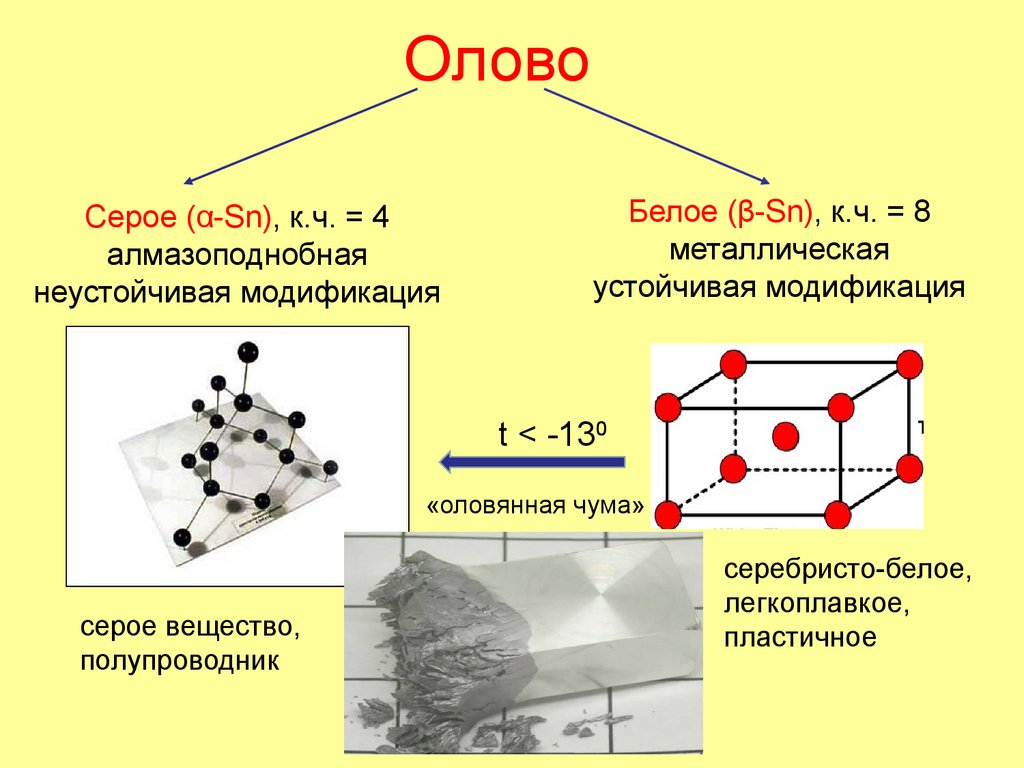
32. Олово
Cерое (α-Sn), к.ч. = 4алмазоподнобная
неустойчивая модификация
Белое (β-Sn), к.ч. = 8
металлическая
устойчивая модификация
t < -130
«оловянная чума»
серое вещество,
полупроводник
серебристо-белое,
легкоплавкое,
пластичное
33. Свинец
Единственнаямодификация с к.ч. = 12
34. Тенденции изменения строения кристаллической решетки
СSi
Ge
Sn
Pb
К.ч.
2, 3, 4
3, 4
4, 8
4, 8
12
Уменьшается электроотрицательность,
увеличиваются металлические
свойства, рыхлая решетка
с низкими координационными
числами, характерная для неМе,
сменяется плотноупакованной
решеткой с высокими к.ч.,
характерной для металлов, к.ч.↑
35. Химические свойства простых веществ
Для углерода, кремния и германия характернаневысокая химическая активность (из-за прочной
атомной
кристаллической
решетки):
большинство
реакций с их участием протекают только при высокой
температуре.
В химических реакциях углерод, кремний и германий
проявляют как окислительные, так и восстановительные
свойства.
Более
характерны
восстановительные
свойства (из-за низкой ЭО).
Олово и свинец – металлы средней активности,
стоят непосредственно перед водородом. В реакциях
проявляют только восстановительные свойства.
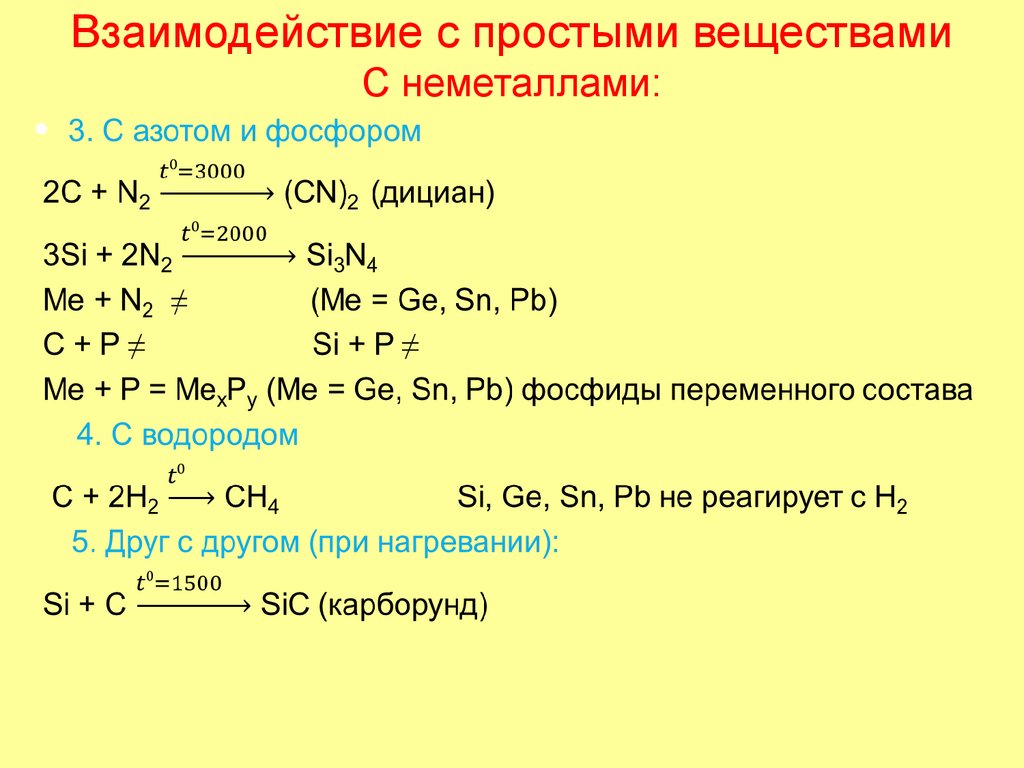
36. Взаимодействие с простыми веществами С неметаллами:
1. С галогенами:Э + 2F2 = CF4
Э + 2Cl2 = ЭCl4
(Э = С, Si, Ge, Sn;
для С и Si t > 1500oC)
Pb + Cl2 = PbCl2
С и Si c бромом и иодом не реагируют!
Ge + 2Br2 = GeBr4
Sn + 2Br2 = SnBr4
Pb + Br2 = PbBr2
Me + I2 = MeI2
(Me = Ge, Sn, Pb)
2. С кислородом и серой (при нагревании):
Э + О2 = ЭО2 (Э = С, Si, Ge, Sn)
2Pb + О2 = 2PbO
Э + 2S = ЭS2
(Э = С, Si)
Me + S = MeS
(Me = Ge, Sn, Pb)
37. Взаимодействие с простыми веществами С неметаллами:
Взаимодействие с простыми веществамиС неметаллами:
38. Взаимодействие с металлами:
• Все реакции идут при высокой температуре• С с металлами I и II групп образует ацетилениды (с.о. = -1), с
p-металлами – метаниды (с.о. = -4), с d-металлами III- VIII
групп – карбиды переменного состава (с.о. = произвольная
отрицательная):
• Сa + 2C = CaC-2 (ацетиленид кальция)
• 4Al + 3C = Al4C-43 (метанид алюминия)
• 3Fe + C = Fe3C (карбид железа – «цементит»)
• Si и Ge с s-металлами образует силициды (германиды) в с.о.
= -4, со многими p-металлами – не реагируют, с d-металлами
образует силициды переменного состава (с.о. =
произвольная отрицательная):
• Si + 2Mg = Mg2Si (силицид магния)
• 2Si + Mо = MоSi2 (силицид молибдена)
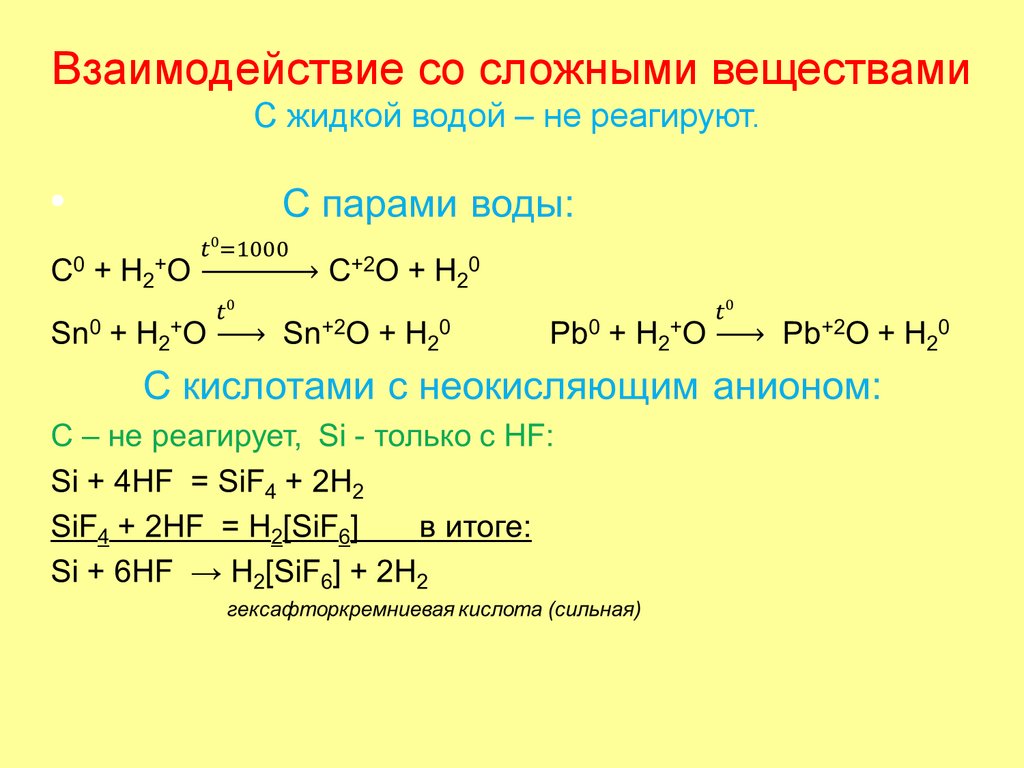
39. Взаимодействие со сложными веществами С жидкой водой – не реагируют.
40.
41.
42.
С растворами щелочей:C не реагирует.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
φSiO32-/Si = -1,7B
Sn, Pb стоят в ряду напряжений до водорода, способны
переходить в анионную форму в растворе (т.к. их гидроксиды
амфотерны), поэтому реагируют:
Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2
(Pb)
Ge растворяется в щелочах только в присутствии окислителя:
Ge + 2NaOH + 2H2O2 = Na2[Ge(OH)6]
43. Взаимодействие со сложными веществами С оксидами металлов (при нагревании):
1) Восстанавливают оксиды металлов до металлов:ZnO + C → 2Zn + CO
4С + Fe3O4 → 3Fe + 4CO
углерод - восстановитель
углерод - восстановитель
Реакции используются для получения металлов из оксидных руд.
2) С образует карбиды даже при взаимодействии с оксидами
активных металлов:
3С0 + СаО → СаС-2 + С+2О
углерод диспропорционирует
9С0 + 2Al2O3 → Al4C-43 + 6C+2O
углерод диспропорционирует
С солями-окислителями, в состав которых входит
элемент в высшей с.о. (при нагревании):
4C + Na2SO4 → Na2S + 4CO
C + 2KNO3 → CO2 + 2KNO2
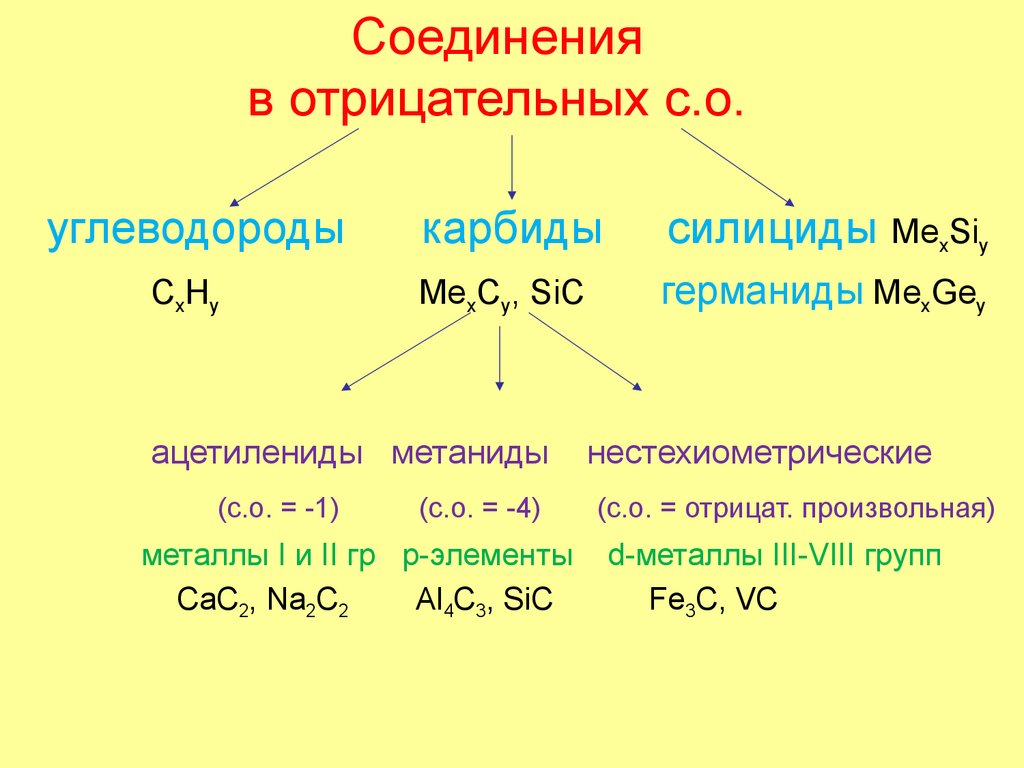
44. Соединения в отрицательных с.о.
углеводородыкарбиды
силициды МеxSiy
CxHy
МеxCy, SiC
германиды МеxGey
ацетилениды метаниды
(с.о. = -1)
(с.о. = -4)
металлы I и II гр p-элементы
СaC2, Na2C2
Al4C3, SiC
нестехиометрические
(с.о. = отрицат. произвольная)
d-металлы III-VIII групп
Fe3C, VC
45. Карбиды Свойства
• Твердые тугоплавкие соединения, нерастворимы илиразлагаются водой
• Карбиды s- и p-металлов разлагаются водой и кислотами:
СaC2 + 2H2O = Ca(OH)2 + C2H2
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
• Нерастворимые ацетилениды разлагаются кислотами:
Ag2C2 + 2HCl = 2AgCl + C2H2
Карбиды d-металлов - твердые тугоплавкие соединения (TC),
нерастворимы, жаропрочные, коррозионно устойчивые.
Получение
1) Синтез из простых веществ
4Al + 3C = Al4C3
2) Взаимодействие оксидов металлов с углеродом
3С + СаО → СаС2 + СО
46. Силициды Свойства
• Твердые тугоплавкие соединения, нерастворимы илиразлагаются водой
• Силициды s-металлов разлагаются водой и кислотами:
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4
Mg2Si + 4HСl = 2MgCl2 + SiH4
Силициды d-металлов - твердые тугоплавкие соединения
(TC) переменного состава, нерастворимы, жаропрочные,
коррозионно устойчивые. MoSi2 используется как
нагреватель для электропечей
Получение
1) Синтез из простых веществ
Si + 2Mg = Mg2Si
2) Взаимодействие оксидов металлов с кремнием
2Si + 2MgO = Mg2Si + SiO2
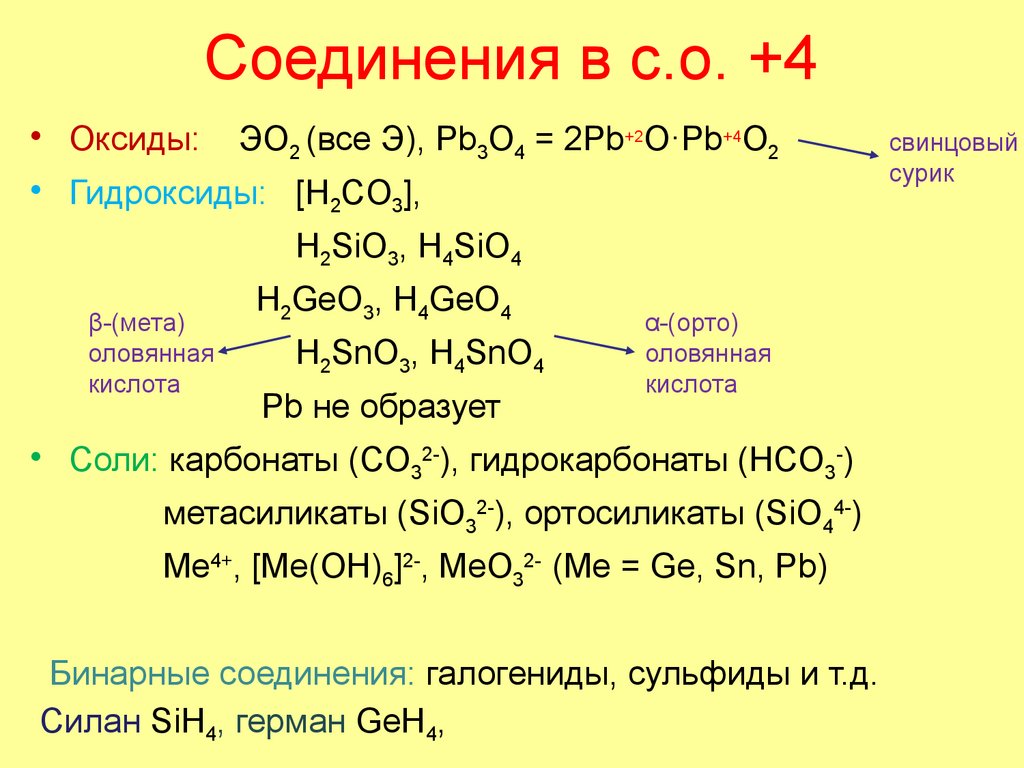
47. Соединения в с.о. +4
• Оксиды: ЭO2 (все Э), Pb3O4 = 2Pb+2O·Pb+4O2• Гидроксиды: [H2CO3],
H2SiO3, H4SiO4
β-(мета)
оловянная
кислота
H2GeO3, H4GeO4
H2SnO3, H4SnO4
Pb не образует
α-(орто)
оловянная
кислота
• Cоли: карбонаты (CO32-), гидрокарбонаты (HCO3-)
метасиликаты (SiO32-), ортосиликаты (SiO44-)
Me4+, [Me(OH)6]2-, MeO32- (Me = Ge, Sn, Pb)
Бинарные соединения: галогениды, сульфиды и т.д.
Силан SiH4, герман GeH4,
свинцовый
сурик
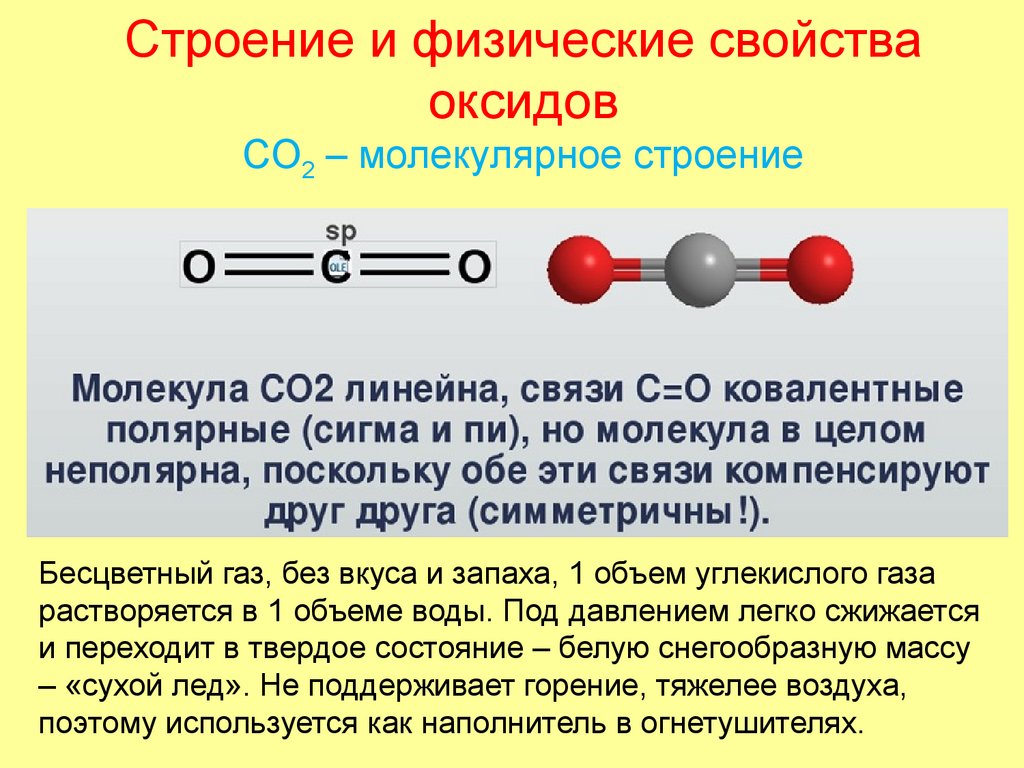
48. Строение и физические свойства оксидов СO2 – молекулярное строение
Бесцветный газ, без вкуса и запаха, 1 объем углекислого газарастворяется в 1 объеме воды. Под давлением легко сжижается
и переходит в твердое состояние – белую снегообразную массу
– «сухой лед». Не поддерживает горение, тяжелее воздуха,
поэтому используется как наполнитель в огнетушителях.
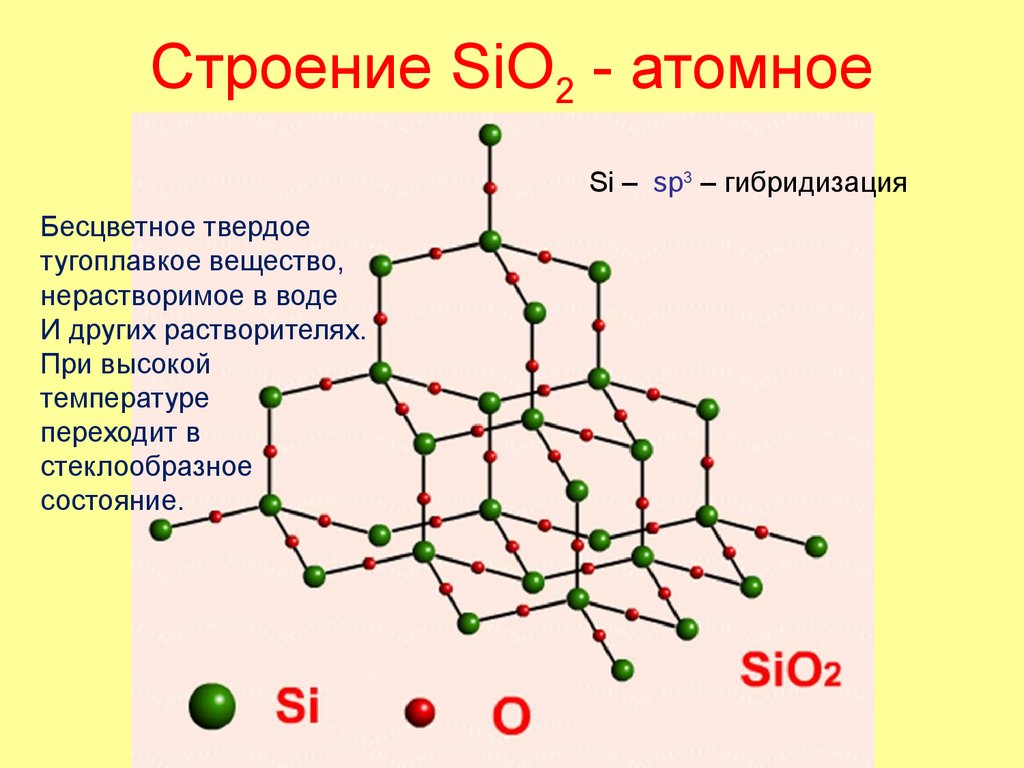
49. Строение SiO2 - атомное
Si – sp3 – гибридизацияБесцветное твердое
тугоплавкое вещество,
нерастворимое в воде
И других растворителях.
При высокой
температуре
переходит в
стеклообразное
состояние.
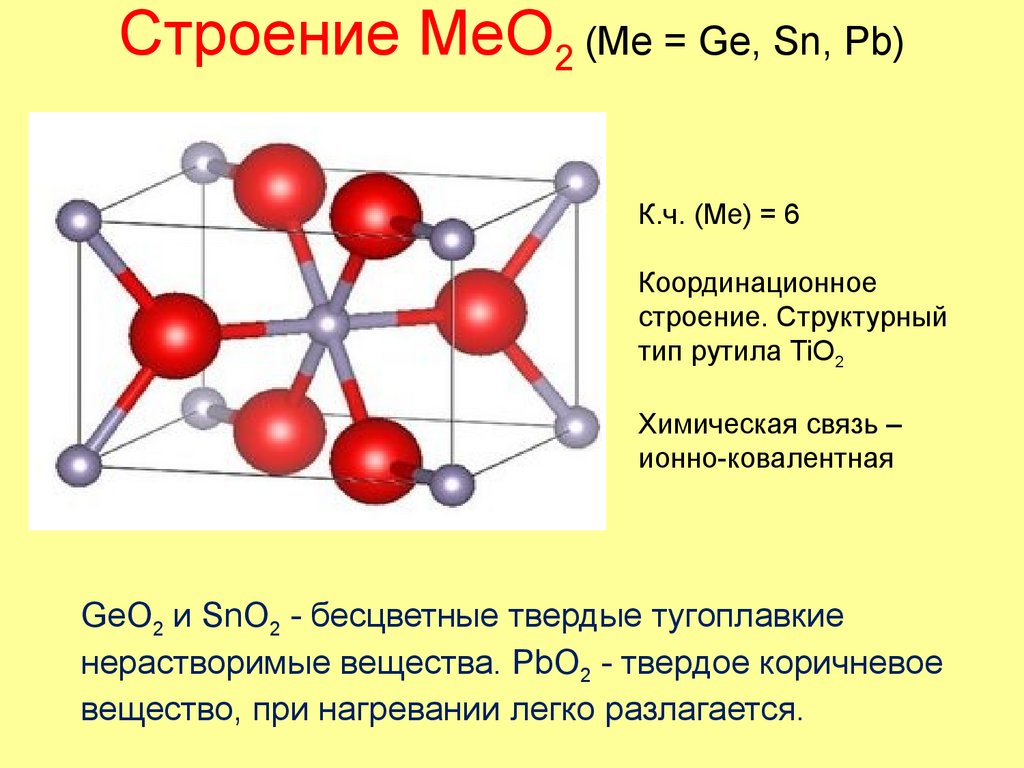
50. Строение MeO2 (Me = Ge, Sn, Pb)
К.ч. (Me) = 6Координационное
строение. Структурный
тип рутила TiO2
Химическая связь –
ионно-ковалентная
GeO2 и SnO2 - бесцветные твердые тугоплавкие
нерастворимые вещества. PbO2 - твердое коричневое
вещество, при нагревании легко разлагается.
51. Строение и физические свойства гидроксидов
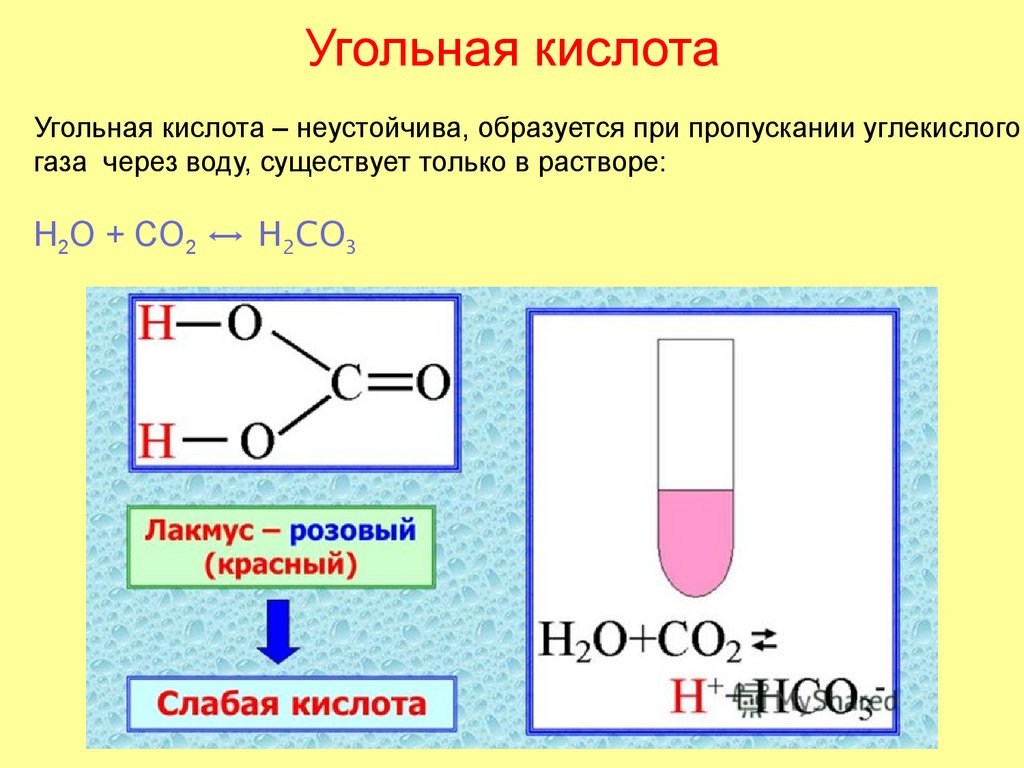
52. Угольная кислота
Угольная кислота – неустойчива, образуется при пропускании углекислогогаза через воду, существует только в растворе:
H2O + CO2 ↔ H2CO3
53. Кремниевые кислоты
H2SiO3метакремниевая
Полимерное строение, нерастворима,
белый желеобразный осадок
H4SiO4
ортокремниевая
молекулярное строение,
растворима, быстро
теряет воду с
образованием
H2SiO3
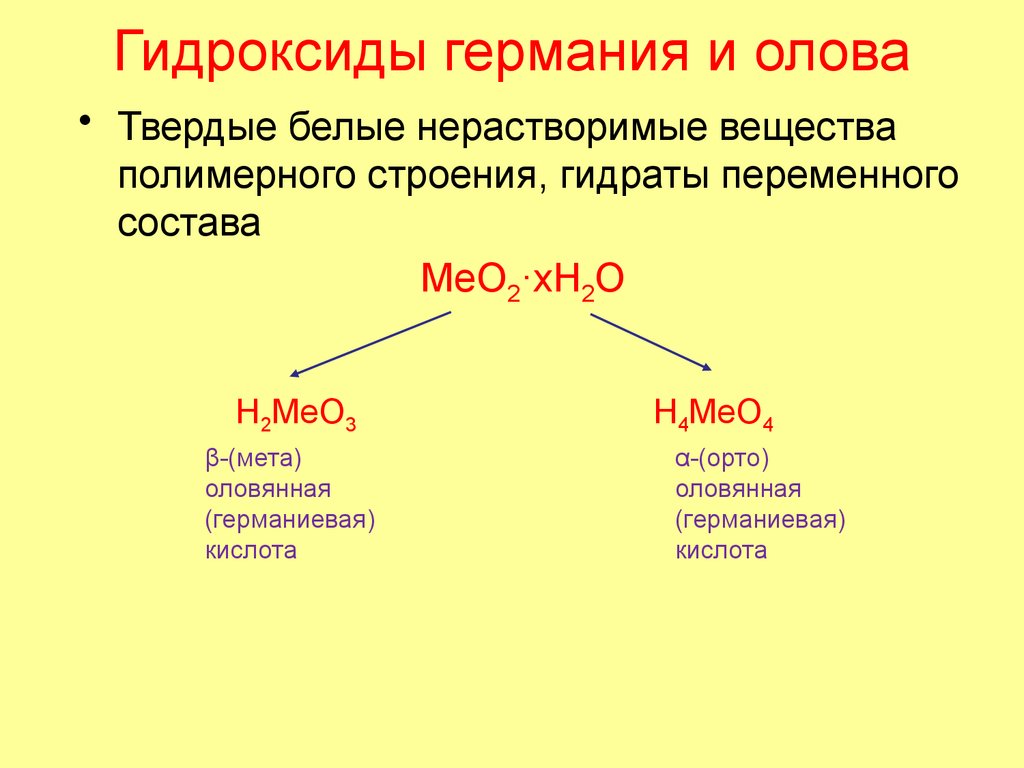
54. Гидроксиды германия и олова
• Твердые белые нерастворимые веществаполимерного строения, гидраты переменного
состава
MeO2·xH2O
H2MeO3
β-(мета)
оловянная
(германиевая)
кислота
H4MeO4
α-(орто)
оловянная
(германиевая)
кислота
55. Химические свойства оксидов и гидроксидов
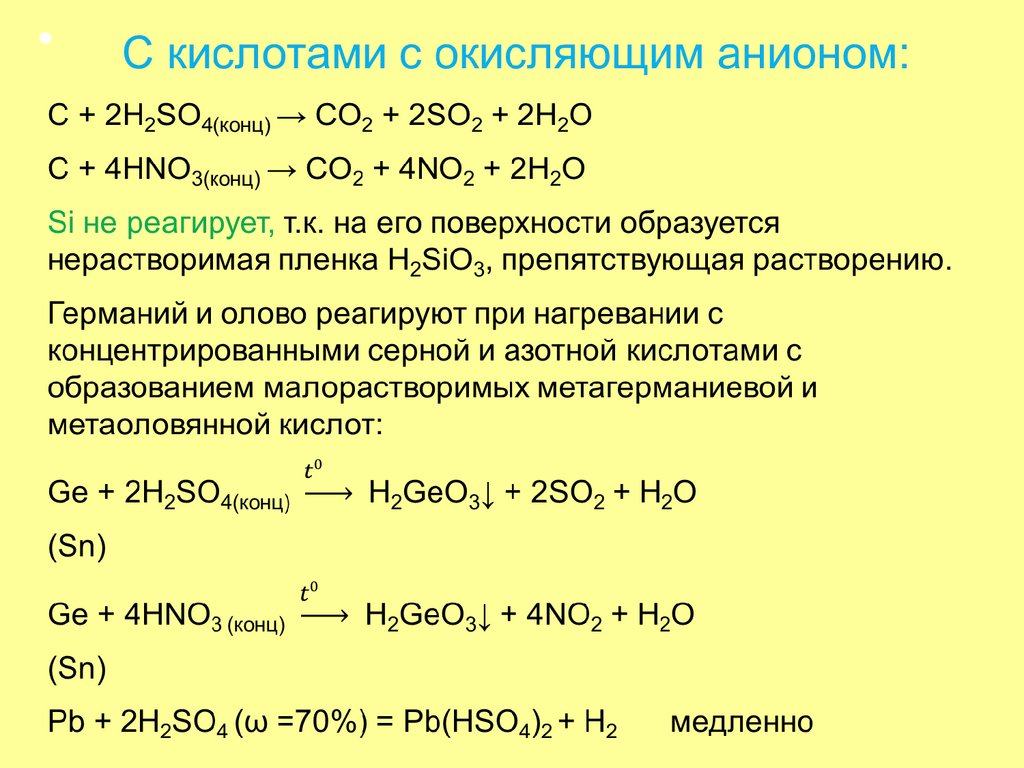
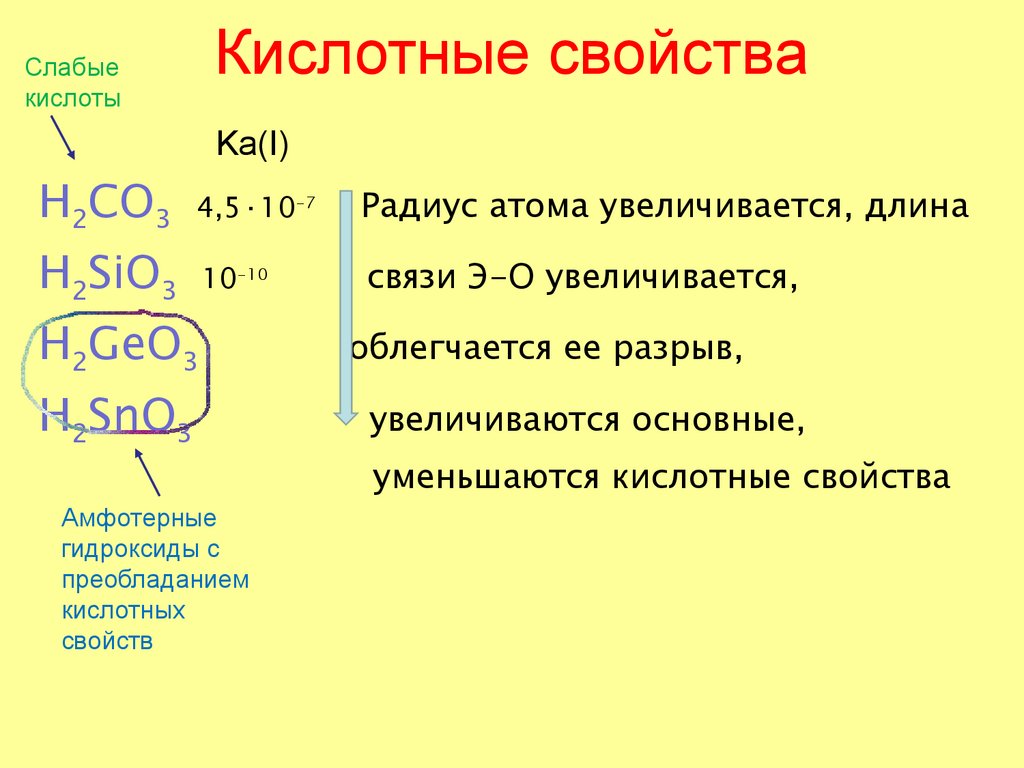
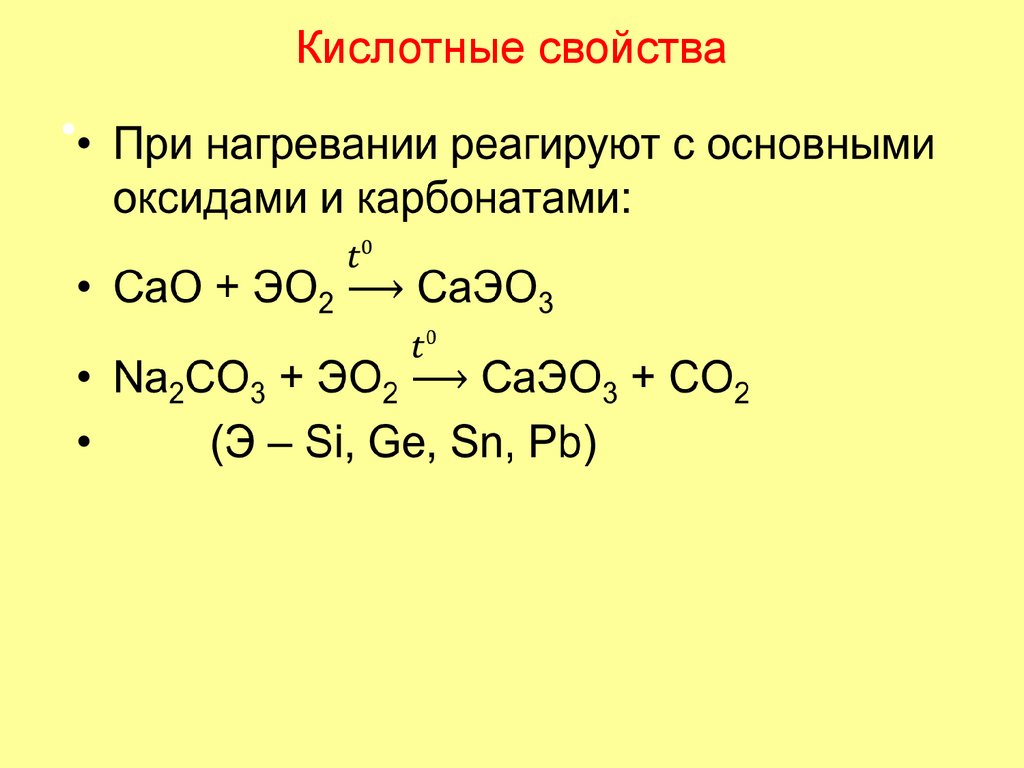
56. Кислотные свойства
Слабыекислоты
Кислотные свойства
Ka(I)
H2CO3 4,5·10
H2SiO3 10
-10
H2GeO3
H2SnO3
Амфотерные
гидроксиды с
преобладанием
кислотных
свойств
-7
Радиус атома увеличивается, длина
связи Э-О увеличивается,
облегчается ее разрыв,
увеличиваются основные,
уменьшаются кислотные свойства
57. Кислотные свойства
• CO2 активен в реакциях из-за молекулярного строения,SiO2 (а также GeO2) – мало активны из-за атомной
кристаллической решетки.
легко реагирует с
• СO2 + NaOH = NaHCO3
растворами щелочей
• СO2 + 2NaOH = Na2CO3 + H2O
• SiO2 + 2NaOH = Na2SiO3 + H2O
• Гидросиликатов не существует.
• GeO2 + 2NaOH = Na2GeO3 + H2O
• SnO2 + 2NaOH = Na2SnO3 + H2O
(PbO2)
• SnO2 + 2NaOH + 2H2O = Na2[Sn(OH)6]
при сплавлении или
медленно с
концентрированным
раствором щелочи
при нагревании
58.
59.
Кислотные свойства60. Специфические свойства SiO2
1) реагирует с плавиковой кислотой (растворяется):SiO2 + 4HF = SiF4 + 2H2O
SiF4 + 2HF = H2[SiF6]
______________________________________________________________________________________________________________
SiO2 + 6HF = H2[SiF6] + 2H2O
2) реагирует с карбонатами металлов (t > 1000oC)
SiO2 + Na2CO3 = Na2SiO3 + CO2
Реакция с карбонатами используется для производства
стекла, цемента.
61.
62. Основные свойства
е
63. Кислотно-основные свойства гидроксидов
• В ряду оксид – гидроксид возрастает химическаяактивность:
ЭO2
H2ЭO3
H4ЭO4
уменьшается энергия связи Э-O, увеличивается химическая активность
H2SiO3 легко растворяется в растворах щелочей в
отличие от SiO2:
H2SiO3 + 2NaOH = Na2SiO3 + 2H2O
H4GeO4 и H4SnO4 растворяются в растворах кислот и
щелочей в отличие от GeO2 и SnO2.
64. Окислительные свойства
• +4 – максимальная с.о., поэтому соединения Э(+4)могут быть только окислителями.
Э
φ, B
CO2/C
+0,48
H2SiO3/Si
-0,79
H2GeO3/Ge
-0,13
Sn4+/Sn2+
+0,15
От углерода к свинцу уменьшается
устойчивость максимальной степени
окисления, увеличиваются
окислительные свойства, φ↑.
Единственное исключение – углерод.
Для него относительно устойчива с.о.
= 0, поэтому окислительные свойства
выше, чем у кремния. CO2 –
мягкий окислитель. Для Pb с.о.
+4 – самая неустойчивая, поэтому
PbO2/Pb2+
+1,45
PbO2 проявляет сильные
окислительные свойства.
65. Окислительные свойства
66. Окислительные свойства PbO2
• φPbO2/PbSO4 = 1,69 В. В сернокислой средеокислительные свойства диоксида свинца сильнее, чем
у перманганата.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
Mn2+ + 4H2O – 5e = MnO4- + 8H+
ǀ2
φ = -1,51 В
PbO2 + 4H+ + SO42- + 2e = PbSO4 + 2H2O ǀ5
φ = +1,69 В
Е = +0,18 В
2Mn2+ + 5PbO2 + 4H+ + 5SO42- = 2MnO4- + 5PbSO4 + 2H2O
PbO2 – реактив на Mn2+. Бесцветный раствор соли
марганца (II) приобретает малиновую окраску при
добавлении серной кислоты и диоксида свинца.
67. Окислительные свойства PbO2
• PbO2 + 4HCl (конц) = PbCl2 + Cl2 + 2H2O• Pb3O4 – свинцовый сурик - cмешанный оксид
свинца (II) и (IV): 2PbO·PbO2. За счет Pb+4 –
сильный окислитель.
• Pb3O4 + 8HCl (конц) = 3PbCl2 + Cl2 + 4H2O
• Pb3O4 + 4HNO3 = 2Pb(NO3)2 + PbO2 + 2H2O
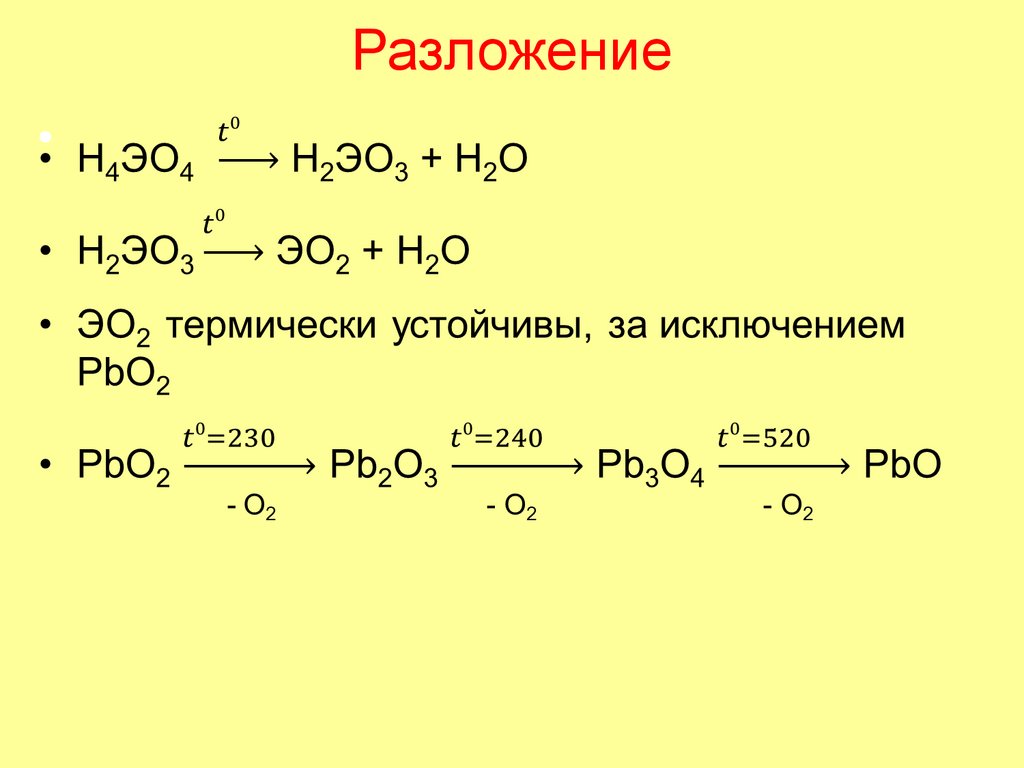
68. Разложение
69.
Способы получения CO2 и SiO2• В лаборатории
• CaCO3 + 2HCl → CaCl2 + H2O + CO2
• В промышленности – при прокаливании известняка t > 1000o
• CaCO3 → CaO + CO2
• SiO2 в больших количествах содержится в природе; имеет
значение реакция получения силикагеля - мелкодисперсного
SiO2, используемого как адсорбент и катализатор (to):
70. Получение оксидов олова и германия
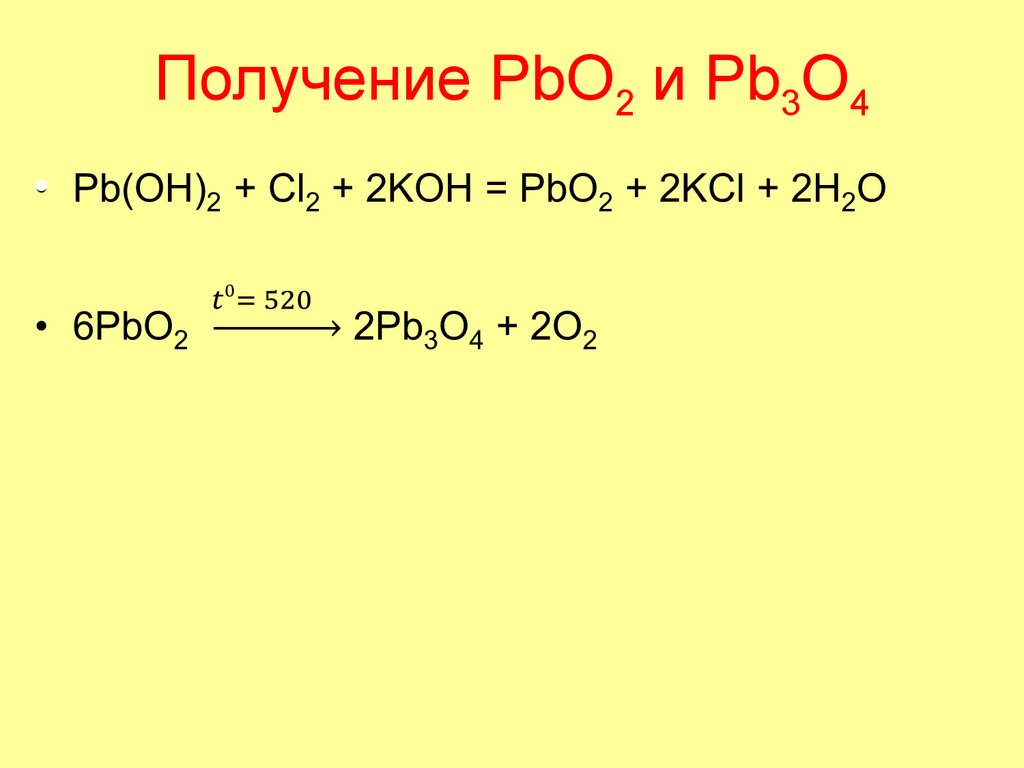
71. Получение PbO2 и Pb3O4
72. Карбонаты, гидрокарбонаты и силикаты
• Твердые вещества ионного строения, соли.Большинство карбонатов и силикатов нерастворимо,
за исключением солей ЩМ. Гидрокарбонаты
растворимы. Гидросиликатов не существует!
• Растворимые карбонаты, гидрокарбонаты и силикаты
гидролизуются по аниону, т.к. образованы слабыми
кислотами, их растворы имеют щелочную среду:
73. Химические свойства карбонатов, гидрокарбонатов и силикатов
1. Термическая устойчивостьКарбонаты (все, кроме карбонатов щелочных металлов,
начиная с Na) разлагаются при нагревании:
• CaCO3 → CaO + CO2
• Гидрокарбонаты при нагревании переходят в карбонаты:
• 2NaHCO3 → Na2CO3 + CO2 + H2O
• Силикаты термически устойчивы (не разлагаются до
плавления)
2. Вступают в реакции обмена с солями, кислотами и
щелочами (общие свойства солей)
74. Химические свойства карбонатов, гидрокарбонатов и силикатов
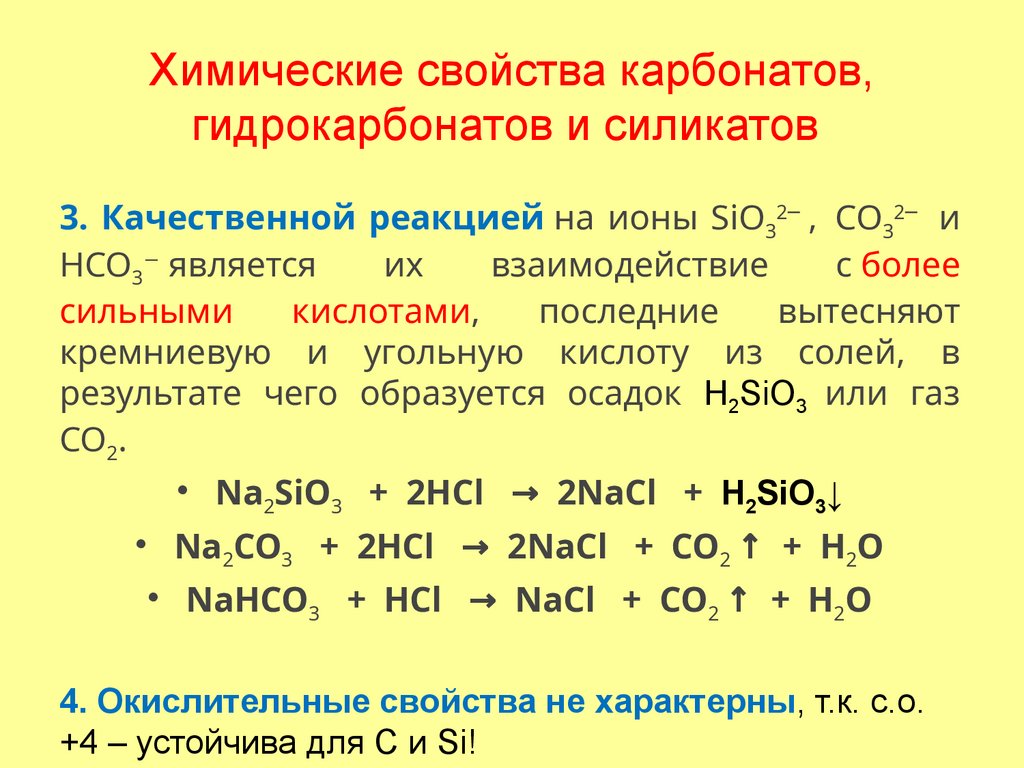
3. Качественной реакцией на ионы SiО32─ , СО32─ иНСО3− является
их
взаимодействие
с более
сильными
кислотами,
последние
вытесняют
кремниевую и угольную кислоту из солей, в
результате чего образуется осадок H2SiO3 или газ
СО2.
• Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
• Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
• NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
4. Окислительные свойства не характерны, т.к. с.о.
+4 – устойчива для С и Si!
75.
Na2SiO3 – жидкое стекло.Для силикатов характерно стеклообразование.
76.
С.о. Н = -1, силаны - гидридыСилан –бесцветный
ядовитый газ с
неприятным запахом
77.
• SiH4 разлагается водой, как и все гидриды(конпропорционируют):
• SiH4 + 3H2O = H2SiO3 + 4H2
• SiH4 + 2NaOH + 2H2O = Na2SiO3 + 4H2
H-
H0
H+
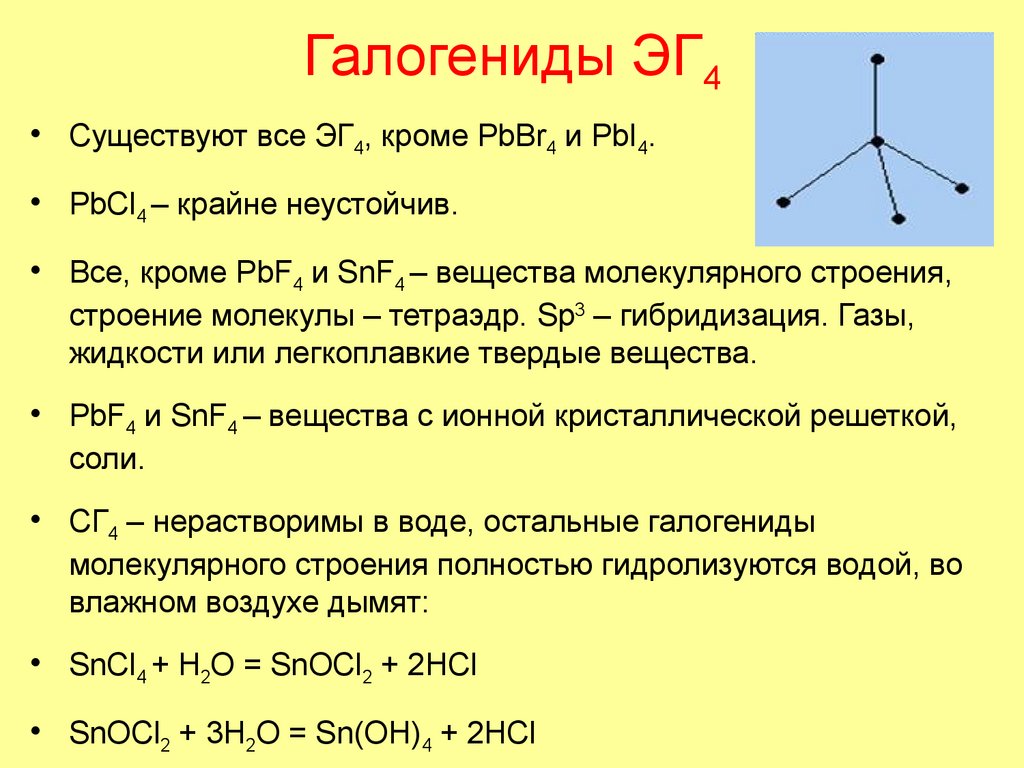
78. Галогениды ЭГ4
• Существуют все ЭГ4, кроме PbBr4 и PbI4.• PbCl4 – крайне неустойчив.
• Все, кроме PbF4 и SnF4 – вещества молекулярного строения,
строение молекулы – тетраэдр. Sp3 – гибридизация. Газы,
жидкости или легкоплавкие твердые вещества.
• PbF4 и SnF4 – вещества c ионной кристаллической решеткой,
соли.
• СГ4 – нерастворимы в воде, остальные галогениды
молекулярного строения полностью гидролизуются водой, во
влажном воздухе дымят:
• SnCl4 + H2O = SnOCl2 + 2HCl
• SnOCl2 + 3H2O = Sn(OH)4 + 2HCl
79.
Кислотные свойства• Гидролизуются с образованием кислот:
SiCl4 + 3H2O = H2SiO3 + 4HCl
• Реагируют с растворами щелочей:
SiCl4 + 6NaOH = Na2SiO3 + 4NaCl + 3H2O
Реагируют с основными галогенидами:
SiF4 + 2NaF = Na2[SiF6]
80. Получение ЭГ4
81. Сульфиды ЭS2
• Существуют все ЭS2, кроме PbS2• CS2 имеет молекулярное строение:
S=C=S молекула линейна, неполярна.
CS2 – бесцветная легкокипящая жидкость с эфирным
запахом, нерастворима в воде, сильно преломляет свет,
является хорошим неполярным растворителем
(растворяет неполярные вещества: серу, фосфор, жиры).
СS2
Увеличивается полярность химической связи,
SiS2
увеличивается доля ионности, молекулярное
GeS2
строение сменяется полимерным (SiS2) и
SnS2
координационным (GeS2, SnS2).
SiS2 – бесцветные кристаллы, разлагаются водой, GeS2 и SnS2 –
соответственно бесцветные и желтые кристаллы,
82. Химические свойства ЭS2
83. Получение ЭS2
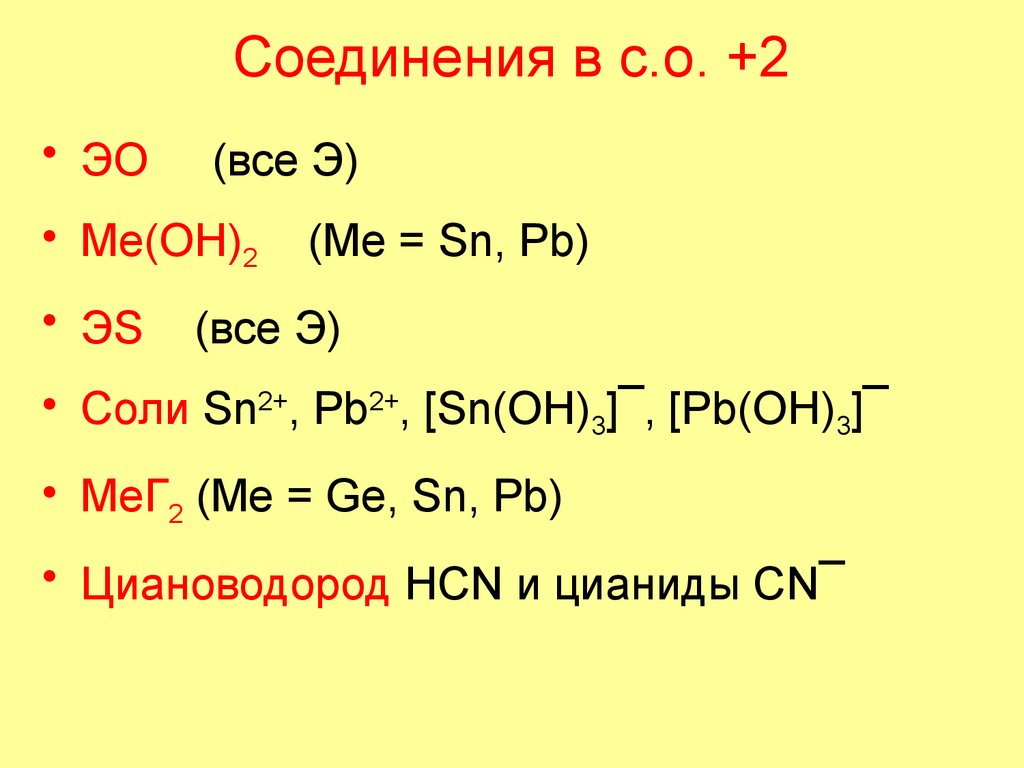
84. Соединения в с.о. +2
• ЭО(все Э)
• Me(OH)2
• ЭS
(Me = Sn, Pb)
(все Э)
• Cоли Sn2+, Pb2+, [Sn(OH)3]¯, [Pb(OH)3]¯
• MeГ2 (Me = Ge, Sn, Pb)
• Циановодород НСN и цианиды СN¯
85. Оксиды ЭО Строение и физические свойства
• СО – угарный газ, бесцветный газ,малорастворимый в воде, ядовит.
• Остальные ЭO – твердые вещества
координационного строения: SiО - коричневый, GeO
и SnO – черные, PbO – две модификации (желтая и
красная).
86. Химические свойства оксидов
• Снесолеобразующие
амфотерные с
преобладанием
основных свойств
белые
осадки
СO формально соответствует
муравьиная кислота HCOOH:
CO + NaOH = HCOONa
HCOONa + HCl = HCOOH + NaCl
87. Окислительно-восстановительные свойства
• + 2 – промежуточная с.о., поэтому соединения в с.о. +2 могутбыть и окислителями, и восстановителями.
• Восстановительные свойства
Для С, Si, Ge с.о. +4 самая устойчивая, поэтому CO, SiO, GeO –
сильные восстановители. Для Sn с.о. +2 и +4 одинаково устойчивы,
поэтому Sn(+2) – мягкий восстановитель. Для Pb c.о. +2 – устойчива,
то Pb(+2) – cлабый восстановитель:
2ЭO + O2 = 2ЭO2 (Э = С, Si, Ge, Sn)
PbO + O2 ≠
CO как восстановитель применяется в металлургии для
восстановления металлов из оксидов:
Fe2O3 + 3CO = 2Fe + 3CO2
CO легко окисляется разными окислителями:
CO + Сl2 = COСl2
фосген – ядовитый газ
CO + S = COS
ядовитый газ
88. Окислительные свойства
• ДДиамагнитны.
89.
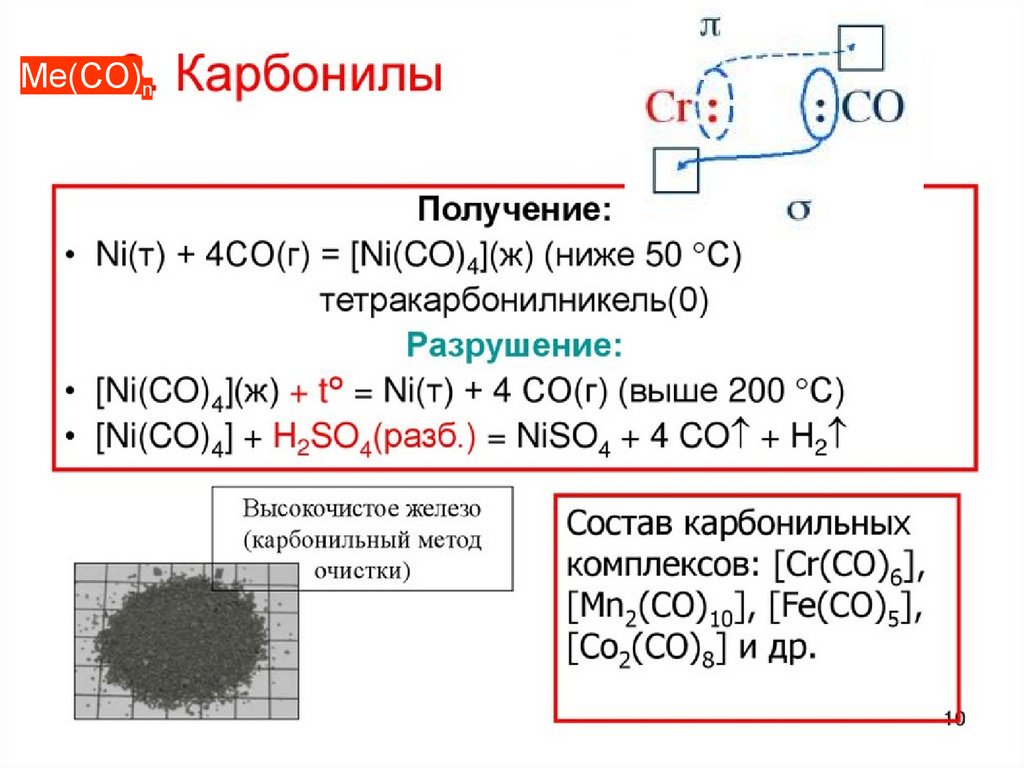
Me(CO)n90. Sn2+, Pb2+ - комплексообразователи
• Образуют гидроксокомплексы и хлоридные комплексы c к.ч.3Хлоридные комплексы: [PbCl3]¯ и [SnCl3]¯ Kуст = 102
Малоустойчивые комплексы, поэтому сущестуют в
концентрированных средах (в среде HCl конц).
PbO + 3НСl = H[PbCl3] + H2O
• Гидроксокомплексы
[Pb(OH)3]¯ Kуст = 1014
[Sn(OH)3]¯ Kуст = 1025
PbO + KOH + H2O = K[Pb(OH)3]
91. Получение оксидов
Получение оксидов
92. Получение гидроксидов олова и свинца (II)
• Осаждением из водных растворовщелочами:
• Pb(NO3)2 + 2KOH = Pb(OH)2 + 2KNO3
• SnCl2 + 2KOH = Sn(OH)2 + 2KNO3
93. Cульфиды MeS (Me – Ge, Sn, Pb)
• MeS – твердые нерастворимые вещества (ПР < 10-20),нерастворимы в минеральных кислотах
• GeS и SnS – бурый, PbS – черный.
• Сильные восстановители – за счет S2- (GeS и SnS - еще и за счет
Ge2+ и Sn2+).
GeS и SnS можно растворить в растворе полисульфида натрия за
счет ОВР:
Sn+2S + Na2S-2 = Na2Sn+4S3
тиостаннат натрия
Sn+2 - 2е → Sn+4 ǀ 1
S- + e → S-2
ǀ2
Pb+2S - слабый восстановитель, не окисляется полисульфидом
натрия.
Обжиг сульфидов: GeS + 3O2 = GeO2 + 2SO2
SnS
2PbS + 3O2 = 2PbO + 2SO2
94.
C+2запах горького миндаля
95. Дициан
C+3Дициан
Бесцветный ядовитый газ,
«псевдогалоген»
Подобно галогенам, диспропорционирует в растворах
щелочей:
(С+3N)2 + 2KOH = KC+2N + KC+4NO + H2O
Горит фиолетовым пламенем:
(CN)2 + 2O2 = 2CO2 + N2
96.
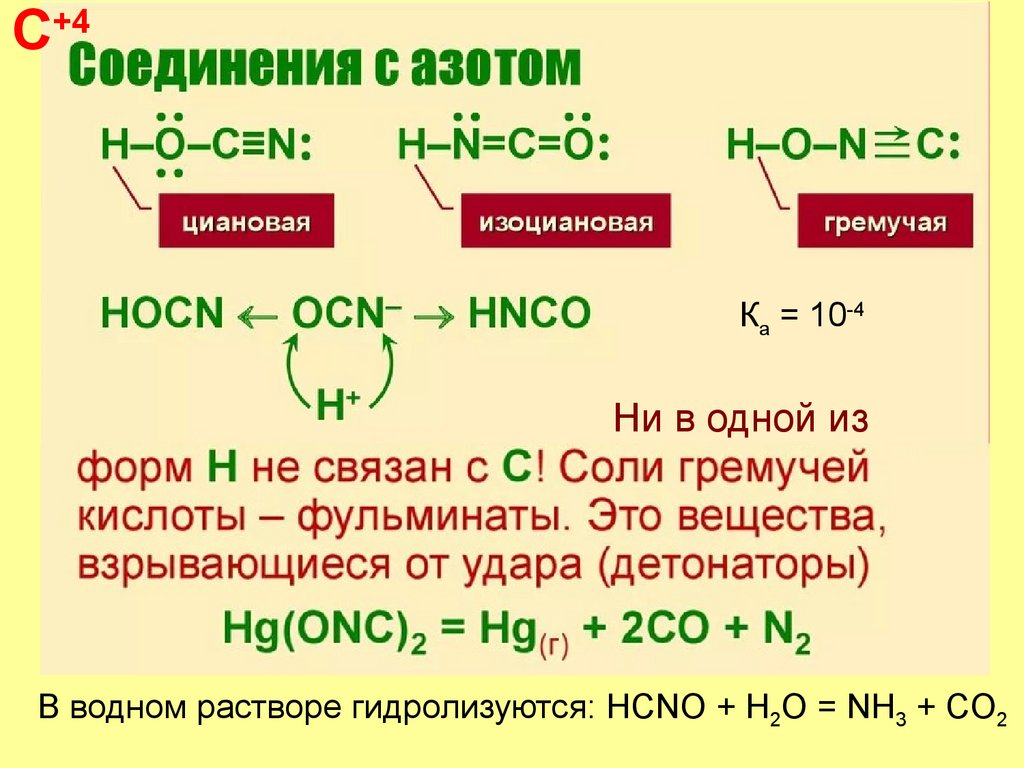
C+4Кa = 10-4
Ни в одной из
В водном растворе гидролизуются: HCNO + H2O = NH3 + CO2
97. Получение углерод-азотных соединений
2NaCN + H2SO4 = Na2SO4 + 2HCN98. Применение углерода
Графит используется в карандашной промышленности. Также его используют вкачестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал.
Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого,
ограненные алмазы — бриллианты используются в качестве драгоценных камней
в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам
и стечению исторических обстоятельств, бриллиант неизменно является самым
дорогим драгоценным камнем.
В фармакологии и медицине широко используются различные соединения
углерода — производные угольной кислоты и карбоновых кислот.
Карболен (активированный уголь), применяется для абсорбции и выведения из
организма различных токсинов.
99. Применение кремния
Кремний находит применение в полупроводниковой техникеи микроэлектронике, в металлургии в качестве добавки к
сталям и в производстве сплавов.
Стив Джобс
демонстрирует
кремниевую
пластину, на
которой «сидят»
десятки
процессоров G5.






































































 Химия
Химия