Похожие презентации:
Классификация неорганических веществ
1. Классификация неорганических веществ
2. Классификация веществ
ВеществаЧистые
вещества
Химические
элементы
Смеси
веществ
Химические
соединения
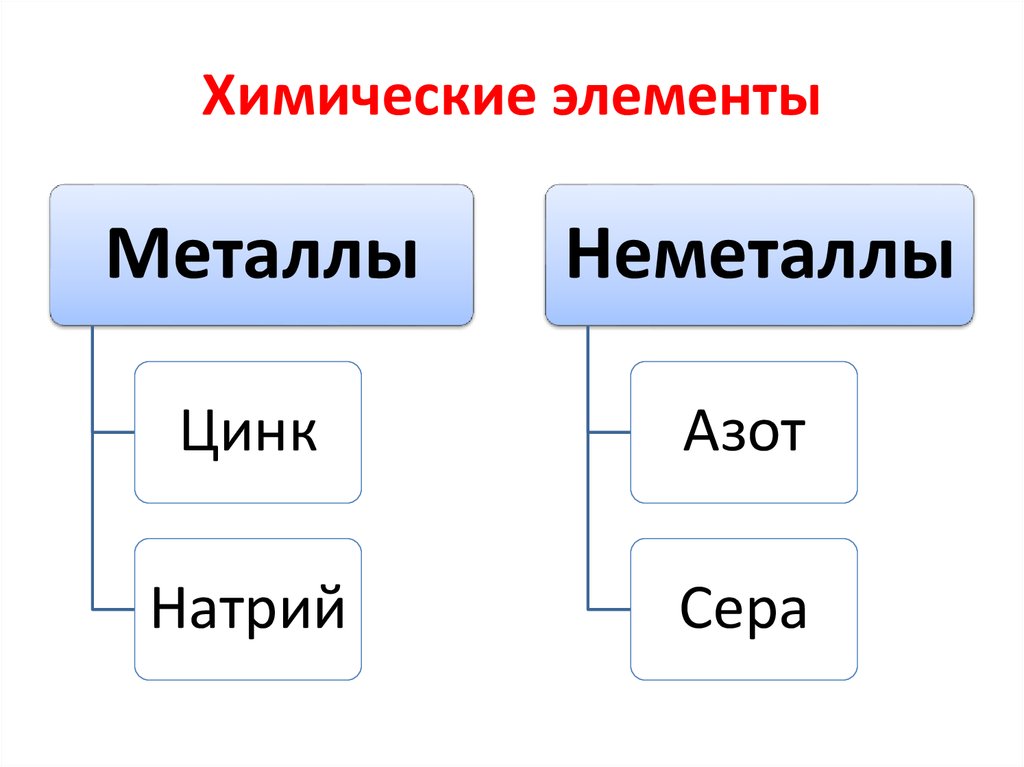
3. Химические элементы
МеталлыНеметаллы
Цинк
Азот
Натрий
Сера
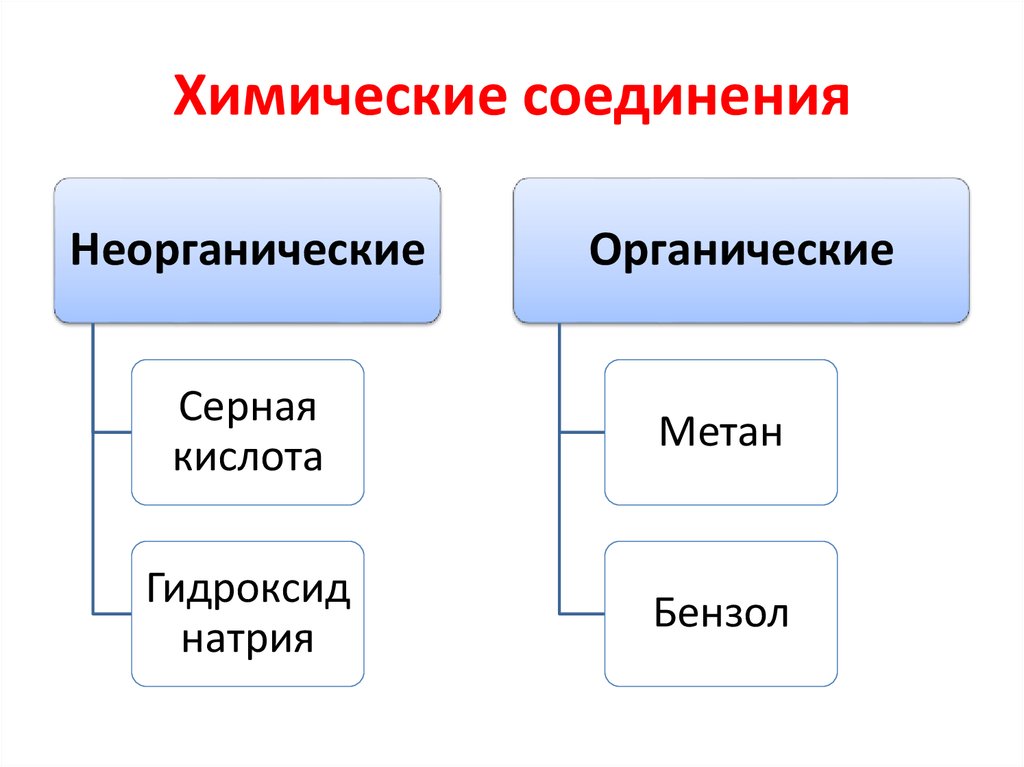
4. Химические соединения
НеорганическиеОрганические
Серная
кислота
Метан
Гидроксид
натрия
Бензол
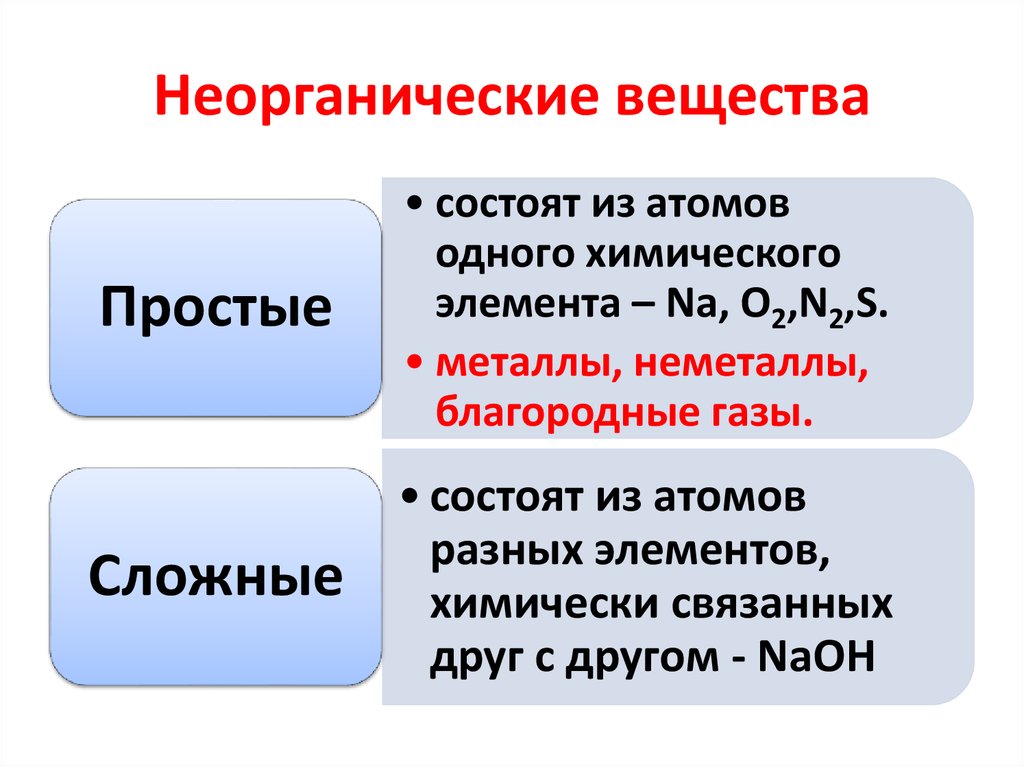
5. Неорганические вещества
Простые• состоят из атомов
одного химического
элемента – Na, O2,N2,S.
• металлы, неметаллы,
благородные газы.
Сложные
• состоят из атомов
разных элементов,
химически связанных
друг с другом - NaOH
6. Классификация простых веществ
• Все простые вещества наосновании строения атомов,
вида химической связи, типа
кристаллических решеток,
физических и химических
свойств делятся на металлы и
неметаллы.
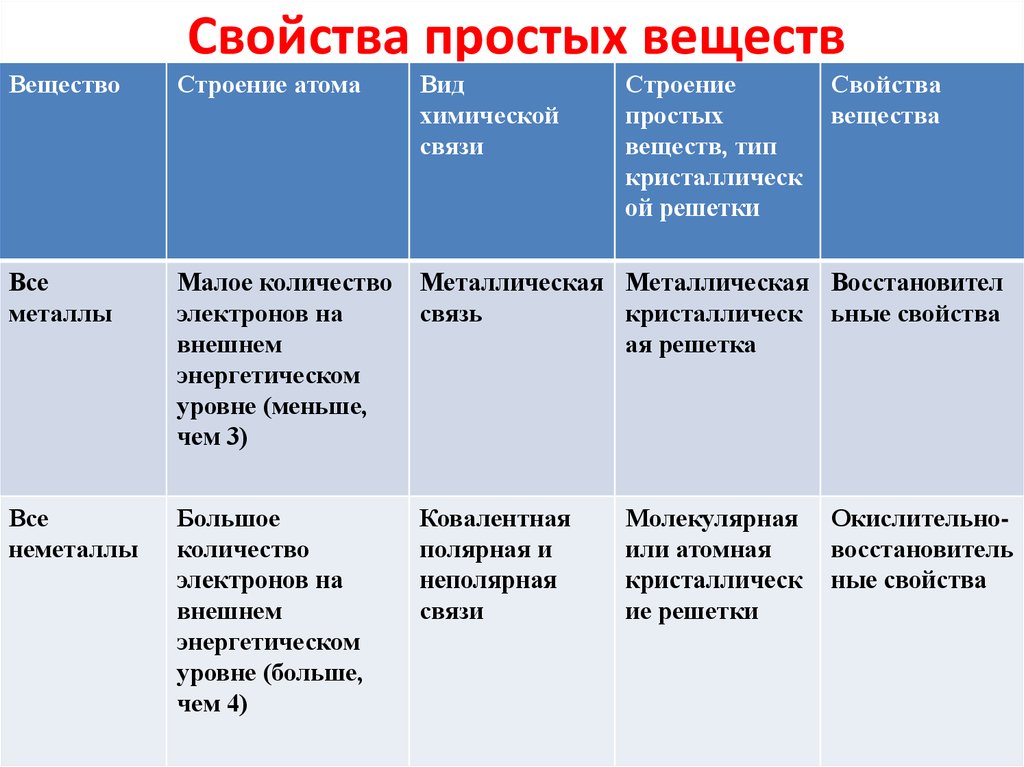
7. Свойства простых веществ
ВеществоСтроение атома
Вид
химической
связи
Строение
простых
веществ, тип
кристаллическ
ой решетки
Все
металлы
Малое количество
электронов на
внешнем
энергетическом
уровне (меньше,
чем 3)
Металлическая Металлическая Восстановител
связь
кристаллическ ьные свойства
ая решетка
Все
неметаллы
Большое
количество
электронов на
внешнем
энергетическом
уровне (больше,
чем 4)
Ковалентная
полярная и
неполярная
связи
Молекулярная
или атомная
кристаллическ
ие решетки
Свойства
вещества
Окислительновосстановитель
ные свойства
8. Свойства простых веществ
ВеществоСтроение атома
Вид
Строение
Свойства
химической простых веществ, вещества
связи
тип
кристаллической
решетки
Благородные Внешний
Нет связей
газы
энергетический между
уровень
атомами
завершен, (октет
электронов или
2 у Не)
Молекулярная
кристаллическая
решетка
Инертны
9.
10.
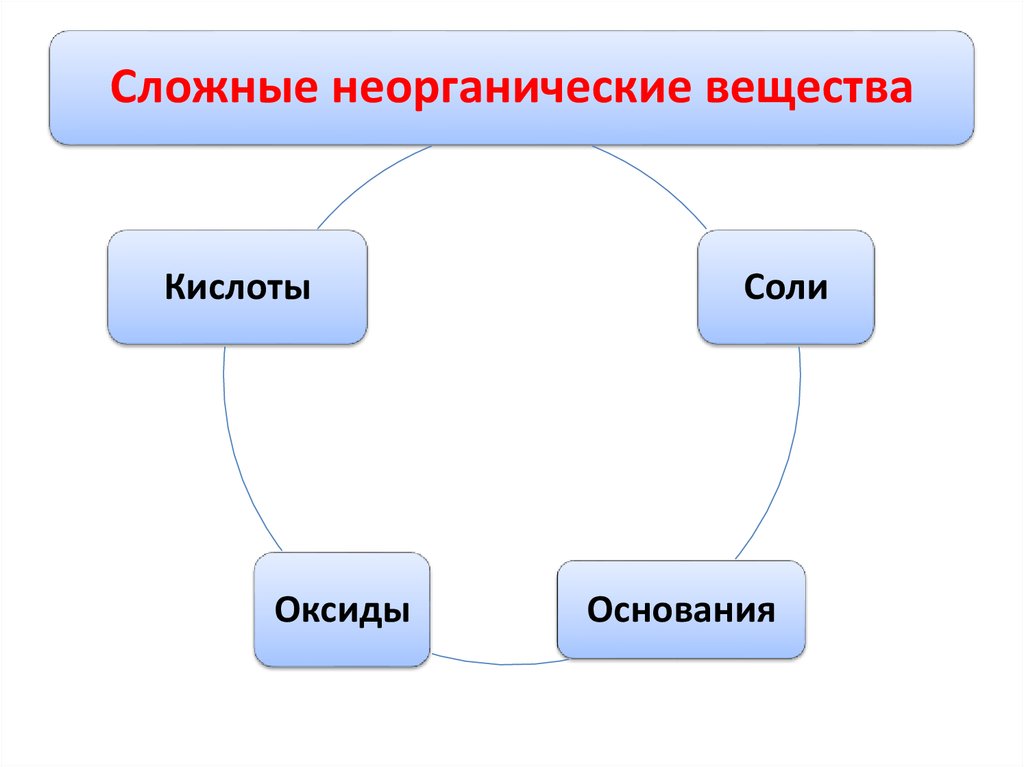
Сложные неорганические веществаКислоты
Оксиды
Соли
Основания
11. Оксиды - ЭмOn
• Это сложные вещества,состоящие из двух
химических элементов,
один из которых – кислород
в степени окисления 2.
12.
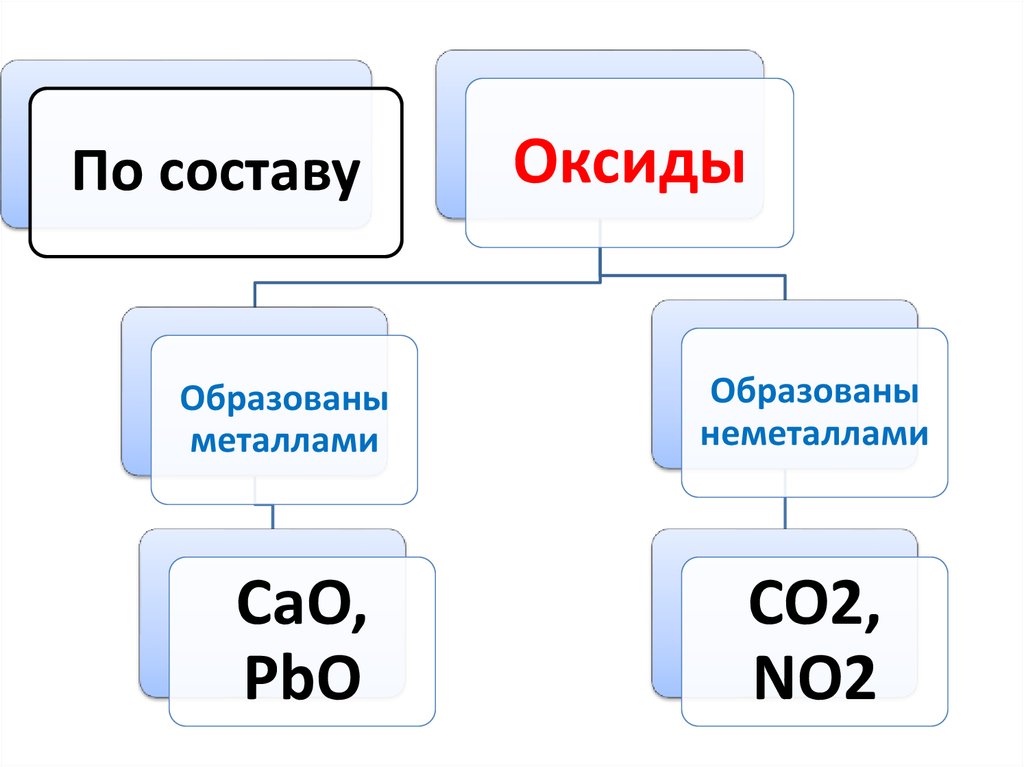
По составуОбразованы
металлами
CaO,
PbO
Оксиды
Образованы
неметаллами
CO2,
NO2
13.
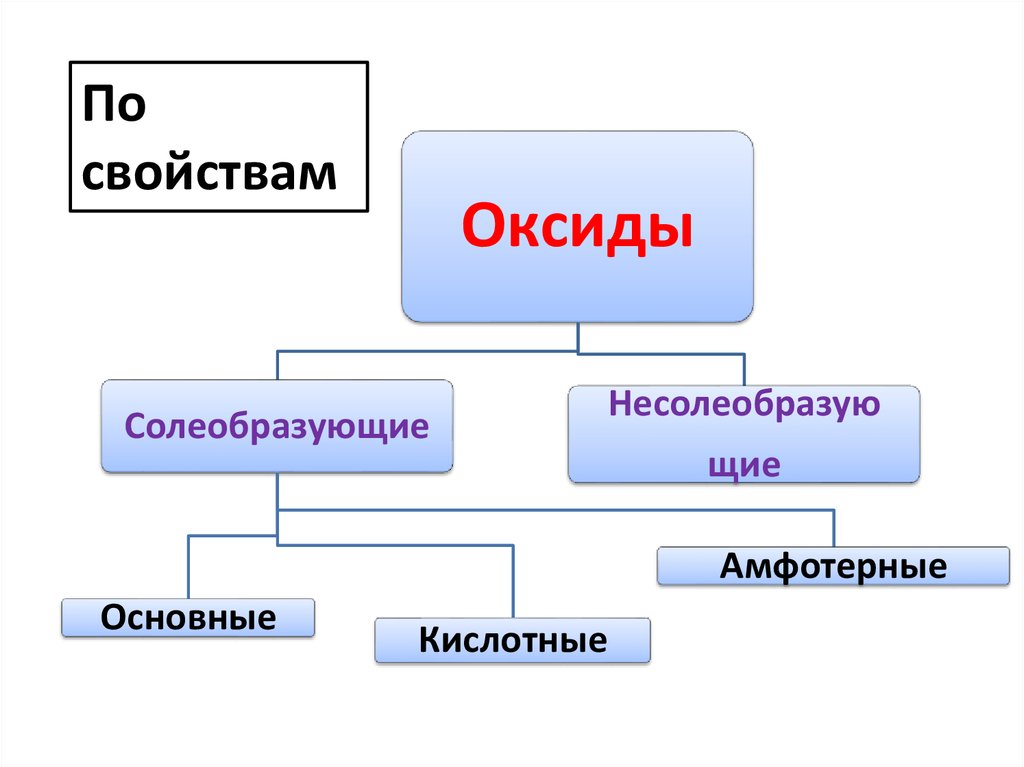
Посвойствам
Оксиды
Солеобразующие
Несолеобразую
щие
Амфотерные
Основные
Кислотные
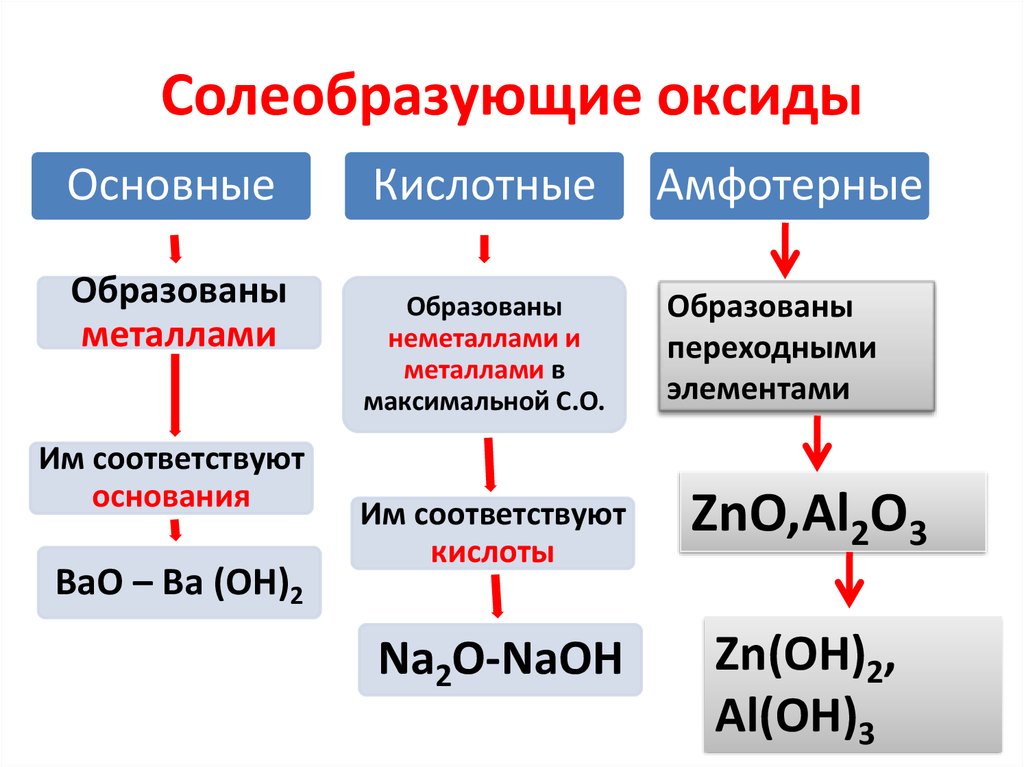
14. Солеобразующие оксиды
ОсновныеОбразованы
металлами
Им соответствуют
основания
BaO – Ba (OH)2
Кислотные
Образованы
неметаллами и
металлами в
максимальной С.О.
Амфотерные
Образованы
переходными
элементами
Им соответствуют
кислоты
ZnO,Al2O3
Na2O-NaOH
Zn(OH)2,
Al(OH)3
15. Несколько степеней окисления
• В названии оксида обязательно указываетсяС.О., если образующий элемент имеет
несколько С.О.
+4-2
SO2 – оксид серы (IV)
+6-2
SO3 – оксид серы (VI)
16. Несолеобразующие оксиды (безразличные)
СО – оксид углерода (II)NO - оксид азота (II)
N2O - оксид азота (I)
17. Химическая связь и кристаллические решетки у оксидов
Оксиды, образованные:1) металлами, имеют ионную связь,
2) переходными металлами- ковалентную
полярную ,
Кристаллические решетки могут быть ионными и
атомными: BaO - ионная К.Р. Al2O3 – атомная К.Р.
Минералы: корунд, сапфир, рубин.
3) неметаллами, имеют, ковалентную полярную
связь, молекулярные (СО2, «сухой лед»), атомные
(SiO2,(кварц, горный хрусталь, агат и т.д.)) К.Р.
18. Демонстрация коллекций минералов и горных пород
Кварц (SiO2)
Корунд (Al2O3)
Асбест (СаО . 3МgО . 4SiO2)
Тальк (3 MgO . 4SiO2.H2O)
Глина белая, красная; в состав входят
оксиды: Al2O3. nH2O – белая; ,боксит Fe2O3
входит в состав красной глины.
• Руды железа: Fe2O3 – красный железняк,
Fe3O4 – магнитный железняк.
19. В состав воздуха входят (оксиды):
• Оксид углерода (IV) - СО2• Вода - H2O
• Вредные примеси, СО – угарный
газ, который образуется при
неполном сжигании топлива.
20. Применение оксидов
• H2O – важнейший минерал Земли участвует вкруговороте веществ.
• SiO2 - оксид кремния, входит в состав
большинства минералов, встречающихся в
природе: кремнезем, тальк, асбест, яшма,
горный хрусталь, полевой шпат.
• Fe2O3, Fe3O4 – руды для производства чугуна и
стали.
• СО2 – углекислый газ, круговорот веществ в
природе, фотосинтез.
21. Основания- М+у(ОН)у
Основания-+у
М (ОН)у
• где у – число гидроксогрупп,
равное степени окисления металла
М+у
• Основания- это сложные
вещества, состоящие из атомов
металла и одной или несколько
гидроксогрупп (-ОН)
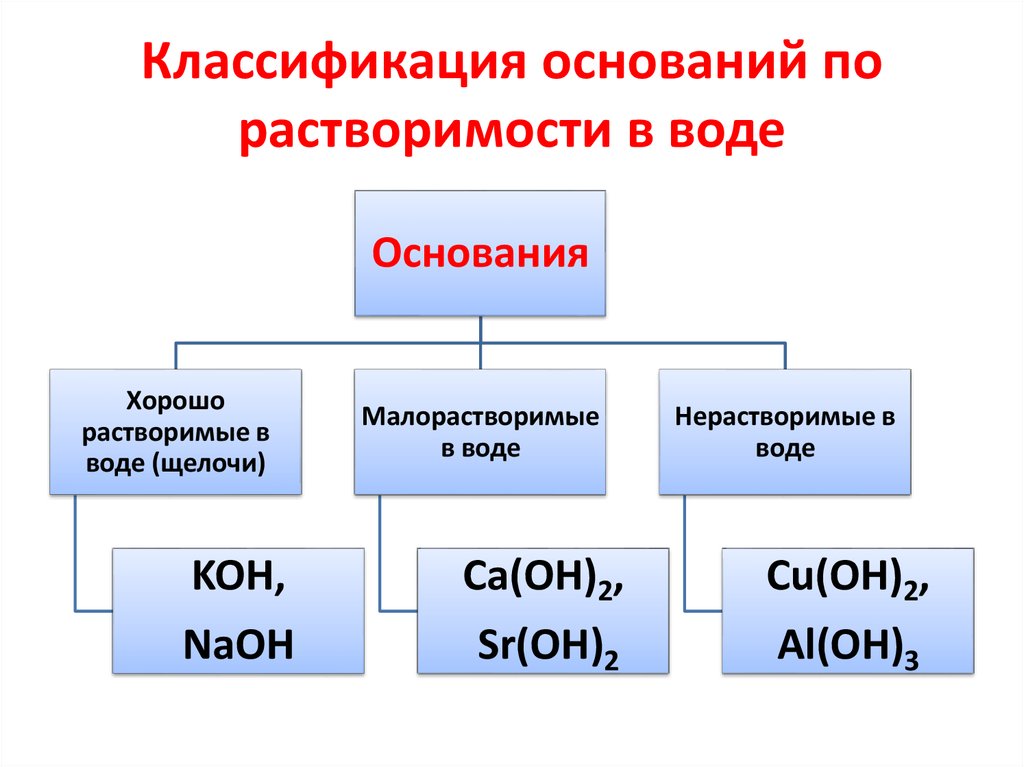
22. Классификация оснований по растворимости в воде
ОснованияХорошо
растворимые в
воде (щелочи)
Малорастворимые
в воде
Нерастворимые в
воде
KOH,
Ca(OH)2,
Cu(OH)2,
NaOH
Sr(OH)2
Al(OH)3
23. Химическая связь и кристаллические решетки у оснований
• Основания имеют ионную связьмежду металлом и
гидроксогруппой, в
гидроксогруппе- ковалентная
полярная связь.
• Кристаллическая решетка –
ионная, твердая.
24. Амфотерные основания- это сложные вещества, которые проявляют и свойства кислот, и свойства оснований.
• нерастворимы в воде, им соответствуютамфотерные оксиды со С.О. +2, +3, +4
• ZnO - Zn(OH)2 ↔ Н2ZnО2
• Al2O3 - Al(OH)3 ↔ Н3AlО3
• GeO2 – Ge(OH)4 ↔ Н4GeO4
• Для них возможны ковалентные
полярные связи и молекулярные
кристаллические решетки.
25. Применение оснований
• NaOH- гидроксид натрия, «едкий натр»;очистка нефтепродуктов, отбеливание
бумаги, производство мыла, осушка газов в
органическом синтезе.
• Ca(OH)2 – гидроксид кальция, каменная
известь; в смеси с песком- известковый
раствор, побелка; производство сахарозы.
• NH3.H2O (NH4OH)- гидрат аммиака (гидроксид
аммония), нашатырный спирт – медицина,
аммиачная вода- жидкое азотное удобрение.
26. Применение оснований
• Al(OH)3- гидроксид алюминия, медицина –алмагель, препарат, обладающий
обволакивающим адсорбирующим
действием.
• AlCl3+3 NH4OH= Al(OH)3↓+3NH4Cl – получение
в лаборатории
• Fe(OH)3- гидроксид железа (III)- компонент
желтого пигмента красок и эмалей,
поглотительная масса для очистки
природного газа; катализатор в органическом
синтезе.
27. Кислоты- НхАс
• где Ас – кислотный остаток (от англ. acid-кислота), х- число атомовводорода, равное заряду иона
кислотного остатка.
• Кислоты- это сложные вещества,
состоящие из атомов водорода,
способных замещаться на атомы
металла, и кислотных остатков.
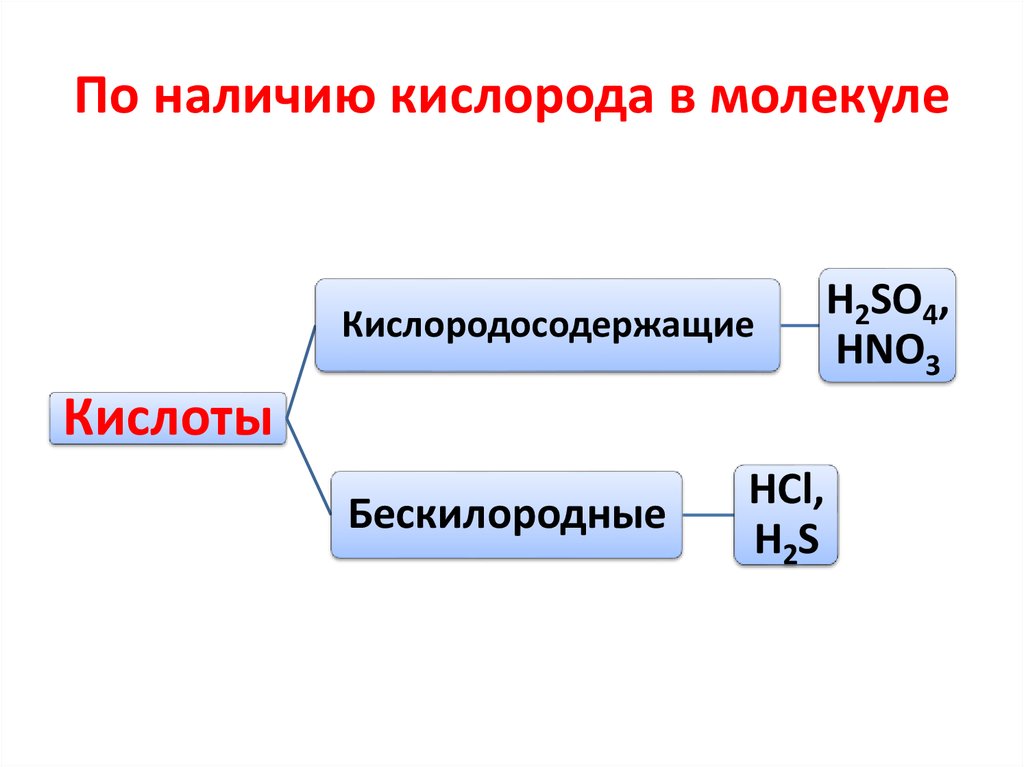
28. По наличию кислорода в молекуле
КислородосодержащиеКислоты
Бескилородные
HCl,
H2S
H2SO4,
HNO3
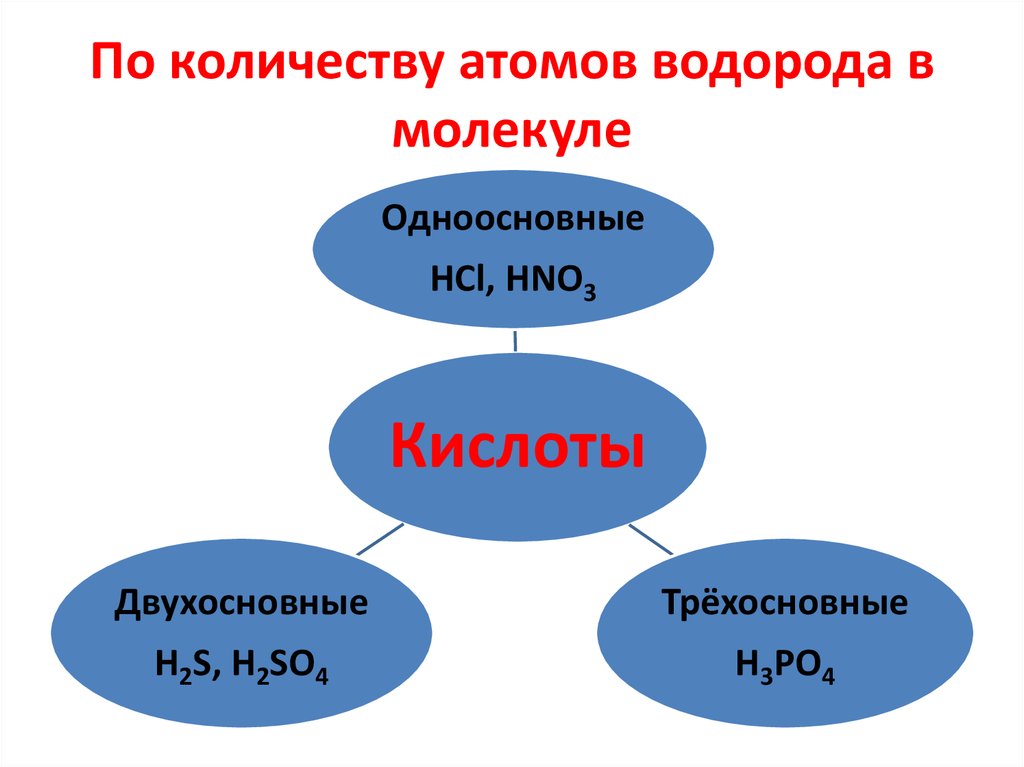
29. По количеству атомов водорода в молекуле
ОдноосновныеHCl, HNO3
Кислоты
Двухосновные
Трёхосновные
H2S, H2SO4
Н3РО4
30. Химическая связь и кристаллические решетки у кислот
• Химическая связь междуатомами в кислотах
ковалентная полярная.
• Строение веществ –
молекулярное.
31. Использование кислот
• H2SO4 – серная кислота; производствоминеральных удобрений, солей
бескислородных кислот; очистка
нефтепродуктов, поверхностей металлов;
органический синтез; производство волокон,
краски, лаков, лекарственных препаратов;
взрывотехника; заливка аккумуляторов.
• HNO3- азотная кислота; производство азотных
удобрений, лекарственных препаратов;
органический синтез; окислитель ракетного
топлива.
32. Использование кислот
• Н3РО4 – фосфорная кислота;производство удобрений;
• HCl – соляная кислота; травление
металлов, производство солей,
пищевая промышленность,
медицина, органический синтез.
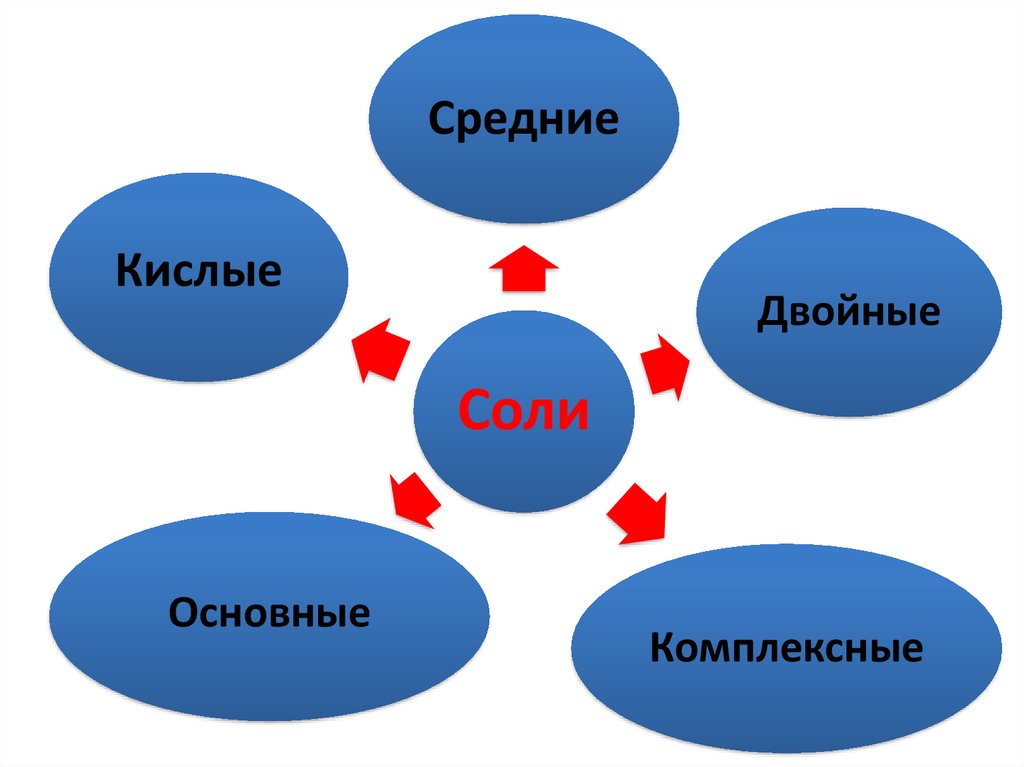
33. Соли
• это сложные вещества,состоящие из катионов
металла ( иона аммония) и
анионов кислотных
остатков.
34.
СредниеКислые
Двойные
Соли
Основные
Комплексные
35. Средние соли
• это продукты полного замещения атомовводорода в молекуле кислоты атомами
металла (иона аммония) или полного
замещения гидросогрупп в молекуле
основания кислотными остатками.
Н3РО4 → Na3PO4
Ba(OH)2- BaCl2
(NH4)3PO4
36. Кислые соли
• это продукты неполного замещенияатомов водорода в молекулах
многоосновных кислот атомами металла
(иона аммония).
Н3РО4 → NaH2PO4
Na2HPO4
37. Основные соли
• это продукты неполногозамещения гидроксогрупп в
многокислотных основаниях
кислотными остатками.
• Fe(OH)3 → (FeOH)Cl2
Fe(OH)2Cl
38. Двойные и комплексные соли
отличаются друг от друга характером
диссоциации в водных растворах.
Двойные соли диссоциируют в одну
ступень на катионы металлов и анионы
кислотных остатков.
KAl(SO4)2↔K+ +Al3+ + 2 SO42Комплексные соли при диссоциации
образуют сложные комплексные ионы,
которые устойчивы в водных растворах.
[Cu(NH3)4]SO4↔ [Cu(NH3)4]2+ + SO4 2-
39. Координационная теория А.Вернера
• Комплексные (координационные) соединенияпостроены так: в центре находится атом или ионкомплексообразователь (им может быть металл, в
основном d-элементы- имеющие свободные
орбитали, а также элемент, имеющий
неподеленные пары), а вокруг него – атомы,
молекулы или ионы (лиганды), образовавшие с
ним в основном ковалентные связи по донорноакцепторному механизму.
• Лигандами могут быть анионы кислот, некоторые
молекулы небольшого размера (H2O, NH3,
CO)имеющие атомы с неподелёнными
электронными парами.
40. Координационная теория А.Вернера
• Общее число лигандов, непосредственносвязанных с центральным атомом,
называется координационным числом.
• Ион- комплексообразователь и лиганды
составляют внутреннюю сферу комплексного
соединения, которую записывают в
квадратные скобки.
• Число лиганд соответствуют
координационному числу ионакомплексообразователя.
• [Cu(NH3)4]SO4
41. Координационная теория А.Вернера
Наиболее характерны:
Кч=2 (Cu+, Ag+, Au+)
Кч=4 (Cu2+, Au3+,Zn2+,Pb2+,Pt2+,Al3+)
Кч=6 (Fe2+, Fe3+, Ni2+, Al3+, Pt4+,Cr3+)
Заряд внутренней сферы равен сумме
зарядов иона- комплексообразователя и
лиганд.
• Ионы, не вошедшие во внутреннюю сферу,
образуют внешнюю сферу.
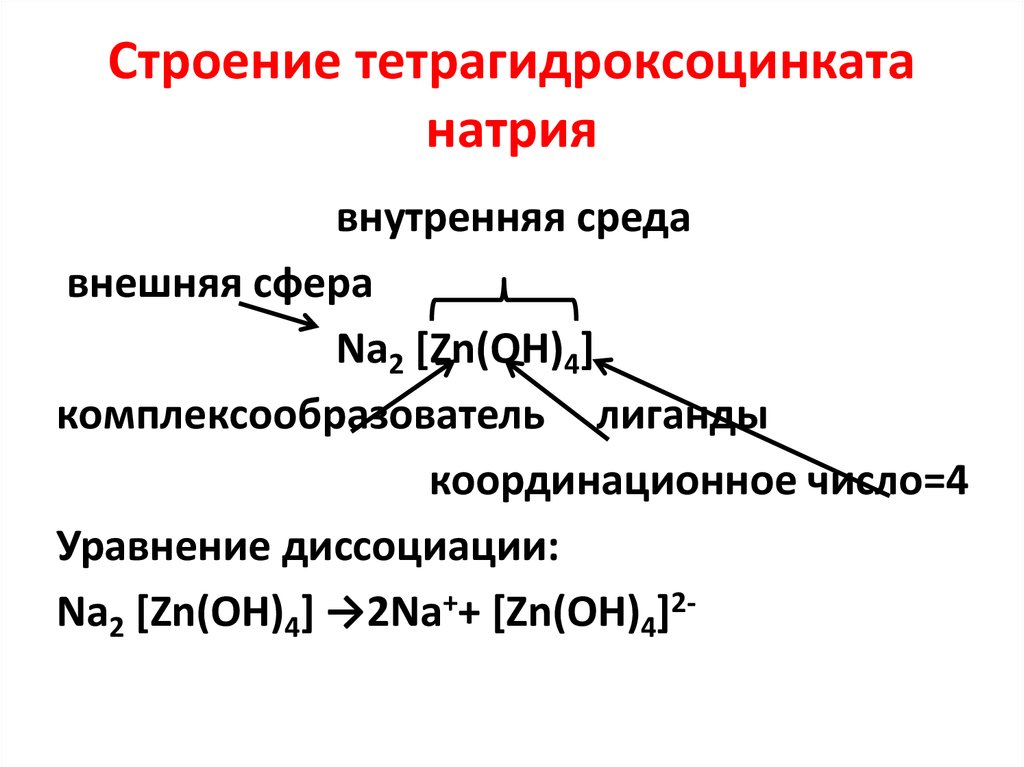
42. Строение тетрагидроксоцинката натрия
внутренняя средавнешняя сфера
Na2 [Zn(OH)4]
комплексообразователь лиганды
координационное число=4
Уравнение диссоциации:
Na2 [Zn(OH)4] →2Na++ [Zn(OH)4]2-
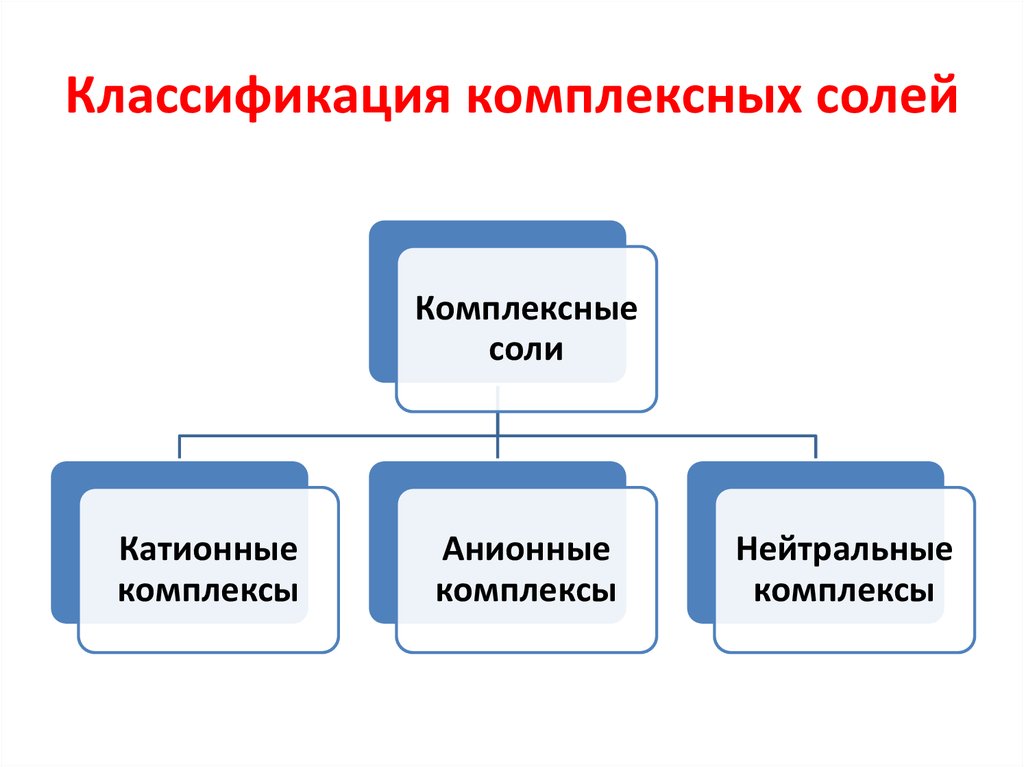
43. Классификация комплексных солей
Комплексныесоли
Катионные
комплексы
Анионные
комплексы
Нейтральные
комплексы
44. Катионные комплексы
• [Cu(NH3)4]2+SO42• cульфат-тетраммин меди (II)• название составляется, начиная с
аниона молекулы; ионкомплексообразователя назван порусски в родительном падеже.
45. Анионные комплексы
• Na2+[Zn(OH)4]2• тетрагидроксоцинкат натрия• ион- комплексообразователь
называем по латыни с
суффиксом «ат»
46. Нейтральные комплексы
• Ион-комплексообразовательназываем по-русски в
именительном падеже:
• [Fe(CO)5]
• пента-карбонил-железо
47. Значение комплексных соединений в природе
Огромное: Хлорофилл- комплексноесоединение, ионом-комплексообразователем
является магний; хлорофилл отвечает за фотосинтез.
Гемоглобин- комплексное соединение, ионом
комплексообразователем является железо.
Гемоглобин отвечает за газообмен в клетке: снабжает
клетку кислородом и удаляет углекислый газ.
Витамин-В12 –комплексное соединение кобальта.
От комплексных соединений в живых организмах
зависит обмен веществ.
48. Химическая связь и кристаллические решетки у солей
В солях присутствует ионнаясвязь, ковалентная полярная
связь, а в комплексных
соединениях между иономкомплексообразователем и
лигандами – связь по донорноакцепторному механизму.
49. Значение солей
В повседневной жизни соли имеютогромное значение: в быту NaHCO3 гидрокарбонат натрия, пищевая сода;
CaCO3 - карбонат кальция, мел, известняк,
мрамор;
стеарат Na,K –твердое и жидкое мыло;
KMnO4 - дезинфицирующее средство;
50. Значение солей
• минеральные удобрения: азотныеNH4NO3- нитрат аммония, калийные KCl –
хлорид калия, фосфорные (NH4)2HPO4гидрофосфат аммония.
• В промышленности: соли катализаторы
AlCl3, FeBr3.
• Биологическое значение: соли NaCl, KCl,
Na2HPO4,NaHPO4,NaHCO3,CaF2,Ca3(PO4)2.
• Малахит (CuOH)2CO3- минерал.




































 Химия
Химия








