Похожие презентации:
Органические соединения углеводы
1. Углеводы
2.
Углеводы - органические соединения, содержащие вмолекуле одновременно альдегидную или кето- группу и
несколько спиртовых групп.
Они имеют большое значение в живой природе (в животном
и растительном мире) как источники энергии в процессах
метаболизма, структурные компоненты клеточных стенок
растений, бактерий и входят в состав жизненно важных
веществ (нуклеиновые кислоты, витамины и др.). Они
составляют значительную долю пищи млекопитающих.
Углеводы пищи - основной источник энергии для организма
человека.
Углеводы имеют большое промышленное значение. Такие
отрасли промышленности, как химическая, целлюлознобумажная, деревообрабатывающая, текстильная, пищевая и
др. заняты переработкой углеводного сырья
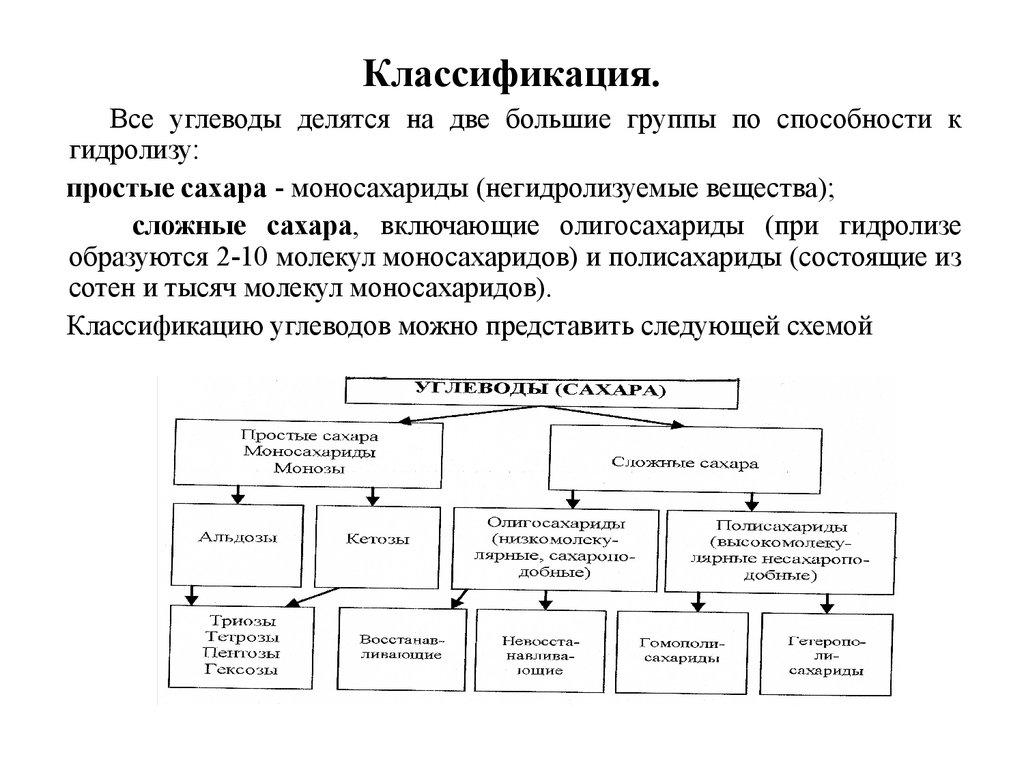
3. Классификация.
Все углеводы делятся на две большие группы по способности кгидролизу:
простые сахара - моносахариды (негидролизуемые вещества);
сложные сахара, включающие олигосахариды (при гидролизе
образуются 2-10 молекул моносахаридов) и полисахариды (состоящие из
сотен и тысяч молекул моносахаридов).
Классификацию углеводов можно представить следующей схемой
4. Моносахариды
В зависимости от числа углеродных атомов (3-7)моносахариды относятся к триозам, тетрозам, пентозам и
гексозам. В природе наиболее распространены и наиболее
важны для жизнедеятельности пентозы С5Н10О5 и гексозы
С6Н12О6. Линейные формы альдопентоз:
5. Линейные формы альдогексоз. Важнейшие представители из гексоз являются глюкоза, фруктоза, галактоза и манноза:
даны в виде проекционных формул Фишера, из которых видно, чтотолько фруктоза является кетозой, остальные вещества относятся к
альдозам.
6.
Принадлежность любой монозы к D- или L ряду определяется по конфигурации еепоследнего асимметрического атома углерода
(считая от карбонильной группы). Если
гидроксил этого атома расположен справа (как
у D - глицеринового альдегида), то моноза
относится к D - ряду. В случае расположения
гидроксила слева ее относят к
L - ряду.
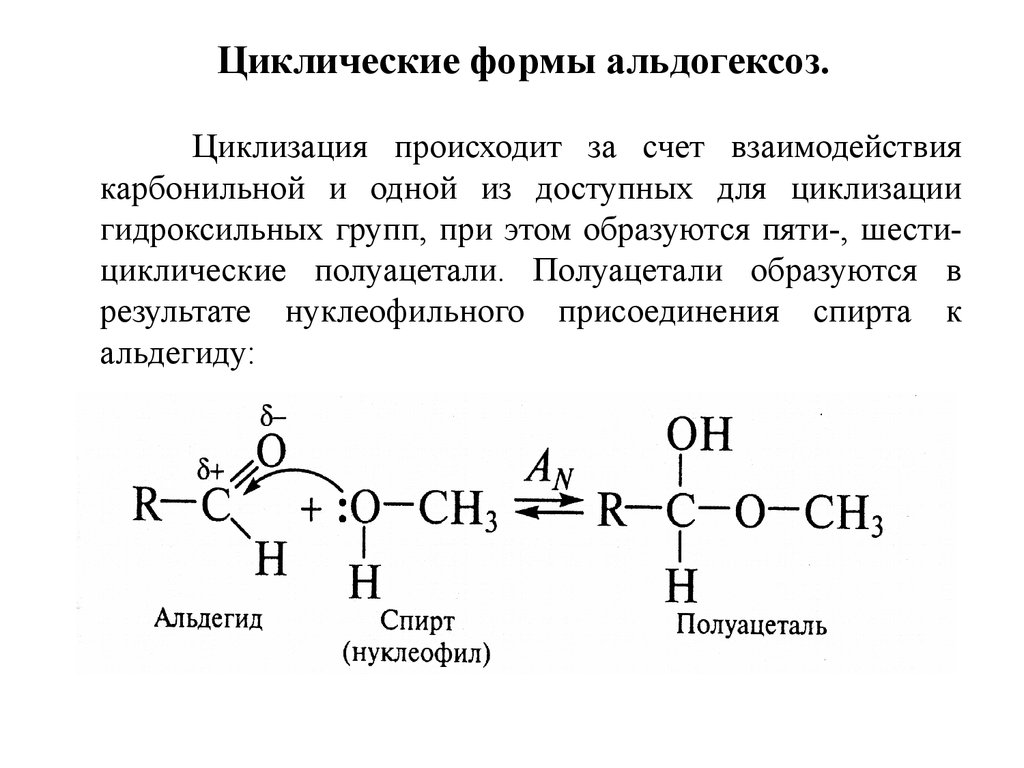
7. Циклические формы альдогексоз.
Циклизация происходит за счет взаимодействиякарбонильной и одной из доступных для циклизации
гидроксильных групп, при этом образуются пяти-, шестициклические полуацетали. Полуацетали образуются в
результате нуклеофильного присоединения спирта к
альдегиду:
8.
9.
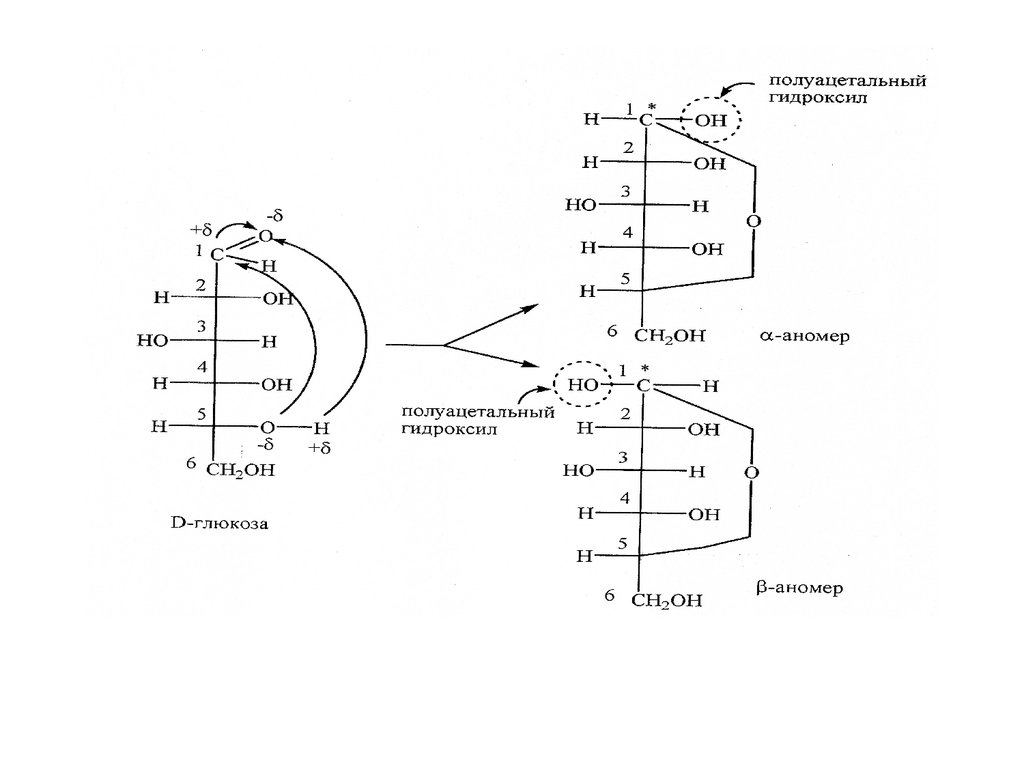
Моносахариды образуют циклическую полуацеталь. Образованиециклической
формы
сопровождается
появлением
нового
гидроксила, получившего название гликозидного.
Так как карбонильная группа плоская, возможны два варианта атаки
и образования двух соединений в и формах. В образовавшихся
циклических формах и атом углерода С1 становиться
асимметрическим. При наличии пяти асимметрических атомов С
существуют 25 = 32 циклические формы D- и L- рядов.
Если в образовании цикла участвует гидроксильная группа пятого
атома углерода, то образуются шестичленные циклы, называемые
пиранозными.
В тех случаях, когда в образовании циклов участвуют
гидроксильные группы четвертого атома углерода, образуются
пятичленные циклы, которые называют фуранозными. и - формы
одной манозы являются диастериомерами и имеют собственные
название - аномеры.
10. Цикло-цепная таутомерия моноз
Все монозы в кристаллическом состоянии имеют циклическоестроение ( или ). При растворении в воде циклический
полуацеталь разрушается, превращаясь в линейную (оксо)
форму. Линейная форма, в свою очередь циклизуется, образуя
и - циклы. Линейная форма и обе циклические формы
взаимно превращаются и находятся в состоянии
динамического равновесия, то есть являются таутомерами,
отсюда термин - цикло-цепная таутомерия (таутомеры обратимые изомеры).
В молекулах моносахаридов имеются два типа функциональных групп (карбонильная и спиртовые группы), поэтому
возможно
их
внутримолекулярное
взаимодействие.
Взаимодействие гидроксила при четвертом или пятом атоме
углерода с карбонильной группой приведет к образованию
циклического полуацеталя, с появлением шести- и
пятичленных пиранозных и фуранозных форм глюкозы и
нового гидроксила - полуацетального или гликозидного.
11.
При изображении моносахаридов и их таутомерных превращений пользуютсяциклическими проекционными формулами Колли-Толленса или Хеуорса, которые
позволяют отразить пространственную структуру молекулы.
Таутомерное равновесие форм D-глюкозы, записанное формулами Колли-Толленса
12.
Таутомерное равновесие форм D-глюкозы можно изобразитьследующими
перспективными
формулами
(формулы
Хеуорса):
13. Химические свойства моносахаридов
Химические свойства моносахаридов определяютсяприродой их функциональных групп и строением
молекул.
Моносахариды находятся в водном растворе в виде
пяти равновесных формах, чем обусловлены
особенности их свойств: вступать в химические
реакции в двух формах. Цепная форма проявляет
свойства альдегидов или кетонов.
В реакции, характерных для гидроксильных групп
(образование эфиров, сахаратов) моносахара
вступают в циклической форме. Это связано с тем,
что хотя ОН-группа есть в обеих формах, наиболее
активным является гликозидный (полуацетальный)
гидроксил, так как легко образует эфиры-гликозиды.
14. Реакции по альдегидной группе
Характерные реакции окисления моносахаридовпротекают легко, процесс и продукты реакции зависят от
природы окислителя, температуры, рН среды. При
окислении альдоз в нейтральной и кислой среде могут
образоваться альдоновые (гликоновые) кислоты (при
мягких условиях процесса, например, из глюкозы
образуется глюконовая кислота, из галактозы галактоновая кислота).
При действии сильных окислителей (разбавленная азотная
кислота) альдозы превращаются в двухосновные кислоты гликаровые
(сахарные
кислоты),
имеющие
карбоксильные группы у первого и последнего атома
углерода.
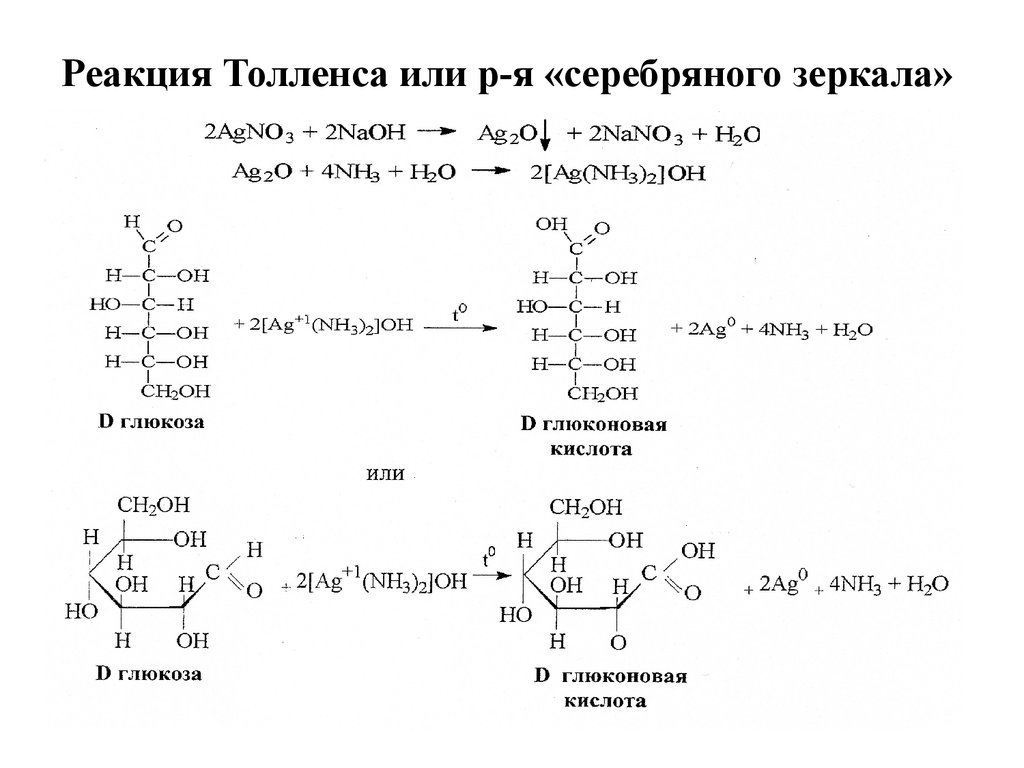
Все моносахариды (альдозы) — восстанавливающие
сахара. Для них характерна реакция «серебряного
зеркала» и взаимодействие с Фелинговой жидкостью. Эти
реакции являются качественными.
15. Реакция Толленса или р-я «серебряного зеркала»
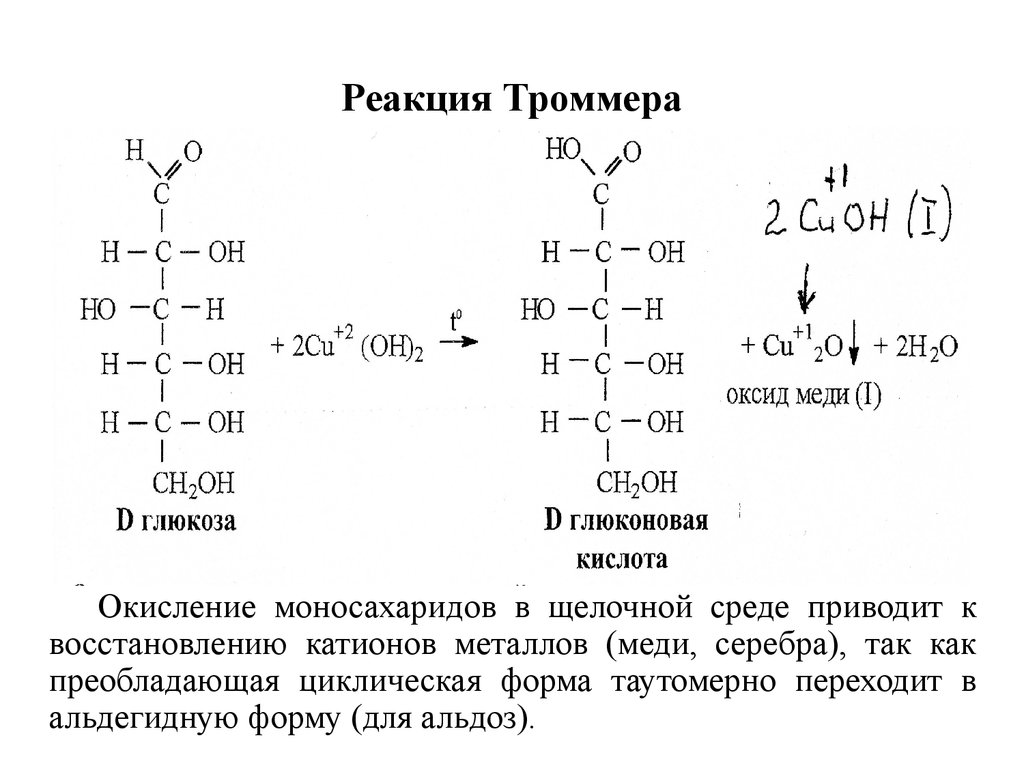
16. Реакция Троммера
Окисление моносахаридов в щелочной среде приводит квосстановлению катионов металлов (меди, серебра), так как
преобладающая циклическая форма таутомерно переходит в
альдегидную форму (для альдоз).
17. Реакции по гидроксильным группам
Моносахариды по гидроксильным группам могутобразовывать простые эфира, сложные эфиры или
сахараты с Са(ОН)2 (качественная реакция на
многоатомные спирты).
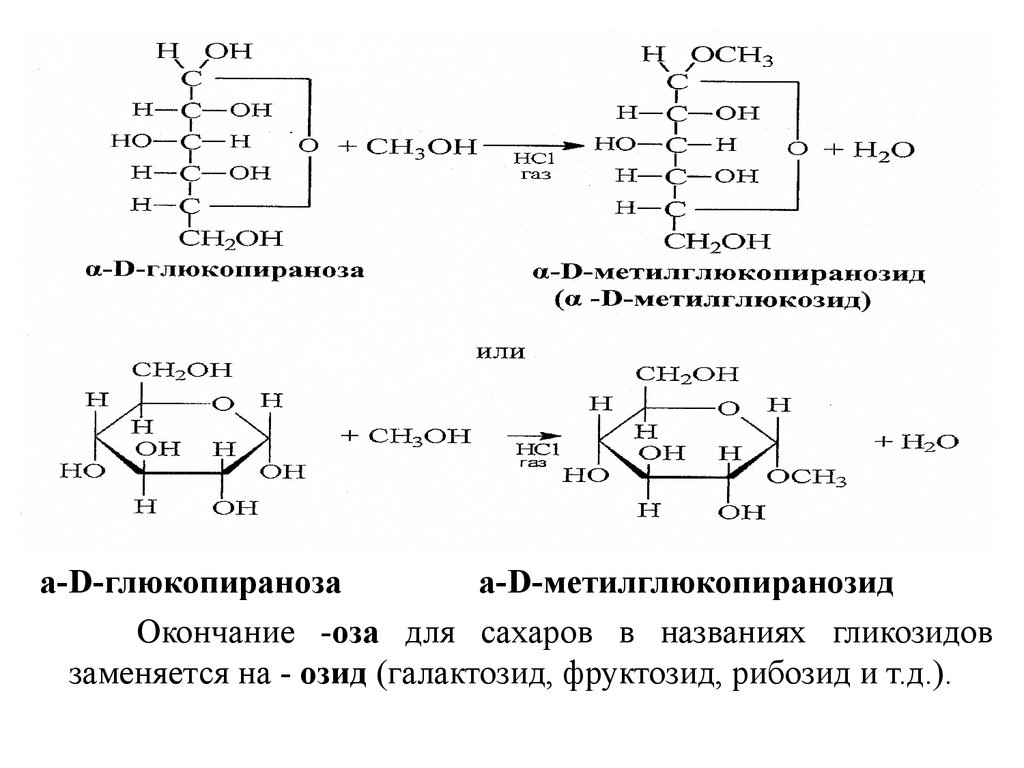
18. Реакции алкилирования
Реакции моноалкилирования. Одна из важнейших реакциймоносахаридов - взаимодействие с гидроксилсодержащими
соединениями (спиртами, фенолами и др.) в условиях
кислотного катализа, когда в реакции участвует только
полуацетальный (гликозидный) гидроксил и образуются
циклические ацетали - гликозиды. Например:
19.
а-D-глюкопиранозаа-D-метилглюкопиранозид
Окончание -оза для cахаров в названиях гликозидов
заменяется на - озид (галактозид, фруктозид, рибозид и т.д.).
20. Реакции фосфорилирования
21. Дисахариды
Наиболее распространенными природными олигосахаридамиявляются дисахариды, состоящие из двух моносахаридных звеньев
одинаковой или разной природы, связь между которыми
осуществляется:
1. дисахариды гликозил-гликозы - образуется моногликозидная
связь за счет гликозидного (полуацетальный) гидроксила одной
молекулы и спиртового гидроксила другой молекулы;
2. дисахариды гликозид-гликозиды - образуется дигликозидная
связь за счет гликозидных гидроксилов обоих моносахаридов.
В первом случае в молекуле дисахарида с моногликозидной связью
остается свободным полуацетальный (гликозидный) гидроксил и
сохраняется способность к раскрытию цикла, т.е. к оксо-цикло
таутомерии. В открытой форме дисахарида появляется
карбонильная группа (альдегидная) и ее восстанавливающие
свойства.
Поэтому
такие
дисахариды
называются
восстанавливающими. К ним относятся мальтоза, целлобиоза и
лактоза.
22.
В дисахаридах с дигликозидной связью отсутствуетсвободный полуацетальный гидроксил и невозможна
циклоцепная таутомерия, т.е. невозможен переход
дисахарида к таутомерной открытой (альдегидной) форме.
Такие
дисахариды
не
обладают
способностью
восстанавливать катионы металлов, т.е. являются
невосстанавливающими. К ним относятся сахароза и
трегалоза (при гидролизе трегалозы образуются две
молекулы а-D-глюкопиранозы).
.
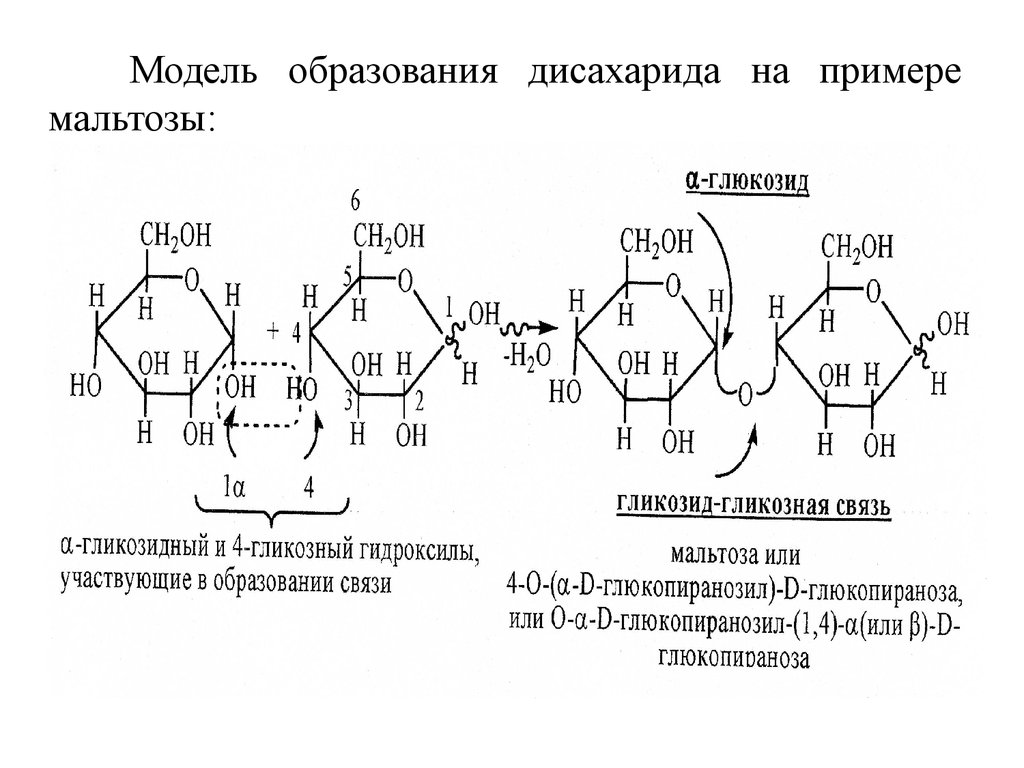
23.
Модель образования дисахарида на примеремальтозы:
24. Восстанавливающие дисахариды.
Мальтоза (солодовый сахар). В мальтозе остатки двухмолекул а-D-глюкопиранозы связаны -1,4-а-гликозидной
связью и аномерный атом углерода со свободной
полуацетальной гидроксильной группой может иметь как
-конфигурацию ( -мальтоза), так и ( -конфигурацию ( мальтоза).
25. Схема таутомерных превращений мальтозы
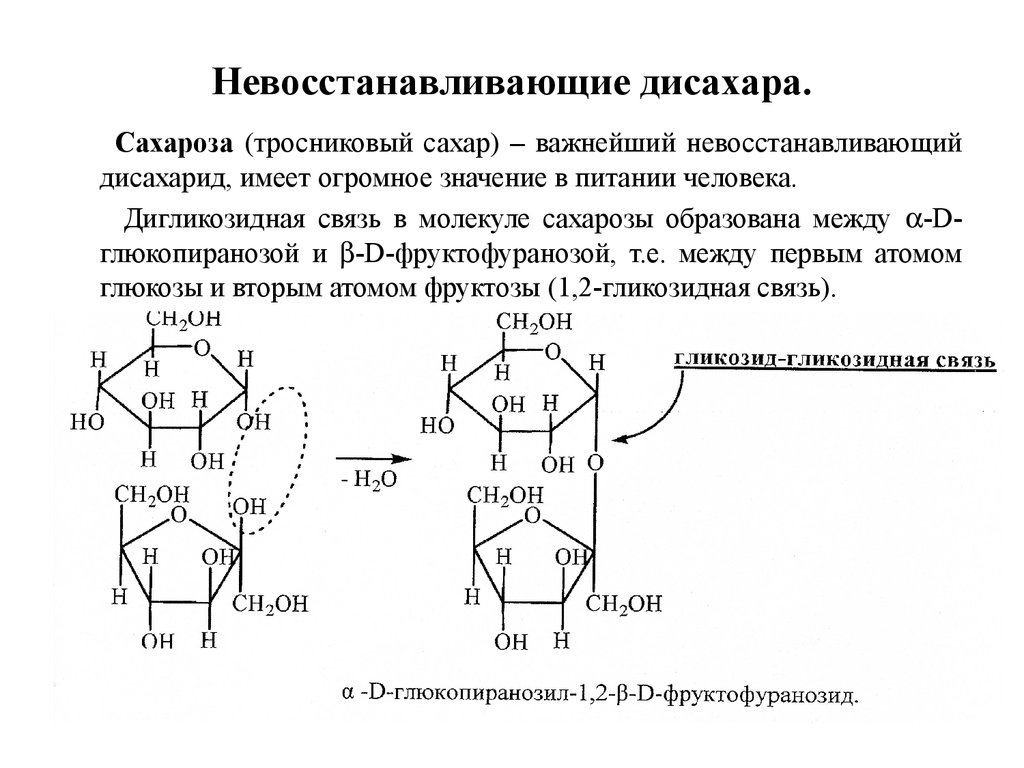
26. Невосстанавливающие дисахара.
Сахароза (тросниковый сахар) – важнейший невосстанавливающийдисахарид, имеет огромное значение в питании человека.
Дигликозидная связь в молекуле сахарозы образована между -Dглюкопиранозой и -D-фруктофуранозой, т.е. между первым атомом
глюкозы и вторым атомом фруктозы (1,2-гликозидная связь).
27. Полисахариды
Высокомолекулярные углеводы являются продуктамиполиконденсации моносахаридов, соединенные кислородными
мостиками в длинные неразветвленные или разветвленные цепи. В
образовании
цепей
полисахарида
участвует
гликозидный
(полуацетальный) гидроксил одной молекулы и спиртовой гидроксил
другой молекулы моносахарида, т.е. полисахариды по химической
природе являются полигликозидами (полиацеталями).
На конце цепи полисахарида имеется остаток моносахарида со
свободным полуацетальным гидроксилом и возможен таутомерный
переход к альдегидной группе, а значит и возможна
восстанавливающая способность. Однако малая доля концевых
групп цепей означает очень слабую и не проявляемую обычными
методами восстанавливающую способность полисахарида.
Поэтому все полисахариды относят к невосстанавливающим
сахарам.
Подразделяются на гомополисахариды и гетерополисахариды, при
этом гомополисахариды состоят из одной монозы, гетеро – из
различных.
28.
Крахмал - важнейший резервный полисахарид растений, т.е.источник запасной энергии в метаболистических процессах,
входит в углеводы пищи человека (хлеб, картофель, крупа,
мука и др.). Он накапливается в виде зерен в клетках семян,
луковиц, листьев, стеблей. В картофеле содержатся 17-24, в
хлебе 60-75, в рисе 90-99 % крахмала. Крахмал представляет
собой белое аморфное вещество, нерастворимое в холодной
воде, эфире, этаноле. Крахмал, являясь гомополисахаридом,
состоит из а-D-глюкопиранозы; представлен двумя фракциями
- амилозой и амилопектином.
Амилоза - линейный полисахарид, в котором связь между
остатками D-глюкозы –а(1-4).
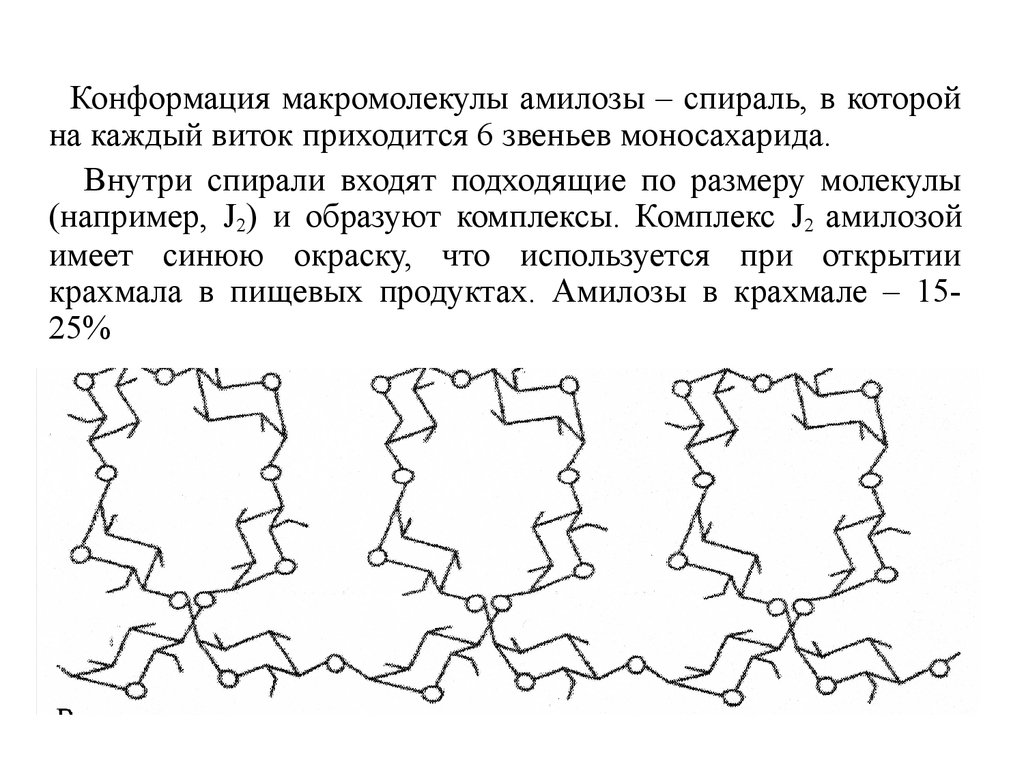
29.
Конформация макромолекулы амилозы – спираль, в которойна каждый виток приходится 6 звеньев моносахарида.
Внутри спирали входят подходящие по размеру молекулы
(например, J2) и образуют комплексы. Комплекс J2 амилозой
имеет синюю окраску, что используется при открытии
крахмала в пищевых продуктах. Амилозы в крахмале – 1525%
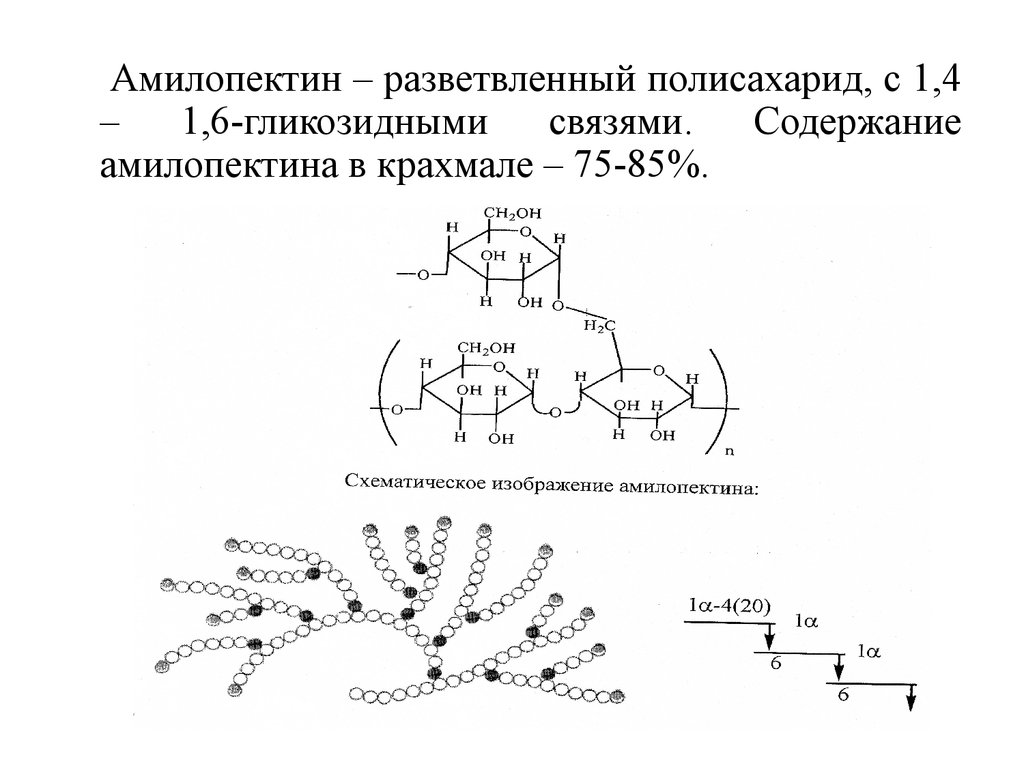
30.
Амилопектин – разветвленный полисахарид, с 1,4–
1,6-гликозидными
связями.
Содержание
амилопектина в крахмале – 75-85%.




















 Биология
Биология Химия
Химия








