Похожие презентации:
Физико-химические методы исследования биополимеров: Структурная формула соединения
1.
Физико-химические методыисследования биополимеров:
Структурная формула соединения
Максим Анатольевич Дубинный
maxim@nmr.ru
+7(905)511-57-71
ИБХ РАН
2.
2Содержание
1. Очень краткое введение
2. Одномерный ЯМР
3. Масс спектрометрия высокого разрешения
4. Двумерный ЯМР
5. Примеры успеха - люциферины
3.
3История (Нобелевские премии)
1943 Отто Штерн
Открытие спина ядер
1944 Исидор Раби
1945 Вольфганг Паули
Магнитный резонанс в газах Формализм, принцип запрета
1952 Эдвард Парселл
Феликс Блох
Первый эксперимент ЯМР
4.
4Древний ЯМР-Спектрометр
5.
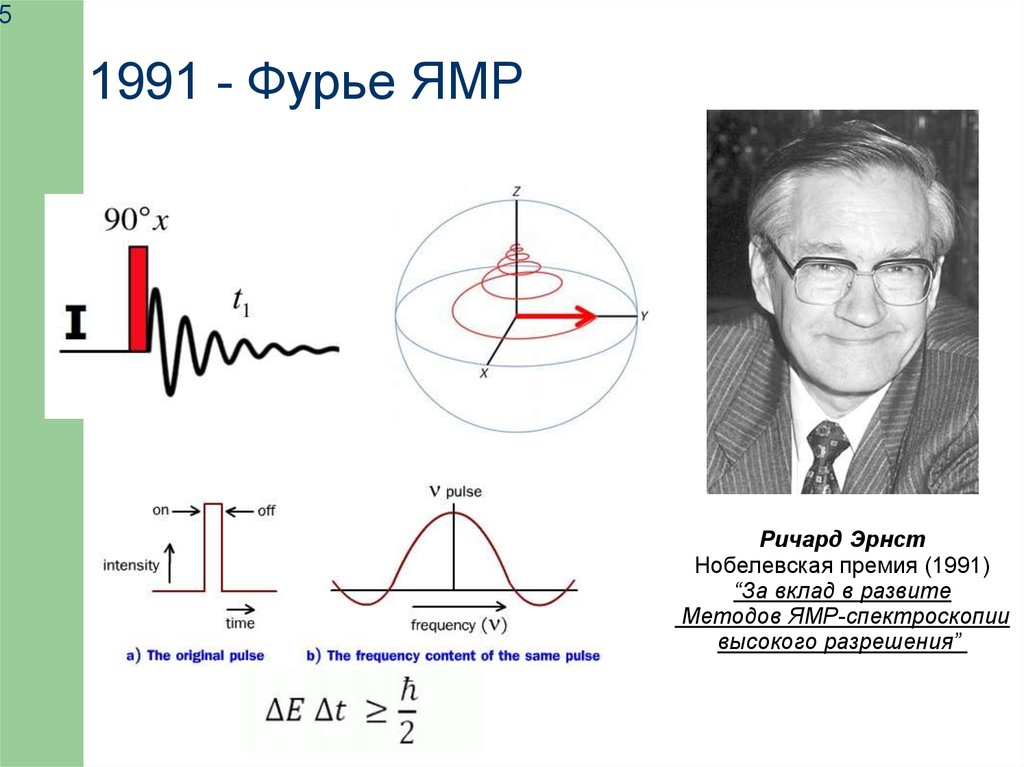
51991 - Фурье ЯМР
Ричард Эрнст
Нобелевская премия (1991)
“За вклад в развите
Методов ЯМР-спектроскопии
высокого разрешения”
6.
62002 — За развитие методов
идентификации и структурного анализа
биологических макромолекул
Джон Б. Фенн
1/4 премии
За МС
Коити Танака
1/4 премии
За МС
Курт Вютрих
1/2 премии
За ЯМР
7.
72003 — за открытие магнитнорезонансной томографии
Пауль Ц. Лаутербур
Питер Мансфилд
8.
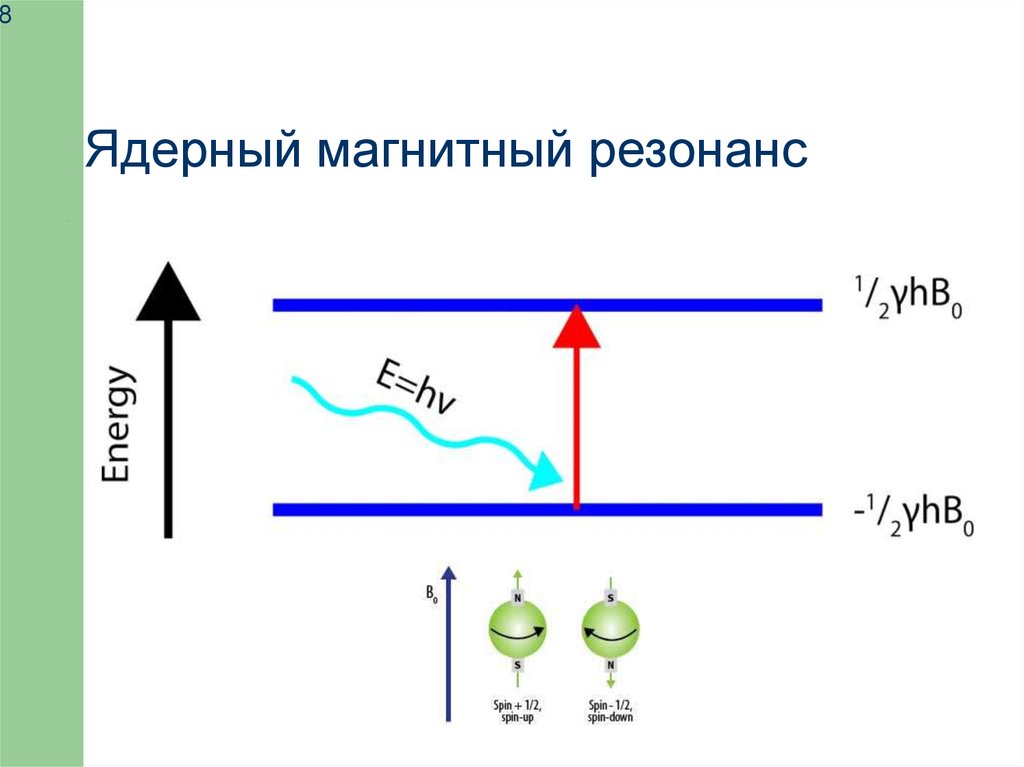
8Ядерный магнитный резонанс
9.
9ЯМР-активные изотопы
10.
10
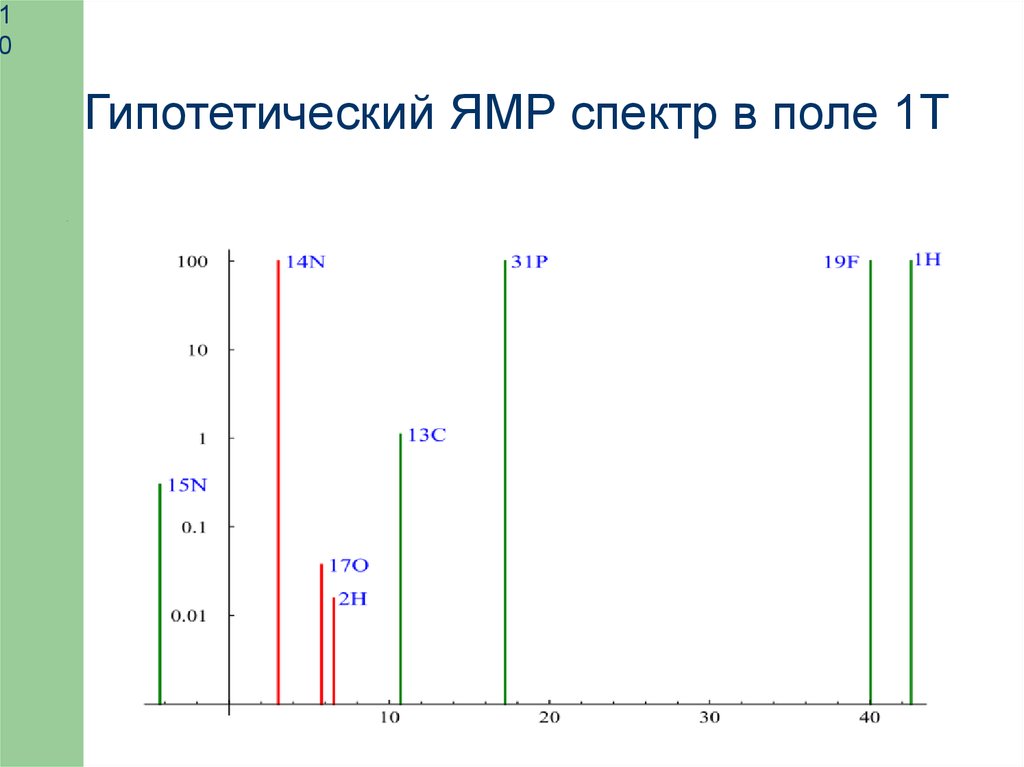
Гипотетический ЯМР спектр в поле 1Т
11.
11
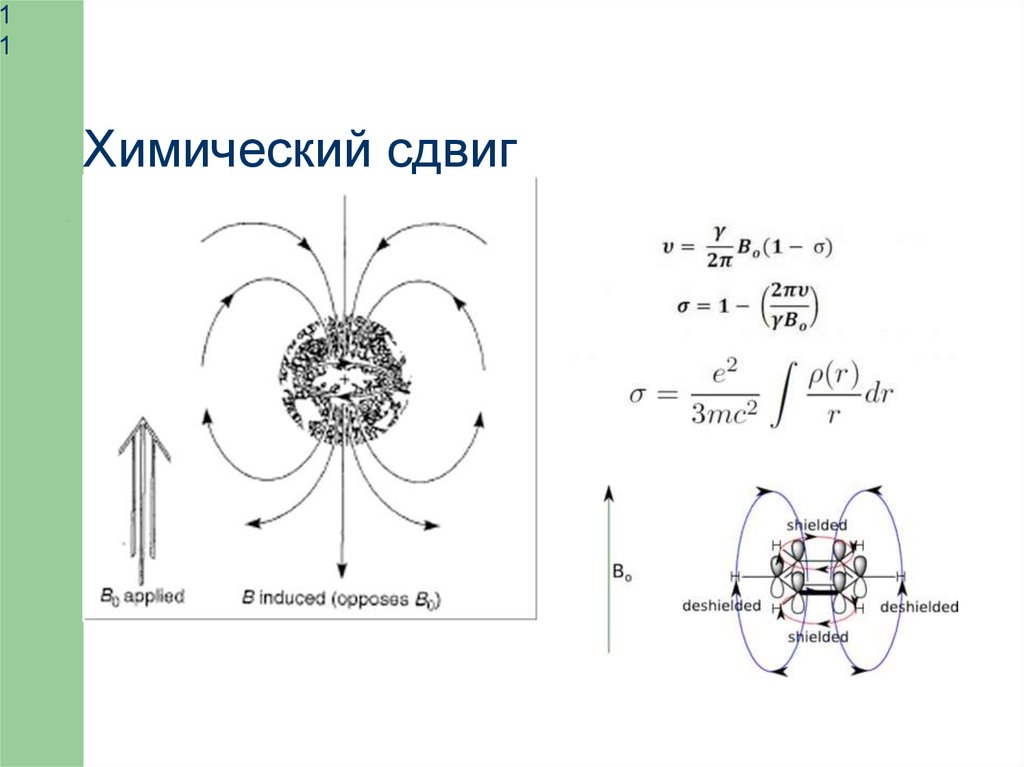
Химический сдвиг
12.
12
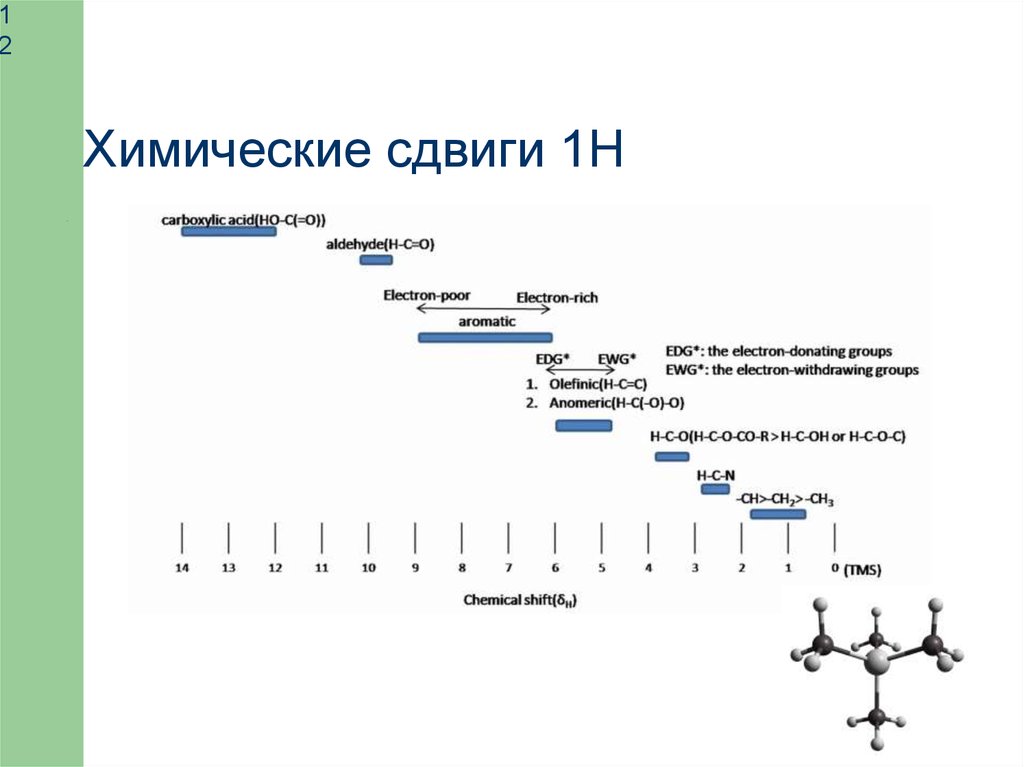
Химические сдвиги 1Н
13.
13
Химические сдвиги 13С
14.
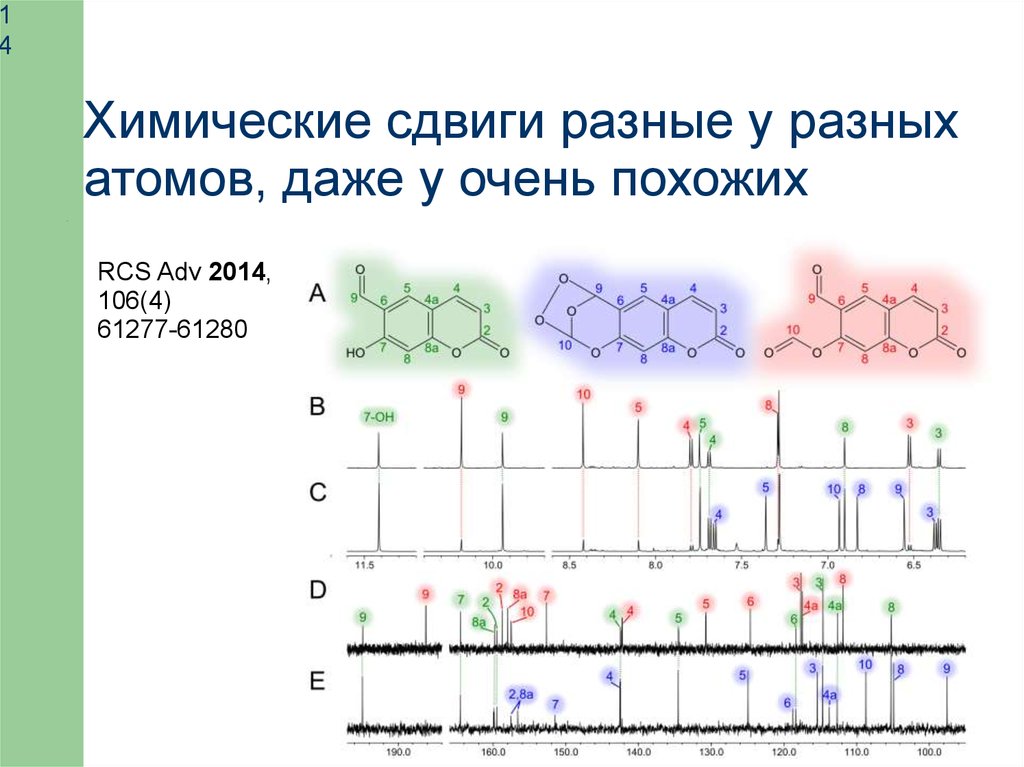
14
Химические сдвиги разные у разных
атомов, даже у очень похожих
RCS Adv 2014,
106(4)
61277-61280
15.
15
Чувствительность ЯМР
N +1/ 2
=e
N +1/ 2
− ΔE
kT
=e
− ℏγ B0
kT
ℏγ B0
−5
≈ 1−
∼1− 10
kT
Sens∼ γ B 0
16.
16
Чувствительность ЯМР
Sens∼ γ B 0
Повышаем B0 — сверхпроводящие магниты
Работаем с ядрами с высоким γ (1H, 19F)
Снимаем все частоты сразу — Фурье-ЯМР
Уменьшаем шум в усилителях сигнала —
криогенно-охлажденные датчики
Обогащаем образец редкими изотопами (13С,
15N)
Оптимизируем ЯМР-эксперименты
17.
17
Применение ЯМР-спектроскопии
Оценка чистоты, контроль химических реакций
Идентификация неизвестных химических соединений
Метаболомика
Получение структуры низкомолекулярных соединений
3D структура макромолекул
Локализация интерфейсов межмолекулярных
взаимодействий
Исследования подвижности макромолекул, кинетики,
термодинамики конформационных переходов
Свойства неупорядоченных белков
Структура переходных состояний
Верификация МД -траекторий, уточнение силовых полей
18.
18
Где нужны химические
формулы?
Установление химических формул
новых природных соединений при
«нулевых» исходных данных
Контроль химического синтеза
положение защитных и реакционных групп,
идентификация продуктов реакций
Промышленный шпионаж
То же самое, но для «рукотворных»
соединений
19.
19
Метаболические пути живой клетки
http://www.genome.jp/kegg-bin/show_pathway?map01100
20.
20
Физические методы
которые могут помочь для установления
структурной формулы
ЯМР-спектроскопия
«+» Структурная формула или её фрагменты
«–» Низкая чувствительность
Масс-спектрометрия
«+» Брутто-формула вещества и фрагментов
«+» Высокая чувствительность
«–» Не всё «летит», нет структурной информации
ИК-спектроскопия
«+» Наличие/отсутствие функциональных групп
«–» Нет структурной информации
Рентгеноструктурный анализ
«+» Структурная формула и пространственная структура
«–» Нужен кристалл
21.
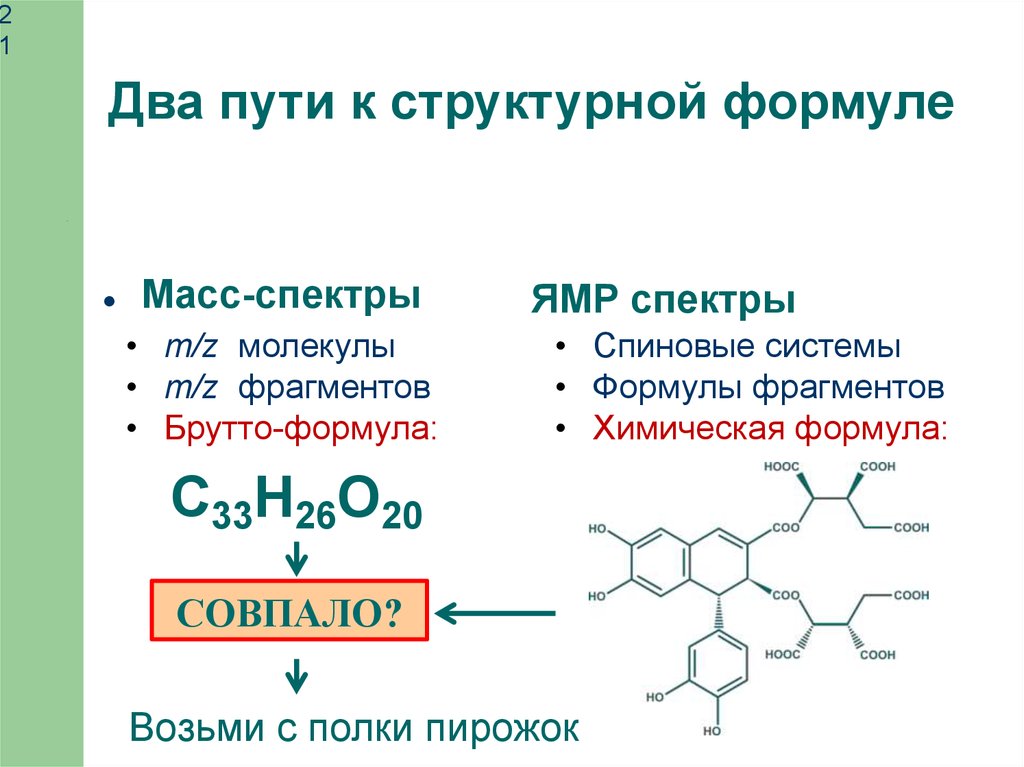
21
Два пути к структурной формуле
Масс-спектры
• m/z молекулы
• m/z фрагментов
• Брутто-формула:
ЯМР спектры
• Спиновые системы
• Формулы фрагментов
• Химическая формула:
С33H26O20
СОВПАЛО?
Возьми с полки пирожок
22.
22
Современный масс-спектрометр
Agilent 6210: ВЭЖХ ─ времяпролетный массспектрометр с электроспрей-ионизацией
(en.wikipedia.org)
23.
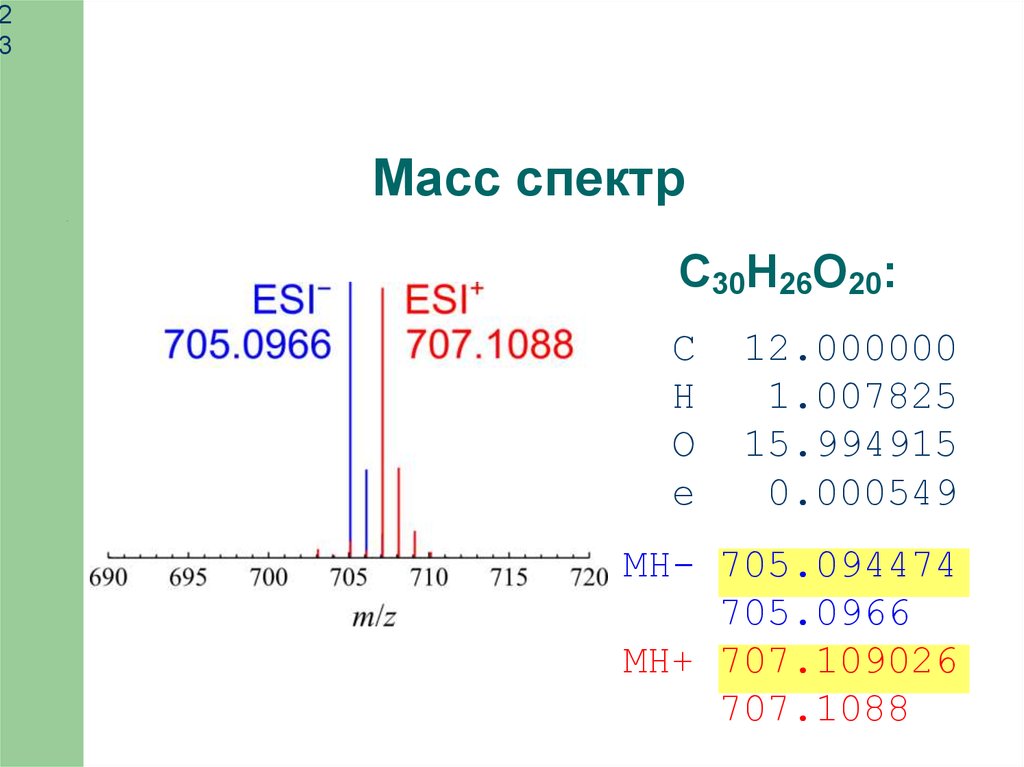
23
Масс спектр
C30H26O20:
C
H
O
e
12.000000
1.007825
15.994915
0.000549
MH- 705.094474
705.0966
MH+ 707.109026
707.1088
24.
24
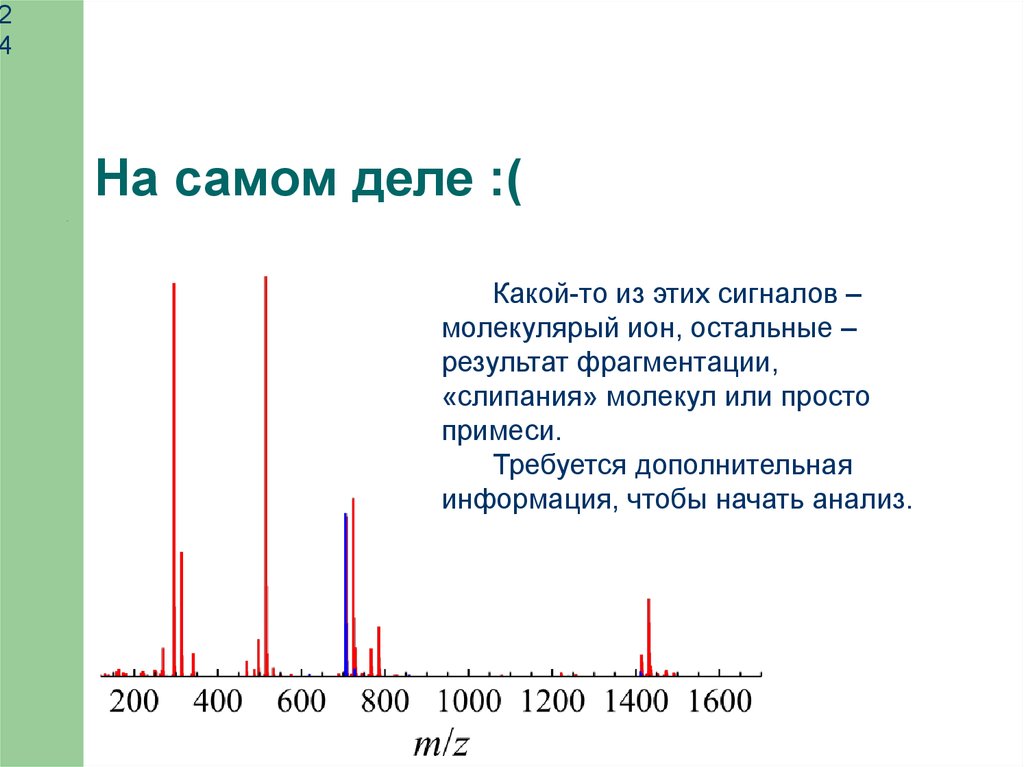
На самом деле :(
Какой-то из этих сигналов –
молекулярый ион, остальные –
результат фрагментации,
«слипания» молекул или просто
примеси.
Требуется дополнительная
информация, чтобы начать анализ.
25.
25
Если известна формула
26.
26
Если известна масса?
пример: ESI MH+=324.1067
Как убрать очевидную бессмыслицу?
27.
27
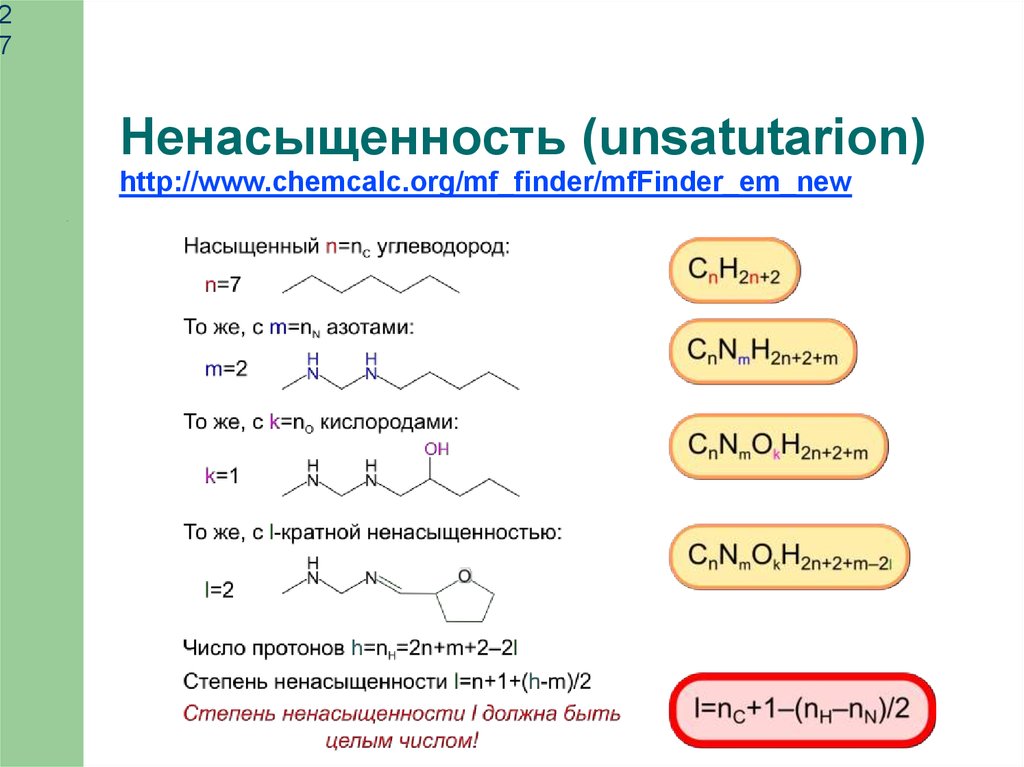
Ненасыщенность (unsatutarion)
http://www.chemcalc.org/mf_finder/mfFinder_em_new
28.
28
C учетом ненасыщенности
ESI MH+=324.1067
29.
30
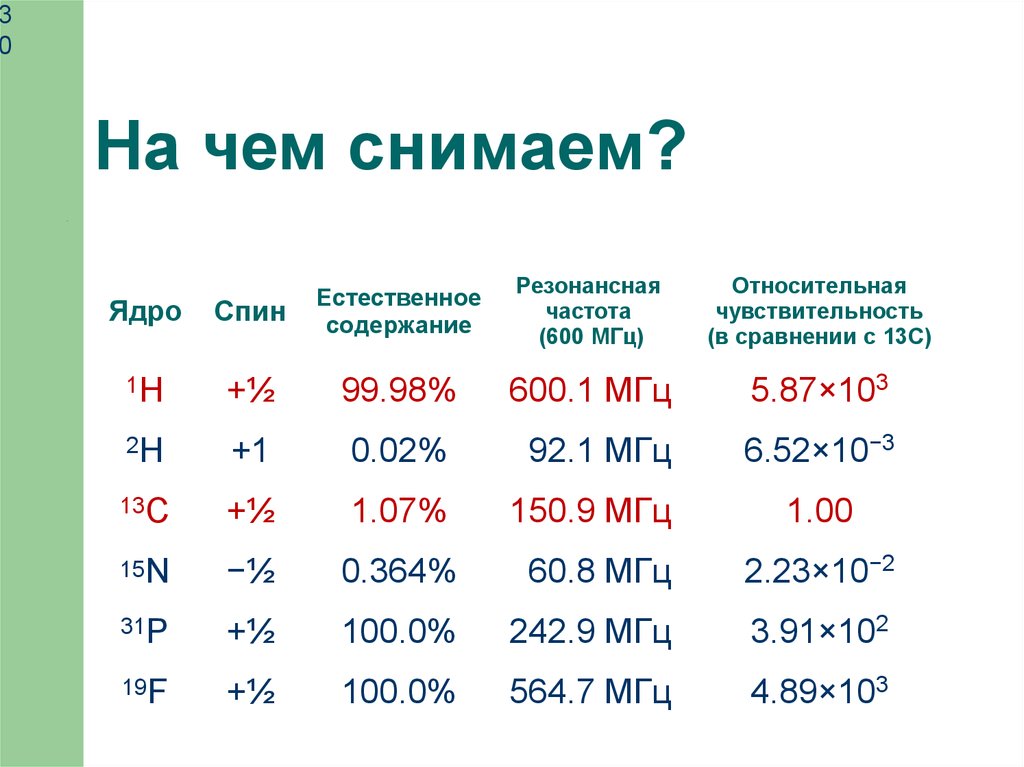
На чем снимаем?
Резонансная
частота
(600 МГц)
Относительная
чувствительность
(в сравнении с 13С)
Ядро
Спин
Естественное
содержание
1H
+½
99.98%
600.1 МГц
5.87×103
2H
+1
0.02%
92.1 МГц
6.52×10−3
13C
+½
1.07%
150.9 МГц
1.00
15N
−½
0.364%
60.8 МГц
2.23×10−2
31P
+½
100.0%
242.9 МГц
3.91×102
19F
+½
100.0%
564.7 МГц
4.89×103
30.
31
Что снимаем?
Имея 0.05-1 мг вещества с MW 100-1000:
Одномерный 1Н спектр
от секунд до минут
Двумерные 1Н-1Н (гомоядерные) спектры
от 10 минут до 12 часов
Двумерные 1Н-13С (гетероядерные) спектры
от 10 минут до 12 часов
Одномерный 13С спектр
от 10 минут до 12 часов
+ Другие спектры на ядрах 15N, 31P, 19F и пр.
31.
32
Когда НЕ снимаем?
Когда не растворяется ни в одном из
растворителей, используемых в ЯМР.
Когда мало вещества:
Для 1H спектров: до 0.1 мг
Для 13С спектров: до 5-10 мг («видно глазом»)
Для 15N спектров (только 15N-HMBC): до 20 мг
Когда много примесей. В образце должно быть
1-2 основных компонента + растворитель,
остальное – в концентрации в 5-10 раз меньше.
32.
33
Растворители для ЯМР
спектроскопии: H2O
H2O + 10% D2O. Используется для расчета структур
белков в естественном окружении, а так же для
съемки спектров любых соединений, растворимых в
воде.
Сигнал растворителя: 1H = 4.7 м.д.
Присутствуют 1H сигналы: NH, NH2, NH3+.
Отсутствуют 1H сигналы: OH, COOH,
PO3-4H, SO3-4H
Съемка спектров: любых, кроме HMBC. Искажены
величины интегралов из-за подавления растворителя
33.
34
Растворители для ЯМР
спектроскопии: D2O (D=2H)
Хорошо подходит для образцов, не содержащих
NH, NH2 групп. Для белков медленная скорость
обмена NH↔ND говорит о наличии водородной
связи.
Сигнал растворителя: 1H = 4.7 м.д.
Отсутствуют 1H сигналы: те же, что и в H2O +
NH, NH2, NH3+
Съемка спектров: любых
34.
35
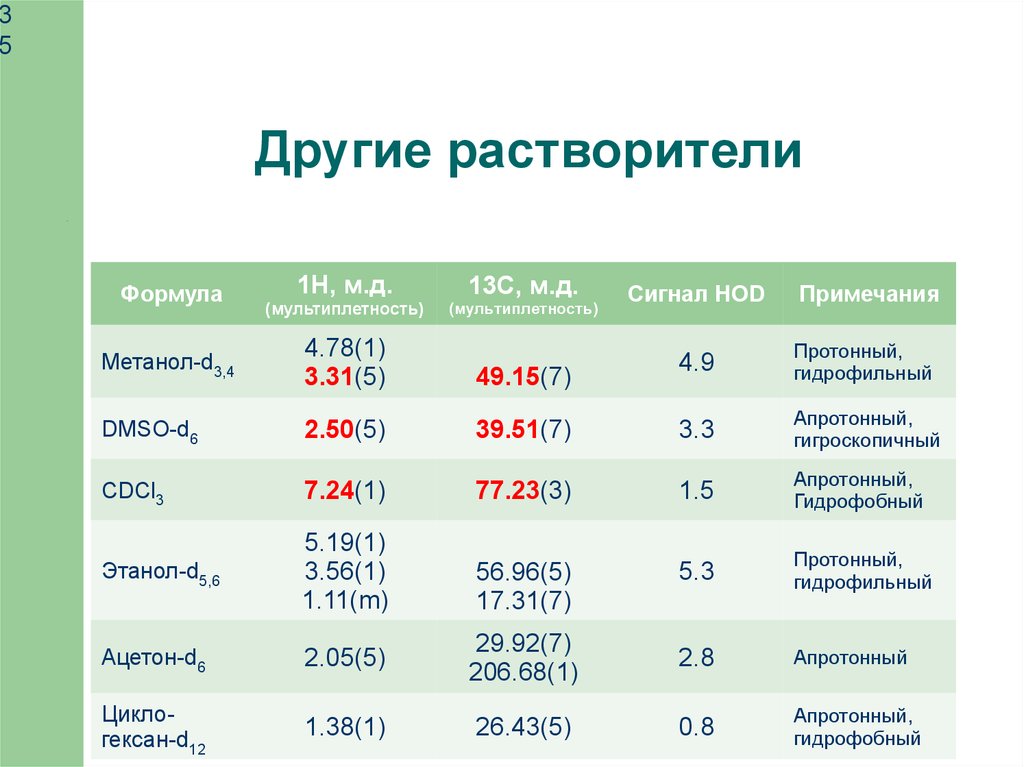
Другие растворители
Формула
1H, м.д.
(мультиплетность)
13С, м.д.
(мультиплетность)
Метанол-d3,4
4.78(1)
3.31(5)
49.15(7)
DMSO-d6
2.50(5)
CDCl3
Сигнал HOD
Примечания
4.9
Протонный,
гидрофильный
39.51(7)
3.3
Апротонный,
гигроскопичный
7.24(1)
77.23(3)
1.5
Апротонный,
Гидрофобный
Этанол-d5,6
5.19(1)
3.56(1)
1.11(m)
56.96(5)
17.31(7)
5.3
Протонный,
гидрофильный
Ацетон-d6
2.05(5)
29.92(7)
206.68(1)
2.8
Апротонный
Циклогексан-d12
1.38(1)
26.43(5)
0.8
Апротонный,
гидрофобный
35.
36
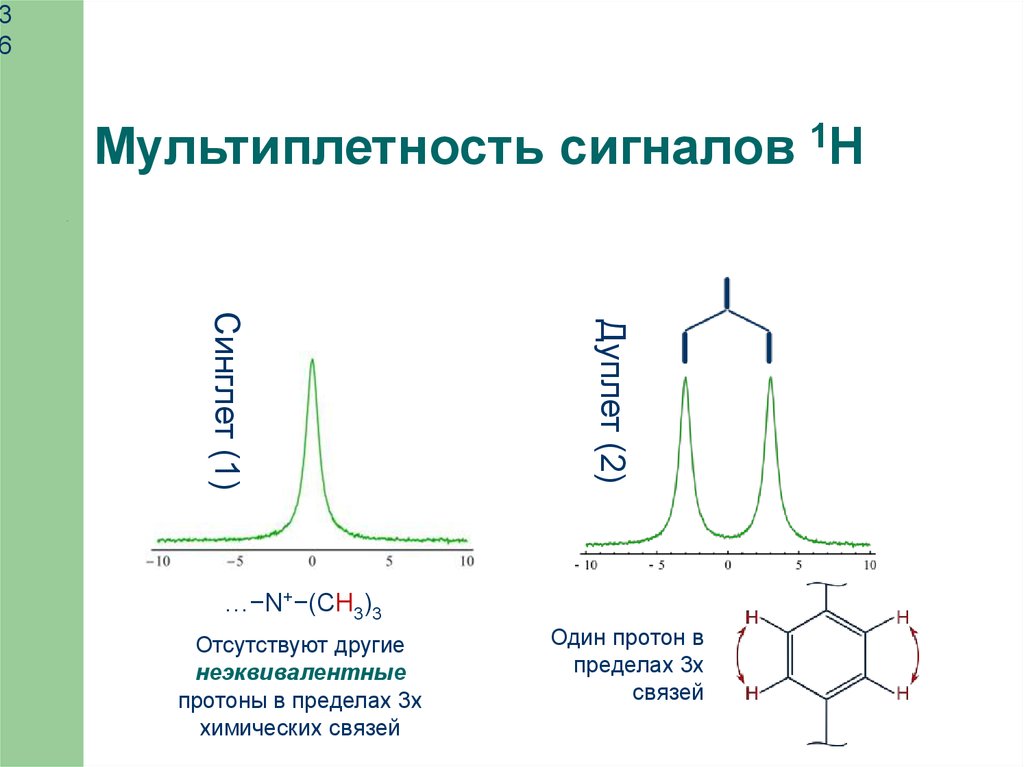
Мультиплетность сигналов 1H
Дуплет (2)
Синглет (1)
…−N+−(CH3)3
Отсутствуют другие
неэквивалентные
протоны в пределах 3х
химических связей
Один протон в
пределах 3х
связей
36.
37
Мультиплетность сигналов 1H
Два эквивалентных
соседа
Квартет (4)
Дуплет дуплетов
Триплет (3)
CH3−СH2− …
NH−СH−CHOH
CH3−СH2−O − …
Два НЕэквивалентных
соседа
Три соседа
37.
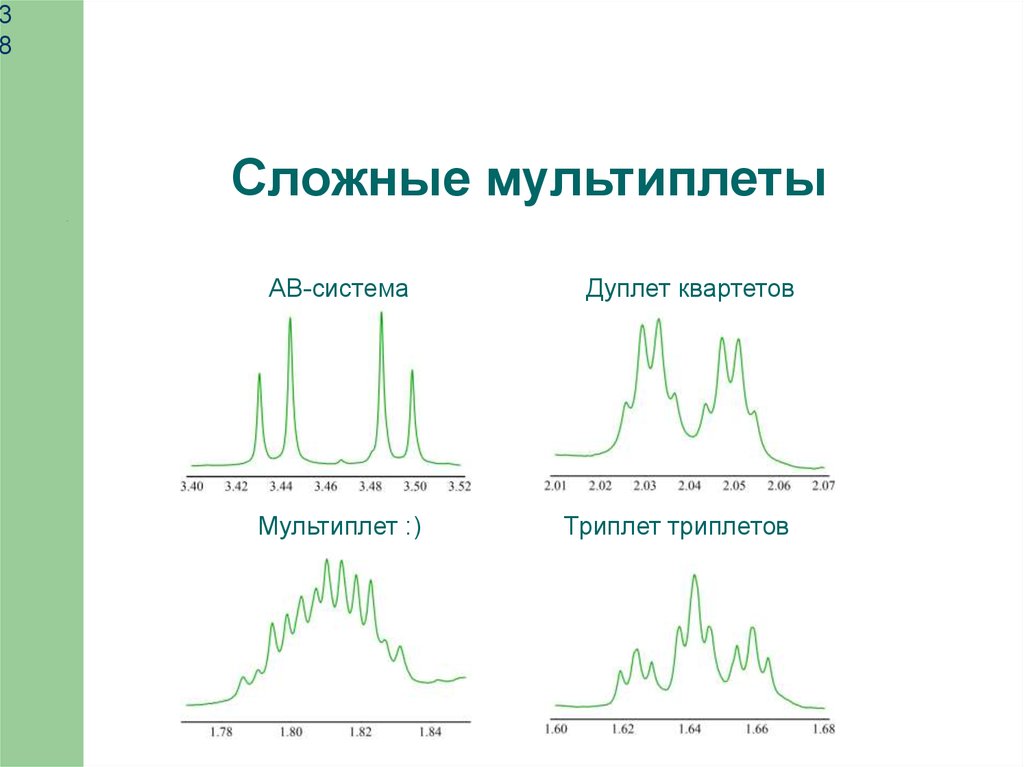
38
Сложные мультиплеты
AB-система
Мультиплет :)
Дуплет квартетов
Триплет триплетов
38.
39
Ложные мультиплеты
39.
40
Интегралы
показывают число протонов в мультиплете
40.
41
Химические сдвиги 1Н
Метилы
C−CH3 0÷1.5 м.д.
Метилы
N,O−CH3 3−4 м.д.
Метилены
С−СН1,2 1−3 м.д.
Метилены
N,O−СН1,2 3−6 м.д.
Ароматика
СH
6−7 м.д.
Амиды
NH,NH2 6−11 м.д.
41.
42
Химические сдвиги 1Н
42.
43
Химические сдвиги 13С
Метилы
C−CH3 5-15 м.д.
Метилены С−СН1,2 20−60 м.д.
Метилены O−СН1,2 60−90 м.д.
Ароматика,С,CH 100-150 м.д.
Олефины
Карбоксилы С=O
160-220 м.д.
43.
44
Химические сдвиги 13С
44.
45
Виды 2D ЯМР спектров,
используемые для определения строения молекул
Гомоядерная спектроскопия (1H1H):
2D COSY
2D TOCSY
2D NOESY/ROESY
Гетероядерная спектроскопия
(1H - 13C или 1H15N):
‒ 2D HSQC
‒ 2D HMBC
‒ 2D HSQC-COSY (H2BC)
‒ 2D HSQC-TOCSY
‒ 2D ADEQUATE
45.
46
Импульсные последовательности
46.
47
Зачем нужен 2D ЯМР?
47.
48
Двумерная спектроскопия ЯМР
Ричард Эрнст.
1964: Создание метода импульсной Фурьеспектроскопии ЯМР
1974: Создание методов 2D спектроскопии
ЯМР
Джин Джинер.
1971. Предложена идея метода 2D
спектроскопии ЯМР.
1979. Разработка совместно с Ричардом
Эрнстом метода NOESY.
48.
49
49.
50
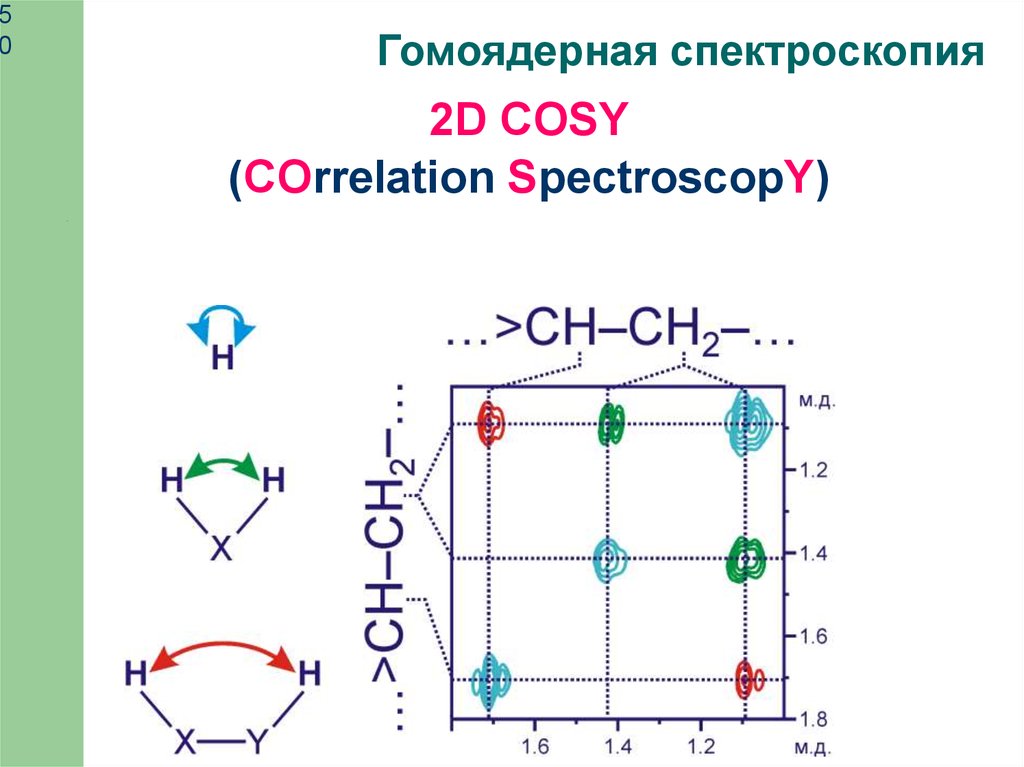
Гомоядерная спектроскопия
2D COSY
(COrrelation SpectroscopY)
50.
51
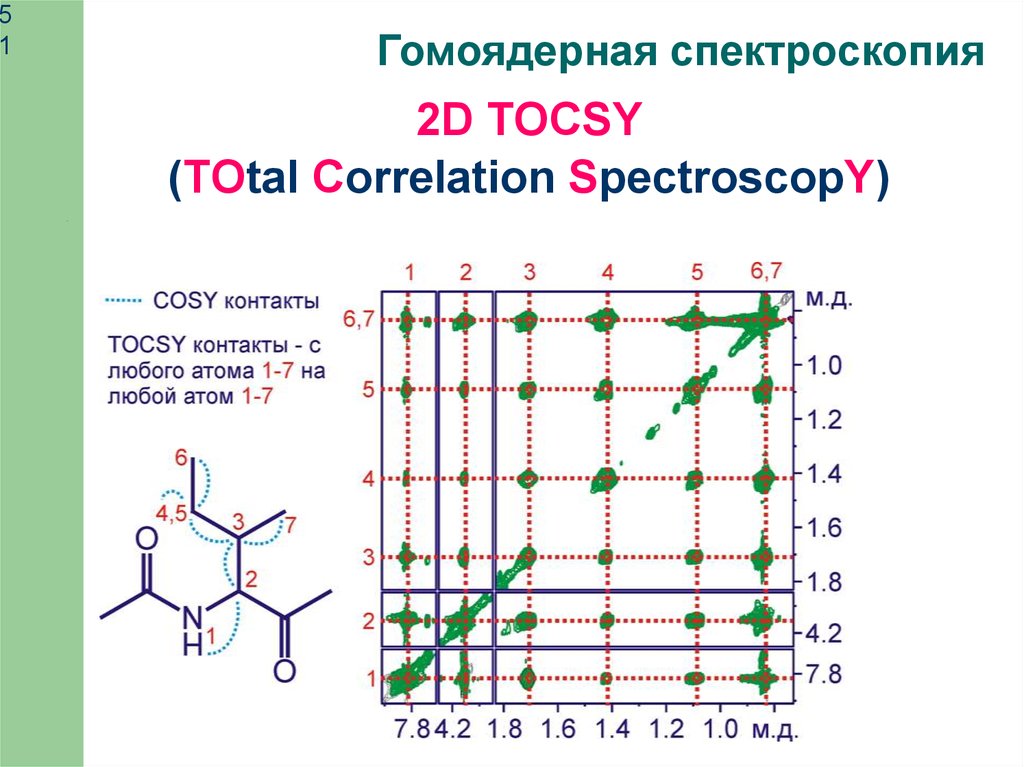
Гомоядерная спектроскопия
2D TOCSY
(TOtal Correlation SpectroscopY)
51.
52
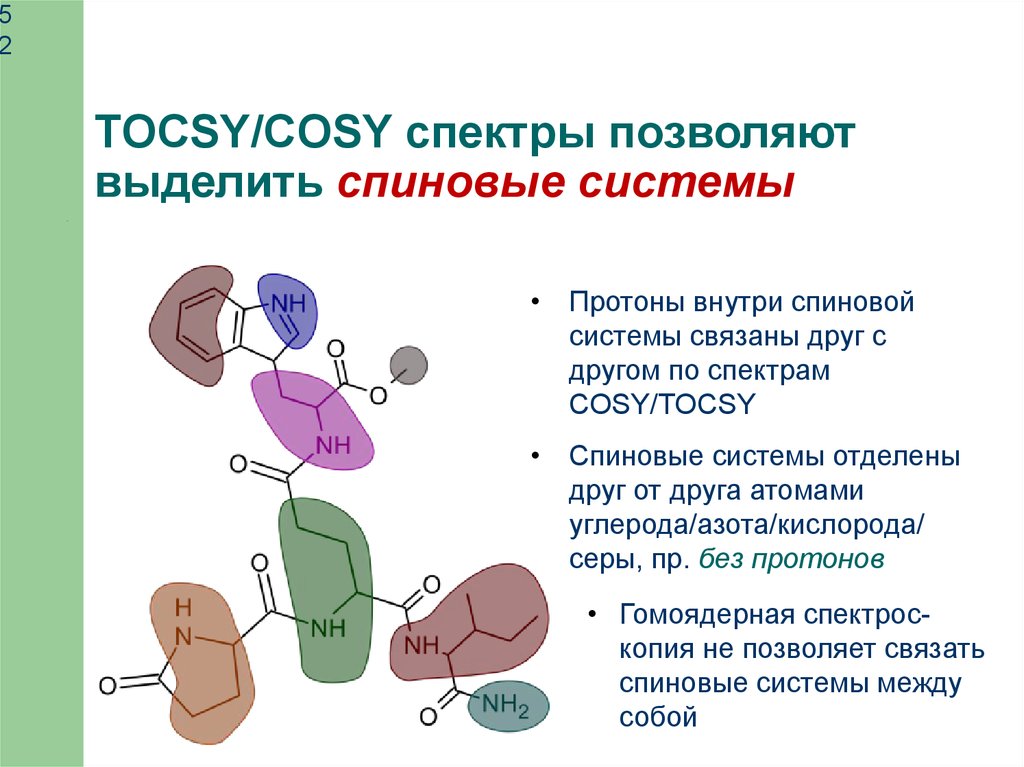
TOCSY/COSY спектры позволяют
выделить спиновые системы
• Протоны внутри спиновой
системы связаны друг с
другом по спектрам
COSY/TOCSY
• Спиновые системы отделены
друг от друга атомами
углерода/азота/кислорода/
серы, пр. без протонов
• Гомоядерная спектроскопия не позволяет связать
спиновые системы между
собой
52.
53
Гетероядерная спектроскопия
2D HSQC
(Heteronuclear Single Quantum Coherence)
53.
54
Гетероядерная спектроскопия
2D HMBC
(Heteronuclear Multiple Bond Correlation)
54.
55
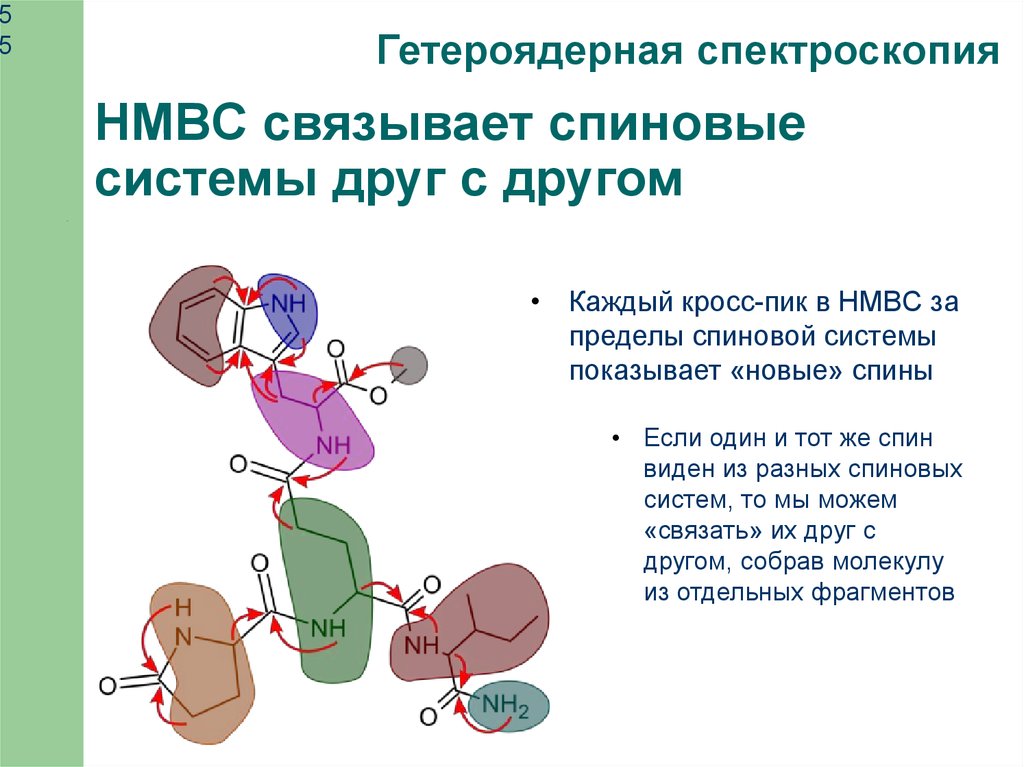
Гетероядерная спектроскопия
HMBC связывает спиновые
системы друг с другом
• Каждый кросс-пик в HMBC за
пределы спиновой системы
показывает «новые» спины
• Если один и тот же спин
виден из разных спиновых
систем, то мы можем
«связать» их друг с
другом, собрав молекулу
из отдельных фрагментов
55.
56
Порядок действий
56.
57
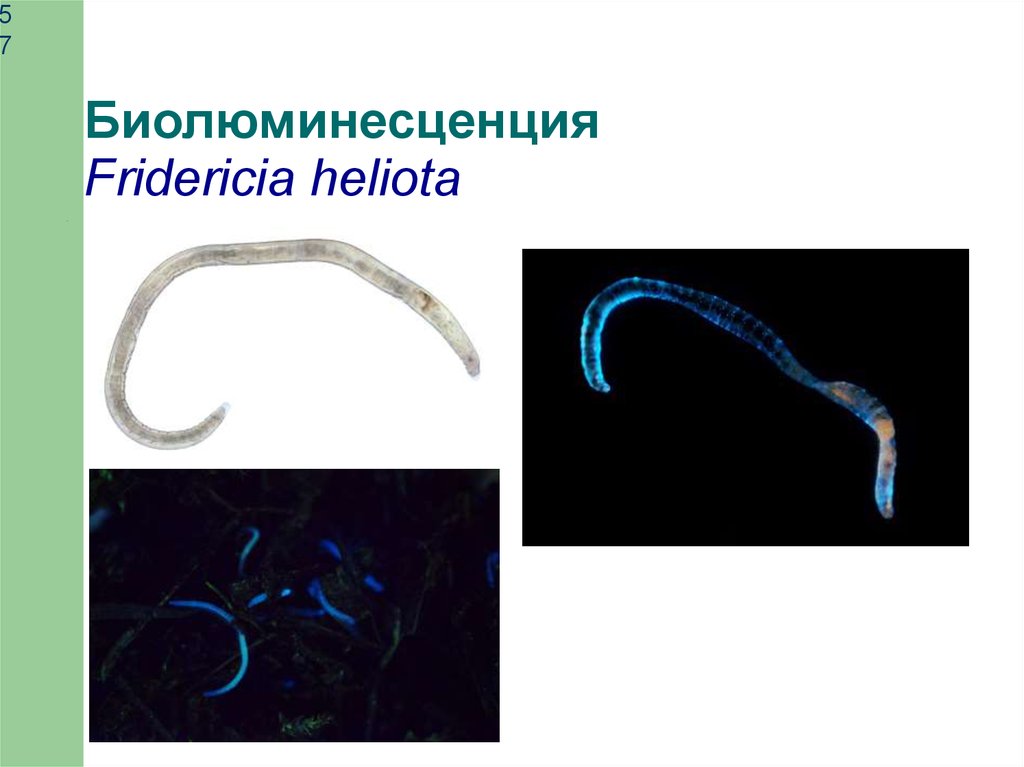
Биолюминесценция
Fridericia heliota
57.
58
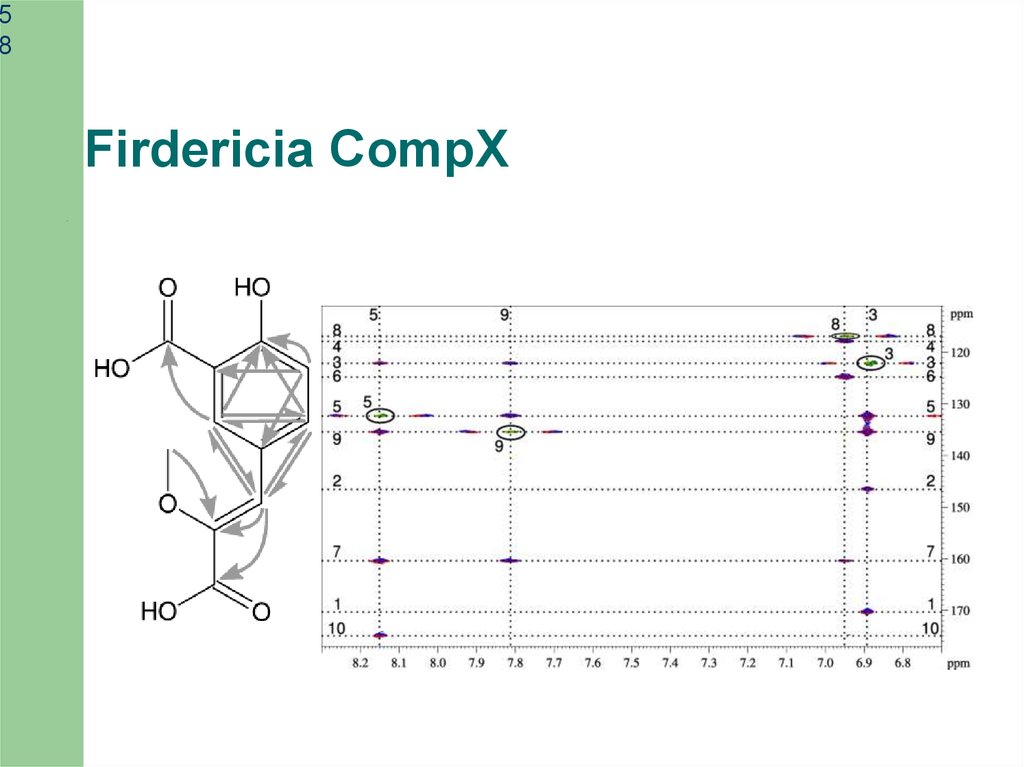
Firdericia CompX
58.
59
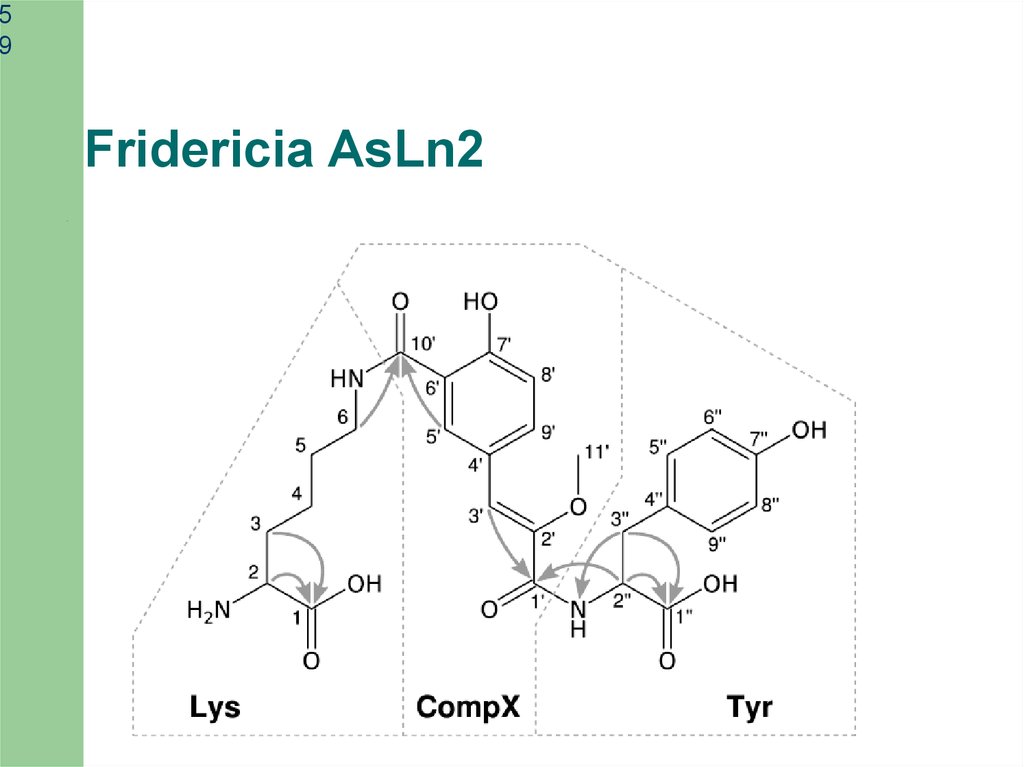
Fridericia AsLn2
59.
60
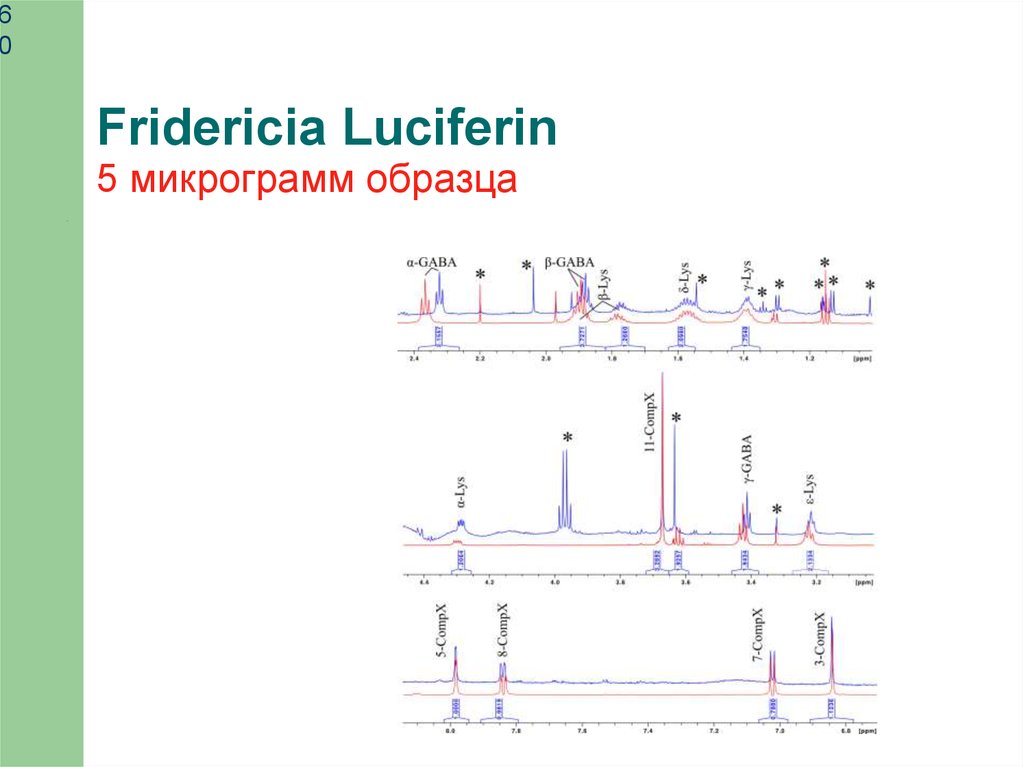
Fridericia Luciferin
5 микрограмм образца
60.
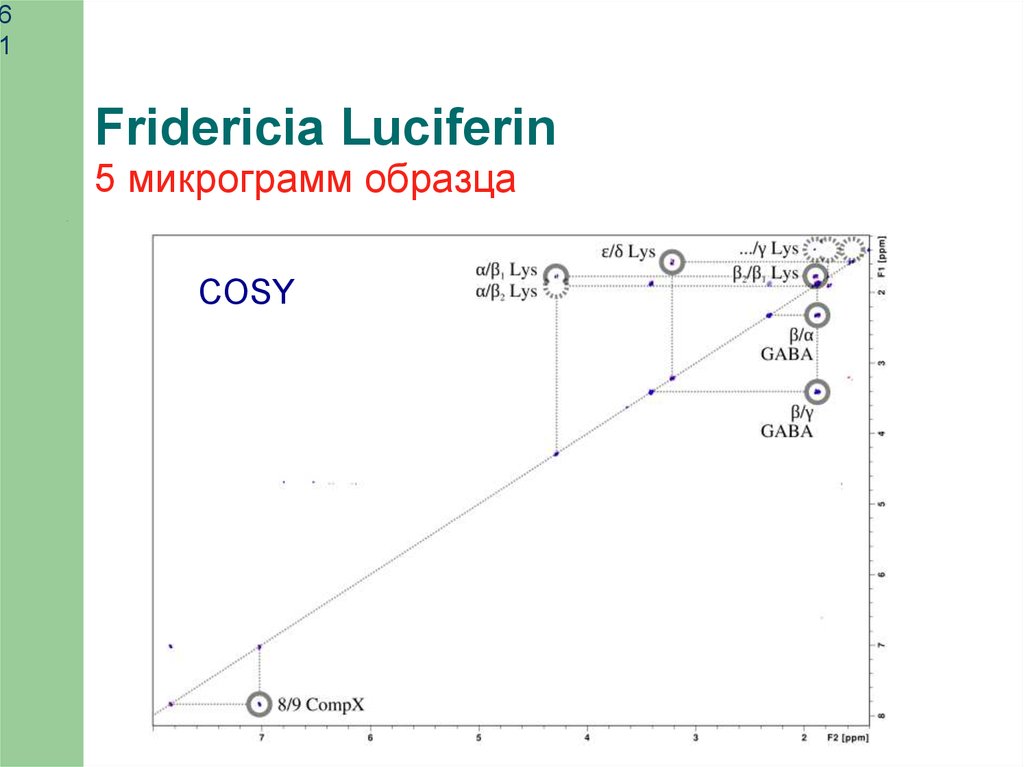
61
Fridericia Luciferin
5 микрограмм образца
COSY
61.
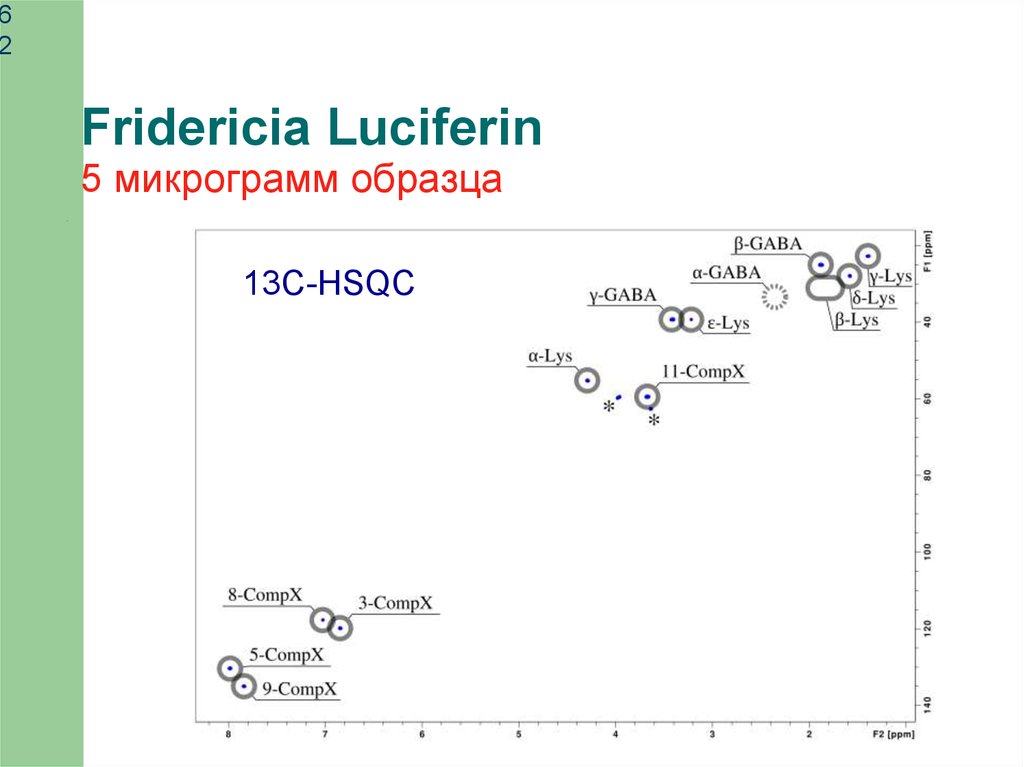
62
Fridericia Luciferin
5 микрограмм образца
13C-HSQC
62.
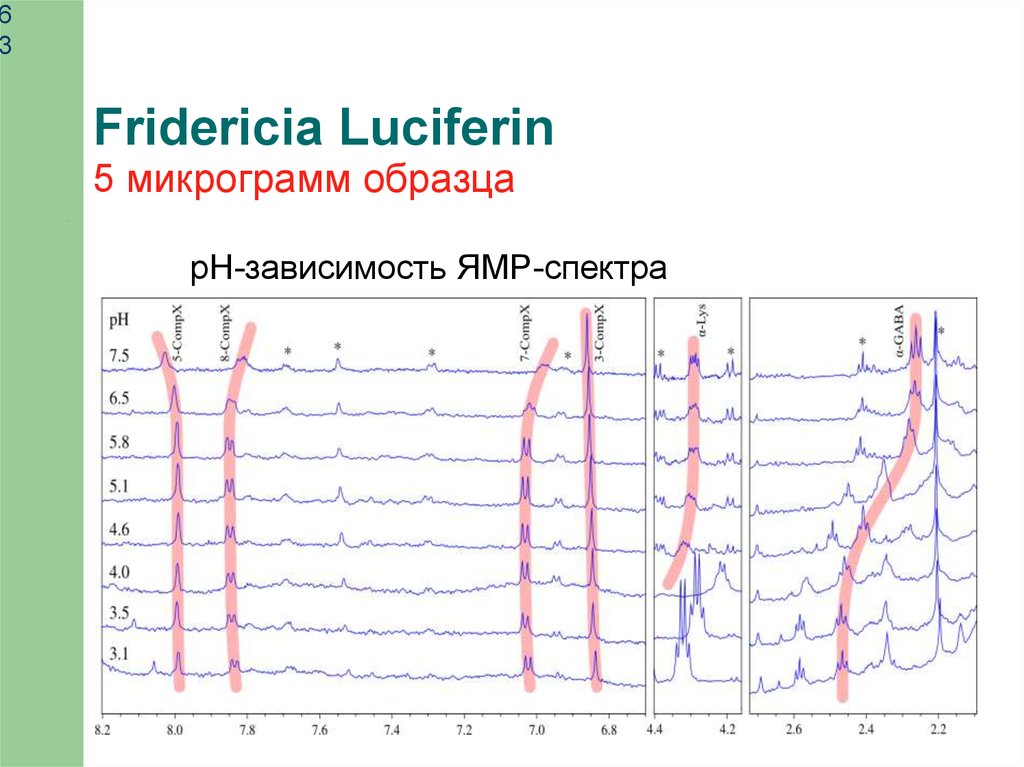
63
Fridericia Luciferin
5 микрограмм образца
pH-зависимость ЯМР-спектра
63.
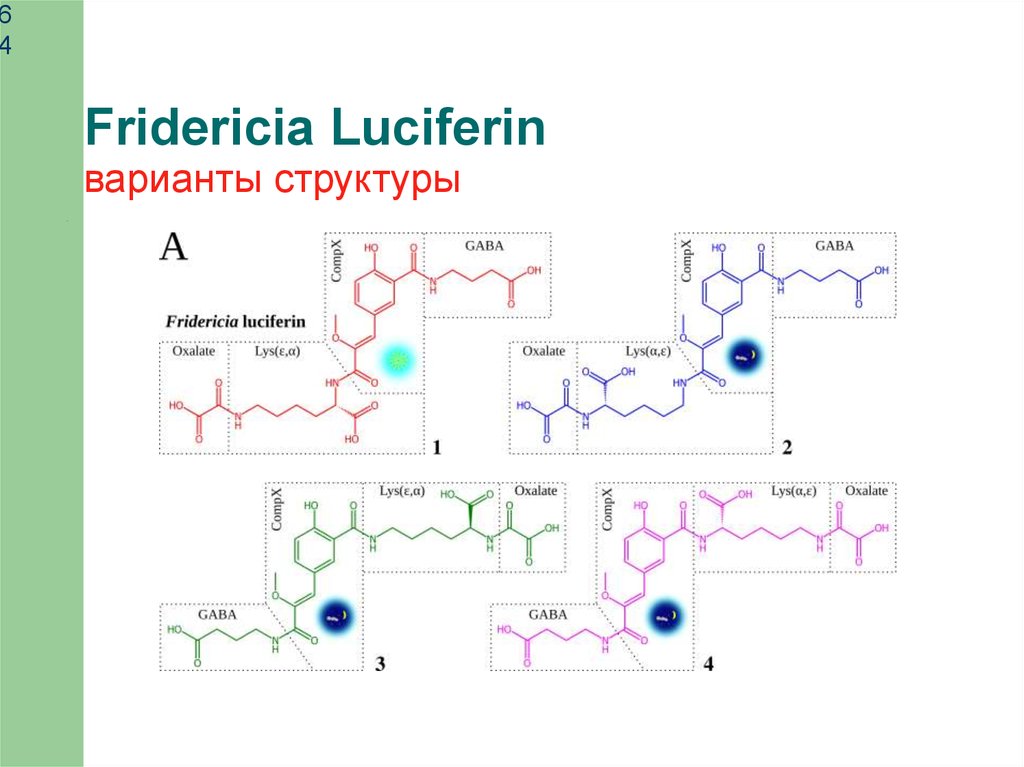
64
Fridericia Luciferin
варианты структуры
64.
65
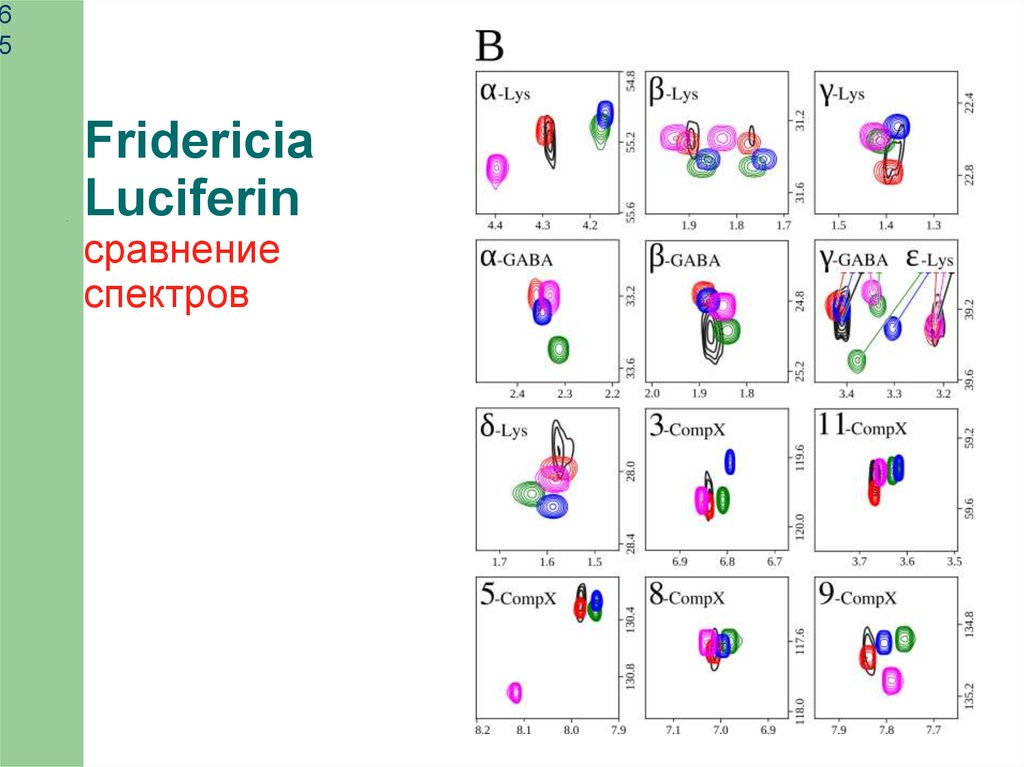
Fridericia
Luciferin
сравнение
спектров
65.
66
Биолюминесценция
Fridericia heliota
66.
67
Другие компоненты Fridericia heliota
новая пептидная химия?
67.
68
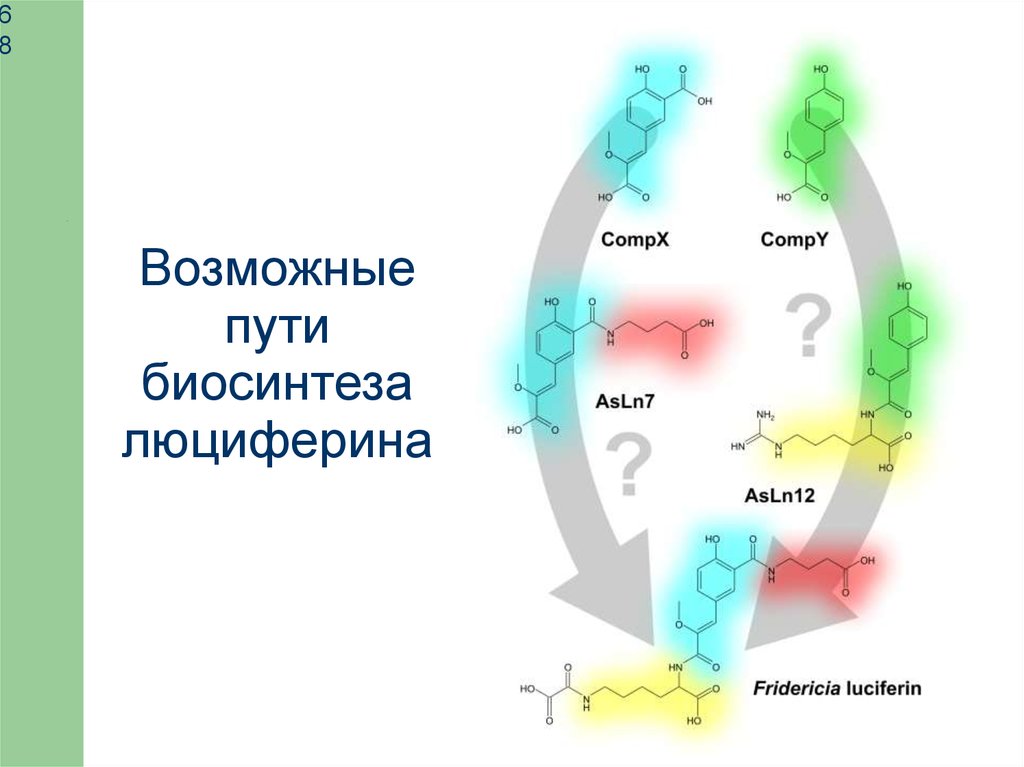
Возможные
пути
биосинтеза
люциферина
68.
69
Красивая картинка для обложки
журнала
69.
70
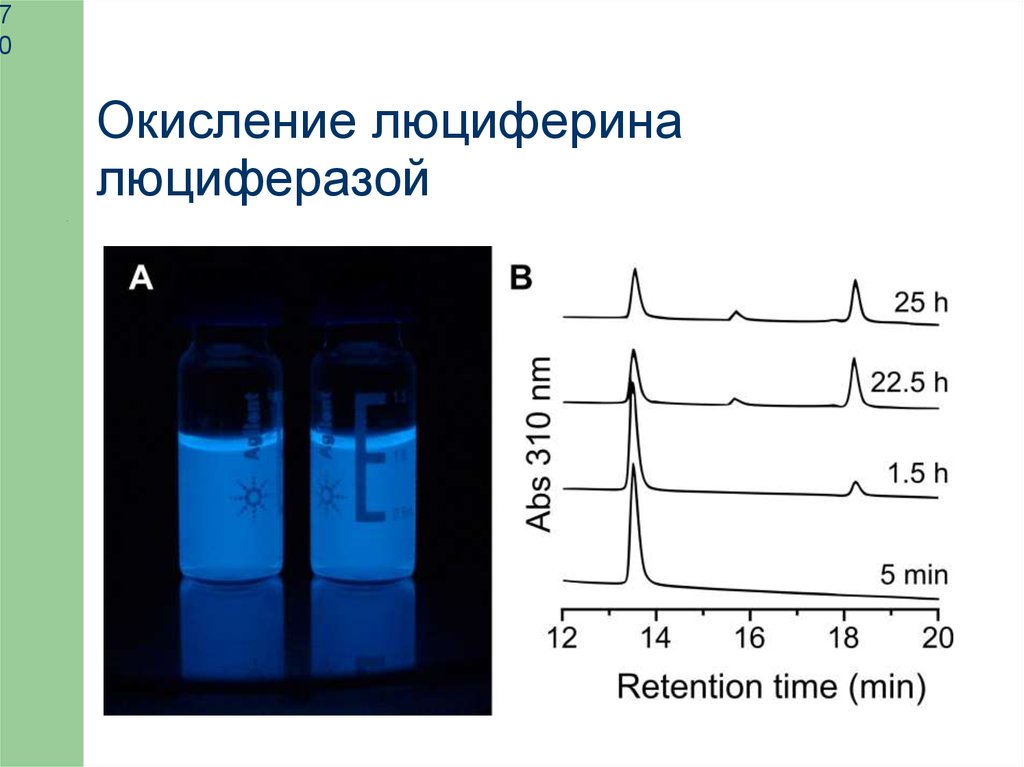
Окисление люциферина
люциферазой
70.
71
Изменение 1Н ЯМР-спектра
71.
72
Изменения в
спектрах
COSY и HSQC
72.
73
Механизм
биолюминесценции:
сравнение
светлячков и
червяков
73.
74
Грибы
Опёнок
биолюминесцентный
Чешуйчатка
НЕ биолюминесцентный
74.
75
Нам помогли не светящиеся
грибы!
75.
76
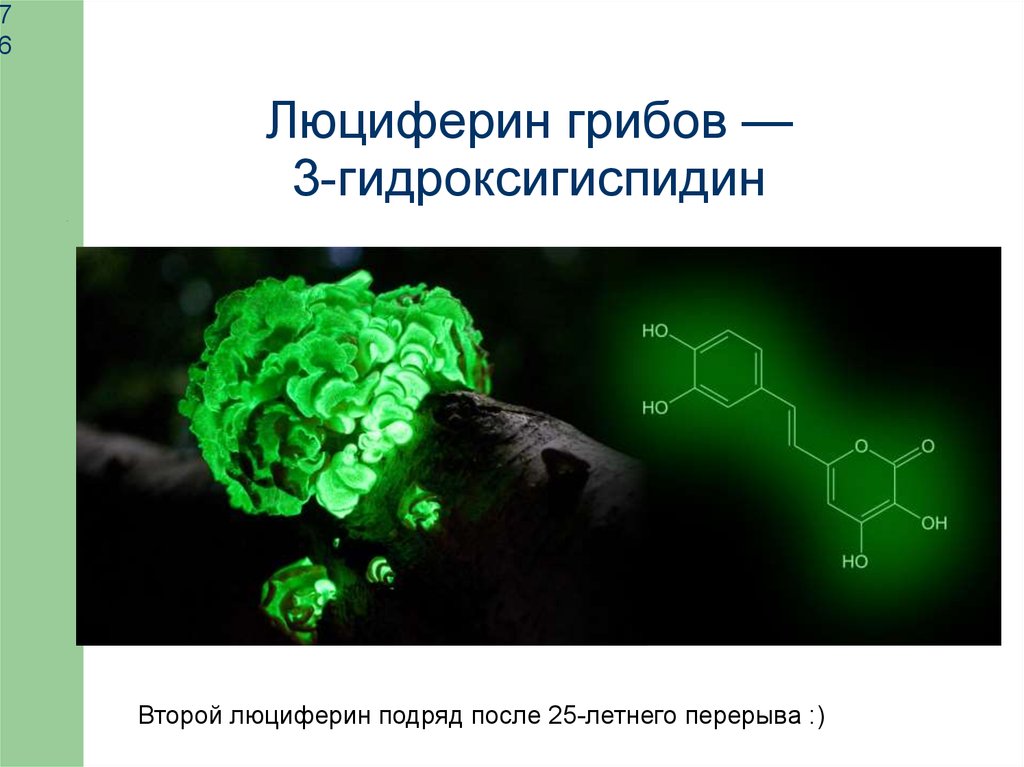
Люциферин грибов —
3-гидроксигиспидин
Второй люциферин подряд после 25-летнего перерыва :)
76.
77
Благодарности
В лекции были использованы образцы и
фрагменты спектров, предоставленные:
Абдильданова Асель Абаевна, Алматы, Казахстан,
Институт химических наук им. А.Б. Бектурова
Болдырев Иван Александрович, ИБХ РАН,
Лаборатория химии липидов
Дейгин Владислав Исаакович, ИБХ РАН,
Лаборатория биофармацевтики
Кемельбеков Улан Сатыбалдыулы, Кокшетау, Казахстан, КГУ им. Ш.
Уалиханова, Лаборатория инженерного профиля ЯМР-спектроскопии.
Константинова Ирина Дмитриевна, ИБХ РАН,
Лаборатория биотехнологии
Осмаков Дмитрий Игоревич, ИБХ РАН,
Лаборатория нейрорецепторов и нейрорегуляторов
Саблина Марина Александровна, ИБХ РАН,
Лаборатория углеводов
Ямпольский Илья Викторович, ИБХ РАН,
Группа синтеза природных соединений












































 Химия
Химия








